Международный неврологический журнал 5 (43) 2011
Вернуться к номеру
Глиатилин в лечении больных в восстановительном периоде мозгового инсульта
Авторы: Мищенко В.Н., Лапшина И.А., ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины», г. Харьков
Рубрики: Неврология
Версия для печати
Статья посвящена применению производного экзогенного холина Глиатилина в качестве нейропротектора в восстановительном периоде инсульта. Показано, что назначение Глиатилина больным в восстановительном периоде ишемического инсульта в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг 2 раза в сутки в течение 2 месяцев позволяет ускорить восстановление неврологических функций, в том числе уменьшить очаговую неврологическую симптоматику.
Инсульт, восстановление, Глиатилин, симптомы.
В последние годы во всем мире прогрессивно возрастает количество мозговых инсультов (МИ), и в первую очередь за счет ишемических нарушений мозгового кровообращения [1–3]. В ближайшие десятилетия эксперты ВОЗ предполагают дальнейший рост количества мозговых инсультов [4–7]. Это обусловлено возрастанием в популяции населения планеты людей пожилого возраста и значительной распространенностью таких факторов риска МИ, как артериальная гипертензия, болезни сердца, сахарный диабет, ожирение, курение и др. [8–10]. Также актуальна проблема МИ в Украине, где около 110 тыс. населения ежегодно заболевает инсультом, из них 35 % людей трудоспособного возраста [11].
Инсульт является ведущей причиной смертности и инвалидизации в развитых странах мира. Только 10–20 % больных после инсульта возвращается к труду. Около 25 % инвалидизации взрослого населения обусловлено инсультом [1, 6].
Согласно данным регистров инсульта, 20–43 % больных после МИ нуждаются в постороннем уходе, у 33–48 % наблюдаются явления гемипареза, а у 18–27 % имеются афатические нарушения [8–10]. Следствием этого являются огромные экономические потери, которые, по некоторым оценкам, составляют 4 % бюджета здравоохранения развитых стран [5]. Так, например, во Франции стоимость постинсультной помощи в течение 1,5 года на одного больного составляет 19 513 евро [5].
Растет во всем мире и количество случаев хронических нарушений мозгового кровообращения, которые приводят к развитию мозгового инсульта или деменции [8, 9, 11].
Возрастающая заболеваемость мозговым инсультом и связанная с ней высокая инвалидизация определяют актуальность проблемы эффективного лечения больных с сосудистыми заболеваниями головного мозга [12, 13].
Основной целью терапии ишемического инсульта в восстановительном периоде является восстановление функциональной интеграции центральной нервной системы (ЦНС) и устранение неврологического дефицита. В этот период, когда уже сформировались морфологические инфарктные изменения в веществе головного мозга, все большее значение приобретает репаративная терапия с использованием средств, направленных на улучшение пластичности неповрежденной мозговой ткани и межнейронального взаимодействия. К таким препаратам относятся нейропротекторы, обладающие трофическими и модуляторными свойствами, усиливающие регенераторно-репаративные процессы, способствующие восстановлению нарушенных функций. Они оказывают прямое активирующее влияние на структуры головного мозга, улучшают память и когнитивные функции, а также повышают устойчивость ЦНС к повреждающим воздействиям [12, 14–16].
Основные задачи нейрореабилитации больных, которые перенесли инсульт, сводятся к восстановлению нарушенных функций, психической и социальной реадаптации пациентов, профилактике постинсультных осложнений (спастичность, контрактуры и др.). Раннее начало (в острейшем периоде), длительность и систематичность, комплексность, этапность, а также активное участие больного и членов семьи определяют успех реабилитационных мероприятий [17]. На темпы восстановления нарушенных функций влияет много различных факторов: возраст больных, тяжесть инсульта, локализация очага поражения, сопутствующие заболевания, начало реабилитационных мероприятий, время и качество оказания медицинской помощи и другие [18]. В последнее время появилось много данных, свидетельствующих о роли когнитивных и аффективных нарушений, оказывающих негативное влияние на эффективность реабилитации у постинсультных больных. Когнитивные нарушения встречаются, по данным разных авторов, у 22–77% больных в течение года от начала развития инсульта. При этом когнитивные нарушения, достигающие степени деменции, выявляются у 25–34 % больных [19–22].
Таким образом, когнитивные нарушения наряду с другими последствиями инсульта вносят существенный вклад в социальную и бытовую дезадаптацию больных после инсульта. Постинсультными когнитивными расстройствами принято называть нарушения памяти и других высших мозговых функций, которые возникли или достигли клинической значимости в первые месяцы после инсульта. Основными причинами когнитивных нарушений у больных после перенесенного мозгового ишемического инсульта могут быть поражение в результате инсульта стратегических для когнитивной деятельности отделов головного мозга, развитие мультиинфарктного состояния, обширные поражения белого вещества (лейкоареоз), сопутствующие нейродегенеративные заболевания, депрессия [23].
Когнитивные нарушения оказывают отрицательное влияние на реабилитационный процесс, усиливают инвалидизацию и значительно ухудшают качество жизни больных, а также людей, которые ухаживают за ними.
Лечение больных в постинсультном периоде является сложной задачей, обусловленной многообразием патобиохимических и патофизиологических механизмов, лежащих в его основе.
В литературе имеются данные о положительном влиянии нейропротекторов на эффективность восстановления после перенесенного инсульта [15, 16, 24, 25].
Одними из наиболее эффективных препаратов среди нейропротекторов являются производные экзогенного холина: CDP (цитиколин), GPS (холина альфосцерат (Глиатилин)), рекогнан.
Глиатилин (альфа-глицерилфосфорилхолин, аlpha- glycerylphosphorylcholine) — соединение, содержащее 40 % холина и превращающееся в организме в метаболически активную форму — фосфорилхолин, способный проникать через гематоэнцефалический барьер и активировать биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов [26].
В экспериментах на животных показано, что Глиатилин предупреждает индуцированный холинергический дефицит, предотвращает развитие деменции, облегчает процессы обучения и запоминания за счет увеличения синтеза и высвобождения ацетилхолина в мозговых структурах [27].
Другим механизмом действия Глиатилина является анаболический эффект, проявляющийся в стимуляции мембранного и глицеролипидного синтеза вследствие образования предшественников фосфолипидов мембран из продуктов его метаболического распада [27, 28].
Таким образом, Глиатилин активирует холинергическую нейротрансмиссию, повышая пластичность ткани мозга, оказывает мембраностабилизирующее и антиоксидантное действие.
Нами был проанализирован ряд клинических исследований по применению холина альфосцерата у пациентов с различными сосудистыми заболеваниями головного мозга.
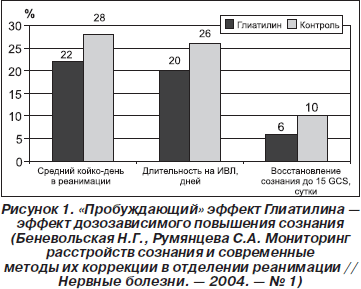
Пилотные клинические исследования Глиатилина в остром периоде тяжелого ишемического инсульта (внутривенные введения в дозе 1 г 3–4 раза в сутки в течение 5 дней) выявили «пробуждающий» эффект препарата (рис. 1). Отмечались уменьшение выраженности нарушений дыхания и кровообращения, улучшение показателей церебральной оксиметрии, положительная динамика стволовых вызванных потенциалов на акустическую стимуляцию, что свидетельствовало о нормализации функционального состояния ствола мозга. Отмечено также благоприятное влияние Глиатилина на психическую деятельность больных, память, восстановление речевых функций [29–33].
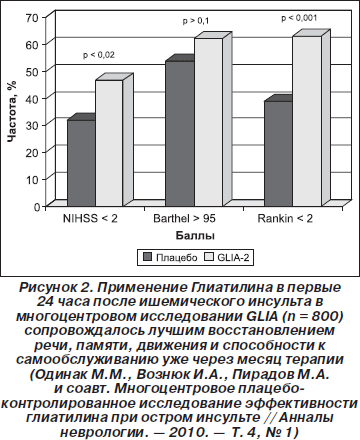
Особого внимания заслуживают результаты обширного мультицентрового 3-летнего исследования возможностей Глиатилина у 800 пациентов с острым ишемическим инсультом в ведущих клиниках Российской Федерации [29]. Согласно полученным результатам при введении препарата начиная с 1-х до 90-х суток (1–15-й дни — 200 мг/сутки, 15–30-й дни — 100 мг/сутки, далее — 800 мг/сутки) было выявлено, что уже к 30-му дню введения у пациентов, получавших Глиатилин, отмечалось значимое повышение способности к самообслуживанию (показатель менее 2 баллов по шкале Рэнкина), к 90-му дню достоверно чаще отмечалось снижение неврологического дефицита (выраженность менее 2 баллов по шкале NIHSS) (рис. 2). Важно подчеркнуть, что отмеченные клинические параметры улучшения коррелировали с данными нейровизуализации объема очага поражени: в группе пациентов, получавших Глиатилин, к 30-му дню отмечалось минимальное увеличение объема инфаркта мозга.
Исследование, проведенное группой итальянских ученых (F. Amenta и соавт., 2010), показало, что применение препарата Глиатилин вызывало значительное улучшение когнитивных функций у пациентов с легкой и среднетяжелой формой болезни Альцгеймера [34].
Итальянскими учеными Lucilla Parnetti, Francesco Amenta, Virgilio Gallai был проведен обзор научных данных, касающихся клинической эффективности холина альфосцерата, предшественника ацетилхолина, который применялся для лечения деменции [35].
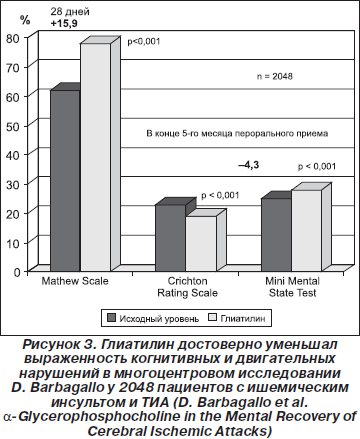
Приведенные сведения были получены в результате обобщения данных, полученных в ходе тринадцати клинических испытаний, в которые было включено 4054 пациента с ишемическим инсультом, с различными формами сосудистой деменции, в том числе деменцией альцгеймеровского типа, а также при лечении острых нарушений мозгового кровообращения (рис. 3). Результаты этих исследований показали положительное влияние препарата Глиатилин на когнитивные функции у обследуемых больных.
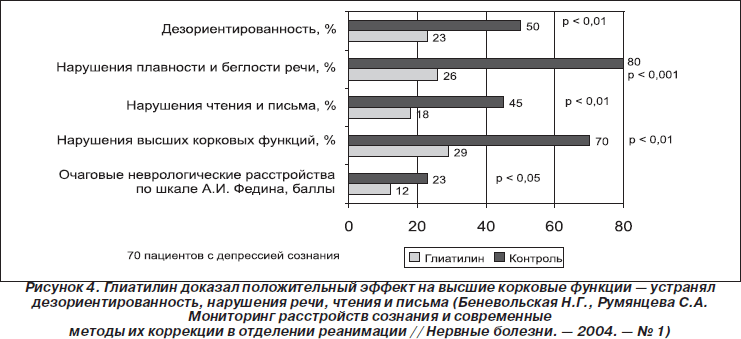
Были проведены многочисленные исследования, которые продемонстрировали эффективность Глиатилина в отношении двигательных нарушений, уровня сознания, когнитивных расстройств у больных в остром периоде мозгового инсульта (рис. 4). Вместе с тем эффективность и безопасность препарата Глиатилин у больных в восстановительном периоде ишемического инсульта представляет научный интерес.
На базе отдела сосудистой патологии головного мозга ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины» было проведено открытое исследование эффективности и переносимости холина альфосцерата у больных в восстановительном периоде ишемического мозгового инсульта.
Цель исследования — определить влияние препарата Глиатилин на выраженность неврологического дефицита, показатели повседневной жизненной активности и состояние когнитивных функций в восстановительном периоде ишемического инсульта.
Задачи исследования:
1. Оценить влияние препарата Глиатилин на основные субъективные проявления заболевания у больных в постинсультном периоде.
2. Оценить динамику объективных неврологических симптомов заболевания в результате лечения Глиатилином.
3. Изучить влияние препарата Глиатилин на когнитивные функции у обследованных больных.
4. Определить влияние препарата на повседневную жизненную активность и показатели качества жизни.
5. Оценить переносимость препарата Глиатилин, выявить возможные побочные явления, в том числе проанализировать влияние терапии Глиатилином на общее состояние больных, перенесших ишемический инсульт.
В исследование было включено 20 пациентов в восстановительном периоде ишемического мозгового инсульта в возрасте 45–75 лет, которые находились на лечении в отделении сосудистой патологии головного мозга ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины». Все пациенты получали исследуемый препарат Глиатилин в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг (одна капсула) 2 раза в сутки — 2 месяца.
Для решения поставленных задач исследования в работе были применены следующие методы обследования: клинико-неврологический; психодиагностический (шкала MMSE); уровень повседневной жизненной активности, а также степень инвалидизации пациентов определялись при помощи шкалы Рэнкина; функциональное состояние больных и их способность к самообслуживанию оценивались при помощи индекса Бартель; качество жизни больных определяли с помощью опросника SF-36.
Диагноз выставлялся на основании изучения жалоб больных, данных анамнеза жизни и болезни, неврологического и соматического статуса.
Среди обследованных пациентов у 15 (75 %) больных в патологический процесс были вовлечены бассейны средних мозговых артерий, у 5 (25 %) больных — вертебробазилярный бассейн. У 8 больных очаг ишемии локализовался в правом полушарии, у 7 — в левом.
Для верификации диагноза ишемического инсульта и определения его подтипа проводили КТ или МРТ головного мозга, ультразвуковую допплерографию, дуплексное сканирование каротидных артерий и электрокардиографию. По механизму развития атеротромботический инсульт перенесли 12 больных, кардиоэмболический — 6 больных, лакунарный — 2 больных.
У больных, перенесших МИ в системе средних мозговых артерий, превалировали жалобы на слабость в контралатеральных конечностях, онемение и нарушения чувствительности в этих конечностях. У больных с левополушарными каротидными нарушениями отмечались расстройства речи в виде моторной и сенсорной, амнестической афазии. Для больных, перенесших инсульт в вертебробазилярном бассейне, были более характерны жалобы на стойкие головокружения, в основном при смене положения тела, поворотах головы, шум, звон в голове и ушах, тошноту, затруднение при глотании, дизартрию, зрительные нарушения.
При объективном исследовании у всех больных отмечалась диффузная органическая симптоматика в сочетании с очаговыми нарушениями. Превалировали глазодвигательные нарушения: слабость конвергенции, ограничение взора вверх, недостаточность отводящих нервов. У больных выявлялись асимметрия лицевой мускулатуры, нистагм при крайних отведениях, нарушения статики и координации, афатические, двигательные (разной степени выраженности), чувствительные (преимущественно по гемитипу), тонусные нарушения, анизорефлексия, преимущественно по гемитипу, снижение силы в конечностях (контралатеральных очагу поражения). Выявлялась группа симптомов: снижение корнеальных рефлексов, отечность языка с отпечатками зубов, болезненность глазных яблок при надавливании, которые расценивались как косвенные признаки ликворной гипертензии.
Кроме того, у больных обнаруживались рефлексы орального автоматизма, патологические знаки, анизокория.
Очаговая неврологическая симптоматика отвечала пораженному сосудистому бассейну, локализации ишемического очага.
Анализ субъективной и объективной неврологической симптоматики позволил выделить ведущие клинические синдромы.
Очаговые неврологические синдромы отмечались в 75 % случаев. Симптоматика соответствовала локализации ишемического очага, пораженному сосудистому бассейну.
Вестибулоатактический синдром отмечался у 80 % больных, характеризовался головокружениями, шаткостью при ходьбе, усиливающейся при взгляде на движущиеся предметы и изменении положения тела, сопровождался нарушениями статики и координации, атаксией в пробе Ромберга.
Цефалгический синдром встречался в 95 % случаев. Он характеризовался выраженностью, монотонностью и однообразием головной боли.
Ликворно-гипертензионный синдром встречался у половины больных. Он характеризовался упорными головными болями распирающего характера, с чувством давления на глазные яблоки, тошнотой и обусловливал развитие и усугубление неврологической симптоматики вторично-стволового характера (глазодвигательные нарушения, пирамидные знаки, патологические рефлексы, псевдобульбарные нарушения). Наличие гипертензионного синдрома подтверждалось данными обследования глазного дна, КТ-данными, косвенными ЭЭГ-, УЗДГ-признаками.
Астенический синдром отмечался у всех обследованных больных. Он представлен в основном в виде выраженного компонента физической и психической утомляемости и снижения сенсорной толерантности.
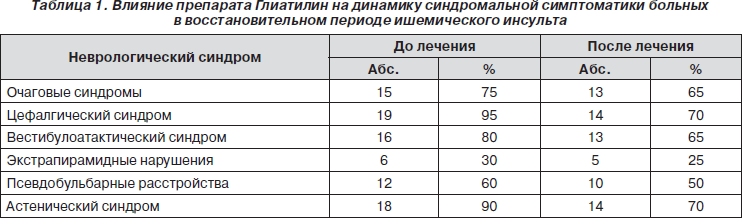
Нами была оценена динамика неврологических симптомов и синдромов до и после лечения препаратом Глиатилин. Как видно из данных, представленных в табл. 1, под влиянием лечения препаратом Глиатилин отмечается ослабление выраженности синдромальной неврологической симптоматики.
Как правило, соответствующие позитивные сдвиги у пациентов начинали проявляться через 2 недели лечения исследуемым препаратом, и в дальнейшем редукция неврологической и соматической симптоматики усиливалась.
Как видно из табл. 1, терапия препаратом Глиатилин способствовала существенному уменьшению количественной выраженности и встречаемости практически всего перечня объективной и субъективной симптоматики. У большинства пациентов степень выраженности жалоб снизилась от 4 баллов до 1–2 баллов, а у 2 пациентов отмечалась полная редукция предъявляемых ими жалоб.
В процессе лечения отмечалось уменьшение выраженности астенического синдрома, псевдобульбарных расстройств. У части больных наблюдалась редукция очаговых неврологических синдромов (улучшение двигательных функций, речи, вестибулоатактического синдрома).
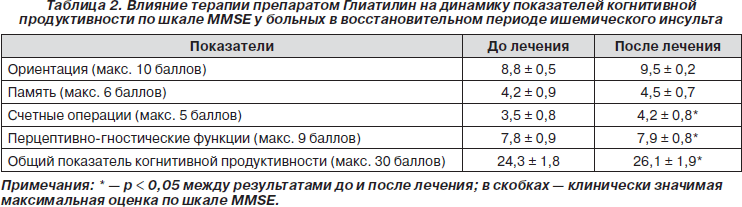
Состояние когнитивных функций до и после лечения препаратом Глиатилин было оценено с помощью шкалы MMSE. До лечения общий показатель когнитивной продуктивности по шкале MMSE составлял 24,3 ± 1,8 балла. Имело место выраженное сужение объемов вербальной памяти и счетных операций. У обследованных больных характерными были нарушения в сфере внимания, признаки дисфункции лобных долей (импульсивность, некритичность, персеверации). Нарушения памяти у этих больных сочетались с другими когнитивными расстройствами — дефектами устойчивости и переключения внимания, нарушением критики, поведения и др. В первую очередь страдала кратковременная память, уменьшался ее объем, выявлялось повышение тормозимости следов кратковременной памяти.
Динамика показателей по шкале MMSE до и после лечения представлена в табл. 2.
Анализ динамики когнитивных функций в процессе лечения больных показал статистически значимое улучшение всех показателей когнитивной сферы (памяти, внимания, ориентации, счетных функций). У больных после лечения общий показатель когнитивной продуктивности составил 26,1 ± 1,9 балла.
Анализируя результаты психодиагностического исследования, следует отметить, что у большинства пациентов под влиянием лечения препаратом Глиатилин существенно улучшились когнитивные функции, повысилась умственная работоспособность, улучшились показатели памяти, внимания.
Балльная динамика функционального состояния больных в восстановительном периоде ишемического инсульта и их способности к самообслуживанию, оцененных с помощью индекса Бартель, представлена в табл. 3.
В начале исследования средний балл по индексу Бартель у больных в восстановительном периоде ишемического инсульта составил 55,0 ± 5,0.
На фоне проводимой терапии через 2 недели (14 ± 2 дня), а затем через 1,5 месяца (44 ± 3 дня) у всех больных наблюдалось улучшение их функционального состояния, средний показатель индекса Бартель за этот период повысился на 14,5 балла и составил 69,5 балла.
К концу лечения, через 2,5 месяца (74 ± 3 дня), индекс Бартель у обследуемых больных был в пределах 78,5 ± 2,5, он возрос по сравнению с исходным визитом на 23,5 балла.
Степень инвалидизации по шкале Рэнкина в динамике на фоне лечения препаратом Глиатилин у больных в восстановительном периоде ишемического инсульта представлена в табл. 4.
Как видно из табл. 4, в начале исследования уровень инвалидизации по шкале Рэнкина у больных в восстановительном периоде ишемического инсульта составил 3,4 ± 0,2 балла.
На фоне лечения препаратом Глиатилин отмечалось уменьшение степени инвалидизации больных, которое характеризовалось уменьшением баллов по шкале Рэнкина, что свидетельствовало об улучшении функциональных возможностей пациентов в постинсультном периоде.
Результаты клинического исследования влияния курса Глиатилина на динамику показателей качества жизни представлены в табл. 5.
В результате тестирования по всем показателям опросника качества жизни SF-36 после терапии Глиатилином параметры качества жизни были существенно выше, чем до лечения. Почти по всем базовым значениям субсфер опросника SF-36 был превышен 50-балльный барьер, что свидетельствовало о достижении пациентами лучшего качества жизни.
Так, показатель «физическая активность» (переносимость физических нагрузок) и показатель «роль физических проблем в ограничении жизнедеятельности» достоверно возросли. Пациенты отмечали повышение внутренней энергии и энтузиазма при выполнении своих обычных повседневных обязанностей. На фоне лечения Глиатилином снизилась чувствительность к некоторым проявлениям физической боли, она меньше влияла на поведение, активность и объем выполняемых работ. Пациенты также значительно выше оценивали свое общее восприятие здоровья и жизнеспособность.
Улучшение общего физического состояния оказывало положительный эффект и на осознание своего психического здоровья, так как для большинства пациентов психологический статус тесно связан с физическим и функциональным. Пациенты отмечали повышение своей социальной активности, они получали удовлетворение от возможности поддерживать контакты с окружающими. Можно говорить о снижении степени фиксации на негативных эмоциях, когда пациенты чувствовали себя бесполезными и беспомощными, и повышении возможности расширения социального и психологического мира.
В ходе настоящего клинического исследования больных в восстановительном периоде ишемического инсульта было зарегистрировано 4 случая нежелательных явлений. У одного пациента была острая респираторная вирусная инфекция, данное неблагоприятное явление не связано с приемом исследуемого препарата. У двоих пациентов отмечалась легкая тошнота, которая прошла самостоятельно без коррекции дозы препарата, у одного больного возник металлический привкус во время инфузии. Ни у одного из пациентов проявление побочного эффекта не потребовало прекращения лечения.
Препарат не оказал отрицательного влияния на основные показатели сердечной деятельности и гемодинамики (артериальное давление и частоту сердечных сокращений): по завершении исследования у больных не отмечено достоверных изменений показателей частоты сердечных сокращений и артериального давления.
Назначение исследуемого препарата не оказало также какого-либо отрицательного влияния на показатели морфологического состава периферической крови, на уровни ее основных биохимических констант, характеризующих функциональное состояние печени и почек, а также не отразилось на показателях клинического анализа мочи.
Исследование показало, что применение препарата Глиатилин в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг (одна капсула) 2 раза в сутки в течение 2 месяцев у больных в восстановительном периоде ишемического инсульта позволяет ускорить восстановление неврологических функций, в том числе уменьшить очаговую неврологическую симптоматику.
Следует отметить, что терапевтические эффекты препарата Глиатилин направлены на коррекцию нарушений высших корковых функций. Эти эффекты включают восстановление концентрации внимания и памяти, улучшение умственной и физической работоспособности, эмоционального состояния больных, улучшение когнитивных функций.
Курсовое применение препарата Глиатилин у пациентов в восстановительном периоде ишемического инсульта положительно сказывается на качестве их жизни.
Препарат хорошо переносится пациентами и не вызывает каких-либо клинически значимых побочных эффектов при длительном приеме в течение 2,5 месяца.
Таким образом, препарат Глиатилин при назначении в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, а затем 400 мг (одна капсула) 2 раза в сутки в течение 2 месяцев может быть рекомендован к применению в качестве средства лечения больных в восстановительном периоде ишемического мозгового инсульта.
1. Cordonnier С., Leys D. Stroke: the bare essentials // Practical Neurol. — 2008. — 8. — 263-272.
2. World Health Organization. STEP wise approach to surveillance (STEPS).— Geneva, Switzerland: WHO, 2006 (http://www.who.int/ chp/steps/en).
3. World health statistics 2007. — Geneva, Switzerland: WHO, 2006 (http://www.who.int/statistics).
4. Olesen J., Baker M.G., Freud T. et al. Consensus document on European brain research // JNNP. — 2006. — 77 (suppl. 1). — il-49.
5. Andlin-Sobocki P., Jonsson B., Wittchen H.-U. et al. Costs of disorders of the brain in Europe // Europ. J. Neurol. — 2005. — 12 (suppl. l). — 1-24.
6. Mathers C.D., Loncar D. Projections of global mortality and burden of disease from 2002 to 2030 // PloS Medicine. — 2006. — 3. — e442.
7. World Health Organization. The World Health Report 2003: shaping the future. — Geneva, Switzerland: WHO, 2003.
8. Argentine C., Prencipe M. The burden of stroke: a need for prevention // Prevention of Ischemic Stroke / Eds. C. Fieschi, M. Fisher. — London: Martin Dunitz, 2000. — 1-5.
9. Warlow С., van Gijn J., Dennis M. et al. Stroke: practical management. — 3rd ed. — Blackwell Publishing, 2008.
10. Adams H.P., del Zoppo G., Alberts M.J. et al. Guidelines for the Early Management of Adults With Ischemic Stroke // Stroke. — 2007 — V. 38. — P. 1655-1711.
11. Мищенко Т.С. Эпидемиология цереброваскулярных заболеваний в Украине // Практична ангіоневрологія. — 2009. — № 1/1. — С. 5.
12. Верещагин Е.И. Современные возможности нейропротекции при острых нарушениях мозгового кровообращения и черепно-мозговой травме (обзор литературы) // Журнал интенсивной терапии. — 2006. — № 3. — С. 4-28.
13. Мищенко Т.С. Достижения в области сосудистых заболеваний головного мозга за последние 2 года // Здоров’я України. — 2010. — № 5. — 12-13.
14. Беленичев И.Ф., Черний В.И., Колесников Ю.М. и др. Рациональная нейропротекция. — Донецк: Издатель Заславский А.Ю., 2009. — 262 с.
15. Дафин Ф. Мурешан. Комплексный подход к нейропротекции и нейропластичности при лечении инсульта // Международный неврологический журнал — 2007. — № 6 (16).
16. Скворцова В.И., Стаховская Л.В., Шамалов Н.А., Кербиков О.О. Результаты многоцентрового исследования безопасности и эффективности церебролизина у больных с острым ишемическим инсультом // Журн. неврологии и психиатрии имени С.С. Корсакова. Прил. Инсульт. — 2006. — № 16. — С. 41-45.
17. Варлоу Ч.П., ван Гейн Ж. Инсульт: Практическое руководство для ведения больных. — СПб., 1998.
18. Seitz R.J. How imaging will guide rehabilitation // Curr. Opin. Neurol. — 2010. — 23. — 79-86.
19. Путилина М.В., Громадская Н.В., Лаздон Н.Е., Ермошкина Н.Ю. Особенности коррекции когнитивных нарушений у пациентов в остром периоде ишемического инсульта // Клиническая фармакология и терапия. — 2005. — Т. 14, № 3. — С. 71-74.
20. Яхно Н.К., Вейн А.М., Голубева В.В. и др. Психические нарушения при лакунарном таламическом инфаркте // Неврол. журн. — 2002. — Т. 7, № 2. — С. 34-37.
21. Bomstein N.M., Gur A.Y., Treves T.A. et al. Do silent brain infarctions predict the development of dementia after first ischemic stroke? // Stroke. — 1996. — Vol. 27. — P. 904-905.
22. Henon H., Pasquir F., Durieu I. et al. Pre-existing dementia in stroke patients. Baseline frequency, associated factors, and outcome // Stroke. — 1997. — Vol. 28. — P. 2429-2436.
23. Яхно Н.Н. Когнитивные расстройства в неврологической клинике // Неврол. журн. — 2006. — № 11 (прил. № 1). — С. 4-13.
24. Виленский Б.С., Кузнецов А.Н., Виноградов О.И. Новое направление применения церебролизина — повторное курсовое введение препарата больным, перенесшим полушарный ишемический инсульт // Неврол. журн. — 2007. — № 1. — С. 1-3.
25. Янишевский С.Н., Одинак М.М., Вознюк И.А., Онищенко Л.С. Клиническая и морфологическая оценка эффективности препаратов с метаболической активностью при острой церебральной ишемии // Современные подходы к диагностике и лечению нервных и психических заболеваний. — СПб., 2000. — 364-365.
26. Lopez C.M., Govoni S., Battaini F. et al. Effect of a new cognition enhancer, alpha-glycerylphosphorylcholine, on scopolamine-induced amnesia and brain acetylcholine // Pharmacol Biochem Behav. — 1991. — Vol. 39, Issue 4. — P. 835-840.
27. Fallbrook A., Turenne S.D., Mamalias N., Kish S.J., Ross B.M. Phosphatidylcholine and phosphatidylethanolamine metabolites may regulate brain phospholipid catabolism via inhibition of lysophospholipase activity // Brain Res. — 1999. — Vol. 10. — P. 207-210.
28. Khaselev N., Murphy R.C. Structural characterization of oxidized phospholipid products derived from arachidonate-containing plasmenyl glycerophosphocholine // J. Lipid Res. — 2000. — № 41. — Р. 564-572.
29. Одинак М.М., Вознюк И.А., Пирадов М.А., Румянцева С.А., Кузнецов А.Н., Янишевский С.Н., Голохвастов С.Ю., Цыган Н.В. Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте // Клиническая неврология. — 2010. — Т. 4, № 1. — С. 20-27.
30. Вознюк И.А., Одинак М.М., Кузнецов А.Н. Применение глиатилина у больных с острым нарушением мозгового кровообращения // Сосудистая патология нервной системы. — СПб., 1998. — 167-172.
31. Антонов И.П. Эффективность применения препарата глиатилин у больных с острыми нарушениями мозгового кровообращения в раннем восстановительном периоде. — СПб.: Terra Medica, 1998. — 36-44.
32. Черний Т.В., Андронова И.А., Черний В.И. Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме // Международный неврологический журнал. — 2011. — № 2. — С. 40.
33. Никонов В.В., Савицкая И.Б. Возможности применения холина альфосцерата для лечения постгипоксической энцефалопатии // Медицина неотложных состояний. — 2011. — № 1–2. — С. 101-106.
34. Amenta F., Carotenuto A., Fasanaro A.M., Lanari A., Previdi P., Rea R. Analisi comparativa della sicurezza/efficacia degli inibitori delle colinesterasi e del precursore colinergico colina alfoscerato nelle demenze ad esordio nell’eta adulta // G. Gerontol. — 2010. — V. 58. — P. 64-68.
35. Lucilla Parnetti, Francesco Amenta, Virgilio Galla. Choline alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data // Mechanisms of Ageing and Development. — 2001. — Vol. 122. — Issue 16. — P. 2041-2055.