Международный неврологический журнал 5 (43) 2011
Вернуться к номеру
Последние достижения и новые направления защиты и восстановления мозга после ишемического инсульта: в центре внимания множественные эффекты цитиколина
Авторы: Фломин Ю.В., Харьковская медицинская академия последипломного образования, Инсультный центр, МЦ «Универсальная клиника «Оберіг», г. Киев
Рубрики: Неврология
Версия для печати
Статья посвящена вопросам нейропротекции при ишемическом инсульте. Подробно описаны эффекты цитиколина. Результаты клинических исследований с участием более 11 тысяч человек свидетельствуют о том, что цитиколин может оказывать положительное влияние при инсульте, черепно-мозговой травме, когнитивных нарушениях. С учетом высокой безопасности и хорошей переносимости цитиколин может играть важную роль в реабилитационном периоде у пациентов после инсульта. Наличие инъекционных и таблетированных форм цитиколина (Сомаксона) обеспечивает преемственность терапии.
Нейропротекция, цитиколин, инсульт.
 Введение
Введение
Наибольших успехов в снижении заболеваемости и смертности от инсульта в развитых странах удалось добиться за счет первичной и вторичной профилактики, то есть мероприятий, направленных на контроль факторов риска, в то время как лечебные вмешательства в остром периоде инсульта зачастую оказывались менее успешными. Одним из наиболее значимых достижений стало внедрение инсультных блоков (Stroke Units), которые позволяют снизить летальность и улучшить функциональный исход при остром инсульте примерно на 20 % (Donnan G.A., Fisher M., 2008). Результаты клинических испытаний NINDS и ECASS-III и многочисленные наблюдения в клинической практике свидетельствуют, что при ишемическом инсульте успешной лечебной стратегией для спасения угрожаемой ткани мозга и улучшения функционального исхода является внутривенная тромболитическая терапия в первые 4,5 ч от начала заболевания (The National Institute of Neurological Disorders and Stroke, 1995; Hacke W., Kaste M., 2008; Wahlgren N., Ahmed N., 2007). Однако через 15 лет после того, как было выдано разрешение на клиническое применение алтеплазы при ишемическом инсульте, тромболитическую терапию получают лишь 2–8 % пациентов, и это показатель вряд ли когда-либо существенно превысит 20 % (Goldberg M.P., 2007). В период 2004–2007 гг. 64 % больниц в США не проводили тромболизис, а в развивающихся странах случаи тромболитической терапии немногочисленны (Kleindorfer D., Xu Y., 2009; Pandian J.D., Padma V., 2007).
Другим перспективным подходом в лечении острой церебральной ишемии является попытка замедлить или остановить патологические процессы ишемического каскада путем воздействия на отдельные его звенья (Gutiйrrez M., Merino J.J., 2009). Мероприятия, направленные на уменьшение ишемического повреждения, получили название нейропротекции (Fisher M., 2006; Ginsberg M.D., 2009). Потребность в нейропротекции еще никогда не была столь велика: наличие безопасного и умеренно эффективного нейропротектора с достаточно широким терапевтическим окном имело бы большое значение для уменьшения растущего бремени инсульта в мире (Hill M.D., Martin R.H., 2011; Fisher M., 2011). В данном обзоре обобщены материалы, которые были рассмотрены в ходе специального заседания, посвященного последним достижениям и новым направлениям в лечении и профилактике инсульта, на XIX Европейской инсультной конференции (Барселона, Испания, 25–28 мая 2010 г.).
Нейропротекция при ишемическом инсульте: итоги и перспективы
Ишемическое повреждение мозга развивается вследствие окклюзии сосуда, вызванной либо тромбозом in situ, либо эмболией кровяным сгустком, образовавшимся в проксимальной артерии или в сердце. Окклюзия церебрального сосуда запускает сложный каскад патологических процессов (ишемический каскад), которые могут привести к необратимому повреждению ткани мозга, то есть инфаркту (Lo E., Dalkara T., 2003; Lo E.H., 2008; Fisher M., 2011). На масштабы и эволюцию ишемического повреждения оказывают влияние многие факторы, такие как коллатеральный кровоток, температура тела, уровень глюкозы и других метаболических продуктов. Комбинация этих факторов определяет продолжительность периода, когда лечебные вмешательства могут уменьшить объем инфаркта у отдельных пациентов (терапевтическое окно) (Martini S.R., Kent Т.А., 2007; Bang O.Y., Saver J.L., 2008).
Разработка нейропротекторов, начало которой положило сообщение Rothman и Olney о глутаматной эксайтотоксичности (1986), основана на все более глубоком изучении ишемического каскада (Donnan G.A., 2008). Несколько сотен потенциальных нейропротекторов изучены на моделях инсульта у животных и в клинических исследованиях (Hossman K.A., 2006; Labiche L.A., Grotta J.C., 2004; O’Collins V.E., Macleod M.R., 2006; Ginsberg M.D., 2009). Последние 20 лет клинических исследований нейропротекторов были периодом больших надежд и горьких разочарований. Несмотря на успешное применение в экспериментах на животных, включая уменьшение размера инфаркта и улучшение функционального исхода, ни один из нейропротекторов не продемонстрировал несомненной эффективности у человека и не получил разрешения на клиническое применение при инсульте в Северной Америке и странах Европейского Союза (Fisher M., 2011).
Было высказано много предположений о причинах отрицательных результатов клинических испытаний нейропротекторов (Gladstone D.J., Black S.E., 2002; Labiche L.A., Grotta J.C., 2004; O’Collins V.E., Macleod M.R., 2006). В частности, известные нам механизмы ишемического каскада, которые были открыты в экспериментах на животных, по-видимому, характерны лишь для серого вещества: у грызунов белое вещество составляет лишь около 10 %, в то время как у человека — около 50 % массы мозга. Более того, нет уверенности в том, что при очаговой церебральной ишемии у человека в сером веществе происходят те же процессы, что и у грызунов (Donnan G.A., 2008). Вызывает сомнения адекватность тестирования нейропротекторных средств на доклинической стадии. Эти и другие соображения привели к появлению рекомендаций STAIR по доклиническому изучению потенциальных нейропротекторов, которые были опубликованы в 1999 г. и обновлены в 2009 г. (Fisher M., Feuerstein G.Z., 2009). Несмотря на широкую известность рекомендаций STAIR, многие лекарственные средства продолжали исследовать без учета изложенных требований (O’Collins V.E., Macleod M.R., 2006). Когда исследования нейропротекторов переходили к этапу клинических испытаний, дизайн многих из них имел множество недостатков, что сделало невозможной адекватную оценку эффективности лечения. Такая комбинация несовершенных доклинических и клинических исследований резко снизила вероятность выявления преимуществ и породила пессимизм в отношении нейропротекции при остром ишемическом инсульте (Sicard K.M., Fisher M., 2009). Этот пессимизм сохраняется и сегодня, несмотря на многообещающие результаты экспериментальных исследований и понимание недостатков клинических испытаний.
На самом деле вопрос состоит, скорее, в том, сумеем ли мы перенести экспериментальные достижения в клиническую практику (Fisher M., 2011). Традиционно в качестве мишени для нейропротекторных средств выбирали одну из молекул или одно из звеньев ишемического каскада (например, глутаматная эксайтотоксичность, свободнорадикальное окисление или воспалительные механизмы) и затем проводили исследования на животных, изучая безопасность и эффективность лечения. Лекарственные средства, которые уменьшали объем инфаркта и улучшали функциональный исход, а также обладали достаточной безопасностью, далее исследовались в клинических испытаниях I, II и III фазы. К сожалению, в силу ряда причин, таких как неоднородность ишемических инсультов, недостаток биомаркеров и небольшой размер выборки, клинические испытания II фазы зачастую были неинформативными (Fisher M., Cheung K., 2006). В связи с этим клинические испытания III фазы планировались и проводились в отсутствие надежной информации об оптимальной дозе и терапевтическом окне для вмешательства. Кроме того, количество участников было недостаточным для выявления небольших клинических преимуществ. Поскольку многие реакции, ведущие к смерти клеток, протекают одновременно, разработка нейропротекторных средств, оказывающих многочисленные эффекты на ишемический каскад, представляется более перспективной, чем разработка средств, воздействующих лишь на одно звено (Lo E.H., Moskowitz M.A., 2005). Недавно Lo высказал предположение, что большинство мишеней, выбранных для лечебных вмешательств, в различные периоды инсульта могут играть различную патофизиологическую роль, поэтому отрицательные результаты исследований нейропротекторов могли быть отчасти обусловлены тем, что эти средства не только уменьшали повреждение, но и препятствовали репарации (Lo E.H., 2008). За исключением самых последних исследований, не использовались важные данные нейровизуализации, такие как подтверждение наличия пенумбры (Fisher M., 2006). Таким образом, ввиду указанных выше и других ограничений до настоящего времени не была убедительно продемонстрирована эффективность нейропротекторов и ни один из них пока не рекомендован для лечения ишемического инсульта в клинической практике (Fisher M., 2011).
Помимо традиционного предназначения, нейропротекторы могут использоваться для достижения следующих целей: увеличение выживаемости ишемической полутени с тем, чтобы наибольший объем пенумбры сохранился до проведения реперфузионной терапии; уменьшение реперфузионного повреждения после успешной реканализации; стимуляция нейропластичности и восстановления нарушенных функций. В отношении последнего из указанных новых подходов к нейропротекции — комбинация защитного действия и более активного восстановления мозга – одним из наиболее перспективных средств представляется цитиколин (Secades J.J., Lorenzo J.L., 2006; Clark W.M., 2009). Множественные (плейотропные) эффекты привлекают внимание исследователей и клиницистов по нескольким причинам. Во-первых, границы терапевтического окна для средств типа «два в одном» должны быть значительно шире, чем для чистых нейропротекторов, которые могут оказывать действие лишь на протяжении нескольких часов или дней от начала инсульта. Благодаря широкому терапевтическому окну появляется возможность включения большего числа пациентов в клинические испытания. Во-вторых, вследствие двойного механизма действия увеличивается вероятность положительного влияния на отсроченные исходы, такие как оценка по модифицированной шкале Ренкина через 90 и 180 дней от начала заболевания. Оба указанных лекарственных средства в настоящее время исследуются в клинических испытаниях, результаты которых помогут нам понять, позволяет ли двойной механизм действия улучшить клинические исходы ишемического инсульта, а также усовершенствовать дизайн будущих клинических испытаний (Fisher M., 2011).
Цитиколин в нейропротекции
Цитидин-5-дифосфохолин (ЦДФ-холин, или цитиколин) — эндогенное соединение, которое присутствует во всех клетках и принимает участие в трех важных циклах биохимических реакций. Во-первых, это синтез фосфатидилхолина (лецитина) — одного из важнейших мембранных фосфолипидов и компонента липопротеина. Во-вторых, цитиколин обеспечивает холин для синтеза ацетилхолина. В-третьих, цитиколин окисляется до бетаина — донора метиловой группы. Вводимый per os цитиколин подвергается гидролизу и всасывается в кишечнике в виде цитидина и холина, которые хорошо проникают через гематоэнцефалический барьер. В дальнейшем при участии фермента ЦТФ-фосфохолинцитидилилтрансферазы происходит ресинтез ЦДФ-холина (Adibhatla R.M., Hatcher J.F., Larsen E.C. 2007; Adibhatla R.M., Hatcher J.F., 2007; Adibhatla R.M., Hatcher J.F., 2010; Conant R., Schauss A.G., 2004; Secades J.J., Lorenzo J.L., 2006).
На ряде моделей повреждения центральной нервной системы было показано, что при острых повреждениях мозга цитиколин действует как нейропротектор. В экспериментальных исследованиях при церебральной ишемии цитиколин уменьшал объем инфаркта, отек мозга и неврологический дефицит (Adibhatla R.M., Hatcher J.F., 2005). Эффекты цитиколина, лежащие в основе нейропротекторного действия, подробно рассмотрены в нескольких публикациях (Secades J.J., Lorenzo J.L., 2006; Saver J.L., 2008). Они включают подавление высвобождения жирных кислот, стимуляцию синтеза фосфатидилхолина, поддержание уровней кардиолипина и сфингомиелина, увеличение синтеза глутатиона и активности глутатионредуктазы, восстановление функции Na+/K+-АТФазы и антиапоптозное действие. Данные Hurtado et al. свидетельствуют, что цитиколин обладает антиэксайтотоксическим эффектом (Hurtado O., Moro M.A., Cardenas A., 2005). Эти исследователи обнаружили, что в условиях ишемии цитиколин уменьшал объем инфаркта мозга пропорционально снижению концентрации глутамата в ткани мозга, которую оценивали с помощью микродиализа. Следует отметить, что полученные результаты указывают на менее выраженное снижение уровня АТФ при ишемии в случае предшествующего введения цитиколина. Влияние цитиколина на уровень АТФ в нейронах позволяет по крайней мере частично объяснить уменьшение уровня внеклеточного глутамата и нейропротекторные эффекты при ишемии нормализацией функции транспортеров. Такое многообразие механизмов действия свидетельствует о том, что механизм действия цитиколина до конца не изучен (Hurtado O., Lizasoain I., 2011).
Эффекты ЦДФ-холина изучались у 11 тыс. добровольцев и пациентов, и в ходе этих исследований было продемонстрировано положительное влияние цитиколина при церебральной ишемии, черепно-мозговой травме и нарушениях памяти (Davalos A., Secades J., 2011). Как следует из результатов оригинальных исследований и метаанализа объединенных данных 1372 пациентов, принимавших участие в 4 клинических испытаниях, лечение цитиколином, начатое в первые 24 часа от начала ишемического инсульта, может иметь клинические преимущества (Clark W.M., Warach S.J., 1997; Clark W.M., Williams B.J., 1999; Clark W.M., 2001; Warach S., Pettigrew L.C., 2000; Davalos A., Castillo J., 2002). Используя диффузионно-взвешенные изображения магнитно-резонансной томографии, Warach et al. выявили значительное уменьшение размеров очага инфаркта мозга между 1-й и 12-й неделями от начала заболевания, если пациенты с 1-го дня болезни получали лечение цитиколином (Warach S., Pettigrew L.C., 2000). Цитиколин способствует регрессу неврологического дефицита и восстановлению нарушенных функций (Saver J.L., 2008; Cobo E., Secades J.J., 2010). По сравнению с контрольной группой у пациентов с тяжелыми ишемическими инсультами (оценка по National Institutes of Health Stroke Scale (NIHSS) ≥ 8 баллов), получавших лечение цитиколином, была выше частота полного восстановления функциональных возможностей (оценка по индексу Бартел ≥ 95 баллов): 33 % в группе цитиколина по сравнению с 21 % в группе плацебо (р = 0,05) (Clark W.M., Williams B.J., 1999; Clark W.M., 2009).
В 2008 г. Saver опубликовал метаанализ 10 клинических испытаний (N = 2279) цитиколина при ишемическом и геморрагическом инсульте (Saver J.L., 2008). По сравнению с плацебо лечение цитиколином ассоциировалось со значительным снижением смертности или инвалидности при длительном наблюдении (67,5 по сравнению с 57,0 %; отношение шансов 0,64, р < 0,001). Анализ данных четырех самых больших клинических испытаний (N > 100) при ишемическом инсульте продемонстрировал довольно однородные и очень схожие положительные результаты. Анализ данных о безопасности лечения продемонстрировал, что при долгосрочном наблюдении цитиколин не увеличивает частоты неблагоприятных событий по сравнению с плацебо (14,5 по сравнению с 14,0 %; отношение шансов 0,99, р = 0,94).
Недавно был опубликован отчет о большом (N = 4191) постмаркетинговом исследовании, в котором изучались безопасность и эффективность лечения цитиколином у корейских пациентов с острым ишемическим инсультом (Cho H.J., Kim Y.J., 2009). Цитиколин (500–4000 мг в сутки) назначался перорально в первые 24 ч от начала заболевания (N = 3736) или после 24 ч от начала заболевания (N = 455), лечение продолжалось не менее 6 недель. Результаты свидетельствовали, что лечение цитиколином улучшало все параметры исхода заболевания (NIHSS, индекс Бартел, модифицированная шкала Ренкина) через 6 недель (р < 0,05). Цитиколин отличался высокой безопасностью, побочные действия были зарегистрированы лишь у 0,73 % пациентов и включали головную боль, диспепсию, кровотечение и осложнения инсульта.
В настоящее время продолжаются два крупных клинических испытания цитиколина при острых повреждениях мозга. В США проходит рандомизированное двойное слепое плацебо-контролируемое клиническое испытание цитиколина при черепно-мозговой травме (Сiticoline brain injury treatment trial — CORBIT) (Zafonte R., Friedewald W.T., 2009). В течение 32 мес. в исследование планируется включить около 1500 пациентов с легкой, умеренной или тяжелой черепно-мозговой травмой, которые будут случайным образом распределены в группу активного лечения (1000 мг цитиколина 2 раза в день) или в группу плацебо. Через 90 дней от начала заболевания будет оцениваться влияние лечения на функциональный исход (набор шкал, оценки по которым будут объединены в глобальный тест). Первые результаты исследования ожидаются к концу 2011 г.
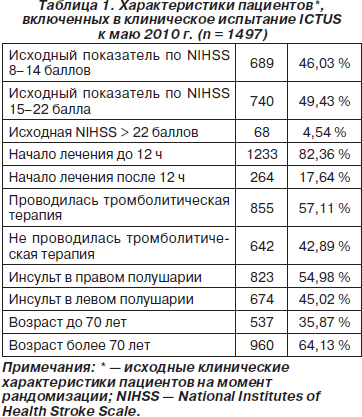
В Европе проводится большое (N = 2600) многоцентровое рандомизированное двойное слепое плацебо-контролируемое клиническое испытание цитиколина при остром ишемическом инсульте (International Citicoline Trial on Acute Stroke — ICTUS) (Davalos A., 2008; Davalos A., Secades J., 2011). Первичной конечной точкой в этом клиническом испытании является комбинация оценок по 3 шкалам (NIHSS, индекс Бартел и модифицированная шкала Ренкина) через 12 недель от начала заболевания. По состоянию на май 2010 года в 50 активных центрах в Испании, Португалии и Германии в исследование были включены 1497 пациентов, характеристики которых представлены в табл. 1. Обращает на себя внимание, что среди испытуемых много пациентов с тяжелым инсультом (54 % участников с исходной оценкой по NIHSS ≥ 15 баллов), а также высокая частота проведения тромболитической терапии алтеплазой (43 %). Результаты исследования ожидаются в 2012 г.
Цитиколин в нейрорепарации
Как известно, самым распространенным последствием инсульта является не смерть, а нарушения повседневной жизнедеятельности (Wolfe C.D.A., 2000). У 60 % пациентов, выживших после инсульта, отмечаются стойкие неврологические нарушения, ограничивающие их жизнедеятельность (Wahlgren N., Ahmed N., 2007). После инсульта часто наблюдаются ограниченная мобильность, высокий риск падений и переломов, алиментарная недостаточность, эмоциональные и когнитивные нарушения, недержание мочи и кала (Teasel R., McRae M., 2002; Dafer R.M., Rao M., 2008; Brittain K., 2001; Fotuhi M., Hachinski V., 2009; Dolan H., Crain B., 2010). Примерно половина пациентов после первого инсульта живет более 5 лет, однако около 30 % таких людей постоянно нуждаются в посторонней помощи, а 1 из 7 полностью зависим от нее (Hankey G.J., Jamrozik K., 2002). Принимая во внимание, что ведущей причиной инвалидности после инсульта является гемипарез, особое значение имеет разработка лечебных вмешательств, способствующих восстановлению двигательных функций в постинсультном периоде (Hurtado O., Lizasoain I., 2011).
В исследованиях на животных цитиколин оказался биологически активным соединением, усиливающим репаративные процессы после ишемии мозга и повышающим уровень ацетилхолина и дофамина. Кроме того, у пожилых животных цитиколин стимулировал высвобождение дофамина и улучшал память и способность к обучению (Secades J.J., Lorenzo J.L., 2006). С учетом плейотропного действия цитиколина Hurtado et al. исследовали у крыс эффекты длительного лечения цитиколином, начатого в первые 24 ч от начала очаговой ишемии мозга (Hurtado O., Cardenas A., 2007). Полученные результаты продемонстрировали, что лечение цитиколином улучшает сенсомоторную интеграцию и асимметричное двигательное поведение. В этих экспериментах цитиколин способствовал восстановлению движений паретичной передней конечности животных. Примечательно, что лечение сопровождалось увеличением плотности дендритов пятого слоя пирамидных нейронов сенсомоторной коры на стороне, противоположной стороне инфаркта. Увеличение плотности дендритов, связанное с реабилитационными мероприятиями или лечебными вмешательствами, ассоциируется с двигательным восстановлением при экспериментальном инсульте (Murphy T.H., Corbett D., 2009). Результаты других исследований также свидетельствуют, что при больших инфарктах с повреждением многих структур происходит значительная реорганизация мозга, захватывающая противоположное полушарие.
Результаты экспериментальных и клинических исследований продемонстрировали, что эффекты цитиколина могут быть обусловлены несколькими механизмами его воздействия на нейропластичность и нейрорепаративные процессы. Так, увеличение количества циркулирующих эндотелиальных клеток-предшествеников при ишемическом инсульте ассоциируется с лучшими исходами и меньшим размером инфаркта мозга, а цитиколин может способствовать мобилизации эндотелиальных клеток-предшествеников из костного мозга (Sobrino T., Hurtado O., 2007). В связи с этим Sobrino et al. исследовали влияние лечения цитиколином, начатого в остром периоде ишемического инсульта, на уровень клеток-предшественников эндотелия в крови (Sobrino T., Rodriguez-Gonzalez R., 2011). В исследование включали пациентов с первым в жизни нелакунарным ишемическим инсультом, симптомы которого появились в течение предшествующих 12 ч. Были включены 48 пациентов, 26 из которых получали лечение цитиколином (2000 мг в сутки на протяжении 6 недель), а 22 не получали лечения цитиколином. Исходно между группами не было значимых различий в уровне колониеобразующих эндотелиальных клеток (р = 0,819). Через 7 дней от начала заболевания уровень колониеобразующих эндотелиальных клеток самым высоким был у пациентов, которые получили лечение алтеплазой и цитиколином, а у испытуемых, получавших цитиколин, этот показатель был значимо выше, чем у пациентов, получавших плацебо (р < 0,001). Результаты анализа методом логистической регрессии свидетельствовали, что лечение цитиколином, особенно в сочетании с тромболитической терапией, было независимым предиктором существенного увеличения уровня колониеобразующих эндотелиальных клеток. Авторы пришли к заключению, что назначение цитиколина при остром инсульте может увеличивать концентрацию эндотелиальных клеток-предшественников и способствовать улучшению исхода заболевания.
Цитиколин при постинсультных сосудистых когнитивных нарушениях
Сосудистые когнитивные нарушения (СКН) охватывают весь спектр когнитивных расстройств, связанных с цереброваскулярными заболеваниями: от легких когнитивных нарушений до сосудистой деменции (СД) (Roman G.C., Sachdev P., 2004; Gorelick P.B., 2011). Результаты недавнего метаанализа 16 исследований свидетельствуют о тесной взаимосвязи инсульта и когнитивных нарушений, вплоть до деменции (Savva G.M., Stephan В.С., 2010). Данные большинства исследований демонстрируют, что инсульт удваивает риск деменции независимо от демографических показателей и наличия сосудистых факторов риска, причем предшествующие когнитивные нарушения не оказывают существенного влияния на риск развития СКН после инсульта (Ivan C.S., Seshadri S., 2004). Умеренные СКН (СКН без деменции) встречаются в 2 раза чаще, чем СД, и намного чаще, чем повторный инсульт (Rockwood K., 1999; Roman G.C., 2002). Через 6 месяцев после инсульта СКН той или иной степени тяжести наблюдаются у 44–74 % пациентов (Savva G.M., Stephan В.С., 2010; Fotuhi M., Hachinski V., 2009; Dolan H., Crain B., 2010). У половины пациентов с СКН в течение 5 лет развивается деменция (Wentzel C., Rockwood K., 2001). СД после ишемического, геморрагического или гемодинамического инсульта наблюдается примерно у 30 % выживших пациентов, а заболеваемость деменцией увеличивается с 7 % в течение первого года после инсульта до 48 % на протяжении 25 лет (Leys D., Henon H., 2005). С учетом критической роли инсульта в развитии деменции у пациентов пожилого возраста как адекватная первичная профилактика, так и полноценное лечение возникшего инсульта, включая нейропротекцию, имеют большое значение для предотвращения деменции (Reitz C., Bos M.J., 2008).
Число исследований, в которых изучались безопасность и эффективность длительного лечения цитиколином при остром инсульте и его эффективность в профилактике постинсультных когнитивных нарушений, пока невелико (Alvarez-Sabin J., Roman G.С., 2011).
Проведено несколько клинических испытаний цитиколина при болезни Альцгеймера, результаты которых свидетельствовали об умеренном улучшении памяти и поведения (Cacabelos R., Alvarez X.A., 1993). Однако в ходе плацебо-контролируемого клинического испытания у 30 пациентов с СД преимуществ лечения в отношении когнитивных функций не выявлено (Cohen R.A., Browndyke J.N., 2003). В кохрановский обзор были включены 14 исследований у пациентов пожилого возраста, которые страдали нарушениями памяти, СКН, СД или сенильной деменцией (Fioravanti M., Yanagi M., 2005). Длительность периода наблюдения составляла от 20–30 дней до 2–3 месяцев, одно исследование продолжалось 12 месяцев. В исследованиях использовались различные дозы цитиколина, критерии включения и конечные точки. Результаты свидетельствовали о позитивном влиянии цитиколина на память и поведение, а также о статистически значимом улучшении общего впечатления о динамике состояния по сравнению с группой плацебо. Величина эффекта была значительной (отношение шансов 8,89; р < 0,001), что свидетельствует о выраженном улучшении в группе активного лечения цитиколином (Fioravanti M., Yanagi M., 2005; Fioravanti M., Buckley A.E., 2006). Авторы обзоров пришли к заключению, что имеется отчетливое положительное влияние цитиколина на когнитивные функции, особенно заметное при оценке поведения. Цитиколин очень хорошо переносится, и в группе плацебо было документировано больше побочных действий, чем в группе активного лечения (Fioravanti M., Yanagi M., 2005; Fioravanti M., Buckley A.E., 2006).
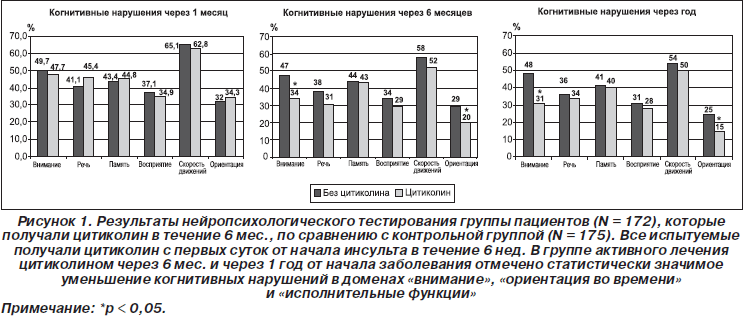
Недавно Alvarez-Sabin et al. продемонстрировали, что лечение цитиколином, начатое в первые 24 часа от начала заболевания и продолжавшееся 6 месяцев, было безопасным и имело преимущества в отношении профилактики постинсультных СКН по сравнению с плацебо (Alvarez-Sabin J., Ortega G., Jacas C., 2010). Цитиколин способствовал улучшению ориентации во времени, внимания и исполнительных функций (рис. 1). Подгруппа пациентов, у которых лечение было продолжено до 12 месяцев, продемонстрировала отличную переносимость и тенденцию к дальнейшему регрессу постинсультных СКН.
Предметом исследования Ortega et al. стало влияние лечения цитиколином на нейрокогнитивные функции после инсульта (Ortega G., Jacas C., 2010). Авторы включили в исследование 347 пациентов с первым в жизни ишемическим инсультом, у которых была проведена тщательная оценка когнитивных функций через 6 недель и 6 месяцев от начала заболевания. Все пациенты получали лечение цитиколином (2000 мг в сутки) в течение 6 недель, а затем методом рандомизации были распределены в одну из двух групп. Первая группа (N = 172) продолжала лечение цитиколином до 6 месяцев от начала заболевания, а вторая (N = 175) прекратила прием цитиколина. Изучение когнитивных функций проводилось с помощью большой батареи нейропсихологических тестов. Средний возраст испытуемых составил 67,2 года. Изначально значимых отличий между группами не было. В период наблюдения умерли 30 пациентов. Через 6 месяцев от начала заболевания у пациентов, которые не получали лечения цитиколином, были существенно более выраженные когнитивные нарушения, включая внимание, исполнительные функции и ориентацию во времени (р < 0,05). Авторы пришли к заключению, что лечение цитиколином в течение 6 месяцев с момента появления симптомов ишемического инсульта безопасно и уменьшает нейрокогнитивные нарушения. Таким образом, имеющиеся данные исследований позволяют сделать вывод, что длительное лечение цитиколином безопасно и может способствовать лучшему функциональному исходу и снижению тяжести когнитивных нарушений после ишемического инсульта (Alvarez-Sabin J., Ortega G., Jacas C., 2010; Garcia-Cobos R., Frank-Garcia A., 2010).
Заключение
Инсульт остается ведущей причиной смертности и инвалидности во всем мире. Тромболитическая терапия алтеплазой уже много лет является единственным медикаментозным вмешательством, обладающим доказанной эффективностью и разрешенным для клинического применения при ишемическом инсульте в развитых странах. Однако даже в странах с высоким уровнем доходов, таких как США, большинство небольших больниц не имеет достаточных ресурсов для проведения тромболизиса. В развивающихся странах, где бремя инсульта особенно велико, эти трудности имеют еще большие масштабы, и тромболитическая терапия проводится в очень небольшом числе случаев. В связи с этим как никогда велика потребность в эффективных нейропротекторах, которые могли бы принести пользу большинству пациентов с инсультом. Нейропротекция при ишемическом инсульте имеет достаточное научное обоснование, однако ввиду недоказанной эффективности изучавшихся вмешательств она пока не заняла надлежащего места в клинической практике. Между тем лечение ишемического инсульта не может сводиться лишь к восстановлению мозгового кровотока и должно включать борьбу с последствиями ишемического повреждения на уровне клеток и тканей.
Цитиколин является одним из наиболее перспективных лекарственных средств, которые могут как защищать мозг от сосудистого повреждения, так и способствовать его репарации. Результаты клинических исследований цитиколина, в которых приняли участие более 11 тыс. человек, свидетельствуют о том, что он может оказывать положительное влияние при инсульте, черепно-мозговой травме и когнитивных нарушениях. Цитиколин увеличивает пластичность мозга и способствует восстановлению двигательных функций после инсульта в эксперименте. Учитывая его высокую безопасность и хорошую переносимость, цитиколин может играть важную роль в реабилитационном периоде, позволяя уменьшить последствия инсульта и связанные с ним ограничения жизнедеятельности. Имеются отдельные сообщения об эффективности цитоколина в профилактике сосудистых когнитивных нарушений и смешанной сосудисто-нейродегенеративной деменции в постинсультном периоде, однако этот вопрос требует дальнейшего изучения.
В настоящее время проводятся исследования, в которых уточняются механизмы действия цитиколина и изучается его потенциал как средства для защиты и восстановления мозга. Если в ходе продолжающихся больших клинических испытаний, таких как ICTUS и CORBIT, удастся подтвердить результаты предшествующих исследований, это откроет дорогу широкому клиническому применению цитиколина при повреждениях мозга. Появление на украинском рынке более доступного препарата цитиколина (Сомаксон, Мили Хелскере Лтд., Великобритания) заставляет с нетерпением ждать новых доказательств эффективности цитиколина, которые должны появиться уже в ближайшее время. Наличие инъекционных и таблетированных форм Сомаксона обеспечивает преемственность терапии.
1. Adibhatla R.M., Hatcher J.F., Larsen E.C. Cytokine biology, lipid metabolism and citicoline in stroke // J. Cereb. Blood Flow Metab. 2007; 27(Suppl. 1): B06-B02.
2. Adibhatla R.M., Hatcher J.F. Cytidine 5'-diphosphocholine (CDP-choline) in stroke and other CNS disorders // Neurochem Res. 2005; 30: 15-23.
3. Adibhatla R.M., Hatcher J.F. Lipid oxidation and peroxidation in CNS health and disease: from molecular mechanisms to therapeutic opportunities // Antioxid. Redox Signal. 2010; 12: 125-169.
4. Adibhatla R.M., Hatcher J.F. Role of lipids in brain injury and diseases // Future Lipidol. 2007; 2: 403-422.
5. Alvarez-Sabin J., Ortega G., Jacas C. et al. Citicoline treatment prevents neurocognitive decline after a first ischemic stroke (Poster 743) // Cerebrovasc. Dis. 2010; 29(Suppl. 2): 268.
6. Alvarez-Sabin J., Roman G.С. Citicoline in vascular cognitive impairment and vascular dementia after stroke // Stroke. 2011; 42; S40-S43.
7. Bang O.Y., Saver J.L., Buck B.H. et al. UCLA Collateral Investigator. Impact of collateral flow on tissue fate in acute ischaemic stroke // J. Neurol. Neurosurg. Psych. 2008; 79: 625-629.
8. Brittain K. Stroke and incontinence care // Nurs. Times. 2001; 97: 57.
9. Cacabelos R., Alvarez X.A., Franco-Maside A. et al. Effect of CDP-choline on cognition and immune function in Alzheimer’s disease and multi-infarct dementia // Ann. NY Acad. Sci. 1993; 695: 321-323.
10. Cho H.J., Kim Y.J. Efficacy and safety of oral citicoline in acute ischemic stroke: drug surveillance study in 4,191 cases // Methods Find Exp. Clin. Pharmacol. 2009; 31: 171-176.
11. Clark W.M., Warach S.J., Pettigrew L.C., et al. A randomized dose-response trial of citicoline in acute ischemic stroke patients // Citicoline Stroke Study Group. Neurology. 1997; 49: 671-678.
12. Clark W.M., Wechsler L.R., Sabounjian L.A., Schwiderski U.E. Citicoline Stroke Study Group. A phase III randomized efficacy trial of 2000 mg citicoline in acute ischemic stroke patients // Neurology 2001; 57: 1595-1602.
13. Clark W.M., Williams B.J., Selzer K.A. et al. A randomized efficacy trial of citicoline in patients with acute ischemic stroke // Stroke. 1999; 30: 2592-2597.
14. Clark W.M. Efficacy of citicoline as an acute stroke treatment // Expert. Opin. Pharmacother. 2009; 10(5): 839-846.
15. Cobo E., Secades J.J., Miras F. et al. Boosting the chances to improve stroke treatment // Stroke. 2010; 41: el43-e50.
16. Cohen R.A., Browndyke J.N., Moser D.J. et al. Long-term citicoline (cytidine diphosphate choline) use in patients with vascular dementia: neuroimaging and neuropsychological outcomes // Cerebrovasc Dis. 2003; 16: 199-204.
17. Conant R., Schauss A.G. Therapeutic applications of citicoline for stroke and cognitive dysfunction in the elderly: a review of the literature // Altern. Med. Rev. 2004; 9: 17-31.
18. Dafer R.M., Rao M., Shareef A., Sharma A. Poststroke depression // Top Stroke Rehabil. 2008; 15(1): 13-21.
19. Davalos A., Castillo J., Alvarez-Sabin J. et al. Oral citicoline in acute ischemic stroke: an individual patient data pooling analysis of clinical trials // Stroke. 2002; 33: 2850-2857.
20. Davalos A., Secades J. Citicoline Predinical and Clinical Update 2009–2010 // Stroke 2011; 42: S36-S39.
21. Davalos A. Protocol 06PRT/3005: ICTUS study: International Citicoline Trial on acUte Stroke (NCT00331890) oral citicoline in acute ischemic stroke // Lancet Protocol Reviews 2007. http://www.thelancet.com/journals/lancet/misc/protocol/protocolreviews
22. Dolan H., Crain B., Troncoso J. et al. Atherosclerosis, dementia, and Alzheimer disease in the Baltimore Longitudinal Study of Aging cohort // Ann. Neurol. 2010; 68: 231-240.
23. Donnan G.A., Fisher M., Macleod M., Davis S.M. Stroke // Lancet. 2008; 371: 1612-1623.
24. Donnan G.A. A new road map for neuroprotection // Stroke. 2008; 39: 242-248.
25. Fioravanti M., Buckley A.E. Citicoline (Cognizin) in the treatment of cognitive impairment // Clin. Interv. Aging. 2006; 1: 247-251.
26. Fioravanti M., Yanagi M. Cytidinediphosphocholine (CDP-choline) for cognitive and behavioural disturbances associated with chronic cerebral disorders in the elderly // Cochrane Database Syst. Rev. 2005; 18: CD000269.
27. Fisher M., Cheung K., Howard G., Warach S. New pathways for evaluating potential acute stroke therapies // Int. J. Stroke. 2006; 1: 52-58.
28. Fisher M., Feuerstein G.Z., Howells D.W. et al. the STAIR group. Update of the Stroke Therapy Academic Industry Roundtable preclinical recommendations // Stroke. 2009; 40: 2244-2250.
29. Fisher M. New approaches to neuroprotective drug development // Stroke 2011; 42; S24-S27
30. Fisher M. The ischemic penumbra: a new opportunity for neuroprotection // Cerebrovasc. Dis. 2006 (suppl. 2): 64-70.
31. Fotuhi M., Hachinski V., Whitehouse P.J. Changing perspectives regarding late-life dementia // Nat. Rev. Neurol. 2009; 5: 649-658.
32. Garcia-Cobos R., Frank-Garcia A., Gutierrez-Fernandez M., Diez-Tejedor E. Citicoline use in cognitive decline: vascular and degenerative // J. Neurol. Sci. 2010; 299: 188-192.
33. Ginsberg M.D. Current status of neuroprotection for cerebral ischemia: synoptic overview // Stroke 2009; 40; S111-S114.
34. Gladstone D.J., Black S.E., Hakim A.M. Toward wisdom from failure: lessons from neuroprotective stroke trials and new directions // Stroke. 2002; 33: 2123-2136.
35. Goldberg M.P. New approaches to clinical trials in neuroprotection: introduction // Stroke. 2007; 38(part 2): 789-790.
36. Gorelic P.B., Scuteri A., Black S.E. et al. Vascular contribution to cognitive impairment and dementia: a statement for healthcare professionals from the American Heart Associasion/American Stroke Association // Stroke. 2011; 42: 2672-2713.
37. Gutiйrrez M., Merino J.J., de Leciсana M.A., Dнez-Tejedor E. Cerebral protection, brain repair, plasticity and cell therapy in ischemic stroke // Cerebrovasc. Dis. 2009; 27(Suppl. 1): 177-86.
38. Hacke W., Kaste M., Bluhmki E. et al. the ECASS Investigators. Thrombolysis with Alteplase 3 to 4.5 hours after acute ischemic stroke // N. Engl. J. Med. 2008; 359: 1317-1329.
39. Hankey G.J., Jamrozik K., Broadhurst R.J., Forbes S., Anderson C.S. Long-term disability after first-ever stroke and related prognostic factors in the Perth Community Stroke Study, 1989–1990 // Stroke. 2002; 33: 1034-1040.
40. Hill M.D., Martin R.H., Palesch Y.Y. et al. The Albumin in Acute Stroke part 1 trial: an exploratory efficacy analysis // Stroke. 2011; 42: 1621-1625.
41. Hossman K.A. Pathophysiology and therapy of experimental stroke // Cell. Mol. Neurobiol. 2006; 26: 1055-1081.
42. Hurtado O., Cardenas A., Pradillo J.M. et al. A chronic treatment with CDP-choline improves functional recovery and increases neuronal plasticity after experimental stroke // Neurobiol. Dis. 2007; 26: 105-111.
43. Hurtado O., Lizasoain I., Moro M.A. Neuroprotection and recovery: recent data at the bench on citicoline // Stroke. 2011; 42: S33-S35.
44. Hurtado O., Moro M.A., Cardenas A. et al. Neuroprotection afforded by prior citicoline administration in experimental brain ischemia: effects on glutamate transport // Neurobiol. Dis. 2005; 18: 336-345.
45. Ivan C.S., Seshadri S., Beiser A. et al. Dementia after stroke: the Framingham Study // Stroke. 2004; 35: 1264-1268.
46. Kleindorfer D., Xu Y., Moomaw. US geographic distribution of rt-PA utilization by hospital for acute ischemic stroke // Stroke. 2009; 40: 3580-3584.
47. Labiche L.A., Grotta J.C. Clinical trials for cytoprotection in stroke // NeuroRx. 2004; 1: 46-70.
48. Leys D., Henon H., Mackowiak-Cordoliani M.A., Pasquier F. Poststroke dementia // Lancet Neurol. 2005; 4: 752-759.
49. Lo E., Dalkara T., Moskowitz M. Mechanisms, challenges and opportunities in stroke // Nat. Rev. Neurosci. 2003; 4: 399-415.
50. Lo E.H., Moskowitz M.A., Jacobs T.P. Exciting, radical, suicidal: how brain cells die after stroke // Stroke. 2005; 36: 189-192.
51. Lo EH. A new penumbra: transitioning from injury into repair after stroke // Nat. Med. 2008; 14: 497-500.
52. Martini S.R., Kent Т.А. Hyperglycemia in acute ischemic stroke: a vascular perspective // J. Cereb. Blood Flow Metab. 2007; 27: 435-451.
53. Murphy T.H., Corbett D. Plasticity during stroke recovery: from synapse to behaviour // Nat. Rev. Neurosci. 2009; 10: 861-872.
54. O’Collins V.E., Macleod M.R., Donnan G.A., Horky L.L., van der Worp B.H., Howells D.W. 1,026 experimental treatments in acute stroke // Ann. Neurol. 2006; 59: 467-477.
55. Ortega G., Jacas C., Quintana M. et al. Citicoline treatment prevents neurocognitive decline after a first ischemic stroke // Cerebrovasc. Dis. 2010; 29(Suppl. 2): 268.
56. Pandian J.D., Padma V., Vijara P. et al. Stroke and thrombolysis in developing countries // Int. J. Stroke. 2007; 2: 17-26.
57. Reitz C., Bos M.J., Hofman A., Koudstaal P.J., Breteler M.M. Prestroke cognitive performance, incident stroke, and risk of dementia: the Rotterdam Study // Stroke. 2008; 39: 36-41.
58. Rockwood K. Subtypes of vascular dementia // Alzheimer Dis. Assoc. Disord. 1999; 13(Suppl. 3): S59-S65.
59. Roman G.C., Sachdev P., Royall D.R. et al. Vascular cognitive disorder: a new diagnostic category updating vascular cognitive impairment and vascular dementia // J. Neurol. Sci. 2004; 226: 81-87.
60. Roman G.C. Vascular dementia may be the most common form of dementia in the elderly // J. Neurol. Sci. 2002; 203-204: 7-10.
61. Saver J.L. Citicoline: update on a promising and widely available agent for neuroprotection and neurorepair // Rev. Neurol. Dis. 2008; 5: 167-177.
62. Savva G.M., Stephan В.С. Alzheimers Society Vascular Dementia Systematic Review Group. Epidemiological studies of the effect of stroke on incident dementia: a systematic review // Stroke. 2010; 41: e41-e46.
63. Secades J.J., Lorenzo J.L. Citicoline: Pharmacological and clinical review, 2006 Update // Methods Find Exp. Clin. Pharmacol. 2006; 28(Suppl. B): l-56.
64. Sicard K.M., Fisher M. Emerging drugs for acute ischemic stroke // Expert. Opin. Emerg Drugs. 2009; 14: l-10.
65. Sobrino T., Hurtado O., Moro M.A. et al. The increase of circulating endothelial progenitor cells after acute ischemic stroke is associated with good outcome // Stroke. 2007; 38: 2759-2764.
66. Sobrino T., Rodriguez-Gonzalez R., Blanco M., Brea D., Perez-Mato M., Rodriguez-Yafiez M., Leira R., Castillo J. CDP-choline treatment increases circulating endothelial progenitor cells in acute ischemic stroke // Neurol. Res. 2011 Jul; 33(6): 572-7.
67. Stroke Therapy Academic Industry Roundtable (Fisher M., Chair). Recommendations for standards regarding preclinical neuroprotective and restorative drug development // Stroke. 1999; 30: 2752-2758.
68. Teasel R., McRae M., Foley N., Bhardwaj A. The incidence and consequences of falls in stroke patients during inpatient rehabilitation: factors associated with high risk // Arch. Phys. Med. Rehab. 2002; 83: 329-333
69. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke // N. Engl. J. Med. 1995; 333: 1581-1587.
70. Wahlgren N., Ahmed N., Dбvalos A. et al. SITS-MOST investigators. Thrombolysis with alteplase for acute ischemic stroke in the Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS-MOST): an observational study // Lancet. 2007; 369: 275-282
71. Warach S., Pettigrew L.C., Dashe J.F. et al. Effect of citicoline on ischemic lesions as measured by diffusion-weighted magnetic resonance imaging. Citicoline 010 Investigators // Arm. Neurol. 2000; 48: 713-722.
72. Wentzel C., Rockwood K., MacKnight C. et al. Progression of impairment in patients with vascular cognitive impairment without dementia // Neurology. 2001; 57: 714-716.
73. Wolfe C.D.A. The impact of stroke // Br. Med. Bull. 2000; 56: 275-86
74. Zafonte R., Friedewald W.T., Lee S.M. et al. The citicoline brain injury treatment (COBRIT) trial: design and methods // J. Neurotrauma. 2009; 26: 2207-2216.