Журнал «» 5(19) 2011
Вернуться к номеру
Поліклінічний досвід застосування препарату Вабадин (симвастатин) в корекції дисліпідемії у пацієнтів з високим ризиком кардіоваскулярних ускладнень
Авторы: Чернишов В.А., Єрмакович І.І., ДУ «Інститут терапії ім. Л.Т. Малої АМН України», м. Харків
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
У статті наведено результати амбулаторного застосування гіполіпідемічного препарату Вабадин (симвастатин) у дозі 40 мг/добу протягом 8 тижнів з метою корекції атерогенної дисліпідемії в 38 пацієнтів з ішемічною хворобою серця, артеріальною гіпертензією й цукровим діабетом 2-го типу віком від 44 до 56 років з високим ризиком серцево-судинних ускладнень.
У цієї категорії пацієнтів при застосуванні препарату продемонстровано виражений гіпохолестеринемічний ефект — знижено рівні ЗХС на 26,6 % (p < 0,01), ХС ЛПНЩ — на 35,8 % (p < 0,001) і ХС не-ЛПВЩ — на 33,5 % (p < 0,001). Зниження рівнів ТГ, ХС ЛПДНЩ і підвищення рівня ХС ЛПВЩ мало характер тенденції, що свідчить про необхідність більш тривалого прийому препарату для достовірної зміни цих показників.
Показано, що наявність Вабадину в складі комбінованої терапії з антиангінальними й антигіпертензивними препаратами дозволяє більш ефективно знизити артеріальний тиск, зменшити кількість і тривалість епізодів ішемії міокарда, знизити дози антиангінальних і антигіпертензивних препаратів. Результати поліклінічного спостереження за пацієнтами свідчать про задовільний профіль переносимості препарату Вабадин у дозі 40 мг, відсутність істотних побічних ефектів і негативного впливу на біохімічні параметри контролю безпеки гіполіпідемічної терапії.
Симвастатин, дисліпідемія, кардіоваскулярний ризик, поліклінічна терапія.
До цього часу накопичено достатню доказову базу ефективності застосування статинів як засобів не тільки вторинної профілактики ішемічної хвороби серця (ІХС) у пацієнтів з високим (дослідження 4S, LIPID та ін.), низьким і середнім (дослідження PROVE-IT, CARE, IDEAL, TNT та ін.) рівнем холестерину (ХС), але й первинної профілактики в осіб без ІХС з наявністю інших чинників кардіоваскулярного ризику (КВР) (дослідження MEGA, JUPITER та ін.) [26, 36, 38].
Корекція ліпідного профілю за допомогою статинів поряд із модифікацією способу життя залишається сьогодні пріоритетним напрямком терапії [35]. Необхідність активної фармакотерапії для пацієнтів із чинниками КВР визначається сукупним ризиком і вмістом ліпідів у крові, а для пацієнтів із серцево-судинними захворюваннями (ССЗ) і цукровим діабетом (ЦД) призначення статинів показане незалежно від вихідного рівня ліпідів [30].
Доведено, що у хворих з ІХС зниження КВР при лікуванні статинами є пропорційним вихідному ризику і не залежить від рівня загального холестерину (ЗХС) до лікування. Звідси випливає, що чим вищий ризик кардіоваскулярних ускладнень (КВУ), тим агресивнішою повинна бути ліпідознижуюча терапія [9], а це, у свою чергу, потребує використання більш високої добової дози гіполіпідемічного засобу.
Однак у рутинній клінічній практиці частіше використовуються невеликі добові дози статинів (10–20 мг/добу), а у більшості проведених досліджень зі статинами порівнювалися ті препарати, що мало застосовуються кардіологами у повсякденній практиці навіть сьогодні. Тому залишається актуальним і становить інтерес дослідження ефективності та безпечності використання більш високих добових доз статинів (40–80 мг) у пацієнтів з високим ризиком КВУ, особливо в амбулаторній практиці.
Мета дослідження — оцінити гіполіпідемічну ефективність, антиішемічні ефекти, вплив на артеріальний тиск (АТ) та безпечність застосування симвастатину у дозі 40 мг/добу (препарат Вабадин, фірма Berlin-Chemie Menarini Group, Німеччина) у пацієнтів з високим ризиком КВУ, які перебувають під амбулаторним спостереженням в умовах поліклініки.
Матеріал і методи
У дослідженні брали участь 38 пацієнтів (20 чоловіків і 18 жінок) з верифікованою ІХС віком від 44 до 56 років (середній вік — 48,9 ± 1,8 року) з гіпертонічною хворобою (ГХ) ІІ–ІІІ стадії і ЦД 2-го типу в стані компенсації або субкомпенсації вуглеводного обміну, що супроводжувався вторинною дисліпопротеїдемією (ДЛП) ІІа, ІІb і ІV типів та комбінованою ДЛП, в якій знижений вміст у сироватці крові холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) — гіпоальфахолестеринемія (ГАХС) — поєднувався із зазначеними типами ДЛП. Усі запрошені особи дали добровільну згоду на участь у дослідженні й перебували під динамічним амбулаторним спостереженням у відділенні популяційних досліджень ДУ «Інститут терапії ім. Л.Т. Малої АМН України» у консультативній поліклініці інституту.
Відбиралися пацієнти, які упродовж 4–6 тижнів до запрошення не приймали будь-яких гіполіпідемічних засобів. Усі пацієнти під час поліклінічного спостереження дотримувалися гіполіпідемічної дієти і продовжували приймати індивідуально підібрану гіпоглікемічну терапію.
Клінічним проявом захворювання в усіх залучених у дослідження осіб була стабільна стенокардія напруження ІІ–ІІІ функціонального класів (ФК) за класифікацією Канадської асоціації кардіологів [3]. ІІ ФК стенокардії напруження діагностовано у 16 (42,1 %) хворих, ІІІ ФК — у 22 (57,9 %) обстежених. Тривалість стенокардії напруження, за даними анамнезу, коливалася від 3 до 13 років і в середньому становила 7,7 ± 2,1 року. У 14 (36,8 %) пацієнтів в анамнезі мав місце перенесений раніше інфаркт міокарда (ІМ) з давністю події від 2 до 9 років (у середньому 5,3 ± 1,9 року). Стадію ГХ та ступінь підвищення АТ встановлювали за рекомендаціями Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2008) [14]. Серед залучених у дослідження осіб ГХ ІІ стадії виявлено в 15 (39,5 %) випадках, ІІІ стадії — у 23 (60,5 %) хворих. Підвищення АТ, що відповідало 1-му ступеню, спостерігалося у 16 (42,1 %) осіб, 2-му ступеню — у 22 (57,9 %) хворих.
У 17 (44,7 %) пацієнтів був ЦД 2-го типу у стані компенсації вуглеводного обміну і у 21 (55,3 %) хворого — у стані субкомпенсації за відомими діагностичними критеріями ВООЗ [40].
Тип ДЛП встановлювався за класифікацією D.S. Fredrickson із сучасними доповненнями [8]. ДЛП ІІа, ІІb і IV типів виявлено відповідно у 7 (18,4 %), 9 (23,7 %) і 6 (15,8 %) хворих. У 8 (21,1 %), 5 (13,1 %) і 3 (7,9 %) випадках спостерігалося поєднання ГАХС з ІІа, ІІb і IV типами ДЛП відповідно.
У дослідження не залучали хворих зі стенокардією напруження IV ФК, тяжкою артеріальною гіпертензією (АГ), застійною серцевою недостатністю, тяжкими порушеннями ритму серця (фібриляція передсердь, пароксизмальна тахікардія, часта шлуночкова екстрасистолія), клінічно вагомими порушеннями функції печінки й нирок, ЦД 1-го типу, захворюваннями м’язів (міастенія та ін. ураження м’язової системи), патологією щитоподібної залози, наявністю в анамнезі ІМ або мозкового інсульту терміном до 6 місяців перед залученням у дослідження.
З приводу стабільної стенокардії напруження та АГ пацієнтам призначено комбіновану антиангінальну й антигіпертензивну терапію, що складалася в 19 (50,0 %) випадках з нітратів пролонгованої дії, у 29 (76,3 %) — кардіоселективних бета-адреноблокаторів, у 27 (71,0 %) — інгібіторів ангіотензинперетворюючого ферменту (ІАПФ), в 11 (28,9 %) — блокаторів рецепторів ангіотензину ІІ (БРАІІ), в 10 (26,3 %) — антагоністів кальцію (АК) і в 38 (100 %) — ацетилсаліцилової кислоти. Для корекції порушень вуглеводного обміну 10 (26,3 %) хворих приймали метформін, 15 (39,5 %) — гліклазид і 13 (34,2 %) — глімепірид.
З метою корекції ДЛП усім хворим призначено симвастатин (Вабадин, Berlin-Chemie Menarini Group, Німеччина) у дозі 40 мг/добу через 30 хв після вечері на термін 8 тижнів.
Усім залученим у дослідження пацієнтам визначали вміст у сироватці крові ЗХС, тригліцеридів (ТГ), ХС ЛПВЩ ферментативним методом на автоаналізаторі Humareader (Німеччина) з використанням наборів реагентів фірми Human (Німеччина). Вміст холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ) обчислювали за формулою W.T. Friedewald [18]:
ХС ЛПНЩ = ЗХС – (ХС ЛПВЩ + ТГ/2,22),
де ТГ/2,22 — вміст холестерину у складі ліпопротеїдів дуже низької щільності (ХС ЛПДНЩ).
Для поглибленої характеристики ДЛП додатково визначали концентрацію ХС у складі не-ЛПВЩ (ЛПДНЩ + ЛПНЩ) за різницею ЗХС і ХС ЛПВЩ. Оскільки відмітною рисою ДЛП, що асоціюється з ЦД 2-го типу, є одночасне порушення метаболізму ЛПВЩ і ТГ, визначали також співвідношення ТГ/ХС ЛПВЩ, що характеризує внесок ліпопротеїдліполізу ТГ-вмісних ЛПДНЩ в утворення ЛПВЩ [2].
Зазначені показники ліпідного обміну визначалися, відповідно, у вихідному стані пацієнтів до призначення симвастатину і у два наступних візити — через 4 і 8 тижнів від початку гіполіпідемічної терапії.
Досягнення цільових рівнів ліпідів у хворих контролювали за рекомендаціями Європейського товариства кардіологів (ESC, 2007) [29] та Менеджменту з лікування дисліпідемій ADA і ACC (2008) для пацієнтів високого кардіометаболічного ризику [27].
Для оцінки антиішемічних ефектів симвастатину всім пацієнтам проводили добове моніторування електрокардіограми (ДМЕКГ) за допомогою системи кардіомоніторування «Ритм» науково-технічного товариства «Бета» (Україна, м. Кіровоград) за стандартною методикою [16]. Аналізували середню кількість і тривалість больових та безбольових епізодів ішемії міокарда, а також середній час сумарної ішемії міокарда за добу.
Для дослідження впливу симвастатину на АТ усім залученим у дослідження хворим виконували добове моніторування артеріального тиску (ДМАТ) за допомогою приладу АВМР-04 (Meditech, Угорщина). Аналізували такі показники: середній систолічний і діастолічний артеріальний тиск за добу (САТсер і ДАТсер), середній САТ і ДАТ удень і вночі (САТсер (день), ДАТсер (день), САТсер (ніч), ДАТсер (ніч)).
Для оцінки безпечності гіполіпідемічної терапії симвастатином у дозі 40 мг/добу в динаміці спостереження за хворими проводили біохімічні дослідження крові з визначенням вмісту сечовини, креатиніну, глюкози, сечової кислоти, активності печінкових трансаміназ (аспартат- і аланінамінотрансферази (АсАТ, АлАТ)), креатинфосфокінази (КФК) стандартними загальновідомими методами [5].
Статистичну обробку отриманих даних виконано на персональному комп’ютері за допомогою прикладної програми Statistica. Результати наведено як середні арифметичні значення і помилки середньої величини (M ± m). Вірогідність відмінностей оцінювали за t-критерієм Стьюдента.
Результати та їх обговорення
Відомо, що головним механізмом дії статинів є блокування внутрішньопечінкового синтезу ХС внаслідок пригнічення активності ключового ферменту синтезу ХС — 3-гідроксиметил-глютарил-коензим-А-редуктази (ГМГ-КоА). Це призводить до збільшення на поверхні гепатоцитів кількості рецепторів до ЛПНЩ і посилення виведення частинок ЛПНЩ із кровотоку [11]. Наслідком цього є зниження вмісту в крові ЗХС через уміст ХС ЛПНЩ. За даними клінічних досліджень, симвастатин у терапевтичних дозах 20–40 мг/добу знижує рівень ЗХС у середньому на 23–27 % і ХС ЛПНЩ — на 27–48 %. Вираженість впливу препарату на показники ліпідного обміну має дозозалежний характер. Кожне подвоєння дози симвастатину, починаючи з 20 мг/добу, дозволяє додатково знизити рівень ХС ЛПНЩ на 6–7 % [10].
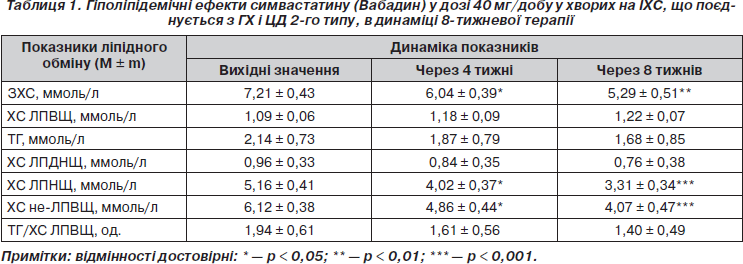
Результати проведеного нами дослідження гіполіпідемічних ефектів симвастатину (Вабадин), що застосовувався з метою корекції атерогенної ДЛП у хворих на ІХС, ГХ і ЦД 2-го типу (табл. 1) свідчать, що призначення препарату в дозі 40 мг/добу упродовж 8 тижнів призводить до вираженого гіпохолестеринемічного ефекту. Так, рівень ЗХС вже через 4 тижні лікування вірогідно знизився в середньому на 16,2 % (p < 0,05), а ще через 4 тижні — на 26,5 % (p < 0,01). При цьому зниження вмісту в крові ЗХС відбувалося переважно через зменшення концентрації ХС у складі ЛПНЩ відповідно на 22,1 % (p < 0,05) і 35,8 % (p < 0,001). Схожий гіпохолестеринемічний ефект спостерігали інші дослідники, які призначали Вабадин хворим без ЦД 2-го типу в добових дозах 20 мг упродовж 30 днів [10] і 20–40 мг упродовж 24 тижнів [6].
Позитивний вплив Вабадину на підвищений рівень ЗХС і його фракцію у складі частинок ЛПНЩ є надзвичайно важливим, оскільки саме ці показники безпосередньо корелюють з ризиком атеросклерозу і пов’язаних із ним КВУ. Їх зниження в результаті гіполіпідемічної терапії до цільових значень супроводжується достовірним покращенням прогнозу захворювання. Загальноприйнятими на сьогодні цільовими рівнями для хворих на ІХС вважаються показники ЗХС < 4,5 ммоль/л і ХС ЛПНЩ < 2,5 ммоль/л. При приєднанні до ІХС двох і більше чинників ризику (в тому числі ЦД 2-го типу) доцільним вважається зниження цих показників < 4,0 ммоль/л і < 1,8 ммоль/л відповідно [29, 30]. У країнах Західної Європи із 70 % пацієнтів, які отримують статини для зниження рівня ХС, цільових значень ЗХС і ХС ЛПНЩ досягають лише 53 % [20]. Результати дослідження Lipid Treatment Assessment Project-2 свідчать, що лише 30 % пацієнтів з дуже високим КВР (ІХС + 2 і більше чинників ризику) досягають цільового рівня ХС ЛПНЩ < 1,8 ммоль/л [4].
У нашому дослідженні з 38 пацієнтів цільового рівня ЗХС < 4,5 ммоль/л досягли 18 (47,4 %) хворих, рівня ХС ЛПНЩ < 2,5 ммоль/л — 16 (42,1 %) осіб. Із 14 (36,8 %) пацієнтів з дуже високим КВР (перенесений в анамнезі ІМ) рівень ЗХС < 4,0 ммоль/л через 8 тижнів лікування відзначений у 7 (18,4 %) хворих, рівень ХС ЛПНЩ < 1,8 ммоль/л — у 6 (15,8 %) осіб. У контексті обговорення отриманих даних зазначимо, що, на жаль, найнижча межа ХС ЛПНЩ, за якою вже не спостерігається зменшення частоти кардіоваскулярних подій, залишається невизначеною. Тому сьогодні можна стверджувати, що чим нижчий рівень ХС ЛПНЩ, тим кращий серцево-судинний прогноз [9].
Окрім ХС ЛПНЩ, що залишається головним «негативним персонажем» атерогенезу і головною ліпідною мішенню терапії, існують інші ліпідні фракції, здатні робити внесок у підвищення КВР, такі як ТГ і ХС ЛПВЩ. Особливо це стосується хворих на ЦД, у яких часто зустрічається комбінована ДЛП, при якій ризик смерті від ІХС залишається високим [13]. Діабетична ДЛП корелює з інсулінорезистентністю (ІР) і супроводжується підвищеним рівнем ТГ і зниженим рівнем ХС ЛПВЩ — показниками, внесок яких у підвищення ризику КВУ є доведеним [13, 20, 22].
У нашому дослідженні у хворих на ІХС, поєднаною з ГХ і ЦД 2-го типу, застосування Вабадину у дозі 40 мг/добу упродовж 8 тижнів супроводжувалося тенденцією до зниження вмісту ТГ у крові на 12,6 і 21,5 % (p > 0,05) відповідно через 4 і 8 тижнів лікування. Аналогічні зміни відбувалися з фракцією ХС у складі ЛПДНЩ (відзначено тенденцію до зниження показника відповідно на 12,5 і 20,8 % (p > 0,05)).
Обговорюючи отримані дані, слід указати, що в раніше надрукованих працях з вивчення симвастатину та інших статинів відсоток зниження рівня ТГ залежав від вихідного значення показника [15, 37]: чим вищий вихідний рівень ТГ, тим більший відсоток його зниження на тлі монотерапії статином.
У нашому дослідженні, незважаючи на підвищений вихідний рівень ТГ, динаміка показника мала характер тенденції до зниження, ймовірно, із двох причин. По-перше, ІР, що існує при ЦД 2-го типу, може послаблювати гіпотригліцеридемічну активність статинів через посилений додатковий синтез ТГ із вільних жирних кислот у поєднанні з підвищеним рівнем глюкози (синтез ТГ у цьому разі відбувається гліцерофосфатним шляхом) [11, 21]. По-друге, можна вважати, що термін 8 тижнів є недостатнім для отримання достовірного зниження сироваткового рівня ТГ у хворих на ЦД 2-го типу на тлі терапії симвастатином у дозі 40 мг/добу. Підтвердженням цього є дані окремих дослідників [6], які навіть у хворих без ЦД 2-го типу спостерігали достовірне зниження ТГ на 20,1 % (p < 0,05) при застосуванні Вабадину у дозі 20–40 мг/добу лише через 24 тижні лікування.
При ЦД 2-го типу, як відомо, підвищений синтез ЛПДНЩ, багатих на ТГ, поряд із сповільненням катаболізму цих частинок у зв’язку зі зниженням активності позапечінкової ліпопротеїдліпази опосередковано призводить до зниження вмісту в сироватці крові антиатерогенних ЛПВЩ. Це відбувається внаслідок зменшення субстрату (позбавлених від ТГ шару частинок ЛПДНЩ), необхідного для утворення ЛПВЩ [11, 13, 17]. Більше того, при ЦД 2-го типу у структурі ЛПВЩ відбуваються якісні зміни, як-от: глікозування апобілків, перекисне окислення, збільшення вмісту в них ТГ та кількості малих щільних частинок ЛПВЩ. Усі ці зміни порушують ХС-акцепторну функцію ЛПВЩ, зворотний транспорт ХС і можуть мати значення в атерогенезі [17, 21].
Не можна виключити, що в нашому дослідженні саме за цих умов підвищення концентрації ХС ЛПВЩ під впливом Вабадину у дозі 40 мг/добу не було достовірним. Через 4 і 8 тижнів лікування показник мав тенденцію до підвищення відповідно на 8,2 та 11,9 % (p > 0,05). У контексті обговорення цих даних слід відзначити, що у більшості відкритих досліджень з невеликою кількістю пацієнтів підвищення рівня ХС ЛПВЩ при лікуванні симвастатином становить приблизно 8–14 % і, як правило, не досягає статистичної достовірності [7, 15].
Окремими дослідниками [15, 19] встановлено, що вплив симвастатину на рівень ХС ЛПВЩ залежить від його вихідного значення: чим воно нижче, тим більший відсоток його підвищення. В нашому дослідженні середній вихідний рівень ХС ЛПВЩ не був низьким і перебільшував 1,0 ммоль/л (1,09 ± 0,06 ммоль/л), із цим може бути пов’язана тенденція до підвищення показника під впливом курсової терапії Вабадином.
Сьогодні доречним підходом до лікування пацієнтів із метаболічним синдромом або ЦД 2-го типу з категорії високого ризику повинна бути терапія, спрямована на корекцію співвідношення ТГ/ХС ЛПВЩ, оскільки відмітною рисою ДЛП, що асоціюється з цими станами, є одночасне порушення метаболізму ЛПВЩ і ТГ [39]. У нашому дослідженні показник співвідношення ТГ/ХС ЛПВЩ мав тенденцію до зниження на 17,9 і 27,8 % (p > 0,05) відповідно через 4 та 8 тижнів лікування Вабадином у дозі 40 мг/добу внаслідок недостовірної позитивної динаміки ТГ і ХС ЛПВЩ. Імовірно, що для достовірного зниження цього ліпідного співвідношення потрібний більш тривалий термін гіполіпідемічної терапії у хворих на ЦД 2-го типу.
Цікавим є і такий показник, як уміст ХС у складі не-ЛПВЩ. Існують докази того, що рівень ХС не-ЛПВЩ може розглядатися як більш сильний предиктор ССЗ, ніж рівень ХС ЛПНЩ, особливо у пацієнтів, які приймають статини [27, 28]. Отримані нами дані свідчать, що лікування Вабадином 40 мг/добу призводить до позитивної динаміки ХС не-ЛПВЩ вже через 4 тижні терапії (зниження показника на 20,6 % (p < 0,05)) і подальшого суттєвого зменшення вмісту ХС не-ЛПВЩ (на 33,5 % (p < 0,001)) наприкінці лікування. Причому вагомий внесок у зниження концентрації ХС не-ЛПВЩ робить гіпохолестеринемічний ефект препарату, зокрема зниження рівня ХС ЛПНЩ на 35,8 % (p < 0,001), оскільки зменшення вмісту в сироватці крові ХС у складі ЛПДНЩ унаслідок гіпотригліцеридемічної дії Вабадину було недостовірним і характеризувалося лише тенденцією до зниження показника (табл. 1).
Отже, результати вивчення гіполіпідемічної дії препарату Вабадин (симвастатин) у дозі 40 мг/добу у хворих на ІХС, що поєднується з ГХ і ЦД 2-го типу, призначеного з метою корекції атерогенної ДЛП, свідчать про виражений гіпохолестеринемічний ефект, що спостерігається через 8 тижнів лікування і полягає у достовірному зниженні рівня ЗХС на 26,6 % (p < 0,01) переважно через зменшення вмісту ХС у складі ЛПНЩ на 35,8 % (p < 0,001). Завдяки гіпохолестеринемічній дії Вабадину спостерігається достовірне зниження концентрації ХС у складі не-ЛПВЩ у середньому на 33,5 % (p < 0,001).
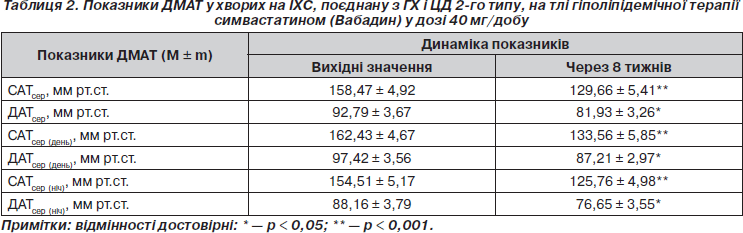
Додавання симвастатину (Вабадину) у дозі 40 мг/добу до комбінованої антиангінальної й антигіпертензивної терапії, до якої входили нітрати пролонгованої дії, кардіоселективні b-адреноблокатори з вазодилатуючими властивостями, ІАПФ, БРАІІ, АК, сприяло посиленню гіпотензивного ефекту, що підтверджувалося результатами ДМАТ (табл. 2). Так, через 8 тижнів лікування спостерігалося вірогідне зниження рівнів САТсер і ДАТсер на 18,2 і 11,7 % відповідно (p < 0,001) переважно внаслідок зниження показників уночі (на 18,6 та 13,1 % відповідно (p < 0,001)), що є важливим у запобіганні виникненню КВУ в ранкові години (з 4-ї до 10-ї). Посилення гіпотензивного ефекту вночі може бути пов’язано як із призначенням симвастатину (Вабадину) у вечірні години, так і зі стимуляцією синтезу NO судинним ендотелієм внаслідок синергізму дії на цей синтез поєднаного застосування статинів з нітратами, b-адреноблокаторами (небіволол), ІАПФ, БРА ІІ та АК [1]. Доказом посилення гіпотензивного ефекту цих препаратів була необхідність зниження їх добової дози наприкінці лікування симвастатином (Вабадином) у 22 (57,9 %) хворих.
Сьогодні добре відомі неліпідні (плейотропні) ефекти статинів (антитромботичні, протизапальні, а також сприятливий вплив на функцію судинного ендотелію) [33]. Статинам властива і протиішемічна дія, що безпосередньо пов’язана з нормалізацією функції ендотелію артерій. Цей плейотропний ефект інгібіторів ГМГ-КоА-редуктази вивчено переважно у хворих із стабільною ІХС [24, 33]. Встановлено, що вже через 1 місяць після призначення симвастатину відбувається покращення функції ендотелію [15].
Дані ДМЕКГ (табл. 3) свідчать, що наявність симвастатину (Вабадину) у дозі 40 мг/добу у складі комбінованої терапії разом з антиангінальними і антигіпертензивними препаратами дозволяє зменшити добову кількість больових і безбольових епізодів ішемії міокарда на 42,1 % (p < 0,05) і 37,0 % (p = 0,05) відповідно та їх середню тривалість на 48,4 % (p < 0,01) і 51,2 % (p < 0,05). При цьому середній час сумарної ішемії міокарда за добу зменшується через 8 тижнів терапії на 69,7 % (p < 0,05). Отримані дані дозволяють зробити висновок, що одночасно з гіполіпідемічним ефектом Вабадину відзначається позитивна динаміка перебігу хронічної коронарної недостатності, що узгоджується з результатами інших дослідників [12], які встановили, що навіть при застосуванні вдвічі меншої добової дози препарату вже через 4 тижні лікування частота приступів стенокардії зменшується на 52,4 % (p < 0,05) з одночасним зниженням добової потреби в прийманні нітрогліцерину на 68,1 % (p < 0,05), АТ — на 14,4 % (p < 0,05), зростанням толерантності до фізичного навантаження — на 43,6 % (p < 0,05). Це пояснюється протиішемічною дією статинів, яка безпосередньо пов’язана з відновленням функції судинного ендотелію [32]. В умовах гіперхолестеринемії відбувається порушення ендотелійзалежної вазодилатації коронарних артерій, що супроводжується спастичними реакціями в місцях стенозу та міокардіальною ішемією [34]. Вабадин, як і інші статини, здатний зменшувати ступінь дисфункції судинного ендотелію шляхом пригнічення продукції чинників, які його ушкоджують (окислені ЛПНЩ, цитокіни). У результаті відбувається стимуляція продукції NO та простацикліну, зменшуються коронароспазм і частота епізодів ішемії міокарда [41].
У нашому дослідженні застосування симвастатину (Вабадину) у дозі 40 мг/добу упродовж 8 тижнів привело до зменшення добової дози пролонгованих нітратів удвічі у 9 (23,7 %) хворих, відміни нітратів у зв’язку з припиненням приступів стенокардії — у 5 (13,1 %) пацієнтів.
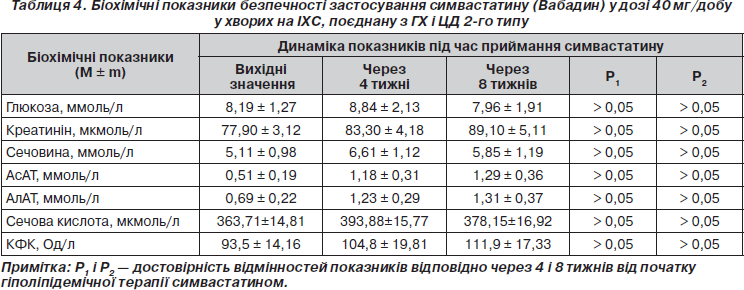
Упродовж 8-тижневого приймання симвастатину (Вабадину) у дозі 40 мг/добу толерантність хворих до лікування була задовільною. В цілому по групі залучених у дослідження пацієнтів підвищення активності печінкових трансаміназ (АсАТ, АлАТ) було невірогідним (p > 0,05) (табл. 4). В жодному із спостережень не виникло необхідності у відміні Вабадину внаслідок підвищення рівнів печінкових трансаміназ до величин, які перебільшують триразову верхню межу норми. В усіх випадках (14 пацієнтів) підвищення АсАТ, АлАТ було транзиторним і спостерігалося переважно наприкінці 4-тижневого приймання препарату. У наступні 4 тижні спостереження зростання рівнів печінкових трансаміназ не відзначалося. Такі показники, як рівні глюкози, креатиніну, сечовини, січової кислоти, на тлі гіполіпідемічної терапії Вабадином вірогідно не змінювались (табл. 4). У жодному випадку не зареєстровано виникнення скарг хворих на дискомфорт або біль у м’язах. Тенденція до підвищення активності КФК (табл. 4) не супроводжувалася необхідністю зменшення добової дози або відміни препарату. В 11 пацієнтів спостерігалися явища шлунково-кишкового дискомфорту: метеоризм (n = 4), дискомфорт в епігастральній ділянці та правому підребер’ї (n = 2), бурчання в животі (n = 3), зниження апетиту, що мали тимчасовий характер і не потребували змін добової дози або відміни Вабадину.
Обговорюючи побічні ефекти статинів, зазначимо, що всі представники цього класу препаратів здатні підвищувати рівні печінкових трансаміназ, однак гепатотоксичність, що відзначається як більше ніж триразове підвищення рівнів печінкових ферментів, реєструється, за даними великих досліджень, у менше ніж 2 % випадків [25, 31]. Щодо ризику міопатії, то, за даними найбільш масштабних досліджень 4S і HPS, він становить 0,01 % щорічно [25]. Підвищують ризик міотоксичності статинів порушення структури клітинних мембран на тлі зниження рівня ХС [23].
Отже, симвастатин залишається надійним, добре вивченим, ефективним і безпечним препаратом для корекції порушень ліпідного обміну, який можна застосовувати в поліклінічних і стаціонарних умовах. Завдяки своєму сприятливому впливу на прогноз він рекомендований для вторинної профілактики КВУ у хворих на ІХС високого і дуже високого ризику. Наш власний поліклінічний досвід застосування препарату Вабадин (симвастатин) у дозі 40 мг/добу виробництва компанії Berlin-Chemiе Menarini Group (Німеччина) свідчить, що цей препарат є прикладом вибору якісних і доступних для населення генеричних гіполіпідемічних засобів. Результати нашого поліклінічного спостереження продемонстрували не тільки достатню гіполіпідемічну ефективність Вабадину, але і його здатність оптимізувати антиангінальну й антигіпертензивну терапію у хворих на ІХС, що поєднується з ГХ і ЦД 2-го типу.
Висновки
1. Препарат Вабадин (симвастатин), призначений хворим на ІХС, що поєднується з ГХ і ЦД 2-го типу, в дозі 40 мг/добу упродовж 8 тижнів для корекції атерогенної ДЛП справляє виражену гіпохолестеринемічну дію, що призводить до зниження рівня ЗХС на 26,6 % (p < 0,01), вмісту ХС у складі ЛПНЩ — на 35,8 % (p < 0,001), концентрації ХС у складі не-ЛПВЩ — на 33,5 % (p < 0,001).
2. Зниження рівнів ТГ і ХС ЛПДНЩ та підвищення вмісту ХС у складі ЛПВЩ під впливом 8-тижневої терапії Вабадином у хворих на ІХС і ЦД 2-го типу має характер тенденції, що свідчить про необхідність більш тривалого застосування препарату для досягнення вірогідних змін цих показників.
3. Застосування Вабадину разом із антигіпертензивними засобами посилює гіпотензивний ефект вночі, про що свідчить зниження САТсер та ДАТсер на 18,2 і 11,7 % відповідно (p < 0,001) переважно за рахунок САТсер (ніч) і ДАТсер (ніч) відповідно на 18,6 і 13,1 % (p < 0,001) та дозволяє зменшити добові дози антигіпертензивних препаратів у 57,9 % хворих.
4. Вабадин (симвастатин) у дозі 40 мг/добу у складі комбінованої терапії разом з антиангінальними і антигіпертензивними препаратами упродовж 8 тижнів лікування сприяє зменшенню добової кількості больових і безбольових епізодів ішемії міокарда на 42,1 % (p < 0,05) і 37,0 % (p = 0,05), їх середньої тривалості на 48,4 % (p < 0,01) і 51,2 % (p < 0,05) відповідно, середнього часу сумарної ішемії міокарда за добу на 69,7 % (p < 0,05). Антиішемічна дія Вабадину дозволяє знизити добові дози пролонгованих нітратів у 23,7 % випадків, відмінити нітрати у зв’язку з припиненням приступів стенокардії у 13,1 % пацієнтів.
5. Вабадин (симвастатин), застосований у добовій дозі 40 мг упродовж 8 тижнів, є безпечним препаратом із задовільним профілем толерантності. Препарат не спричиняє суттєвих побічних ефектів, що потребують зменшення добової дози або припинення лікування.
Список літератури знаходиться в редакції