Журнал «» 5(19) 2011
Вернуться к номеру
Порівняльна характеристика ефективності застосування фіксованої комбінації аторвастатину з езетимібом (Статезі) і монотерапії аторвастатином у пацієнтів із дисліпідемією і цукровим діабетом 2-го типу
Авторы: Чернишов В.А., ДУ «Інститут терапії ім. Л.Т. Малої АМН України», м. Харків
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
У статті наведено порівняльну характеристику ефективності 12-тижневої гіполіпідемічної терапії фіксованою комбінацією аторвастатину 10 мг з езетимібом 10 мг (препарат Статезі) і монотерапії аторвастатином 10 мг у 43 хворих на гіпертонічну хворобу (ГХ) ІІ–ІІІ стадії, що поєднана із цукровим діабетом (ЦД) 2-го типу й вторинною дисліпідемією (ДЛП) віком від 43 до 59 років. 19 пацієнтам проводилася монотерапія аторвастатином, 24 — препаратом Статезі. Групи хворих були порівнянні за віком, статтю, типом ДЛП, поєднанням ГХ із ішемічною хворобою серця. У всіх осіб у динаміці лікування визначали вміст у венозній крові натще загального холестерину (ЗХС), тригліцеридів (ТГ), холестерину ліпопротеїдів високої й низької щільності (ХС ЛПВЩ, ХС ЛПНЩ), холестерину (ХС) не-ЛПВЩ, рівня глюкози, С-реактивного білка (СРБ), інсуліну, печінкових трансаміназ, сечовини, креатиніну, сечової кислоти. У динаміці терапії також визначався індекс інсулінорезистентності НОМА.
Показано, що корекція вторинної ДЛП препаратом Статезі має явні переваги перед монотерапією аторвастатином. Так, через 12 тижнів лікування додатковий ефект у зниженні ЗХС і ХС ЛПНЩ становив відповідно 13,2 % (p < 0,05) і 16,8 % (р < 0,001), ТГ і ХС не-ЛПВЩ відповідно 12,4 % (р < 0,05) і 15,6 % (р < 0,001). Додаткове підвищення рівня ХС ЛПВЩ на 11,4 % мало характер тенденції (р > 0,05). При застосуванні препарату Статезі рівнів ЗХС < 4,5 ммоль/л і ХС ЛПНЩ < 2,5 ммоль/л досягають удвічі більше пацієнтів, ніж на монотерапії аторвастатином (75 проти 36,8 %). Плейотропні ефекти препарату Статезі більш виражені, ніж аторвастатину. При 12-тижневому застосуванні Статезі порівняно з аторвастатином додатковий ефект у зниженні СРБ становив 9,5 % (р < 0,001), глікемії й інсулінемії натще відповідно 5,5 % (р < 0,05) і 5,7 % (р < 0,01), індекс НОМА 8,9 % (р < 0,05).
Гіполіпідемічна терапія препаратом Статезі й аторвастатином була безпечною в пацієнтів із ЦД 2-го типу, характеризувалася задовільним профілем толерантності й відсутністю негативної динаміки лабораторних показників контролю.
Зроблено висновок про доцільність застосування препарату Статезі для корекції вторинних порушень ліпідного обміну у хворих на ЦД 2-го типу на підставі більш вираженої гіполіпідемічної й плейотропної дії.
Цукровий діабет, дисліпідемія, гіполіпідемічна терапія, статини, езетиміб.
Відомо, що позитивний вплив статинів на підвищений рівень загального холестерину (ЗХС) сироватки крові й уміст холестерину (ХС) у складі ліпопротеїдів низької щільності (ЛПНЩ) є надзвичайно важливим, оскільки саме ці показники ліпідного обміну безпосередньо корелюють з ризиком атеросклерозу і пов’язаних з ним серцево-судинних ускладнень. Їх зниження в результаті гіполіпідемічної терапії до цільових значень супроводжується вірогідним покращенням прогнозу захворювання [7, 8].
На сьогодні загальноприйнятим (ESC/EAS, 2011) цільовим рівнем ХС ЛПНЩ для пацієнтів із дуже високим кардіоваскулярним ризиком (КВР) (встановлене серцево-судинне захворювання (ССЗ), наявність цукрового діабету (ЦД) 1-го і 2-го типу з ураженням органів-мішеней, хронічного захворювання нирок середньої тяжкості чи тяжкого або КВР > 10 % за шкалою Systemic Coronary Risk Evaluation (SCORE) вважається рівень нижче 1,8 ммоль/л. Якщо останній досягти неможливо, доцільно знизити рівень ХС ЛПНЩ на 50 % і понад від вихідного. Для пацієнтів із високим КВР (суттєво виражені одиничні чинники ризику, рівень КВР за шкалою SCORE 5–10 %) цільове значення показника становить нижче 2,5 ммоль/л, а для осіб із помірним КВР (рівень КВР за шкалою SCORE 1–5 %) — нижче 3,0 ммоль/л [26]. У країнах Західної Європи із 70 % пацієнтів, які отримують статини для зниження рівня ХС, значень ЗХС < 4,5 ммоль/л і ХС ЛПНЩ < 2,5 ммоль/л досягають лише 53 % [14]. У США, незважаючи на агресивний підхід до лікування гіперхолестеринемії (ГХС), ситуація зі зниженням рівня ХС ЛПНЩ < 2,6 ммоль/л також далека від ідеальної (44,9 % дорослого населення США мають рівень ХС ЛПНЩ > 3,4 ммоль/л) [29]. Результати дослідження Lipid Treatment Assessment Project 2 свідчать, що лише 30 % пацієнтів із дуже високим ризиком серцево-судинних ускладнень (ішемічна хвороба серця (ІХС) + 2 і більше чинники ризику, в тому числі ЦД 2-го типу) досягають цільового рівня ХС ЛПНЩ < 1,8 ммоль/л [4].
Подвоєння добової дози статину, як відомо, призводить до додаткового зниження рівня ХС ЛПНЩ усього лише на 6 % («правило шести») [8] та підвищує вартість лікування. Один із механізмів незначного збільшення ефективності статинів при подвоєнні дози може бути пов’язаний з посиленням абсорбції ХС із кишечника. Тому використання комбінації статину з речовинами, що блокують абсорбцію ХС в кишечнику, є дуже перспективним [16]. Серед останніх найбільш відомим на фармацевтичному ринку препаратом вважається езетиміб [24], монотерапія яким у дозі 10 мг/добу в пацієнтів із ГХС зменшує рівень ХС ЛПНЩ в сироватці крові на 20 %, тригліцеридів (ТГ) — на 8 % і підвищує рівень ХС ліпопротеїдів високої щільності (ЛПВЩ) на 5 % [38]. У більшості пацієнтів із дисліпідемією (ДЛП) поєднане застосування статину з езетимібом дозволяє швидше й ефективніше досягти цільових рівнів ХС ЛПНЩ порівняно з монотерапією статинами. Якщо при монотерапії статини в початковій дозі знижують рівень ХС ЛПНЩ на 25–30 %, то при комбінованому застосуванні з езетимібом 10 мг/добу можна отримати додатковий сумарний холестеринознижуючий ефект на 50–55 % [40].
При застосуванні статинів для корекції ДЛП у пацієнтів з інсулінорезистентністю (ІР) переваги має аторвастатин, який більшою мірою зменшує підвищений рівень ХС ЛПНЩ і на відміну від інших статинів спричиняє значно більше зниження рівня ТГ, що порівнянно з ефектом фібратів і нікотинової кислоти [10]. Як свідчать дослідження останніх років, крім гіполіпідемічної дії, езетиміб покращує функцію нирок, зменшує ІР, знижує рівні маркерів запалення [36]. Аторвастатину також властиві протизапальні ефекти та здатність покращувати чутливість тканин до інсуліну у хворих на ЦД 2-го типу [1].
Поява на фармацевтичному ринку України фіксованої комбінації аторвастатину 10 мг з езетимібом 10 мг (препарат Статезі фірми Mili Healthcare Ltd., Великобританія) відкриває можливості для її застосування при корекції порушень ліпідного обміну у хворих на ЦД 2-го типу й дослідження ефективності порівняно з монотерапією аторвастатином, що зумовлене насамперед імовірністю потенціації гіполіпідемічних і плейотропних ефектів, дуже важливих для цієї категорії пацієнтів.
Мета роботи — дати характеристику ефективності застосування фіксованої комбінації аторвастатину 10 мг з езетимібом 10 мг (Статезі) порівняно з монотерапією аторвастатином 10 мг/добу для корекції ДЛП у пацієнтів із ЦД 2-го типу.
Матеріали і методи дослідження
У дослідженні брали участь 43 пацієнти (20 чоловіків і 23 жінки) віком від 43 до 59 років (середній вік 50,8 ± 2,9 року) із гіпертонічною хворобою (ГХ) ІІ–ІІІ стадії і ЦД 2-го типу в стані компенсації або субкомпенсації вуглеводного обміну, що супроводжувався вторинною ДЛП. Всі запрошені особи дали добровільну згоду на участь у дослідженні й перебували під динамічним амбулаторним спостереженням у відділі популяційних досліджень ДУ «Інститут терапії ім. Л.Т. Малої АМН України».
Відбиралися пацієнти, які упродовж 4–8 тижнів до запрошення не приймали будь-яких гіполіпідемічних засобів. Усі особи під час спостереження впродовж 12 тижнів дотримувалися гіполіпідемічної дієти і продовжували приймати індивідуально підібрану гіпоглікемічну терапію. З метою оцінки ймовірного впливу гіполіпідемічних засобів на ІР гіпоглікемічну терапію впродовж усього терміну спостереження пацієнтам не змінювали. Хворих інформували також про необхідність утримання від куріння і споживання алкогольних напоїв.
Тривалість ГХ за даними анамнезу в середньому становила 7,9 ± 1,1 року (від 4 до 11 років). Стадію ГХ і ступінь підвищення артеріального тиску (АТ) встановлювали за рекомендаціями Української асоціації кардіологів із профілактики та лікування артеріальної гіпертензії (2008) [11]. Серед залучених у дослідження осіб ГХ ІІ стадії виявлена в 24 (55,8 %) випадках, ІІІ стадії — у 19 (44,2 %) хворих. Підвищення АТ, що відповідало 1-му ступеню, спостерігалося в 17 (39,5 %) осіб, 2-му ступеню — у 26 (60,5 %) хворих.
За даними медичної документації, у 19 (44,2 %) пацієнтів мала місце верифікована ішемічна хвороба серця (ІХС), клінічним проявом якої була стабільна стенокардія напруження ІІ–ІІІ функціонального класу (ФК). У 8 (18,6 %) пацієнтів спостерігався ІІ ФК, в 11 (25,6 %) — ІІІ ФК стенокардії напруження. Тривалість захворювання коливалася від 1 до 12 років і в середньому становила 6,8 ± 1,8 року. У 6 (13,9 %) пацієнтів в анамнезі мав місце перенесений раніше інфаркт міокарда (ІМ) з давністю події від 3 до 8 років (у середньому 5,8 ± 1,2 року).
ЦД 2-го типу в стані компенсації та субкомпенсації вуглеводного обміну за відомими діагностичними критеріями ВООЗ [42] мали відповідно 28 (65,1 %) та 15 (34,9 %) обстежених.
Тип ДЛП встановлювався за класифікацією D.S. Fredrickson із сучасними доповненнями [6]. ДЛП ІІа і ІІb типів виявлено відповідно в 11 (25,6 %) та 9 (20,9 %) випадках. Поєднання зниженого вмісту в сироватці крові ХС ЛПВЩ (гіпоальфахолестеринемії (ГАХС)) з ІІа і ІІb типами ДЛП мала однакова кількість хворих — по 7 (16,3 %) осіб відповідно. Поєднання ГАХС з IV типом ДЛП виявлено в 9 (29,9 %) пацієнтів.
У дослідження не залучали хворих зі стенокардією напруження IV ФК, тяжкою артеріальною гіпертензією, застійною серцевою недостатністю, тяжкими порушеннями серцевого ритму (фібриляція передсердь, пароксизмальна тахікардія, часта шлуночкова екстрасистолія), клінічно вагомими порушеннями функції печінки й нирок, ЦД 1-го типу, захворюваннями м’язів (міастенія та інші ураження м’язової системи), патологією щитоподібної залози, наявністю в анамнезі ІМ або мозкового інсульту терміном до 6 місяців перед залученням у дослідження.
Антигіпертензивна й антиангінальна терапія включала препарати, які не справляли негативного впливу на вуглеводний і ліпідний обмін (нітрати пролонгованої дії, кардіоселективні бета-адреноблокатори, інгібітори ангіотензинперетворюючого ферменту, блокатори рецепторів ангіотензину ІІ, антагоністи кальцію, ацетилсаліцилова кислота). Для корекції порушень вуглеводного обміну 12 (27,9 %) хворих приймали метформін, 7 (16,3 %) — гліклазид і 10 (23,2 %) — глімепірид. Комбінацію метформіну з гліклазидом отримували 6 (13,9 %) пацієнтів, метформіну з глімепіридом — 8 (18,6 %) осіб.
З метою корекції ДЛП 19 (44,2 %) хворим (І група) призначено монотерапію аторвастатином 10 мг/добу після вечері на термін 12 тижнів і 24 (55,8 %) пацієнтам (ІІ гр.) на такий самий термін призначено фіксовану комбінацію аторвастатину 10 мг з езетимібом 10 мг в одній таблетці (препарат Статезі) одноразово після вечері. І і ІІ гр. хворих були порівнянні за віком, статтю, типом ДЛП та поєднанням ГХ з ІХС.
Усім залученим у дослідження пацієнтам визначали вміст у сироватці крові ЗХС, ТГ, ХС ЛПВЩ ферментативним методом на автоаналізаторі Humareader (Німеччина) з використанням наборів реагентів фірми Human (Німеччина). Вміст ХС ЛПНЩ обчислювали за формулою W.T. Friedewald [13]:
ХС ЛПНЩ = ЗХС – (ХС ЛПВЩ + ТГ/2,22),
де ТГ/2,22 — це вміст ХС у складі ліпопротеїдів дуже низької щільності (ЛПДНЩ).
Для поглибленої характеристики ДЛП додатково визначали концентрацію ХС у складі не-ЛПВЩ (ЛПДНЩ + ЛПНЩ) за різницею ЗХС і ХС ЛПВЩ. Оскільки відмінною рисою ДЛП, що асоціюється з ЦД 2-го типу, є одночасне порушення метаболізму ЛПВЩ і ТГ, визначали також співвідношення ТГ/ХС ЛПВЩ, що характеризує внесок ліпопротеїдліполізу ТГ-вмісних ЛПДНЩ в утворення ЛПВЩ [2].
Зазначені показники ліпідного обміну визначалися в пацієнтів до призначення гіполіпідемічної терапії і через 4, 8 та 12 тижнів лікування.
Досягнення цільових рівнів ліпідів у хворих контролювали за рекомендаціями Європейського товариства кардіологів (ESC, 2011) [26] та Менеджменту з лікування дисліпідемій ADA i ACC (2008) для пацієнтів високого кардіометаболічного ризику [23].
Усім залученим у дослідження особам у динаміці гіполіпідемічної терапії визначали рівні імунореактивного інсуліну, С-реактивного білка (СРБ) натще методом твердофазного імуноферментного аналізу, рівень глікемії натще — глюкозооксидазним методом. Оцінку стану ІР в динаміці гіполіпідемічної терапії здійснювали за допомогою індексу НОМА (Homeostatic Model Assessment), який розраховували за формулою: рівень інсуліну натще (мкОд/мл) ґ глюкоза крові натще (ммоль/л)/22,5. ІР в обстежених хворих діагностували при індексі НОМА вище 3 ум.од.
Для оцінки безпечності гіполіпідемічної терапії в динаміці спостереження за хворими проводили біохімічні дослідження крові з визначенням вмісту сечовини, креатиніну, сечової кислоти, активності печінкових трансаміназ (аспартат- і аланінамінотрансфераз (АсАТ, АлАТ)), креатинфосфокінази (КФК) стандартними загальновідомими методами [5].
Статистичну обробку отриманих даних виконано на персональному комп’ютері за допомогою прикладної програми Stаtistica. Результати наведено у вигляді середніх арифметичних значень і помилки середньої величини (М ± m). Вірогідність відмінностей оцінювали за t-критерієм Стьюдента.
Результати і обговорення
На сьогодні аторвастатин — один із найбільш потужних синтетичних інгібіторів активності ключового ферменту біосинтезу ХС 3-гідрокси-3-метилглутарил-коезим-А (ГМГ-КоА)-редуктази [1]. У дозі 10–80 мг/добу він знижує рівень ЗХС на 3–46 %, ХС ЛПНЩ — на 41–61 %. ТГ — на 14–33 % і спричиняє варіабельне підвищення рівня ХС ЛПВЩ на 5,1–8,7 % у пацієнтів із різними типами ДЛП [31].
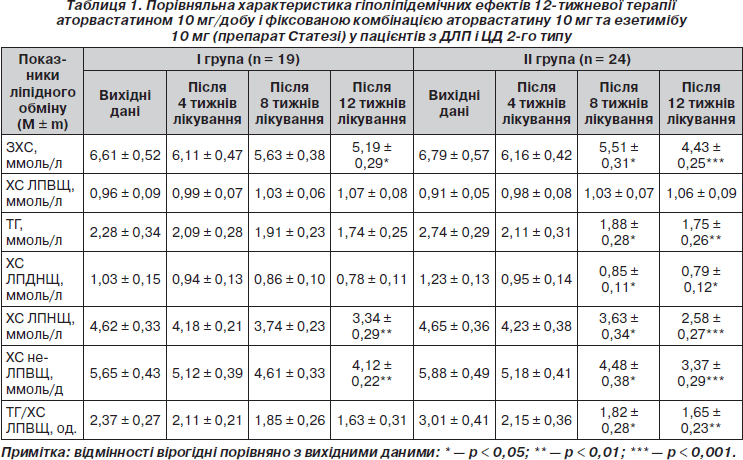
У нашому дослідженні 12-тижнева монотерапія аторвастатином 10 мг/добу у хворих І гр. (табл. 1) призвела до вірогідного зниження рівня ЗХС (на 21,5 %; p < 0,05) та ХС ЛПНЩ (на 27,7 %; p < 0,01). Зниження сироваткового вмісту ТГ в середньому на 23,7 %, ХС ЛПДНЩ на 24,3 % та підвищення концентрації ХС у складі ЛПВЩ на 11,4 % не були вірогідними (p > 0,05) і мали характер тенденції. Імовірно, що в умовах ІР, яка існує при ЦД 2-го типу, може спостерігатися послаблення гіпотригліцеридемічної дії статинів через посилений додатковий синтез печінкою ТГ із вільних жирних кислот у поєднанні з підвищеним рівнем глюкози (синтез ТГ при цьому відбувається за гліцерофосфатним шляхом) [9, 18]. Щодо ХС ЛПВЩ, то лікування аторвастатином підвищує рівень цієї антиатерогенної фракції ХС в середньому на 12–15 % при призначенні доз від 2,5 до 20 мг/добу [1]. Причому у хворих з низьким вихідним значенням цього показника спостерігається більш помітне його підвищення [3]. У контексті обговорення отриманих нами даних варто відмітити, що у більшості відкритих досліджень із невеликою кількістю пацієнтів підвищення рівня ХС ЛПВЩ під впливом статинів, як правило, не досягає статистичної вірогідності.
Тенденція до зниження сироваткового вмісту ТГ та до підвищення рівня ХС ЛПВЩ сприяла зниженню величини співвідношення ТГ/ХС ЛПВЩ у хворих І гр. у середньому на 31,2 % (p > 0,05), що є бажаним для пацієнтів з ІР і ЦД 2-го типу, оскільки саме при цих станах спостерігається одночасне порушення метаболізму ЛПВЩ і ТГ, а гіполіпідемічна терапія, що спрямована на корекцію співвідношення ТГ/ХС ЛПВЩ, вважається сьогодні доречним підходом до лікування пацієнтів із метаболічним синдромом або ЦД 2-го типу із категорії високого кардіоваскулярного ризику [41].
Завдяки гіпохолестеринемічній дії аторвастатину монотерапія препаратом упродовж 12 тижнів призвела до вірогідного зниження вмісту ХС у складі не-ЛПВЩ у хворих І гр. (у середньому на 27,1 %; p < 0,01), що є важливим, оскільки існують докази, що рівень ХС не-ЛПВЩ може розглядатися як більш сильний предиктор ССЗ, ніж ХС ЛПНЩ, особливо в пацієнтів, які приймають статини [23, 25].
Наприкінці дослідження (12 тижнів) у хворих на ЦД 2-го типу І гр. відмічено вірогідне зниження рівня ЗХС (до 5,19 ± 0,29 ммоль/л; p < 0,05) та вірогідне зниження вмісту ХС у складі ЛПНЩ (до 3,34 ± 0,29 ммоль/л), що все ж таки перевищувало цільові рівні ЗХС і ХС ЛПНЩ для хворих на ЦД (< 4,0 ммоль/л та < 1,8 ммоль/л відповідно [23, 26]).
У нашому дослідженні рівнів ЗХС < 4,5 ммоль/л і ХС ЛПНЩ < 2,5 ммоль/л у результаті 12-тижневої монотерапії аторвастатином 10 мг/добу досягли 7 (36,8 %) із 19 хворих на ЦД 2-го типу. Із 8 хворих із дуже високим ризиком ускладнень (ІХС + ЦД) цільових рівнів ЗХС < 4,0 ммоль/л і ХС ЛПНЩ < 1,8 ммоль/л досягли 3 (37,5 %) пацієнти. Імовірно, що для досягнення цільового результату решті пацієнтів І гр. необхідна більш тривала гіполіпідемічна терапія, а в низці випадків і більш ефективна корекція порушень вуглеводного обміну. Це зумовлене тим, що саме наявність ІР у хворих на ЦД може асоціюватися з тривалим існуванням не тільки гіперглікемії, але й діабетичної ДЛП, усунення якої безпосередньо пов’язане з відновленням чутливості тканин до інсуліну [7, 10].
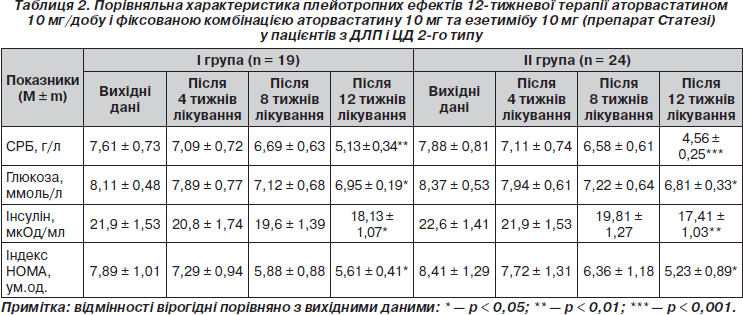
Як свідчать дані табл. 2, монотерапія аторвастатином супроводжувалась лише частковим відновленням чутливості периферичних тканин до інсуліну у хворих І гр. Незважаючи на вірогідне зниження рівнів глюкози та інсуліну натще (на 14,3 %, p < 0,05, і 17,2 %, p <0,05 відповідно), вірогідне зниження індексу НОМА (у середньому на 28,9 %; p < 0,05), останній (5,61 ± 0,41 ум.од.) все ж таки перевищував 3 ум.од., що свідчить про збереження ІР.
Російські дослідники [3] також спостерігали помірне зниження рівня глюкози в крові натще у хворих на ЦД 2-го типу на тлі 8-тижневої монотерапії аторвастатином 10 мг/добу, яке пояснили підвищенням чутливості тканин до інсуліну. У контексті обговорення такого плейотропного ефекту аторвастатину варто відмітити, що, пригнічуючи синтез білків сімейства Rho, статини здатні знижувати активність Rho-кінази, яка бере участь в інактивації рецепторів до інсуліну [32]. Крім того, статини, знижуючи рівень цитокінів, подібно інсуліну, активують переміщення глюкози через мембрану [32, 33].
В останні роки підтвердження здобула гіпотеза про важливість запалення і імунних реакцій у розвитку атеросклерозу та його ускладнень [1]. Продемонстровано, що аторвастатин здатний знижувати рівень СРБ в сироватці крові в середньому на 31 % [15]. Отримані нами дані погоджуються з цими результатами. У хворих І гр. (табл. 2) 12-тижнева монотерапія аторвастатином 10 мг/добу супроводжувалася наприкінці лікування вірогідним зменшенням концентрації СРБ (на 32,6 %; p < 0,01), що має значення для зниження ризику атеросклеротичних ускладнень при ЦД 2-го типу.
У клінічних дослідженнях доведено, що езетиміб і статини справляють взаємопотенціюючу дією і при їхньому одночасному застосуванні гіполіпідемічний ефект суттєво зростає порівняно з монотерапією статинами [17]. Саме завдяки характерному для аторвастатину широкому спектру дії на ліпідний профіль, високій гіполіпідемічній активності й швидкому досягненню цільового рівня ліпідів при дослідженні ефективності комбінацій езетимібу з різними статинами велика надія покладається сьогодні на поєднане застосування аторвастатину з езетимібом [15].
Результати проведеного дослідження (табл. 1) свідчать, що застосування у хворих на ЦД 2-го типу фіксованої комбінації аторвастатину 10 мг та езетимібу 10 мг (препарату Статезі) сприяє оптимізації гіполіпідемічних утручань. Так, уже через 8 тижнів лікування у хворих ІІ гр. спостерігалося вірогідне зниження рівнів ЗХС (на 18,8 %; р = 0,05), ТГ (на 31,4 %; p < 0,05), ХС ЛПДНЩ (на 30,9 %; p < 0,05), ХС ЛПНЩ (на 21,9 %; р < 0,05), ХС не-ЛПВЩ (на 23,8 %; р < 0,05) та величини співвідношення ТГ/ХС ЛПВЩ (на 39,5 %; р < 0,05). Відмічено тенденцію до підвищення вмісту ХС у складі ЛПВЩ у середньому на 5,1 % (р > 0,05). Схожі результати щодо зниження ХС ЛПНЩ (на 19,4 %; р < 0,001) та концентрації ХС не-ЛПВЩ (на 23,5 %; р < 0,001) навіть за більш короткий термін спостереження (6 тижнів) отримано в дослідженні EASE [35].
Подальше приймання хворими ІІ гр. препарату Статезі наприкінці дослідження (12 тижнів) призвело до ще більш вираженого гіполіпідемічного ефекту внаслідок адитивного впливу складових фіксованої комбінації на ліпідний профіль. Так, відмічено більш суттєві порівняно з 8-тижневим терміном лікування гіпохолестеринемічний і гіпотригліцеридемічний ефекти комбінованої гіполіпідемічної терапії: рівні ЗХС і ХС ЛПНЩ вірогідно знизилися (відповідно на 34,7 %; p < 0,001, та 44,5 %; р < 0,001), а рівні ТГ і ХС ЛПДНЩ — на 36,1 % (р < 0,01) та 35,8 % (р < 0,05) відповідно. Саме завдяки цим ефектам спостерігалося подальше вірогідне зниження концентрації ХС не-ЛПВЩ (на 42,7 %; р < 0,001). Виявлено також більш помітну тенденцію до підвищення вмісту ХС у складі ЛПВЩ (у середньому на 16,5 %; p > 0,05). Гіпотригліцеридемічна дія препарату Статезі поряд із тенденцією до підвищення рівня ХС ЛПВЩ сприяли вірогідному зниженню величини співвідношення ТГ/ХС ЛПВЩ (у середньому на 45,2 %; p < 0,01).
Порівняно з монотерапією аторвастатином 10 мг/добу (І гр. хворих на ЦД 2-го типу) фіксована комбінація аторвастатину 10 мг з езетимібом 10 мг (препарат Статезі) мала явні переваги в корекції порушень ліпідного обміну. Так, у хворих ІІ гр. додатковий ефект у зниженні сироваткового вмісту ЗХС і ХС ЛПНЩ становив відповідно 13,2 % (p < 0,05) та 16,8 % (р < 0,001), ТГ і ХС ЛПДНЩ — 12,4 % (р < 0,05) та 11,5 % (р < 0,05), концентрації ХС не-ЛПВЩ — 15,6 % (p < 0,001).
У контексті обговорення отриманих нами результатів відмітимо, що за даними одних дослідників [21], додавання 10 мг езетимібу до аторвастатину в дозі 10 мг на термін 12 тижнів посилює зниження ХС ЛПНЩ на 15 %, а при дозі аторвастатину 80 мг/добу — на 11 %, у той час як, за даними інших авторів [22], приймання аторвастатину 10 мг разом з езетимібом 10 мг навіть за більш короткий термін лікування (6 тижнів) посилює зниження ХС ЛПНЩ на 14 % порівняно з монотерапією аторвастатином. Додатковий ефект у підвищенні рівня ХС ЛПВЩ, який мав характер тенденції, становив 5,4 % (p > 0,05). Більш виражений гіпотригліцеридемічний ефект Статезі та більш помітна тенденція до підвищення вмісту ХС у складі ЛПВЩ у хворих ІІ гр. пояснюються більш високим вихідним рівнем ТГ і більш низькою вихідною концентрацією ХС ЛПВЩ порівняно з пацієнтами І гр. (табл. 1). Обговорюючи ці дані, слід вказати, що в раніше надрукованих роботах [12, 39] з вивчення статинів повідомлялось, що чим вищий вихідний рівень ТГ, тим більший відсоток його зниження на тлі монотерапії статином і, навпаки, чим нижче вихідне значення ХС ЛПВЩ, тим більший відсоток його підвищення. Що стосується езетимібу, то, за даними одного із досліджень [28], у яке увійшли 13 % хворих на ЦД 2-го типу, додавання езетимібу до статину призводило до зниження рівня ТГ на 20 % в осіб із вихідним значенням показника ≥ 1,5 ммоль/л, у той час як у пацієнтів із вихідним рівнем ТГ < 1,5 ммоль/л зниження показника становило лише 7 %. В іншому дослідженні [34] підтверджено, що комбінація езетимібу зі статином підвищує концентрацію ХС ЛПВЩ на 10 %, у той час як у дослідженні японських авторів [36], до якого залучено невелику кількість хворих на ЦД 2-го типу (n = 42), додавання езетимібу до статину сприяло підвищенню вмісту ХС ЛПВЩ в сироватці крові усього лише на 3,5 %. Наведені дані свідчать про те, що необхідні додаткові дослідження з вивчення впливу езетимібу на рівень ХС ЛПВЩ у хворих на ЦД 2-го типу.
Додатковий ефект комбінованої гіполіпідемічної терапії у зниженні величини співвідношення ТГ/ХС ЛПВЩ порівняно з монотерапією аторвастатином в нашому дослідженні становив 14 % (p < 0,01), що свідчить про явні переваги препарату Статезі в корекції діабетичної ДЛП, при якій частіше спостерігається одночасне порушення метаболізму ТГ і ЛПВЩ.
Через 12 тижнів приймання препарату Статезі у хворих ІІ гр. відмічено вірогідне зниження сироваткового рівня ЗХС < 4,5 ммоль/л — у середньому до 4,43 ± 0,25 ммоль/л, в той час як концентрація ХС ЛПНЩ 2,58 ± 0,27 ммоль/л зовсім не набагато перевищувала рівень показника < 2,5 ммоль/л. Застосування фіксованої комбінації аторвастатину 10 мг і езетимібу 10 мг (препарату Статезі) у хворих на ЦД 2-го типу порівняно з монотерапією аторвастатином 10 мг/добу за 12 тижнів лікування сприяло досягненню рівнів ЗХС < 4,5 ммоль/л і ХС ЛПНЩ < 2,5 ммоль/л у більшої кількості хворих: 18 (75 %) із 24 проти 7 (36,6 %) із 19. У підгрупі пацієнтів із дуже високим ризиком ускладнень (ІХС + ЦД) (n = 11) цільових рівнів ЗХС < 4,0 ммоль/л і ХС ЛПНЩ < 1,8 ммоль/л досягли 4 (36,4 %) особи, що порівнянно з монотерапією аторвастатином (3; 37,5 %).
Як свідчать вірогідні дані останніх років, езетиміб, як і аторвастатин, має плейотропний ефект. Повідомляється, що він знижує рівні маркерів запалення, які можуть бути передвісниками тяжкості перебігу атеросклеротичного процесу [19, 36]. Встановлено, що більш виражене зниження такого маркеру запалення, як СРБ, відбувається при поєднаному застосуванні езетимібу зі статином. Так, комбінація езетимібу 10 мг з аторвастатином 10 мг при 12-тижневому лікуванні призводила до більш вираженого зниження рівня СРБ порівняно з монотерапією аторвастатином (на 41 і 31 % відповідно; p < 0,01), що вказує на більш виражений протизапальний ефект комбінованого лікування (аналогічне зниження рівня СРБ спостерігалося при додаванні езетимібу до інших статинів [27]). Щодо хворих із метаболічними розладами, зокрема з порушенням толерантності до глюкози, монотерапія езетимібом 10 мг/добу або симвастатином 20 мг/добу через 12 тижнів лікування сприяла зниженню рівня СРБ, яке було більш вираженим при комбінованому застосуванні препаратів (35 проти 25 %; p < 0,001) [30].
Проведений у нашому дослідженні порівняльний аналіз ефективності зниження рівня СРБ у хворих на ЦД 2-го типу під впливом гіполіпідемічної терапії (табл. 2) свідчить про більш ефективне зниження показника у разі 12-тижневого застосування фіксованої комбінації аторвастатину з езетимібом (препарат Статезі), ніж при монотерапії аторвастатином (42,1 %, p < 0,001, і 32,6 %, р <0,01, відповідно). Додатковий ефект зниження рівня СРБ на комбінованій гіполіпідемічній терапії становив при цьому 9,5 % (р < 0,001).
Серед інших, відомих за останні роки плейотропних ефектів езетимібу у хворих на ЦД 2-го типу слід відмітити його здатність зменшувати ІР [36]. Так, повідомляється про позитивну динаміку індексу НОМА (індексу ІР) після призначення езетимібу 10 мг/добу хворим з ГХС, 30 % із яких мали ЦД 2-го типу або порушення толерантності до глюкози. Ці дані викликають надзвичайний інтерес у контексті нещодавніх доказів асоціації статинотерапії з невеликим збільшенням ризику нових випадків ЦД 2-го типу [20, 37]. Як вважають, у цьому разі додавання езетимібу до статину було б найбільш доцільним для нейтралізації діабетогенного ефекту й покращення чутливості тканин до інсуліну. У нашому дослідженні гіполіпідемічна терапія фіксованою комбінацією аторвастатину з езетимібом у хворих на ЦД 2-го типу (табл. 2) порівняно з монотерапією спричиняла більш виражений гіпоглікемічний ефект наприкінці лікування (рівні глюкози в сироватці крові натще знизилися відповідно на 19,8 %, p < 0,05, і 14,3 %, р < 0,05). Ураховуючи, що добові дози антидіабетичних препаратів упродовж усього терміну дослідження не змінювалися, можна припустити самостійний потенціюючий вплив поєднаного застосування аторвастатину з езетимібом на утилізацію глюкози периферичними тканинами (додатковий ефект від комбінованої терапії становив 5,5 %; p < 0,05) Призначення препарату Статезі хворим на ЦД 2-го типу сприяло зниженню інсулінемії натще в середньому на 22,9 % (р < 0,01), що було на 5,7 % (р < 0,01) більше, ніж при монотерапії аторвастатином (17,2 %; р < 0,05). Покращення чутливості тканин до інсуліну при застосуванні препарату Статезі підтверджувалося вірогідним зниженням індексу ІР (індексу НОМА) на 37,8 % (р < 0,05). Ефект додаткового зниження показника від комбінованої терапії становив 8,9 % (р < 0,05) у порівнянні з монотерапією аторвастатином (28,9 %; p < 0,05). Наприкінці лікування середні значення індексу НОМА (5,23 ± 0,89 ум.од.) ще перебільшували бажані (нижче 3,0 ум.од.), що свідчило про часткове покращення чутливості тканин до інсуліну й необхідність подальшої корекції порушень вуглеводного обміну.
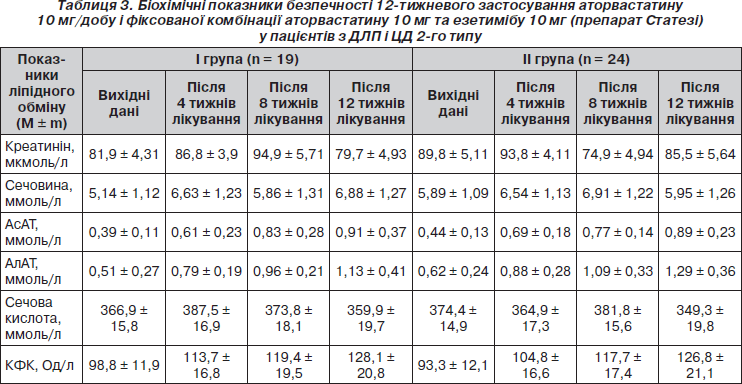
Як 12-тижневе приймання фіксованої комбінації аторвастатину з езетимібом (препарату Статезі), так і 12-тижнева монотерапія аторвастатином у залучених у дослідження хворих на ЦД 2-го типу супроводжувалися задовільною толерантністю до гіполіпідемічних засобів і відсутністю негативних змін лабораторних показників, у тому числі активності печінкових трансаміназ (АсАТ, АлАТ), КФК, рівнів сечовини, креатиніну, сечової кислоти (табл. 3). Частота небажаних явищ під час терапії в обох групах пацієнтів була порівнянною (6 (25 %) в групі Статезі і 5 (26,3 %) у групі монотерапії аторвастатином). Під час спостереження за хворими зміни в самопочутті, пов’язані з гіполіпідемічною терапією, мали тимчасовий характер і не потребували відміни гіполіпідемічних засобів.
Висновки
1. Порівняно з 12-тижневою монотерапією аторвастатином 10 мг/добу фіксована комбінація аторвастатину 10 мг з езетимібом (препарат Статезі) має явні переваги в корекції порушень ліпідного обміну у хворих на ЦД 2-го типу: додатковий ефект у зниженні сироваткового вмісту ЗХС і ХС ЛПНЩ становить відповідно 13,2 % (p < 0,05) та 16,8 % (р < 0,001), ТГ і ХС не-ЛПВЩ — 12,4 % (р < 0,05) та 15,6 % (р < 0,001) відповідно. Додатковий ефект у підвищенні рівня ХС ЛПВЩ, що має характер тенденції, у середньому становить 5,4 % (p > 0,05).
2. Застосування препарату Статезі у хворих на ЦД 2-го типу дозволяє за 12-тижневий термін покращити результати корекції ДЛП: рівнів ЗХС < 4,5 ммоль/л і ХС ЛПНЩ < 2,5 ммоль/л досягають вдвічі більше пацієнтів порівняно з хворими на монотерапії аторвастатином (75 проти 36,8 %).
3. Фіксована комбінація аторвастатину 10 мг з езетимібом 10 мг (препарат Статезі) порівняно з монотерапією аторвастатином 10 мг/добу має більш виражені плейотропні ефекти, корисні для хворих на ЦД 2-го типу. За 12-тижневий термін її застосування відбувається додаткове зниження рівнів СРБ на 9,5 % (p < 0,001), глікемії та інсулінемії натще відповідно на 5,5 % (p < 0,005) і 5,7 % (р < 0,01), індексу НОМА на 8,9 % (р < 0,0 %).
4. Гіполіпідемічна терапія препаратом Статезі так само, як і монотерапія аторвастатином, є безпечною для хворих на ЦД 2-го типу і характеризується задовільним профілем толерантності та відсутністю негативних змін лабораторних показників.
1. Бубнова М.Г. Аторвастатин: гиполипидемическая активность, плейотропные свойства и эффективность в профилактике атеросклероза и коронарной болезни сердца // Кардиология. — 2004. — № 8. — С. 96-104.
2. Бубнова М.Г., Аронов Д.М., Перова Н.В. и др. Правастатин в коррекции атерогенной экзогенно-индуцированной постпрандиальной гиперлипидемии // Кардиология. — 2002. — № 1. — С. 27-32.
3. Бубнова М.Г., Аронов Д.М., Перова Н.В. и др. Липидкорригирующие эффекты низкой дозы аторвастатина у больных сахарным диабетом типа 2 и ожирением // Сахарный диабет. — 2003. — № 1. — С. 30-34.
4. Коваленко В.Н. Гиполипидемическая терапия как основа снижения сердечно-сосудистого риска // Здоров’я України. — 2009. — № 19 (224). — С. 17.
5. Комаров Ф.И., Коровкин Б.Ф., Меньшиков В.В. Биохимические исследования в клинике. — Элиста: Джангар, 1999. — 250 с.
6. Лутай М.І. Дисліпідемії: клінічне значення та класифікації // Нова медицина. — 2003. — № 4 (9). — С. 16-21.
7. Лутай М.И. Липидоснижающая терапия у больных ишемической болезнью сердца и сахарным диабетом: точка зрения кардиолога // Здоров’я України. — 2010 вересень. Тематичний номер. — С. 42-43.
8. Лутай М.И., Лысенко А.Ф., Пономарева Г.В. Клинический опыт применения препарата Вабадин (Симвастатин) для коррекции дислипидемии в условиях клинической практики // Артериальная гипертензия. — 2009. — № 6 (8). — С. 10-14.
9. Мамедов М.Н. Особенности липидных нарушений у больных сахарным диабетом 2-го типа: в каких случаях следует применять статины // Кардиология. — 2006. — № 3. — С. 90-96.
10. Митченко Е.И., Романов В.Ю. Гиполипидемический эффект аторвастатина и состояние инсулинорезистентности у больных с метаболическим синдромом //Здоров’я України. — 2005. — № 22 (131). — С. 28; 31.
11. Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії: Посібник до Національної програми профілактики і лікування артеріальної гіпертензії. — К.: ПП ВМВ, 2008. — 80 с.
12. Рожкова Т.А., Сусеков А.В., Соловьева Е.Ю. и др. Эффективность и переносимость статинов у больных с первичными гиперлипидемиями в амбулаторной клинической практике // Кардиология. — 2005. — № 9. — С. 32-34.
13. Смирнова І.П. Дисліпопротеїдемії: методи діагностики та епідеміологія // Нова медицина. — 2003. — № 4 (9). — С. 22-25.
14. Тихонова С.А., Хижняк Е.В. Статины: вопросы, требующие решения // Therapia. — 2008. — № 3 (24). — C. 81-85.
15. Туркина Н. Гиполипидемическая терапия во вторичной профилактике атеросклероза: от монотерапии к комбинированному лечению // Medicine Review. — 2010. — № 4 (13). — C. 51-54.
16. Чернишов В.А. Подвійне блокування абсорбції та синтезу холестерину в корекції дисліпідемії // Укр. терапевт. журн. — 2011. — № 1. — С. 97-101.
17. Шатило В.Б., Ищук В.А. Применение Статези — современный подход к снижению липопротеидов низкой плотности в лечении кардиоваскулярной патологии // Медицина неотложных состояний. — 2010. — № 3 (28). — С. 130-135.
18. Яфасов К.М., Дублянская Н.В. Дислипидемия при сахарном диабете ІІ типа: патогенез и лечение // Кардиология. — 2001. — № 9. — С. 74-77.
19. Athyros V.G., Kakafika A.I., Karagiannis A. et al. Do we need to consider inflammatory markers when we treat atherosclerotic disease? // Atherosclerosis. — 2008. — Vol. 200. — P. 1-2.
20. Athyros V.G., Tziomalos K., Karagiannis A. et al. Lipid-lowering agents and new onset diabetes mellitus // Expert Opin. Pharmacother. — 2010. — Vol. 11. — P. 1965-1970.
21. Ballantyne C.M., Houri J., Notarbartolo A. et al. Effect of Ezetimibe Coadministered With Atorvastatin in 628 Patients With Primary Hypercholesterolemia. A Prospective, Randomized, Double — Blind Trial // Circulation. — 2003. — Vol. 107. — P. 2409-2415.
22. Blagden M.D., Chipperfield R. Efficacy and safety of ezitimibe co-administered with atorvastatin in untreated patients with primary hypercholesterolaemia and coronary heart disease // Curr. Med. Res. Opin. — 2007. — Vol. 23, № 4. — P. 767-775.
23. Brunzell J.D., Davidson V., Furberg C.D. et al. Consensus Conference Report. Lipoprotein management in patients with cardiometabolic risk // J. Am. Coll. Cardiol. — 2008. — Vol. 51. — P. 1512-1524.
24. Cheng A.Y., Leiter L.A. Clinical use of ezetimibe // Can. J. Clin. Pharmacol. — 2003. — Vol. 10 (Suppl. A). — P. 21A-25A.
25. Denke M.A. Weighing in before the fight: low-density lipoprotein cholesterol and non-high-density lipoprotein cholesterol versus apolipoprotein B as a best predictor for coronary heart disease and the best measure of therapy // Circulation. — 2005. — Vol. 112. — P. 3868-3870.
26. ESC/EAS Guidelines for the management of dyslipidaemias. The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Sosiety (EAS) // Eur. Heart J. — 2011. — Vol. 32. — P. 1769-1818.
27. Gagne C., Bays H., Weiss S. et al. Efficacy and safety of ezetimibe added to ongoing statin therapy for treatment of patients with primary hypercholesterolemia // Am. J. Cardiol. — 2002. — Vol. 90, № 10. — P. 1084-1091.
28. Gazi I.F., Daskalopoulon S.S., Nair D.R. et al. Effect of ezetimibe in patients who cannot tolerate statins or cannot get to the low-density lipoprotein cholesterol target despite taking a statin // Curr. Med. Res. Opin. — 2007. — Vol. 23. — P. 2183-2192.
29. Grundy S.M., Cleeman J.I., Mezz C.N.B. et al. Implications of Recent Clinical Trial for the National Cholesterol Education Program Adult Treatment Panel III Guidelines // Circulation. — 2004. — Vol. 110. — P. 227-239.
30. Karter A.L., Batista M.C., Ferrera S.R. Synergistic effect of simvastatin and ezetimibe on lipid and proinflammatory profiles in pre-diabetic subjects // Diabetol. Metab. Syndr. — 2010. — Vol. 2. — P. 34.
31. Lamon-Fava S., Diffenderfer M.R., Barrett P.H. et al. Effects of different doses of atorvastatin on human apolipoprotein B-100, B-48, and A-I metabolism // J. Lipid Res. — 2007. — Vol. 48, № 8. — P. 1746-1753.
32. Le Roith D., Zick Y. Recent advances in our understanding of insulin action and insulin resistance // Diabetes Care. — 2001. — Vol. 24. — P. 588-597.
33. McFarine S.I., Banerji M., Sowers J.R. Insulin resistance and cardiovascular disease // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 713-718.
34. Migdalis I., Efthimiadis A., Pappas S. et al. Clinical experience with ezetimibe/simvastatin in a Mediterranean population // Curr. Med. Res. Opin. — 2009. — Vol. 25. — P. 2571-2576.
35. Pearson T.A., Denke M.A., McBride P.E. et al. A community based, randomized trial of ezetimibe added to statin therapy to attain NCEP ATP III goals for LDL cholesterol in hypercholesterolemic patients: The Ezetimibe Add-On to Statin for Effectiveness (EASE) Trial // Mayo Clin. Proc. — 2005. — Vol. 80, № 5. — P. 587-595.
36. Sarigianni M., Katsiki N., Mikhailidis D.P. Ezetimibe in diabetes: more than cholesterol lowering // Curr. Med. Res. Opin. — 2010. — Vol. 26, № 10. — P. 2517-2520.
37. Sattar N., Preiss D., Murray H.M. et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomized statin trials // Lancet. — 2010. — Vol. 375. — P. 735-742.
38. Shinichiro M., Keijiro S. Ezetimibe, a Selective Inhibitor of the Transport of Cholesterol // Inter. Med. — 2008. — Vol. 47. — P. 1165-1170.
39. Stein E., Lane M., Laskarzewski P. et al. Comparison of statins in hypertriglyceridaemia //Am. J. Cardiol. — 1998. — Vol. 81(Suppl. 4A). — P. 66B-69B.
40. Toth P.P., Davidson M.H. Simvastatin plus ezetimibe: combination therapy for the management of dyslipidaemia // Expert. Opin. Pharmacother. — 2005. — Vol. 6, № 1. — P. 131-139.
41. Wild S.H., Byrne C.D. Коррекция липидного профиля в снижении кардиоваскулярного риска у пациентов с метаболическим синдромом или сахарным диабетом 2 типа // Практическая ангиология. — 2006. — № 2 (03). — С. 57-60.
42. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications. Report of WHO consultation: Part 1. Diagnosis and classification of diabetes mellitus. — Geneva, 1999. — P. 1059.