Журнал «» 5(19) 2011
Вернуться к номеру
Симпозиум «Коррекция гиперурикемии как фактора риска сердечно-сосудистой заболеваемости и смертности»
Авторы: Бильченко А.В., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Проводят: Ассоциация кардиологов Украины, Всеукраинское общественное объединение против гипертензии, ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины.
Рекомендован: кардиологам, терапевтам, семейным врачам.
Исторически представление о нарушении обмена ксантинов было связано с клиническими проявлениями, т.е. подагрой и нефролитиазом. Взаимосвязь подагры с кардиоваскулярными заболеваниями и нефропатией многократно подтверждалась, однако не привлекала значительного внимания ввиду относительно небольшой распространенности подагры в популяции. С другой стороны, попытки применения мочевой кислоты (МК) как суррогатного маркера развития нефропатии оказались несостоятельными [1].
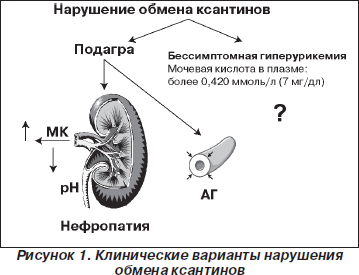
Новая волна интереса к мочевой кислоте связана c пониманием роли бессимптомной гиперурикемии (определяемой чаще всего как повышение уровня мочевой кислоты в плазме > 7,0 мг/дл, рис. 1) как мощного, независимого и модифицируемого фактора риска сердечно-сосудистой (СС) заболеваемости и смертности, основанным на данных многочисленных эпидемиологических и проспективных исследований.
Роль МК как предиктора сердечно-сосудистой заболеваемости и смертности изучалась практически во всех крупных популяционных исследованиях, причем были получены различные результаты [2–6]. Сопоставление двух наиболее крупных исследований — NHANES и Framingham Heart Study — позволило выявить важную закономерность, подтвердившуюся и в других исследованиях. Оказалось, что в целом в популяциях с более высоким кардиоваскулярным риском возрастает роль МК как независимого фактора риска СС-заболеваемости и смертности (кардиоваскулярная смертность была почти в 2 раза выше у лиц, включенных в исследование NHANES, в сравнении с Framingham Heart Study) [5, 6].
Данное положение было подтверждено в исследовании на основе регистра PreCIS database. В исследование были включены 3098 больных с высоким кардиоваскулярным риском. Период наблюдения составил 14 262 человеко-года. По результатам данного исследования, повышение исходного уровня МК на 1 мг/дл ассоциировалось с увеличением на 39 % риска смерти, независимо от других известных факторов риска [7].
В настоящее время доказана роль гиперурикемии как независимого предиктора кардиоваскулярной заболеваемости и смертности у больных ишемической болезнью сердца [8–10], хронической [11] и острой сердечной недостаточностью [12], артериальной гипертензией и предгипертензией [13] и метаболическим синдромом [14].
Особенно значительна роль гиперурикемии как независимого фактора риска СС-смертности у больных с ИБС и хронической сердечной недостаточностью. Данные исследования MONICA/KORA Cohort Study показали, что у больных с документированной ИБС повышение уровня мочевой кислоты, независимо от других известных факторов риска, ассоциировалось с достоверным и значительным увеличением как сердечно-сосудистой, так и общей смертности [8]. У больных инфарктом миокарда с элевацией сегмента ST повышение уровня мочевой кислоты — также независимый предиктор неблагоприятных исходов [9].
Крупное исследование влияния различных факторов на выраженность атеросклеротического поражения коронарных артерий по данным коронарографии показало, что уровень МК является более значимым фактором, определяющим степень поражения коронарных артерий, чем снижение уровня ЛПВП, повышение АД и возраст больных [10].
Хорошо изучена роль гиперурикемии у больных с ХСН. Несколько исследований показали, что бессимптомная гиперурикемия является независимым предиктором смертности и потребности в трансплантации сердца у больных с ХСН. При повышении уровня МК более 9,50 мг/дл риск смерти в течение года у больных с ХСН возрастал в 7 раз, а при повышении более 800 мкмоль/л — в 18,6 раза. Гиперурикемия, по данным этих исследований, оказалась более значимым предиктором смертности, чем фракция выброса левого желудочка, несмотря на то что уровень МК имел с ней сильную отрицательную корреляцию и положительную — с давлением в легочной артерии [15, 16]. Гиперурикемия не только предиктор неблагоприятных исходов у больных с ХСН, но и независимый фактор риска развития сердечной недостаточности у лиц старше 60 лет. Повышение уровня мочевой кислоты увеличивает риск смерти и у больных с острой сердечной недостаточностью. В исследовании, основанном на наблюдении в течение года за 560 больными, выжившими после острой сердечной недостаточности, было показано, что при исходном уровне МК менее 7,7 мг/дл смертность от всех причин была 21,6 %, а при уровне МК более 7,7 мг/дл смертность была почти в 2 раза выше и составила 39,7 % [12].
Наиболее изучена роль МК как предиктора кардиоваскулярных событий у больных артериальной гипертензией, сахарным диабетом и метаболическим синдромом (МС).
Повышенное потребление с пищей пуринов и/или белков, высокие дозы алкоголя или нарушения в системе ферментов, метаболизирующих ксантины, снижение скорости клубочковой фильтрации, прием тиазидных или тиазидоподобных диуретиков приводит к увеличению уровня мочевой кислоты в плазме.
Повышение уровня МК связано с риском развития артериальной гипертензии у нормотензивных лиц. Экспериментальные исследования показали, что повышение уровня МК приводит к развитию артериальной гипертензии за счет прямого влияния МК на гладкие мышцы и эндотелий сосудов. Роль бессимптомной гиперурикемии в развитии артериальной гипертензии доказана в крупном метаанализе 18 исследований, включившем 55 607 человек со средним периодом наблюдения 6 лет и показавшем, что риск развития гипертензии увеличивается на 40 % (RR 1,41; 95% CI, 1,23–1,58) [17]. Кроме того, у подростков с впервые возникшей артериальной гипертензией распространенность повышения уровня МК более 90 %. В данной популяции препараты, снижающие уровень МК, приводят к снижению АД, сопоставимому с эффектом основных классов антигипертензивных препаратов.
Бессимптомная гиперурикемия встречается у 25 % больных артериальной гипертензией, у 75 % больных с тяжелой АГ и у половины больных, принимающих тиазидные и тиазидоподобные диуретики, и является, как правило, следствием нарушенного клиренса уратов почками.
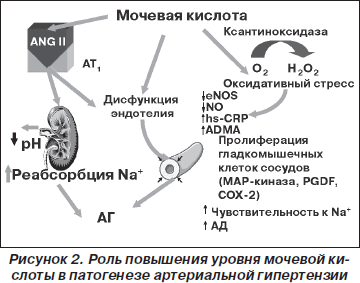
В свою очередь, при постоянной гиперурикемии развитие артериальной гипертензии связано с развитием прегломерулярной артериопатии и тубулоинтерстициальным поражением. Повышение уровня МК стимулирует активацию ренин-ангиотензиновой системы и усугубляет дисфункцию эндотелия. Кроме того, в условиях ишемии происходит превращение фермента ксантиноксиредуктазы в ксантиноксидазу, что приводит к изменению метаболизма ксантинов, превращению мочевой кислоты из антиоксиданта в прооксидант и стимулированию оксидативного стресса. Гиперурикемия приводит к эндотелиальной дисфункции за счет угнетения синтеза NO. Этот эффект мочевой кислоты обусловлен ее прооксидантными свойствами в условиях измененного метаболизма.
Мочевая кислота также стимулирует пролиферацию гладкомышечных клеток сосудов путем активации ростовых факторов, вазоконстрикторных и провоспалительных молекул. Таким образом, мочевая кислота является не только маркером, но и активным компонентом развития артериальной гипертензии (рис. 2) [18].
Однако более важной представляется роль МК как фактора риска кардиоваскулярных событий у больных с АГ, что подтверждается данными проспективных исследований. Вначале были опубликованы данные исследования Worksite Treatment Program, в котором у 8690 пациентов в течение года был достигнут контроль артериального давления и затем поддерживался в течение 18 лет. У тех больных, у которых уровень МК в ходе терапии повысился (в среднем на 1 мг/дл), наблюдалось на 32 % больше кардиоваскулярных событий, несмотря на одинаковый контроль артериального давления. Кардиоваскулярный риск, ассоциированный с повышением уровня МК на 1 мг/дл, сопоставим, по данным авторов исследования, с повышением на 46 мг/дл уровня общего холестерина или на 10 мм рт.ст. САД [19].
Краеугольным камнем в понимании роли мочевой кислоты как независимого предиктора кардиоваскулярной заболеваемости и смертности у больных артериальной гипертензией стало исследование PIUMA Study, включавшее 1720 больных АГ, наблюдавшихся в течение 12 лет. У больных АГ с исходным уровнем МК более 0,396 ммоль/л риск кардиоваскулярных событий, фатальных СС-событий и общей смертности был достоверно выше, чем у больных с исходным уровнем МК от 0,268 до 0,309 ммоль/л. С другой стороны, у больных АГ с низким исходным уровнем мочевой кислоты (менее 0,268 ммоль/л) также было достоверно больше количество СС-событий и выше общая смертность [20].
Следующим важным шагом в доказательстве роли МК как независимого предиктора СС-событий и смертности у больных АГ стало исследование SHEP, включавшее 4327 больных старше 60 лет с изолированной систолической гипертензией, лечившихся в течение 5 лет тиазидными диуретиками в сравнении с плацебо с добавлением атенолола или резерпина при необходимости. Прежде всего подтвердилась линейная зависимость у больных с АГ количества кардиоваскулярных событий, за исключением инсультов, от исходного уровня МК. Во-вторых, терапия тиазидным диуретиком в обычных терапевтических дозах (25 мг хлорталидона) у половины больных в течение года привела к повышению уровня мочевой кислоты. Однако наиболее важно то, что в группе больных, у которых применение тиазидного диуретика привело к повышению уровня МК, количество сердечно-сосудистых событий было на 42 % выше, чем в группе больных, у которых не было отмечено повышение МК [21].
Таким образом, исследование SHEP дало два важных вывода для клинической практики. Применение тиазидных диуретиков в обычных терапевтических дозах приводит у половины больных в течение года к бессимптомному повышению уровня МК, с которым ассоциируется значительное увеличение количества кардиоваскулярных событий. Следовательно, у таких больных необходимо мониторирование уровня МК и его снижение. Это положение отражено в новом Консенсусе экспертов ACCF/AHA 2011 по лечению гипертензии у пожилых [22].
Доказана роль мочевой кислоты и в развитии гипертрофии миокарда левого желудочка у больных артериальной гипертензией. В экспериментальных исследованиях было показано, что аллопуринол обладает способностью предотвращать развитие ГЛЖ при отсутствии снижения артериального давления. Полагают, что МК обладает способностью стимулировать рост кардиомиоцитов. Роль гиперурикемии в развитии ГЛЖ у больных артериальной гипертензией была подтверждена в крупном японском исследовании, в котором участвовало 3305 мужчин в возрасте 35–66 лет. ГЛЖ диагностировалась на основании ЭКГ-критериев Соколова — Лайона и/или Корнельского индекса. Повышение уровня мочевой кислоты в пределах 0,39–0,65 ммоль/л, или 6,6–11,0 мг/дл, значительно и достоверно увеличивало количество больных с ГЛЖ независимо от индекса массы тела, уровня креатинина, наличия диабета и дислипидемии (дополнительный риск 1,58; P < 0,001). Аналогичные результаты были получены у лиц с нормальным артериальным давлением [23].
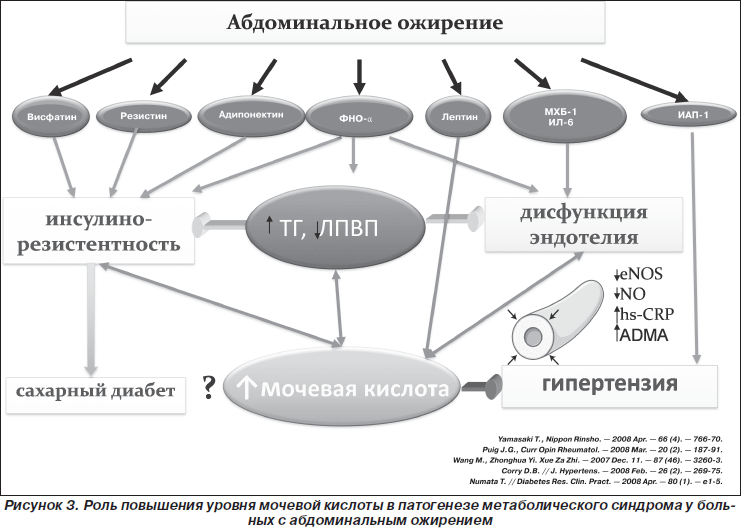
Наиболее часто бессимптомная гиперурикемия выявляется у больных артериальной гипертензией с абдоминальным ожирением. Роль МК как фактора риска кардиоваскулярной заболеваемости и смертности хорошо изучена у больных с метаболическим синдромом [24, 25]. Абдоминальное ожирение у половины больных запускает активацию синтеза адипокинов и цитокинов. Повышение синтеза адипокинов, наряду с другими факторами, приводит к развитию основных компонентов МС: резистентности периферических тканей к инсулину, дислипидемии и дисфункции эндотелия. Дальнейшее прогрессирование процесса приводит, в свою очередь, к повышению АД, развитию сахарного диабета 2-го типа, ускоренному прогрессированию атеросклероза и соответствующим клиническим проявлениям (рис. 3).
Гиперурикемия также рассматривается как важный компонент метаболического синдрома. Более того, первые определения МС включали гиперурикемию как основной компонент наряду с гипертензией и гипергликемией. Многочисленные исследования позволили четко определить роль мочевой кислоты в патогенезе метаболического синдрома [26, 27]. Гиперинсулинемия вследствие резистентности периферических тканей к инсулину снижает экскрецию почками мочевой кислоты, что и вызывает гиперурикемию, связанную со снижением экскреции МК. Абдоминальное ожирение приводит к повышению синтеза мочевой кислоты путем увеличения поступления в печень жирных кислот. Таким образом, гиперурикемия у больных с абдоминальным ожирением носит смешанный характер. В свою очередь, гиперурикемия связана с повышением уровня HbA1с, и повышение уровня МК у больных с метаболическим синдромом — сильный предиктор развития сахарного диабета 2-го типа [27]. Известно также, что уровень МК тесно коррелирует с уровнем лептина у больных МС, а ксантиноксидоредуктаза является одним из ключевых факторов дифференциации адипоцитов. Кроме того, у больных с МС гиперурикемия тесно коррелирует с уровнем триглицеридов, однако механизм этой взаимосвязи до настоящего момента непонятен. Если при этом учесть хорошо изученное влияние МК на функцию эндотелия и регуляцию АД, то становится очевидной ключевая роль МК в развитии метаболического синдрома. Не стоит забывать и хорошо известную роль бессимптомной гиперурикемии в развитии нефролитиаза у больных с метаболическим синдромом [28].
Таким образом, гиперурикемия — сильный, независимый и, главное, модифицируемый предиктор сердечно-сосудистой и общей смертности у больных с высоким и очень высоким сердечно-сосудистым риском (АГ, ИБС, цереброваскулярные заболевания, ХСН, метаболический синдром/сахарный диабет).
Соответственно, необходима разработка методов коррекции бессимптомной гиперурикемии и доказательство их эффективности в рандомизированных проспективных исследованиях.
В настоящее время известны следующие группы препаратов, снижающие уровень мочевой кислоты и устраняющие гиперурикемию [29]:
1) ингибиторы ксантиноксидазы:
— аллопуринол;
2) препараты с урикозурическим эффектом:
— лосартан;
— аторвастатин;
— фенофибрат.
Целесообразность использования ингибиторов ксантиноксидазы у больных кардиоваскулярными заболеваниями и бессимптомной гиперурикемией требует доказательства в рандомизированных исследованиях.
Более интересным с точки зрения клинической практики является использование препаратов с доказанной высокой эффективностью у больных с сердечно-сосудистыми заболеваниями и обладающих урикозурическим эффектом, таких как лосартан [30].
Наиболее хорошо изучено влияние на гиперурикемию лосартана в большом количестве рандомизированных и нерандомизированных исследований. Наиболее крупное исследование — J-HEALTH, проведенное в Японии и включавшее 30 000 больных АГ с периодом наблюдения в среднем 2,9 года. Все больные получали лосартан в средней дозе 47 мг/день (монотерапия — 59 %). В ходе терапии лосартаном 88 % больных достигли целевого уровня АД, при этом 3,6 % больных имели побочные эффекты, что сопоставимо с плацебо [31].
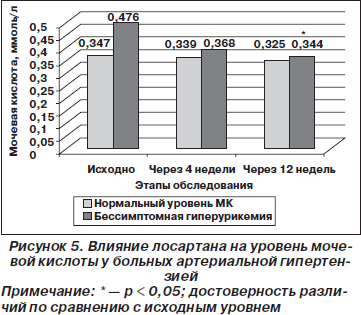
Кроме высокой эффективности и безопасности лосартана было доказано его влияние на уровень МК у больных с гиперурикемией. Исходно все больные были разделены в зависимости от уровня МК и наличия гиперурикемии (> 7 мг/дл) или ее отсутствия (< 7 мг/дл). Терапия лосартаном привела к достоверному снижению уровня мочевой кислоты при исходной гиперурикемии, причем снижение уровня МК не зависело от одновременного назначения ингибиторов ксантиноксидазы [31].
Проведенные нами исследования у 187 больных АГ показали, что бессимптомная гиперурикемия выявляется у каждого четвертого больного с АГ и достоверно чаще у больных с абдоминальным ожирением и принимающих диуретики (рис. 4) [32].

40 больных АГ — 20 больных с нормальным уровнем МК в плазме крови (группа 1) и 20 с бессимптомной гиперурикемией (группа 2) — были включены в открытое рандомизированное не сравнительное исследование влияния лосартана на уровень МК в плазме. Всем больным проводилась терапия лосартаном в дозе 50–100 мг в течение 12 недель.
Применение лосартана привело к снижению уровня МК у больных артериальной гипертензией с исходной гиперурикемией (рис. 5).
Это влияние лосартана на уровень МК зависело от исходного уровня и не коррелировало с изменениями АД и гемодинамики, показателями липидного обмена и вариабельностью сердечного ритма (рис. 6).
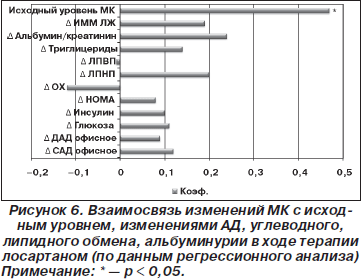
Лосартан также обладает способностью устранять гиперурикемию, связанную с применением тиазидных и тиазидоподобных диуретиков [33, 34]. Проведенные многочисленные исследования с различными комбинациями сартанов и тиазидных диуретиков продемонстрировали уникальность данного свойства молекулы лосартана. Ни один из сартанов, кроме лосартана, не обладал способностью снижать уровень МК при комбинации с тиазидными и тиазидоподобными диуретиками [35–37] (рис. 7).
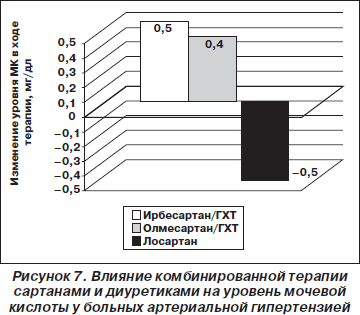
Однако более важно в данном случае, насколько снижение уровня МК при терапии лосартаном оказывает влияние на риск кардиоваскулярной заболеваемости и смертности у больных АГ. Частично ответ на этот вопрос дал анализ исследования Life study, проведенный его авторами. Сопоставление вклада различных факторов показало, что более значительное снижение кардиоваскулярного риска у больных, получавших лосартан, по сравнению с больными, получавшими атенолол, на 29 % было обусловлено снижением уровня мочевой кислоты в плазме при применении лосартана [38, 39]. Эти данные позволяют рассматривать лосартан как препарат выбора у больных АГ с бессимптомной гиперурикемией, в том числе вызванной применением тиазидных и тиазидоподобных диуретиков.
Таким образом, в настоящее время накоплено достаточно доказательств роли бессимптомной гиперурикемии у больных артериальной гипертензией как независимого маркера высокого кардиоваскулярного риска, требующего коррекции [40], что находит отражение в новых редакциях Рекомендаций по лечению больных с АГ [22].
Выводы
1. У больных АГ повышение уровня мочевой кислоты повышает риск СС-событий, фатальных СС-событий и общей смертности.
2. Повышение уровня мочевой кислоты у больных абдоминальным ожирением — независимый предиктор кардиоваскулярной смертности, развития сахарного диабета, артериальной гипертензии и нефролитиаза.
3. При лечении больных АГ тиазидными и тиазидоподобными диуретиками повышение уровня мочевой кислоты — независимый предиктор увеличения СС-смертности.
4. При гиперурикемии у больных с АГ лосартан снижает уровень МК за счет урикозурического эффекта. У больных с АГ и гиперурикемией вследствие применения тиазидных или тиазидоподобных диуретиков необходимо комбинировать их с лосартаном.
1. Gagliardi A.C., Miname M.H., Santos R.D. Uric acid: A marker of increased cardiovascular risk // Atherosclerosis. 2008 May 21.
2. Sakata K., Hashimoto T., Ueshima H., Okayama A. NIPPON DATA 80 Research Group. Absence of an association between serum uric acid and mortality from cardiovascular disease: NIPPON DATA 80, 1980-1994. National Integrated Projects for Prospective Observation of Non-communicable Diseases and its Trend in the Aged // Eur. J. Epidemiol. 2001; 17(5): 461-8.
3. Alderman M.H. Serum Uric Acid As a Cardiovascular Risk Factor for Heart Disease // Current Hypertension Reports 2001; 3: 184-189.
4. Culleton B.F., Larson M.G., Kannel W.B., Levy D. Serum uric acid and risk for cardiovascular disease and death: the Framingham Heart Study // Ann. Intern. Med. 1999 Jul 6; 131(1): 7-13.
5. Niskanen L.K., Laaksonen D.E., Nyyssonen K., Alfthan G., Lakka H.M., Lakka T.A., Salonen J.T. Uric acid level as a risk factor for cardiovascular and all-cause mortality in middle-aged men: a prospective cohort study // Arch. Intern. Med. 2004 Jul 26; 164(14): 1546-51.
6. Fang J., Alderman M.H. Serum uric acid and cardiovascular mortality the NHANES I epidemiologic follow-up study, 1971-1992. National Health and Nutrition Examination Survey // JAMA. 2000 May 10; 283(18): 2404-10.
7. Ioachimescu A.G., Brennan D.M., Hoar B.M., Hazen S.L., Hoogwerf B.J. Serum uric acid is an independent predictor of all-cause mortality in patients at high risk of cardiovascular disease: a preventive cardiology information system (PreCIS) database cohort study // Arthritis Rheum. 2008 Feb; 58(2): 623-30.
8. Meisinger C., Koenig W., Baumert J., Doring A. Uric Acid Levels Are Associated With All-Cause and Cardiovascular Disease Mortality Independent of Systemic Inflammation in Men From the General Population. The MONICA/KORA Cohort Study // Arterioscler Thromb. Vasc. Biol. 2008 Mar 20.
9. Celik T., Iyisoy A. Uric acid levels for the prediction of prognosis in patients with acute ST elevation myocardial infarction: A new potential biomarker // Int. J. Cardiol. 2009 Jan 19.
10. Hu W. et al. Correlation between cardiovascular risk factors and the severity of coronary artery lesions in female patients // Nan Fang Yi Ke Da Xue Xue Bao. 2009 Feb; 29(2): 307-9
11. Ekundayo O.J., Dell’italia L.J., Sanders P.W., Arnett D., Aban I., Love T.E., Filippatos G., Anker S.D., Lloyd-Jones D.M., Bakris G., Mujib M., Ahmed A. Association between hyperuricemia and incident heart failure among older adults: A propensity-matched study // Int. J. Cardiol. 2009 Feb 5.
12. Alimonda A.L., Nunez J., Nunez E., Husser O., Sanchis J., Bodi V., Minana G., Robles R., Mainar L., Merlos P., Darmofal H., Llacer A. Hyperuricemia in acute heart failure. More than a simple spectator? // Eur. J. Intern. Med. 2009 Jan; 20(1): 74-9.
13. Forman J.P., Choi H., Curhan G.C. Uric acid and insulin sensitivity and risk of incident hypertension // Arch. Intern. Med. 2009 Jan 26; 169(2): 155-62
14. Rodilla E., Perez-Lahiguera F., Costa J.A., Gonzalez C., Miralles A., Moral D., Pascual J.M. Association between serum uric acid, metabolic syndrome and microalbuminuria in previously untreated essential hypertensive patients //Med. Clin. (Barc). 2009 Jan 17; 132(1): 1-6.
15. Martinez A., Gonzalez A., Cerda C., Perez P., Castro P., Perez O., Isa R., Corbalan R. Prognostic value of hyperuricemia in chronic heart failure // Rev. Med. Chil. 2004 Sep; 132(9): 1031-6.
16. Pinelli M., Bindi M., Filardo F.P., Moroni F., Castiglioni M.Serum uric acid levels correlate with left ventricular ejection fraction and systolic pulmonary artery pressure in patients with heart failure // Recenti. Prog. Med. 2007 Dec; 98(12): 619-23.
17. Grayson P.C. et al. Arthritis Care Res (Hoboken). 2010 Sep 7.
18. Schachter M. Uric acid and hypertension // Curr. Pharm. Des. 2005; 11(32): 4139-43.
19. Alderman M.H., Cohen H., Madhavan S. Distribution and determinants of cardiovascular events during 20 years of successful antihypertensive treatment // J. Hypertens. 1998; 16: 761-9.
20. Verdecchia P., Schillaci G., Reboldi G., Santeusanio F., Porcellati C., Brunetti P. Relation between serum uric acid and risk of cardiovascular disease in essential hypertension. The PIUMA study // Hypertension. 2000 Dec; 36(6): 1072-8.
21. Franse L.V., Pahor M., Di Bari M., Shorr R.I., Wan J.Y., Somes G.W. et al. Serum uric acid, diuretic treatment and risk of cardiovascular events in the Systolic Hypertension in the Elderly Program (SHEP) // J. Hypertens. 2000; 18: 1149-54.
22. ACCF/AHA 2011 expert consensus document on hypertension in the elderly: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents // Circulation. 2011; 123: 000–000.
23. Mitsuhashi H., Yatsuya H., Matsushita K. Uric Acid and Left Ventricular Hypertrophy in Japanese Men // Circ. J. 2009 Feb 19.
24. Ebrahimpour P., Fakhrzadeh H., Heshmat R., Bandarian F., Larijani B. Serum uric acid levels and risk of metabolic syndrome in healthy adults // Endocr. Pract. 2008 Apr; 14(3): 298-304.
25. Puig J.G., Martinez M.A. Hyperuricemia, gout and the metabolic syndrome // Curr. Opin. Rheumatol. 2008 Mar; 20(2): 187-91.
26. Hayden M.R., Tyagi S.C. Uric acid: A new look at an old risk marker for cardiovascular disease, metabolic syndrome, and type 2 diabetes mellitus: The urate redox shuttle // Nutr. Metab. (Lond). 2004 Oct 19; 1(1): 10.
27. Choi H.K., Ford E.S. Haemoglobin A1c, fasting glucose, serum C-peptide and insulin resistance in relation to serum uric acid levels — the Third National Health and Nutrition Examination Survey // Rheumatology (Oxford). 2008 May; 47(5): 713-7.
28. Sakhaee K., Maalouf N.M. Metabolic syndrome and uric acid nephrolithiasis // Semin Nephrol. 2008 Mar; 28(2): 174-80.
29. Ogino K., Igawa O., Hisatome I. The other antihyperuricemic agents // Nippon Rinsho. 2008 Apr; 66(4): 754-7.
30. Alderman M., Aiyer K.J. Uric acid: role in cardiovascular disease and effects of losartan // Curr. Med. Res. Opin. 2004 Mar; 20(3): 369-79.
31. Naritomi H., Fujita T., Ito S., Ogihara T., Shimada K., Shimamoto K., Tanaka H., Yoshiike N. Efficacy and safety of long-term losartan therapy demonstrated by a prospective observational study in Japanese patients with hypertension: The Japan Hypertension Evaluation with Angiotensin II Antagonist Losartan Therapy (J-HEALTH) study // Hypertens. Res. 2008 Feb; 31(2): 295-304.
32. Більченко О.В. Корекція гіперурикемії як фактора ризику серцево-судинної захворюваності і смертності: Методичні рекомендації. — Київ, 2010. — 20 с.
33. Shimosawa T., Gohchi K., Yatomi Y., Fujita T. Effectiveness of add-on low-dose diuretics in combination therapy for hypertension: losartan/hydrochlorothiazide vs. candesartan/amlodipine // Hypertens Res. 2007 Sep; 30(9): 831-7.
34. Nikas S., Rizos E., Milionis H., Bairaktari E., Kalaitzidis R., Siamopoulos K., Elisaf M. The effects of the addition of losartan on uric acid metabolism in patients receiving indapamide // J. Renin Angiotensin Aldosterone Syst. 2000 Sep; 1(3): 289-91.
35. Линчак Р.М., Шумилова К.М., Мартынюк А.Д., Гусаим Т.А., Семенова Е.В., Жирова Л.Г., Бойцов С.А. Применение препарата Лозап плюс в антигипертензивной терапии // Рациональная фармакотерапия в кардиологии. — 2006. — № 1.
36. Fogari R., Zoppi A., Mugellini A., Corradi L., Lazzari P., Preti P., Derosa G. Efficacy and safety of two treatment combinations of hypertension in very elderly patients // Arch. Gerontol. Geriatr. 2008 May 3.
37. Fogari R., Derosa G., Zoppi A., Rinaldi A., Preti P., Lazzari P., Mugellini A. Effects of manidipine/delapril versus olmesartan/hydrochlorothiazide combination therapy in elderly hypertensive patients with type 2 diabetes mellitus // Hypertens. Res. 2008 Jan; 31(1): 43-50.
38. Hoieggen A. et al. The impact of serum uric acid on cardiovascular outcomes in the LIFE study // Kidney International. 2004; 65: 1041-9.
39. Daskalopoulou S.S. et al. The impact of serum uric acid on cardiovascular outcomes in the LIFE study // Kidney Int. 2004; 66 (4): 1714-5.
40. Krishnan E., Sokolove J. Uric acid in heart disease: a new C-reactive protein? // Current Opinion in Rheumatology. 2011; 23(2): 174-7.