Международный неврологический журнал 6 (44) 2011
Вернуться к номеру
Структурные и метаболические особенности головного мозга при болезни Паркинсона по данным магниторезонансной томографии и магниторезонансной спектроскопии in vivo
Авторы: Рожкова З.З.1, Карабань Н.В.2, Карабань И.Н.2, 1Медицинская клиника «Борис», 2Институт геронтологии НАМН Украины
Рубрики: Неврология
Версия для печати
В работе проанализированы возможности методов МРТ и in vivo МРС для нахождения специфических структурных и метаболических отличий болезни Паркинсона (БП) от паркинсонических синдромов при других нейродегенеративных заболеваниях. Представлено количественное описание концентраций основных церебральных метаболитов (NAA, Cr, Cho) в органах-мишенях, ответственных за когнитивные функции. Обнаружено уменьшение соотношения NAA/Cr в области поясной извилины у больных БП с доклиническими признаками деменции.
Болезнь Паркинсона, диагностика, МРТ, МРС.
Манифестации симптомов болезни Паркинсона (БП) может предшествовать длительный, не менее 5–10 лет, период удовлетворительной компенсации недостаточности функций дофаминергической нигростриарной системы [1]. От момента появления первых признаков заболевания до установления достоверного диагноза, как правило, проходит от 2 до 5 лет. Длительность этого периода, получившего определение как «диагностическая фаза заболевания» [2], является одним из факторов, лимитирующих своевременное назначение патогенетической терапии. Можно полагать, что на ранних стадиях БП скрытые, субклинические признаки нарушения функционального состояния экстрапирамидной нервной системы могут быть выявлены лишь при помощи специальных диагностических методик. Современные методы нейровизуализации позволяют не только прижизненно изучать с помощью магниторезонансной томографии (МРТ) структурные изменения головного мозга, но также оценивать с помощью магниторезонансной спектроскопии (МРС) такие функциональные параметры, как метаболизм и перфузия ткани в любой области головного мозга. Поскольку метаболические изменения нередко опережают во времени появление структурных признаков патологии, методам МРТ и in vivo МРС следует отвести особую роль как реально позволяющим сократить длительность диагностической фазы.
В клинических приложениях in vivo МРС анализируется содержание в ткани головного мозга следующих основных метаболитов: N-ацетил-L-аспартата (NAA), холинсодержащих соединений (Cho), креатина и фосфокреатина (Cr), а также миоинозитола (mIns). NAA — аминокислоту, обнаруживаемую в высокой концентрации в спинном мозге (концентрация производных NAA занимает второе место после глутамата), — называют нейрональным маркером [18]. NAA синтезируется в митохондриях нейронов серого вещества головного мозга (СВГМ) из L-аспартата и ацетил-кофермента-А (СоА), высвобождается из нейронов в цереброспинальную жидкость и затем транспортируется в олигодендроциты [3]. Роль NAA в головном мозге для его нормального развития и функционирования белого вещества головного мозга (БВГМ) изучена [4], и доказано отсутствие прямо пропорциональной зависимости между содержанием NAA и плотностью нейронов. Обнаружение NAA в олигодендроцитах [5] позволяет предположить, что основной вклад в содержание NAA дает миелин.
Наблюдаемый в спектрах 1Н in vivo сигнал Cr характеризует суммарное содержание Cr и фосфокреатина во всех типах нейрональных клеток [6]. Концентрация Cr с возрастом медленно растет [7], однако, за исключением внутримозговых опухолей и участков ишемии [8], содержание Cr в ткани головного мозга достаточно стабильно, что позволяет использовать этот сигнал в качестве внутреннего стандарта для расчета концентрации других метаболитов.
У пациентов с БП в базальных ганглиях наблюдается незначительное уменьшение по сравнению с контрольной группой (КГ) отношений NAA/Cr. Обнаружена отрицательная корреляция между NAA/Cr в височно-теменной области и стадией заболевания по шкале Hoehn — Yahr [9]. Показано, что NAA/Cr уменьшается в симптоматически более пораженном полушарии у пациентов с преимущественной односторонней симптоматикой, а в контралатеральном полушарии было обнаружено возрастание NAA/Cr по сравнению с КГ [10]. В височно-теменных областях найдено существенное убывание NAA/Cr на пораженной стороне.
Современные методы нейровизуализации (МРТ и in vivo 1H МРС) позволяют выявлять мельчайшие структурные и метаболические изменения в ткани головного мозга пациентов с БП, свидетельствующие об активизации процессов нейродегенерации, и, совместно с нейропатологическими и клиническими данными, оценивать, насколько глубоко под влиянием нейродегенерации затронуты когнитивные функции, а также прогнозировать риск их снижения в дальнейшем [11, 12]. Подобно тому, как при болезни Альцгеймера (БА) в определенных структурах головного мозга наблюдаются специфические изменения анатомии, нейрохимии и физиологии, отражающие связь между нейродегенерацией и прогрессивным снижением когнитивных функций, можно предположить, что подобные региональные изменения будут наблюдаться и при появлении когнитивных расстройств у пациентов с БП. Более того, можно предположить, что постепенное прогрессирующее накопление этих изменений позволит сформировать массив специфических биомаркеров, которые задолго до появления клинических симптомов деменции могут рассматриваться как признаки прогрессивного снижения когнитивных функций [13, 14].
Установлено, что как у дементных, так и у недементных пациентов с БП и у пациентов с БА выраженность атрофии гиппокампа коррелирует со степенью нарушения когнитивных функций. Следовательно, можно предположить, что атрофия гиппокампа является морфологическим признаком таких нейродегенеративных заболеваний, как БА и БП. При обследовании пациентов с БА методом МРС было обнаружено, что в области поясной извилины содержание основных церебральных метаболитов (NAA, Cr и Cho) уменьшается по сравнению с наблюдаемым у пациентов КГ, а миоинозитола — увеличивается [15, 16]. К метаболическим признакам БА относят уменьшение отношений NAA/Cr и Cho/Cr, а также увеличение mIns/Cr в области поясной извилины. При этом уменьшение NAA/Cr и Cho/Cr является отражением общих для множества нейродегенеративных заболеваний процессов, а возрастание mIns/Cr в области поясной извилины — специфическим признаком БА. Общность морфологических признаков БА и БП позволяет предположить также и подобие биохимических изменений, характерных для БА и БП [14, 17–19]. Диффузионно взвешенные изображения значительно более чувствительны к структурным и метаболическим изменениям, происходящим в ткани головного мозга при нейродегенерации, по сравнению со стандартными МР-изображениями [20]. В процессе нейродегенерации при изменении нормального церебрального метаболизма возникают новые метаболические пути и одновременно новые продукты метаболизма, которые, в свою очередь, изменяя нормальный клеточный состав, приводят к появлению новых клеточных элементов и, как следствие, меняют нормальную микро- и макроструктуру клеток мозга. Все эти процессы можно охарактеризовать количественно по изменению значений парциальной анизотропии и значениям измеряемых коэффициентов диффузии (ИКД) в различных структурах головного мозга [21, 22].
Целью данного исследования является проверка гипотезы об уменьшении содержания метаболитов в области поясной извилины и уменьшении значений ИКД как о маркерах риска развития деменции при БП по аналогии с тем, что наблюдается у пациентов с БА.
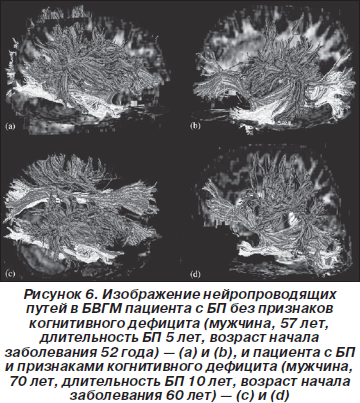
В данной работе были проведены измерения объема гиппокампа и определено содержание основных церебральных метаболитов (NAA, Cr и Cho) и отношений NAA/Cr, Cho/Cr и mIns/Cr в области поясной извилины, а также изучена зависимость между этими показателями и выраженностью когнитивных нарушений у пациентов с БП без признаков и с признаками деменции. В дополнение к значениям отношений NAA/Cr в области поясной извилины в данной работе определены времена спин-спиновой релаксации Т2 протонов метаболитов NAA, Cr и Cho. Для визуализации структурных изменений на основании карт распределения ИКД построены изображения нейропроводящих путей в белом веществе головного мозга для пациентов обеих групп и показано, какие из структур головного мозга подвержены наибольшему влиянию в процессе нейродегенерации.
Материалы и методы
Все пациенты, принявшие участие в нашем исследовании, были разделены на 3 группы. В 1-ю группу вошли 18 здоровых волонтеров (14 мужчин и 4 женщины) в возрасте от 23 до 74 лет (8 молодых 23–28 лет, 10 пожилых 63–74 лет). 2-ю группу составили 15 пациентов с БП без признаков деменции (8 женщин и 7 мужчин) в возрасте от 48 до 70 лет, и 3-ю группу — 15 пациентов с БП и признаками нейропсихологического дефицита (6 женщин и 9 мужчин). Все принявшие участие в исследовании прошли тестирование по шкале UPDRS, MMSE, Hoehn and Yahr range of 1.0–2.5.
МРТ- и МРС-исследования проведены на томографе 1.5Т Signa Excite HD (GE). Для точной локализации области интереса (ОИ) для записи 1Н-спектров in vivo были получены МР изображения в трех ортогональных проекциях. Параметры импульсной последовательности, используемой для получения Т1-взвешенных изображений в аксиальной и фронтальной проекциях: TR = 4,4 мс (TR — временной интервал между возбуждающими импульсами), TE = 2,24 мс (ТЕ — время формирования эхо-сигнала), FA = 70 о (FA — угол отклонения вектора намагниченности после воздействия на спиновую систему возбуждающего импульса), NS = 1 (NS — количество накоплений), FoV = 275 мм (FoV — величина поля обзора), толщина среза 5 мм. Получены Т1-взвешенные изображения в сагиттальной проекции с помощью последовательности градиентного эхо: TR = 200 мс, TE = 4,6 мс, NS = 1, FoV = 200 мм, толщина среза 5 мм, расстояние между срезами 1,5 мм. Дополнительно получены Т1-взвешенные изображения в сагиттальной проекции и для более точной локализации области поясной извилины проведена 3D MPRAGE-реконструкция: TR = 1800 мс, TE = 3,84 мс, NS = 1, FA = 15о, FoV = 256 мм, толщина среза 1,5 мм, количество срезов 128.
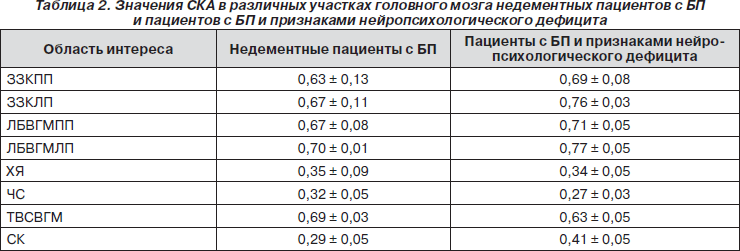
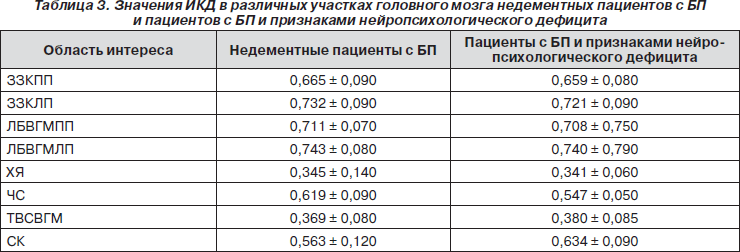
Для визуализации нейропроводящих путей в белом веществе головного мозга были получены диффузионно взвешенные изображения и построены карты распределения коэффициентов диффузии молекул воды в белом веществе головного мозга. Диффузионно взвешенные изображения получены методом EPI с использованием следующих параметров сбора и обработки данных: TR/TE = 10000/38 мс, b = 1000 с/мм2. Значения ИКД молекул воды и средние коэффициенты анизотропии (СКА) рассчитаны в следующих структурах головного мозга: в затылочной зоне коры (ЗЗК) в правом и левом полушарии — соответственно ЗЗКПП и ЗЗКЛП, в лобных долях в белом веществе обоих полушарий головного мозга (ЛБВГМПП, ЛБВГМЛП), в хвостатом ядре (ХЯ), в черной субстанции (ЧС), в теменно-височной области в сером веществе головного мозга (ТВСВГМ) и в скорлупе (СК).
Результаты и обсуждение
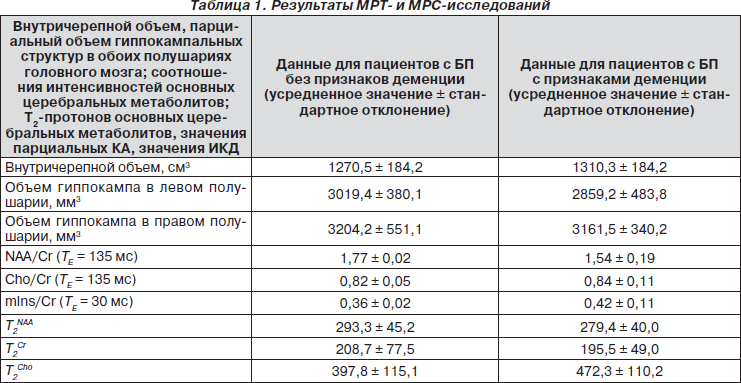
Из анализа изображений в трех ортогональных анатомических проекциях был определен объем различных сегментов, а также суммарный объем гиппокампа. Последовательная выборка срезов толщиной 1,2 мм (по изображениям, реконструированным во фронтальной проекции) позволила рассчитать суммарный внутричерепной объем, а также оценить парциальные объемы супратенториальной субарахноидальной области и срединных структур. Коэффициенты корреляции для каждой из исследованных структур головного мозга свидетельствуют о достаточно высокой точности данного метода расчета: 0,79 при расчете объема гиппокампа и 0,99 для внутричерепного объема. Результаты волюметрических исследований приведены в табл. 1.
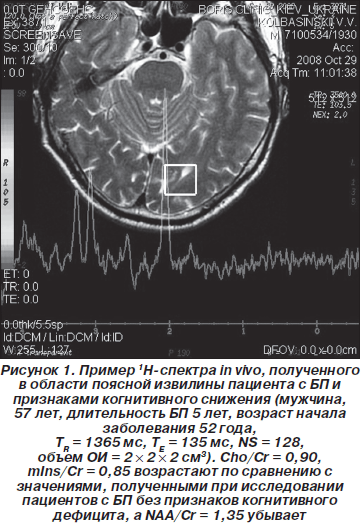
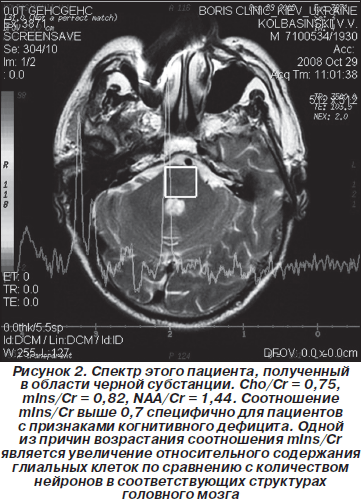
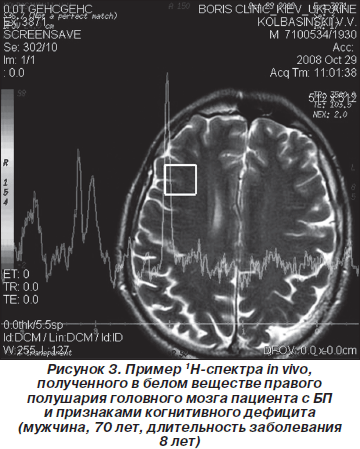
В in vivo 1H-спектрах в белом веществе ткани головного мозга наблюдаются сигналы двадцати различных метаболитов, наиболее интенсивными из которых, а следовательно, используемыми, как правило, для описания региональных особенностей церебрального метаболизма в норме и при патологии, являются сигналы N-ацетиласпартата, креатина и холина. Из анализа данных in vivo 1H-спектров, полученных в области поясной извилины для всех пациентов и волонтеров, были определены средние значения концентрации NAA, а также средние значения отношений NAA/Cr. На рис. 1 приведены спектры, полученные в области поясной извилины (мужчина, 57 лет, длительность БП 5 лет, возраст начала заболевания 52 года). Из спектров были определены значения интегральных интенсивностей сигналов основных метаболитов и рассчитаны отношения NAA/Cr, Cho/Cr и mIns/Cr. Данные расчетов приведены в табл. 1.
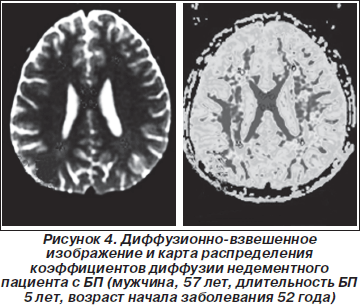
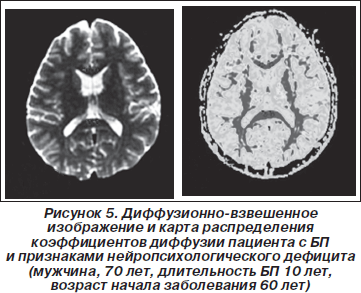
Значения ИКД молекул воды и СКА в ЗЗКПП, ЗЗКЛП, в ЛБВГМПП, ЛБВГМЛП, в ХЯ, в ЧС, в ТВСВГМ и в СК приведены в табл. 2 и 3. Для области поясной извилины рассчитаны значения отношений объемов (ОО). На рис. 4–6 приведены примеры карты распределения ИКД и результаты обработки этих данных — трехмерные изображения нейропроводящих путей.
Из анализа данных, приведенных в табл. 1, следует, что в области поясной извилины у недементных пациентов с БП отношение NAA/Cr, рассчитанное по спектрам при TE = 135 мс, существенно ниже наблюдаемого у пациентов с БП и признаками нейропсихологического дефицита, а отличия отношений Cho/Cr и mIns/Cr менее значительные.
Из анализа данных, приведенных в табл. 2 и 3, обнаружена положительная корреляция между значениями отношений NAA/Cr и СКА (в правом полушарии: r = 0,410, p = 0,018, в левом полушарии: r = 0,570, p = 0,001). А также между значениями отношений NAA/Cr и средними значениями ОО (в правом полушарии: r = 0,441, p = 0,008, в левом полушарии: r = 0,590, p = 0,001). Обнаружена отрицательная корреляция между средними значениями ИКД (в правом полушарии: r = –0,440, p = 0,008, в левом полушарии: r = –0,540, p = 0,001) и значениями отношений NAA/Cr. Показано, что для корреляций между средними значениями NAA/Cr и значениями ОО наблюдается большая чувствительность и специфичность по сравнению с корреляцией между величинами содержания NAA и значениями ОО: в правом полушарии AUC = 0,910. Использование для корреляционного анализа только значений NAA, а не отношений NAA/Cr, дает AUC = 0,770. Корреляция отношений NAA/Cr с ОО соответствует AUC = 0,850.
Заключение
Основным результатом данной работы является обнаруженное в области поясной извилины у пациентов с БП и признаками нейропсихологического дефицита убывание отношений NAA/Cr по сравнению с значениями, обнаруженными у недементных пациентов с БП. Эта тенденция к убыванию NAA/Cr аналогична ранее установленной у пациентов с БА [23, 24]. Более того, поскольку уменьшение NAA/Cr в области поясной извилины не является специфическим биохимическим маркером БА, это дополнительно подтверждает предположение о существовании единых механизмов формирования когнитивных нарушений при нейродегенеративных заболеваниях, таких как БА и БП [23, 24]. Этот результат подтверждает также представление о методе МРС как об эффективном для изучения нейрохимических механизмов когнитивных расстройств при БП, несмотря на отсутствие корреляции между убыванием NAA/Cr и степенью нарушения моторных функций у больных с БП [25–27]. У недементных пациентов с БП среднего возраста (моложе 55 лет) отсутствует корреляция между атрофией гиппокампа, значениями Cho/Cr, mIns/Cr, а также величинами T2i. Сравнение полученных результатов с приведенными в [24] позволяет объяснить большой разброс данных и, как следствие, отличие выводов, сделанных на их основе. Основными факторами, влияющими на величины отношений NAA/Cr у пациентов с БП без признаков деменции и с признаками нейропсихологического дефицита, являются возраст исследуемых и возраст дебюта заболевания.
В заключение отметим, что у пациентов с БП в процессе развития нейропсихологического дефицита при отсутствии существенного отличия в значении объема гиппокампа по сравнению с недементными пациентами с БП, то есть при отсутствии выраженной атрофии срединных структур и гиппокампа, наблюдается достоверное уменьшение отношения NAA/Cr в области поясной извилины. Региональные отличия значений NAA/Cr могут быть использованы для прогноза развития деменции у пациентов с БП.
Метод 1H МРС обладает принципиально новыми возможностями по сравнению со стандартными методами нейровизуализации для изучения биохимических особенностей головного мозга пациентов с БП. Комплексное исследование с применением метода in vivo 1H МРС и метода МРТ для получения диффузионно-взвешенных изображений позволяет изучать взаимоотношения между изменениями диффузионных характеристик ткани головного мозга и церебральным метаболизмом при БП. Визуализация участков нарушения целостности нейропроводящих путей в белом веществе головного мозга может быть использована в дальнейшем для изучения специфики аксональных нарушений при БП у пациентов без признаков деменции и в процессе нарастания нейропсихологического дефицита.
1. Kemp P.M. Imaging the dopaminergic system in suspected Parkinsonism, drug induced movement disorders, and Lewy body dementia // Nuclear Medicine Communications. — 2005. — 26. — P. 87-96.
2. Kemp P.M. Imaging the dopaminergic system in suspected Parkinsonism, drug induced movement disorders, and Lewy body dementia // Nuclear Medicine Communications. — 2005. — 26. — P. 87-96.
3. Viola R.E. The impact of structural biology on neurobiology // PNAS. — 2007. — V. 104, No. 2. — P. 399-400.
4. Charlton R.A., Barrick T.R., McIntyre D.J. et al. White matter denage on diffusion tensor imaging correlates with age-related cognitive decline // Neurology. — 2006. — 66. — P. 217-222.
5. Proton magnetic resonance spectroscopy in dementia with Lewy bodies / J.A. Molina, J.M. Garcia-Segura, J. Benito-Leon et al. // Eur. Neurol. — 2002. — Vol. 48, № 3. — P. 158-163.
6. Chang L., Ernst T., Poland R.E., Jenden D.J. In vivo proton magnetic resonance spectroscopy of the normal aging human brain // Life Sciences. — 1996. — 58. — P. 2049-2056.
7. Saunders D.E., Howe F.A., van den Boogaart A. et al. Aging of the adult human brain: in vivo quantification of metabolite content with proton magnetic resonance spectroscopy // J. Magn. Reson. Imaging. — 1999. — 9. — P. 711-716.
8. Rozhkova Z.Z., Rogozhyn V.A., Shcheglov V.I., Shcheglov D.V., Barkanov A.V., Kuznetsova S.M., Kuznetsov V.V. 1H MRS study of cerebral metabolism in patients with stenosis or occlusion of the internal carotid artery // European Journal of Neurology. — 2006. — 13(2), Supplement 2, September 2006. — P. 59.
9. Abe K., Terakawa H., Takanashi M. et al. Proton magnetic resonance spectroscopy of patients with Parkinsonism // Brain Res. Bull. — 2000. — 52. — P. 589-595.
10.Choe B.-Y., Park J.-W., Lee K.-S. et al. Neuronal laterality in Parkinson’s disease with unilateral symptom by in vivo 1H magnetic resonance spectroscopy // Invest. Radiol. — 1998. — 33. — P. 450-455.
11. Sitburana O., Ondo W.G. Brain magnetic resonance imagimg in parkinsonian disorders // Parkinsonism and Related Disorders. — 2009. — 15. — P. 165-174.
12. Seppi K. MRI for the differential diagnosis of neurodegenerative parkinsonism in clinical practice // Parkinsonism and Related Disorders. — 2007. — 13. — P. 400-405.
13. Selkoe D.J. Alzheimer’s Disease is a synaptic failure // Science. — 2002. — 298. — P. 789–791.
14. Coleman P., Federoff H., Kurlan R. A focus on the synapse for neuroprotection in Alzheimer disease and other dementia // Neurology. — 2004. — 63. — P. 1155-1162.
15. Fellgiebel A., Wille P., Mueller M. et al. Ultrastructural Hippocampal and White Matter Alterations in Mild Cognitive Impairment: A Diffusion Tensor Imaging Study // Dement. Geriatr. Cogn. Disorders. — 2004. — 18. — P. 101-108.
16. Riekkinen P., Kejonen K., Laakso M.P. et al. Hippocampal atrophy is related to impaired memory, but not frontal functions in non-demented Parkinson’s disease patients // NeuroReport. — 1998. — 9. — P. 1507-1511.
17. Summerfeld C., Gomez-Anson B., Tolosa E. et al. Dementia in Parkinson’s disease: a proton magnetic resonance spectroscopy study // Arch. Neurol. — 2002. — 59. — P. 1415-1420.
18. Grieve S.M., Williams L.M., Paul R.H. et al. Cognitive aging, executive function, and fractional anisotrophy: a diffusion tensor MRI study // American Journal of Neuroradiology. — 2007. — 28. — P. 226-235.
19. Schiavene F., Charlton R.A., Barrick T.R. et al. Imaging age-related cognitive decline: a comparison of diffusion tensor and magnetization transfer MRI // Journal of Magnetic Resonance Imaging. — 2009. — 29. — P. 23-30.
20. Xie S., Xiao J.X., Gong G.L. et al. Voxel-based detection of white matter abnormalities in mild Alzheimer disease // Neuro-logy. — 2006. — 66. — 12. — P. 1845-1849.
21. Kanaan R.A., Shergill S.S., Barker G.J. et al. Tract-specific anisotropy measurements in diffusion tensor imaging // Psychiatry Research. — 2006. — 146(1). — P. 73-82.
22. Medina D., DeToledo-Morrell L., Urresta F. et al. White matter changes in mild cognitive impairment and AD: A diffusion tensor imaging study // Neurobiology and Aging. — 2006. — 27(5). — P. 663-672.
23. Cortical cholinergic function is more severely affected in parkinsonian dementia than in Alzheimer disease: an in vivo positron emission tomographic study / N.I. Bohnen, D.I. Kaufer, L.S. Ivanco et al. // Arch Neurol. — 2003. — Vol. 60, № 12. — P. 1745-1748.
24. Molina J.A., Garcia-Segura J.M., Benito-Leon J. Proton magnetic resonance spectroscopy in dementia with Lewy bodies // Eur. Neurol. — 2002. — 48. — P. 158-163.
25. Kantarchi K., Smith R.J., Ivnik R.J. et al. 1H magnetic resonance spectroscopy, cognitive function, and apolipoprotein E genotype in normal aging, mild cognitive impairment and Alzheimer’s disease // J. Int. Neuropsyhol. Soc. — 2002. — 8. — P. 934-942.
26. Vander-Borght T., Minoshima S., Giordani B. et al. Cerebral metabolic differences in Parkinson’s and Alzheimer’s diseases matched for dementia severity // J. Nucl. Med. — 1997. — 38. — P. 797-802.
27. Hanstock C.C., Cwik V.A., Martin W.R. Reduction in metabolite transverse relaxation times in amyotrophic lateral sclerosis // J. Neurol. Sci. — 2002. — 198. — P. 37-41.