Международный неврологический журнал 6 (44) 2011
Вернуться к номеру
Возможности электромиографической диагностики болезни Паркинсона и выявления группы риска у родственников больных
Авторы: Луханина Е.П., Пилькевич Н.А., Институт физиологии им. А.А. Богомольца, Березецкая Н.М., Чивликлий М.А., Институт геронтологии НАМН Украины, г. Киев
Рубрики: Неврология
Версия для печати
У пациентов с болезнью Паркинсона (БП), здоровых лиц среднего и пожилого возраста проведен сравнительный анализ статистических характеристик поверхностной электромиограммы (ЭМГ): гистограммы распределения амплитуды, дисперсии, коэффициента асимметрии и коэффициента эксцесса. С целью выявления группы риска по паркинсонизму указанные характеристики ЭМГ исследованы также у родственников пациентов с БП. Регистрировали ЭМГ сгибателей и разгибателей локтевого сустава в состоянии покоя. У здоровых лиц установлены критические значения нормальных характеристик ЭМГ: размах амплитуды не превышал 20 мкВ, дисперсия — 7, модуль коэффициента асимметрии — 0,2 и коэффициент эксцесса — 0,4. У больных БП параметры этих показателей были значительно повышены (р < 0,001). Выявлена корреляция (р < 0,01) между коэффициентом эксцесса и баллами клинической шкалы, оценивающими интенсивность тремора. По статистическим параметрам ЭМГ у 43 % исследованных родственников обнаружены признаки нарушенной мышечной активности. С целью предотвращения манифестации заболевания БП для группы риска разработаны рекомендации с указанием лекарственных средств, длительного применения которых следует избегать.
Интерференционная электромиография, дисперсия, асимметрия, эксцесс, болезнь Паркинсона, родственники пациентов с болезнью Паркинсона.
Болезнь Паркинсона (БП) — одно из наиболее распространенных нейродегенеративных заболеваний центральной нервной системы, развивающееся вследствие необратимого повреждения дофаминсинтезирующих нейронов черной субстанции и недостаточности дофамина в стриатуме [6]. Снижение уровня нигростриатного дофамина ниже критического уровня приводит к возникновению экстрапирамидных двигательных расстройств, характеризующихся классической триадой: брадикине- зией, мышечной ригидностью и тремором покоя. В основе двигательных расстройств лежат нарушения центральной регуляции тонуса мышц, обусловленные дефицитом супраспинального тормозного контроля и избыточной тонической импульсацией из сегментарных альфа- и гамма-мотонейронов [18].
В развитии БП существенное значение имеет генетический фактор. При этом БП характеризуется выраженной генетической гетерогенностью. Идентифицировано несколько генетических локусов, ответственных за возникновение данного заболевания. О большом значении генетической составляющей в предрасположенности к БП свидетельствуют данные эпидемиологических исследований, установившие, что риск возникновения данного заболевания у родственников больных с БП в 2–7 раз выше, чем в контрольной группе [12]. Функциональная несостоятельность экстрапирамидной системы может развиваться за несколько десятилетий до возможного проявления паркинсонизма [10]. Для предотвращения или замедления развития заболевания требуется выявление ранней, пресимптоматической стадии нейродегенеративного процесса и поиск информативных биомаркеров БП [4].
Объективным диагностическим показателем экстрапирамидной недостаточности является биоэлектрическая активность мышц III типа, регистрируемая со сгибателей и разгибателей конечностей при помощи поверхностных электродов [5, 16]. Электромиограмме (ЭМГ) III типа присущи высокий уровень биоэлектрической активности мышц в покое и «залповые» разряды, соответствующие ритму тремора [2, 8]. Достоинством метода ЭМГ является его неинвазивность и достаточно высокая информативность [7, 16, 20].
При диагностике БП традиционно используются амплитудные и частотные критерии ЭМГ. В связи с важностью проблемы неустанно идет поиск новых подходов к оценке ЭМГ-характеристик с целью объективизации тяжести заболевания и выявления скрытых, субклинических признаков экстрапирамидной недостаточности [11, 14, 17, 19].
В настоящей работе была поставлена задача провести сравнительный анализ статистических характеристик поверхностной ЭМГ в состоянии покоя (гистограмм распределения амплитуды ЭМГ, дисперсии, коэффициента асимметрии и коэффициента эксцесса) у пациентов с БП, здоровых лиц среднего и пожилого возраста, а также использовать указанные показатели для выявления группы риска по паркинсонизму у родственников пациентов с БП. В цели исследования также входила разработка рекомендаций для обнаруженной группы риска по паркинсонизму.
Материалы и методы
Исследования проведены в четырех группах людей: 1) 33 пациента с БП (21 женщина и 12 мужчин, возраст от 47 до 85 лет, средний возраст 63,9 ± 1,5 года), страдающих акинетико-ригидно-дрожательной либо акинетико-ригидной формами данного заболевания в стадии 1,5–3,0 по международной классификации Хена и Яра [15]; 2) 24 практически здоровых лица соответствующей контрольной группы пожилого возраста (16 женщин и 8 мужчин, возраст от 60 до 74 лет, средний возраст 65,0 ± 1,5 года); 3) 37 клинически здоровых родственников больных с БП (дети, братья и сестры, 22 женщин и 15 мужчин, возраст от 30 до 56 лет, средний возраст 45,6 ± 1,5 года); 4) 20 здоровых лиц контрольной группы молодого и среднего возраста (19 женщин и 1 мужчина, возраст от 35 до 58 лет, средний возраст 47,7 ± 2,3 года). Возрастные группы определяли согласно классификации Всемирной организации здравоохранения [1]. Все испытуемые давали согласие на проведение исследований.
У больных с БП для оценки тяжести симптоматики использовали Унифицированную международную рейтинговую шкалу Unified Parkinson’s Disease Rating Scale (UPDRS) [13]. Баллы разделов шкалы I (нарушения в мышлении, настроении), II (снижение дневной активности, нарушение гигиенических навыков) и III (расстройства моторной функции, в том числе брадикинезия, ригидность, тремор) вычисляли на основании 4-балльной градации каждого из симптомов. У исследованных в данной работе больных суммарный балл UPDRS колебался в пределах 41–105, его среднее значение составляло 60,0 ± 3,3. Детальная характеристика больных представлена в табл. 1.
У всех испытуемых записывали интерференционную (суммарную) ЭМГ биполярно на приборе «НейроМПВ» (Москва, Россия) с помощью поверхностных электродов, которые помещали на сгибателе (m. biceps brachii) и разгибателе (m. triceps brachii) плеча. ЭМГ регистрировали у больных на стороне клинически доминирующего гемисиндрома, у остальных для анализа выбирали амплитудные параметры ЭМГ той стороны, где они имели большее значение. Регистрацию ЭМГ проводили лежа на спине, давая указание испытуемому расслабиться.
Безартефактные 10-секундные потоки ЭМГ сигналов анализировались с помощью компьютерных программ Origin 8 и «Статистика 8». Строили гистограммы распределения амплитудных значений ЭМГ. Определяли размах — P (range), дисперсию — Д s2 (variance), коэффициент асимметрии — KA (skewness) и коэффициент эксцесса — КЭ (kurtosis).
Данные, полученные в разных группах испытуемых, усредняли и сравнивали посредством системы ANOVA. Проводили корреляционный анализ статистических характеристик ЭМГ с клиническими баллами международной рейтинговой шкалы UPDRS: их суммарной величиной, баллами I, II и III подразделов этой шкалы, а также с баллами пунктов 20 и 22 (тремора и ригидности руки, на которой регистрировалась ЭМГ, соответственно). Корреляционные связи определяли непараметрическим методом Спирмена. Статистический критерий достоверности был принят на уровне p < 0,05.
Результаты исследования
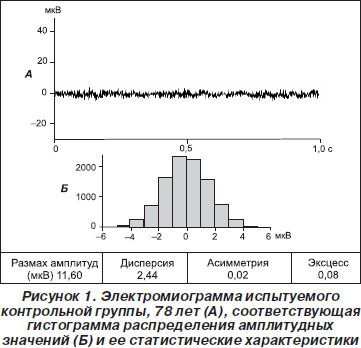
ЭМГ в состоянии покоя у здоровых испытуемых характеризовалась низкой амплитудой (рис. 1), пологой симметричной гистограммой и небольшими значениями Р, Д, КА и КЭ (табл. 2). Р не превышал 20 мкВ, Д — 7, модуль КА — 0,2 и КЭ — 0,4. Никакой существенной разницы в контрольных группах среднего и пожилого возраста не отмечалось.
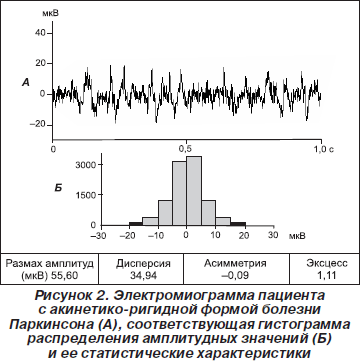
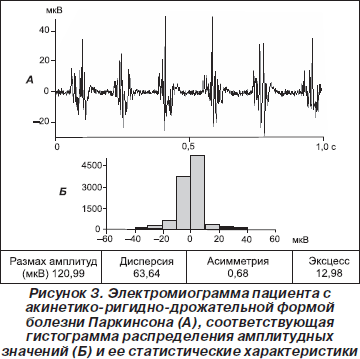
У пациентов с акинетико-ригидной формой БП вследствие невозможности полноценного мышечного расслабления амплитуда ЭМГ сигналов в покое была значительно повышена (рис. 2). Усредненные по группе статистические параметры ЭМГ были с высокой достоверностью (p < 0,001) увеличены по сравнению с контролем. У отдельных больных Р достигал 66 мкВ, Д — 56, КА умеренно увеличивался с перекосом либо влево, либо вправо, КЭ повышался до 1,4 (табл. 2). Еще более высокие статистические параметры отмечались у пациентов с акинетико-ригидно-дрожательной формой БП при наличии в ЭМГ веретеновидных залповых разрядов, следующих с частотой 4–8 Гц. Гистограммы распределения амплитудных значений при указанной форме заболевания характеризовались острым пиком (рис. 3). Р в этой группе пациентов достигал 382 мкВ, Д — 951. Асимметрия у некоторых больных могла быть значительной — до +0,97 либо –2,11. КЭ у всех пациентов отличался большой величиной, колеблясь от 1 до 13 (табл. 2).
Корреляционный анализ статистических характеристик ЭМГ у больных БП и клинических баллов международной рейтинговой шкалы UPDRS выявил достоверную (p < 0,01) зависимость между КЭ и баллами пункта 20 UPDRS, характеризующими интенсивность тремора той руки, на которой регистрировалась ЭМГ. Коэффициент корреляции по Спирмену между этими показателями составлял 0,46. Других достоверных связей мы не обнаружили.
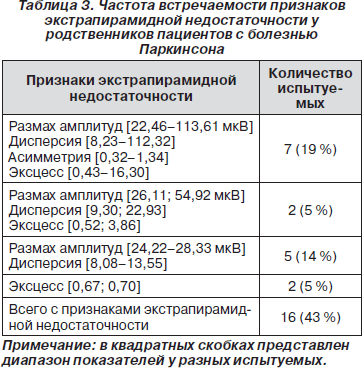
При исследовании ЭМГ у родственников пациентов с БП признаки экстрапирамидной недостаточности, как правило, визуально выявлялись плохо. Повышенная амплитуда ЭМГ потенциалов или вспышки залповых разрядов могли возникать лишь спорадически. Сами залповые разряды, имея маленькую амплитуду, плохо дифференцировались. Поэтому мы полагали, что анализ продолжительных потоков ЭМГ-сигналов с использованием статистических методов окажется более эффективным способом выявления патологических признаков мышечной активности. Параметры Р, Д, КА и КЭ считали выходящими за пределы нормы, если они превышали крайние значения этих показателей в контрольных группах испытуемых. Всего было обнаружено 16 (43 %) родственников пациентов с БП, у которых наблюдались превышения нормальных параметров ЭМГ-сигналов. Оказалось, что у пяти родственников (14 %) выходили за пределы нормы амплитудные характеристики ЭМГ (Р и Д), у двоих (5 %) отмечался увеличенный КЭ, по-видимому, отражающий повышенную синхронизацию в деятельности моторных единиц, еще у двоих наблюдалось увеличение Р, Д и КЭ. Увеличенные значения всех четырех показателей имели место у семи (19 %) родственников (табл. 3). Следует отметить, что отклонения от нормальных значений статистических характеристик ЭМГ чаще выявлялись у лиц старше 45 лет.
В цели данной работы входила разработка рекомендаций для лиц обнаруженной группы риска по паркинсонизму с целью профилактики возможности развития заболевания. Такие рекомендации были нами предложены. Они включали рациональный распорядок дня, пищевой рацион, содержащий витамин В6 (пиридоксин, который является главным катализатором синтеза дофамина), а также перечень лекарственных препаратов, длительного употребления которых следует избегать. В их число входят средства, которые истощают регуляторную функцию дофаминергической системы или снижают ее активность: галоперидол, индоларезерпин, флуоксетин (прозак), метоклопрамид (церукал), клозапин, кордарон, производные фенотиазина и бутирофенола, препараты лития.
Обсуждение результатов
В настоящем исследовании были установлены критические значения нормальных статистических характеристик ЭМГ в состоянии покоя. В контрольных группах лиц пожилого и среднего возраста Р амплитуды не превышал 20 мкВ, Д — 7, модуль КА — 0,2 и КЭ — 0,4. У больных БП параметры этих показателей были повышены с высокой степенью достоверности (p < 0,001). Гистограммы распределения амплитудных значений ЭМГ-сигналов у больных имели острый пик, что особенно было характерно для акинетико-ригидно-дрожательной формы заболевания. При корреляционном анализе выявлена достоверная (p < 0,01) зависимость между КЭ и баллами пункта 20 UPDRS, оценивающими интенсивность тремора той руки, на которой регистрировалась ЭМГ. Этот факт согласуется с точкой зрения [17] о том, что КЭ отражает синхронизацию в активации моторных единиц, ответственную за возникновение залповых мышечных разрядов.
Исследование статистических параметров ЭМГ- сигналов, по нашему мнению, оказалось эффективным для выявления у клинически здоровых родственников пациентов с БП признаков нарушенной мышечной активности, которые обычно не постоянны и плохо выявляются визуально. Всего нами было обнаружено 16 (43 %) родственников пациентов с БП с отклонениями от нормальных показателей. Подобная частота встречаемости экстрапирамидной недостаточности у родственников больных БП (45 %) была описана ранее Н.Б. Маньковским с соавторами [7]. Результаты нашего исследования совпадают с данными других авторов о важном значении генетической составляющей в склонности к развитию экстрапирамидной недостаточности [3, 12]. В основе всех нейродегенеративных заболеваний, в том числе БП, лежит единственный патогенетический фактор — конформационные изменения тех или иных клеточных белков на посттрансляционной стадии [3]. Благодаря компенсаторным и детоксикационным системам клетки она способна в течение многих лет успешно справляться с аномальными белковыми субстратами [21]. Отсроченная манифестация клинических проявлений заболевания является характерной чертой конформационных болезней мозга. Патологический процесс может протекать в латентной форме на протяжении длительного периода времени — до 30 лет [5]. При БП выраженные двигательные расстройства развиваются лишь тогда, когда погибает не менее 70 % дофаминергических нейронов компактной зоны черной субстанции. Есть литературные данные о замедленном темпе патологических изменений в нервных клетках в пресимптоматический период, тогда как на стадии манифестации болезни гибель нейронов значительно ускоряется [9]. В связи с вышеизложенным важное значение придается диагностике субклинических скрытых признаков нарушенной деятельности мышц. Результаты данной работы свидетельствуют о том, что статистические характеристики поверхностной ЭМГ в состоянии покоя (гистограммы распределения амплитуды ЭМГ, дисперсия, коэффициент асимметрии и коэффициент эксцесса) являются объективными и достаточно информативными критериями в диагностике экстрапирамидной недостаточности.
С целью предотвращения манифестации заболевания БП лицам, которые входят в группу риска по паркинсонизму, следует придерживаться определенных рекомендаций. Особое внимание при составлении таких рекомендаций, на наш взгляд, следует уделять дифференцированному употреблению лекарственных средств, которые истощают регуляторную функцию дофаминергической системы или снижают ее активность.
Работа выполнена в рамках целевой программы НАН Украины «Геном» (шифр 6541030).
1. Аршавский И.А. Основы возрастной периодизации // Возрастная физиология. — Ленинград: Наука, 1975. — С. 5-67.
2. Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. — М.: Медицина, 1991.
3. Иллариошкин С.Н. Конформационные болезни мозга. — М.: Янус-К, 2002.
4. Иллариошкин С.Н. Молекулярные основы болезни Паркинсона // Болезнь Паркинсона и расстройства движений: Руководство для врачей по материалам I Национального конгресса. — М., 2008. — С. 8-17.
5. Крыжановский Г.Н., Карабань И.Н., Магаева С.В., Карабань Н.В. Компенсаторные и восстановительные процессы при паркинсонизме. — К.: Институт геронтологии АМН Украины, 1995.
6. Крыжановский Г.Н., Карабань И.Н., Магаева С.В., Кучеряну В.Г., Карабань Н.В. Болезнь Паркинсона. — М.: Медицина, 2002.
7. Маньковский Н.Б., Вайншток А.Б., Олейник Л.И. Сосудистый паркинсонизм. — К.: Здоров’я, 1982.
8. Юсевич Ю.С. Очерки по клинической электромиографии. — М.: Медицина, 1972.
9. Antonini A., Leenders K.L., Eidelberg D. [11C] raclopride-PET studies of the Huntington’s disease rate of progression: relevance of the trinucleotide repeat length // Ann. Neurol. — 1998. — 43 (2). — 253-255.
10. Berg D., Roggendorf W., Schroder U., Klein R., Tatschner T., Benz P., Tucha O., Preier M., Lange K.W., Rainers K., Gerlach M., Becker G. Echogenicity of the substantia nigra: association with increased iron content and marker for susceptibility to nigrostriatal injury // Arch. Neurol. — 2002. — 59 (6). — 999-1005.
11. De Michele G., Sello S., Carboncini M. C., Rossi B, Strambi S. Cross-correlation time-frequency analysis for multiple EMG signals in Parkinson’s disease: wavelet approach // Med. Eng. Phys. — 2003. — 25. — 361-369.
12. Elbaz A., Grigoletto F., Baldereschi M., Breteler M.M., Manubens-Bertran J.M., Lopez-Pousa S., Dartigues J.F., Alperovitch A., Tzourio C., Rocca W.A. Familial aggregation of Parkinson’s disease: a population-based case-control study in Europe. Europarkinson Study Group // Neurology. — 1999. — 52 (9). — 1876-1882.
13. Fahn S., Elton R.L., Members of the UPDRS Development Commettee. Unified Parkinson’s Disease rating scale // Recent developments in Parkinson’s disease / Ed. by S. Fahn, C.D. Marsden, D.B. Calne, M. Goldstein. — New York: Florham Park, Macmillan Health Care Information, 1987. — Vol. 2. — Р. 153-164.
14. Fattorini L., Felici F., Filligoi G.C., Traballesi M., Farina D. Influence of high motor unit synchronization levels on non-linear and spectral variables of the surface EMG // J. Neurosci. Meth. — 2005. — 143. — 133-139.
15. Hoehn M.M., Yahr M.D. Parkinsonism: onset, progression and mortality // Neurology. — 1967. — 17. — 427-442.
16. Hoshiyama M., Kaneoke Y., Koike Y., Takahashi A., Watanabe S. Hypokinesia of associated movement in Parkinson’s disease: a symptom in early stages of the disease // J. Neurol. — 1994. — 241 (9). — 517-521.
17. Meigal A.I., Rissanen S., Tarvainen M.P., Karjalainen P.A., Iudina-Vassel I.A., Airaksinen O., Kankaanpāā M. Novel parameters of surface EMG in patients with Parkinson’s disease and healthy young and old controls // Journal of Electromyography and Kinesiology. — 2009. — 19. — e206-e213.
18. Rascol O.J., Sabatini U., Chollet F., Montastruc J.L., Marc-Vergnes J.F., Rascol A. Impaired activity of the supplementary motor area in akinetic patients with Parkinson’s disease. Improvement by the dopamine agonist apomorphine // Adv. Neurol. — 1993. — 60. — 419-421.
19. Rissanen S., Kankaanpāā M., Tarvainen M.P., Nuutinen J., Tarkka I.M., Airaksinen O., Karjalainen P.A. Analysis of surface EMG signal morphology in Parkinson’s disease // Physiol. Meas. — 2007. — 28 (12). — 1507-1521.
20. Robichaud J.A., Pfann K.D., Leurgans S., Vaillancourt D.E., Comella C.L., Corcos D.M. Variability of EMG patterns: a potential neurophysiological marker of Parkinson’s disease? // Clin. Neurophysiol. — 2009. — 120 (2). — 390-397.
21. Sherman M.Y., Goldberg A.L. Cellular defenses against unfolded proteins: a cell biologist thinks about neurodegenerative disease // Neuron. — 2001. — 29 (1). — 15-32.