Международный неврологический журнал 6 (44) 2011
Вернуться к номеру
Про доцільність застосування Цераксону в лікуванні постінсультних когнітивних розладів у хворих з метаболічним синдромом
Авторы: Копчак О.О., Центральний госпіталь МВС України, м. Київ
Рубрики: Неврология
Версия для печати
У статті розглядається проблема постінсультних когнітивних порушень. Серед факторів, що вірогідно впливають на їх виникнення та тяжкість, є складові метаболічного синдрому. Це вказує на необхідність детального обстеження таких пацієнтів у постінсультному періоді з метою раннього виявлення у них ймовірного когнітивного дефіциту та його корекції.
На прикладі 60 пацієнтів з метаболічним синдромом віком від 49 до 79 років, які перенесли ішемічний інсульт у строки від 3 до 24 місяців, показана доцільність та ефективність використання цитиколіну (Цераксону) на фоні стандартної терапії для зменшення когнітивної дисфункції та інших неврологічних проявів.
Iнсульт, метаболічний синдром, когнітивні порушення, пацієнти, цитиколін.
Вступ
Інсульт є третьою провідною причиною смерті та основною причиною інвалідизації хворих (Barba R., Martinez E.S., Rodriguez G.E. et al., 2000; Левин О.С., Дударова М.А., Усольцева Н.И., 2010). При цьому відомо, що інсульт призводить не лише до зниження якості життя пацієнтів унаслідок розвитку в них неврологічного дефіциту, а також супроводжується порушенням когнітивних функцій (Bour A., Rasquin S., Boreas A., Limburg M., Verhey F., 2010; Sundar U., Adwani S., 2010; Arciniegas D.B., Kellermeyer G.F., Bonifer N.M., Anderson-Salvi K.M., Anderson C.A., 2011).
До постінсультних когнітивних порушень (ПІКП) належать будь-які когнітивні порушення, що виявляються у хворих у перші 3 місяці після інсульту (ранні ПІКП) та пізніше, як правило, упродовж року після перенесеного інсульту (пізні ПІКП) (Левин О.С., Дударова М.А., Усольцева Н.И., 2010). Зазвичай лікарі основну увагу приділяють таким значним постінсультним когнітивним порушенням, як деменція або тяжка афазія. Водночас значно частіше у хворих зустрічаються легкі та помірні форми когнітивних порушень, раннє виявлення яких та застосування адекватного лікування сприятиме попередженню наростання когнітивного дефіциту та покращуватиме прогноз відновлення когнітивних функцій (Snaphaan L., De Leeuv E., 2007).
Відомо, що інсульт підвищує ризик розвитку деменції у хворих від 4 до 12 разів. Постінсультна деменція (ПД) є підтипом судинної деменції, що діагностується у хворих через 3 місяці після гострого або повторного інсульту, і другим основним типом деменції після хвороби Альцгеймера (Khedr Eman M., Hamed Sh.A., El-Shereef H.K. et al., 2009). У клінічних дослідженнях частка хворих із деменцією через 1 рік після інсульту варіює від 9 до 17 %, після 3 років — від 24 до 28 %, через 5 років становить 32 % (Desmond D.W., Moroney J.T., Paik M.C. et al., 2000). Таким чином, збільшення періоду спостереження за хворими після інсульту (1–2 роки) дозволяє виявити значно більший рівень когнітивних порушень у хворих, ніж у дослідженнях із періодом спостереження менше 1 року (Arciniegas D.B., Kellermeyer G.F., Bonifer N.M., Anderson-Salvi K.M., Anderson C.A., 2011).
Постінсультні когнітивні порушення мають різну етіологію і тісно пов’язані з когнітивним статусом пацієнтів перед інсультом (Bowler J.V., 2005). У порівняно невеликій кількості випадків розвиток ПІКП можливо пояснити багатовогнищевим ураженням мозку, коли в патологічний процес втягнуті структури, тісно пов’язані з регуляцією когнітивної діяльності (Desmond D.W., Moroney J.T., Paik M.C. et al., 2000; Sachdev P.S., Brodaty Н., Valenzuela M.J. et al., 2004). Сучасні методи нейровізуалізації дозволяють виявити додаткові церебральні зміни, що підвищують ризик розвитку ПІКП («німі» інфаркти, дифузне ураження білої речовини мозку, церебральні мікрогеморагії, церебральна атрофія) (Rasquin S.M., Verhey F.R., van Oostenbrugge R.J. et al., 2004).
За даними літератури, до найбільш частих постінсультних когнітивних порушень у хворих зараховують лобну дисфункцію (порушення виконавчих функцій), що виникає в разі наявності як поодиноких, так і численних інфарктів у корі та підкіркових структурах головного мозку, внаслідок порушення лобно-підкіркових зв’язків (Vataja R., Pohjaswaara T., Mantyla R. et al., 2003; Godefroy O., Bougusslavsky J., 2007; Sundar U., Adwani S., 2010).
Ризик розвитку когнітивних порушень після інсульту залежить від багатьох чинників (Sachdev P.S., Brodaty Н., Valenzuela M.J. et al., 2004; Левин О.С., Дударова М.А., Усольцева Н.И., 2010). Мультиваріантний аналіз у великій групі хворих, які перенесли інсульт, встановив наявність тісного зв’язку між когнітивними порушення у відстроченому періоді після перенесеного інсульту та низьким рівнем освіти пацієнтів, їх соціально-економічним статусом, артеріальною гіпертензією, цукровим діабетом, кардіальною патологією, тяжкістю інсульту, ураженням лівої гемісфери головного мозку, наявністю в анамнезі цереброваскулярної хвороби, дисфагії, нетримання сечі (Patel M.D., Coshall C., Rudd A.G., Wolfe C.D., 2002). Водночас відомо, що поєднання в одного пацієнта 3 або більше з наступних судинних чинників ризику: артеріальна гіпертензія (АТ > 130/85 мм рт.ст.) або вживання гіпотензивних препаратів, ожиріння (окружність талії > 94 см у чоловіків, > 80 см — у жінок) та дисліпідемія (підвищення рівня тригліцеридів сироватки крові ≥ 1,7 ммоль/л або нормальний рівень тригліцеридів при відповідній терапії; зниження рівня ліпопротеїдів високої щільності (ЛПВЩ) < 1 ммоль/л для чоловіків та < 1,3 ммоль/л для жінок або нормальний рівень ЛПВЩ при відповідній терапії), підвищення рівня глюкози плазми крові натще ≥ 5,6 ммоль/л або терапія гіперглікемії — дає право діагностувати метаболічний синдром (Alberti K.G.M., Eckel R.H., Grundy S.M. et al., 2009). Таким чином, серед факторів, що вірогідно впливають на виникнення та тяжкість ПІКП, є складові метаболічного синдрому.
Отже, вищенаведені дані вказують на необхідність детального обстеження таких пацієнтів у постінсультному періоді з метою раннього виявлення в них ймовірного когнітивного дефіциту та його корекції. У таких випадках важливим діагностичним скринінговим методом для знаходження ознак постінсультних когнітивних порушень є MMSE (Arciniegas D.B,. Kellermeyer G.F., Bonifer N.M., Anderson-Salvi K.M., Anderson C.A., 2011).
Слід наголосити, що важливість дослідження когнітивних функцій у постінсультному періоді не викликає сумнівів, оскільки порушення останніх значно погіршує якість життя хворих. Саме тому ефективність терапії ПІКП залежить від максимально раннього початку та етіопатогенетичного спрямування призначеного лікування (Lindenboom J., Weinstein H., 2004; Petersen R.S., Touchon J., 2005).
На жаль, дотепер відсутні дані масштабних контрольованих досліджень, які б доводили здатність того чи іншого методу лікування запобігати ПІКП, стримувати прогресування чи зменшувати прояви існуючих ПІКП. Однак не викликає сумнівів, що ключове значення має запобігання повторному інсульту. Для цього застосовують комплекс заходів, що включає насамперед адекватну корекцію судинних чинників ризику — артеріальної гіпертензії (гіпотензивна терапія), гіперліпідемії (дієта, статини, нікотинова кислота), гіпергомоцистеїнемії (вітаміни В6, В12, фолієва кислота) (Дамулин И.В., 1999; Левин О.С., Дударова М.А., Усольцева Н.И., 2010). У ряді досліджень показано, що адекватна гіпотензивна терапія може уповільнювати розвиток когнітивного дефіциту (Haag M.D., Hofman A., Koudstaal P.J., Breteler M.M., Stricker B.H., 2009; Peila R., White L.R., Masaki K., Petrovitch H., Launer L.J., 2006). Для покращення когнітивних функцій застосовують широкий спектр ноотропних препаратів, що можна розділити на 4 основні групи: 1) препарати, що діють на певні нейротрансмітерні системи; 2) препарати з нейротрофічною дією; 3) препарати з нейрометаболічною дією; 4) препарати з вазоактивною дією (Левин О.С., Дударова М.А., Усольцева Н.И., 2010).
Одним із перспективних підходів до лікування ПІКП є застосування попередників ацетилхоліну: цитиколіну та холіну альфосцерату, що поєднують риси препаратів із нейромедіаторною (холінергічною) та нейрометаболічною (нейропротекторною) дією (Parnetti L., Mignini F., Tomassoni D. et al., 2007). Крім того, цитиколін може сприяти підвищенню рівня глутатіону й активності глутатіонредуктази, посилюючи активність антиоксидантних систем. Важливе значення при інсульті має здатність цитиколіну посилювати активність холінергічної, дофамінергічної і норадренергічної систем, що на етапі відновлення функцій може потенціювати процеси пластичності та зменшувати вираженість нейропсихічних порушень (Скворцова В.И., Бойцова А., 2007). Здатність цитиколіну покращувати стан когнітивних функцій у хворих із судинною патологією мозку показана в ряді плацебо-контрольованих досліджень (Capurso A., Capurso S., Panza F. et al., 1996; Cohen R.A., Browndyke J.N., Moser D.J. et al., 2003). Сприятлива дія цитиколіну на когнітивні функції може бути пов’язана з посиленням активності холінергічної системи, синтезом і вивільненням дофаміну та норадреналіну в певних ділянках мозку, підвищенням синтезу фосфоліпідів і стабілізацією клітинних мембран, збільшенням захвату глюкози нейронами (Secades J., Lorenzo J., 2006).
Водночас не вивчалась ефективність цитиколіну при лікуванні ПІКП.
Саме тому метою дослідження була оцінка терапевтичної ефективності застосування цитиколіну (Цераксону) у комплексному лікуванні хворих із ПІКП на фоні метаболічного синдрому.
Матеріали та методи
У дослідження включили 60 хворих із метаболічним синдромом віком від 49 до 79 років (у середньому 62,70 ± 9,01 року), які перенесли ішемічний інсульт у строки від 3 до 24 місяців і перебували на лікуванні в неврологічному відділенні Центрального госпіталю Міністерства внутрішніх справ України. Залежно від призначеної терапії всі пацієнти були розподілені на дві групи: основну (n = 30) та контрольну (n = 30), які були рівнозначні за віком, статтю, рівнем освіти, ступенем когнітивних порушень та неврологічного дефіциту. В основній групі за строком після перенесеного інсульту хворі розподілялися таким чином: 3 місяці після інсульту — 4 особи, 6 місяців — 4 пацієнти, 12 місяців — 11 осіб, 24 місяці — 11 обстежених. У контрольній групі розподіл за цим показником був таким: 3 місяці після інсульту — 4 особи, 6 місяців — 5 пацієнтів, 12 місяців — 10, 24 місяці — 11 хворих. Хворі основної групи (n = 30) отримували цитиколін (Цераксон) по 1000 мг внутрішньовенно струминно протягом 10 днів, із подальшим переходом на пероральний прийом по 500 мг 2 рази на добу протягом 1 місяця. Пацієнти як основної, так і контрольної груп отримували стандартну терапію, що включала гіпотензивні засоби, цукрознижуючі препарати, статини, антиагреганти, вазоактивні засоби (вінпоцетин, пентоксифілін), ноотропні (пірацетам), вітаміни групи В, седативні препарати. Курс лікування хворих тривав 6 тижнів.
Всім пацієнтам проведене клініко-неврологічне обстеження з вимірюванням АТ. Хворі пройшли загальні лабораторні тести (загальний аналіз крові, загальний аналіз сечі, біохімічний аналіз крові, ліпідограму), інструментальні (комп’ютерну та/або магнітно-резонансну томографію головного мозку (МРТ)) дослідження. Згідно з даними МРТ, у більшості обстежених виявляли поодинокі вогнища ішемії в медіальних відділах скроневих часток, таламусі, мультифокальне ураження в базальних гангліях (перш за все хвостатому ядрі), білій речовині головного мозку, численні ділянки лейкоареозу перивентрикулярно і в субкортикальних відділах головного мозку, префронтальній корі, в окремих випадках спостерігали численні та/або поодинокі лакунарні вогнища, що були розташовані у глибинних відділах білої речовини, у лобній та скроневій частках.
Для оцінки ступеня когнітивних порушень використовували коротку шкалу оцінки психічного статусу (Mini Mental State Examination — MMSE), що складається з ряду субтестів, які дозволяють швидко й ефективно оцінити орієнтування в часі, місці, стан короткочасної, довгочасної пам’яті, функцію мови, гнозису, праксису (Folstein M., Folstein S., McHugh P.R., 1975). Сума балів за субтестами складає загальний бал MMSE. Результат отримували шляхом сумації балів за кожним з пунктів шкали. Максимальний показник — 30 балів. За даними MMSE 29–30 балів оцінювали як відсутність порушення когнітивних функцій, 28–27 балів — легкі, 24–26 — помірні когнітивні порушення, 20–23 бали — початкову стадію деменції, < 20 — більш виражені стадії деменції (Бачинська Н.Ю., 2010).
Додатково стан когнітивних функцій пацієнтів оцінювали з використанням ряду сучасних нейропсихологічних тестів: методика заучування 10 слів, що дозволяла дослідити процеси пам’яті (запам’ятовування, збереження й відтворення інформації). З метою визначення темпу сенсомоторних реакцій, розумової працездатності, об’єму активної уваги пацієнтів використовували таблиці Шульте. Для дослідження негайної та довгочасної розпізнавальної пам’яті на вербальні стимули застосовували Тест заучування парних взаємопов’язаних слів (The Paired Associates Learning Test-PALT) (Parmenter B.A., Denney D.R., Lynch S.G., 2003). Також використовували тест кольорово-словесної взаємодії (the Stroop Color-Word Interference Test/SСWT), який дозволяв оцінити швидкість обробки інформації та увагу — процеси, що відображали функціонування передньої поясної звивини (виконавчі функції) (Stroop J.R., 1975).
Статистичну обробку отриманих результатів проводили на комп’ютері з використанням пакету статистичного аналізу Microsoft Excel 97. Вірогідність різниці між середніми кількісними значенням двох вибірок визначали за коефіцієнтом Стьюдента (t). Ми також використовували показник відповідності c2 для визначення вірогідності різниці декількох відносних величин, що пов’язані між собою.
Результати та їх обговорення
При обстеженні всі пацієнти скаржилися на головний біль, запаморочення, шум у вухах, голові, зниження пам’яті, порушення концентрації уваги, зниження настрою, підвищену знервованість, порушення нічного сну, хиткість при ходьбі, слабкість у нижніх кінцівках, оніміння дистальних відділів кінцівок. У неврологічному статусі у хворих виявлено: ослаблену конвергенцію очних яблук, виражені субкортикальні рефлекси, ознаки пірамідної та екстрапірамідної недостатності, патологічні рефлекси згинальної та розгинальної групи, координаторні та чутливі порушення.
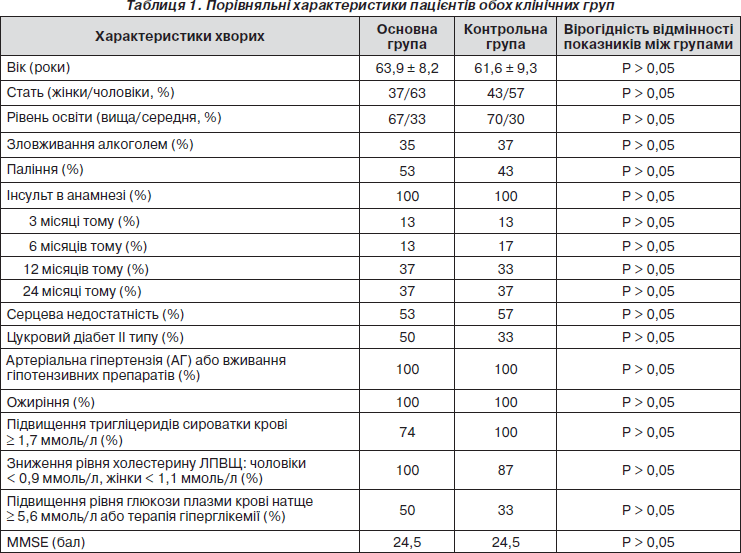
Основні характеристики пацієнтів обох клінічних груп наведені в табл. 1.
Як видно з табл. 1, обидві клінічні групи було рівнозначні за віковим, статевим складом, частотою судинних факторів ризику, поширеністю окремих компонентів метаболічного синдрому, ступенем когнітивних порушень.
Ми вивчали динаміку когнітивних порушень на тлі лікування у хворих обох клінічних груп за даними MMSE (рис. 1, 2).
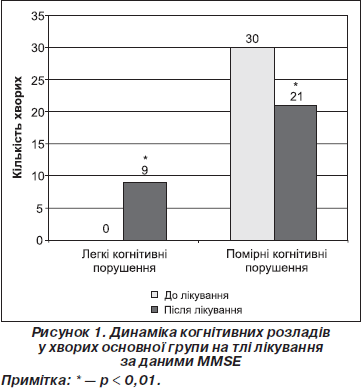
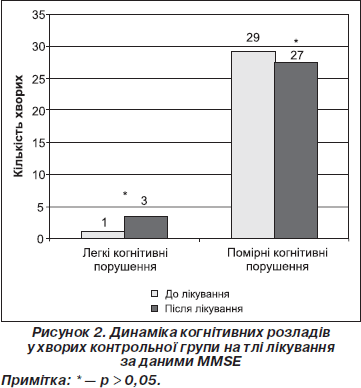
З огляду на вищенаведені дані вірогідно зменшилась вираженість когнітивних порушень лише в основній групі хворих (c2 = 10,5, р < 0,01) (рис. 1). До лікування загальний бал за тестом MMSE в основній групі становив 24,50 ± 0,78, після лікування відмічене вірогідне зростання показника до 26,03 ± 0,96 (р < 0,001), у контрольній групі відмічена незнач- на позитивна динаміка на фоні лікування (MMSE до лікування 24,50 ± 0,68 та після лікування 24,90 ± 0,96 (р > 0,05)).
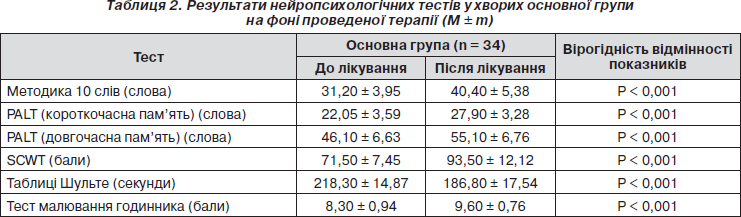
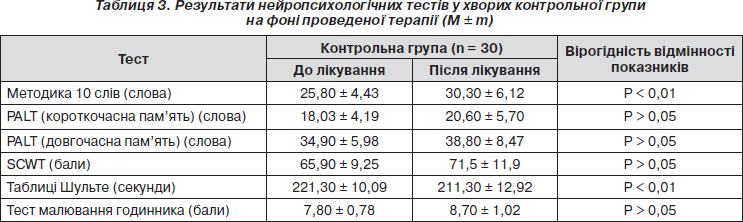
Ми також додатково оцінювали стан окремих когнітивних функцій в обох клінічних групах хворих на фоні лікування з використанням нейропсихологічних тестів (табл. 2, 3).
У пацієнтів основної групи на тлі терапії цитиколіном (табл. 2) відмічено вірогідне покращення показників короткочасної вербальної та семантичної пам’яті (40,40 ± 5,38) за методикою заучування 10 слів порівняно з такими до лікування (31,20 ± 3,95, p < 0,001). Також після проведеного лікування у хворих основної групи відмічено значне зростання швидкості процесів обробки інформації, уваги з 71,50 ± 7,45 до 93,50 ± 12,12 (р < 0,001) за методикою Stroop. Вірогідно підвищився об’єм короткочасної пам’яті з 22,05 ± 3,59 до 27,90 ± 3,28 (р < 0,001) та довгочасної з 46,10 ± 6,63 до 55,1 ± 6,76 (р < 0,001) за методикою the Paired Associates Learning Test (PALT). У пацієнтів основної групи також зареєстровано вірогідне зростання темпу сенсомоторних реакцій за таблицями Шульте (218,30 ± 14,87 та 186,80 ± 17,54, р < 0,001). Після терапії цитиколіном вірогідно покращилось виконання хворими тесту малювання годинника (з 8,30 ± 0,94 до 9,60 ± 0,76, р<0,001) (табл. 2).
Як видно з наведених в табл. 3 даних, у пацієнтів контрольної групи на тлі проведеного лікування спостерігали вірогідне підвищення лише показників короткочасної вербальної та семантичної пам’яті (з 25,8 ± 4,43 до 30,3 ± 6,12, р < 0,01) за методикою заучування 10 слів та темпу сенсомоторних реакцій за таблицями Шульте (221,3 ± 10,09 та 211,3 ± 12,92, р < 0,01). Зміни інших нейропсихологічних показників були невірогідними.
З огляду на отримані результатів стан когнітивних функцій на фоні лікування вірогідно більш виражено покращився у пацієнтів основної групи порівняно з контрольною.
Хворі обох груп після завершення курсу лікування відзначали суттєве зменшення загальної слабкості, покращення пам’яті, сну, зменшення головного болю, запаморочення, шуму у вухах, хиткості при ходьбі.
Отже, лікування хворих основної групи з використанням цитиколіну на фоні стандартної терапії позитивно впливало на їх загальний стан, зменшилась вираженість когнітивного дефіциту за даними ММSE, покращились процеси запам’ятовування, швидкість обробки та відтворення інформації, короткочасна та довгочасна розпізнавальна пам’ять, рівень розумової працездатності та уваги, темп сенсомоторних реакцій згідно з результатами нейропсихологічного тестування. Препарат переносився добре, на тлі терапії цитиколіном (Цераксоном) у пацієнтів не виявлено алергічних реакцій та побічних ефектів.
Враховуючи отримані нами результати, препарат цитиколін (Цераксон) може бути рекомендованим для широкого застосування в комплексній терапії ПІКП у хворих із метаболічним синдромом.
1. Бачинская Н.Ю. Синдром умеренных когнитивных нарушений // Нейро News. — 2010. — № 2/1. — С. 12-17.
2. Дамулин И.В. Сосудистая деменция// Неврол. журн. — 1999. — № 4. — С. 4-11.
3. Левин О.С., Дударова М.А., Усольцева Н.И. Диагностика и лечение постинсультных когнитивных нарушений // Consilium Medicum. — 2010. — Том 12, № 2. — C. 5-12.
4. Скворцова В.И., Бойцова А. Нейропротективная терапия цитиколином в остром периоде церебрального инсульта // Врач. — 2007. — № 12. — C. 25-8.
5. Alberti K.G.M., Eckel R.H., Grundy S.M. et al. Harmonizing the Metabolic Syndrome A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity // Circulation. — 2009. — Vol. 120. — P. 1640-1645.
6. Arciniegas D.B., Kellermeyer G.F., Bonifer N.M., Anderson-Salvi K.M., Anderson C.A. Screening for cognitive decline following single known stroke using the Mini-Mental State Examination // Neuropsychiatric Disease and Treatment. — 2011. — № 7. — P. 189-196.
7. Barba R., Martinez E.S., Rodriguez G.E. et al. Poststroke dementia: clinical features and risk factors // Stroke. — 2000. — Vol. 3. — P. 1494-1501.
8. Bour A., Rasquin S., Boreas A., Limburg M., Verhey F. How predictive is the MMSE for cognitive performance after stroke? // J. Neurol. — 2010. — Vol. 257. — P. 630-637.
9. Bowler J.V. Vascular cognitive impairment // J. Neurol. Neurosurg. Psychiatry. — 2005. — Vol. 76. — P. 35-44.
10. Capurso A., Capurso S., Panza F. et al. Efficacy of cytidine diphosphate choline in patients affected by chronic cerebrovascular disease // Clin. Drug. Invest. — 1996. — № 12. — P. 26-38.
11. Cohen R.A., Browndyke J.N., Moser D.J. et al. Long-term citicoline(cytidine diphosphate choline) use in patients with vascular dementia: neuroimaging and neuropsychological outcomes // Cerebrovasc. Dis. — 2003. — Vol. 16. — P. 199-204.
12. Desmond D.W., Moroney J.T., Paik M.C. et al. Frequency and clinical determinants of dementia after ischemic stroke // Neurology. — 2000. — Vol. 56. — P. 1124-31.
13. Folstein M., Folstein S., McHugh P.R. Mini-mental state: a practical method for grading the cognitive state of patients for the clinical // J. Psychiatr. Res. — 1975. — Vol. 12. — P. 189-198.
14. Godefroy O., Bougusslavsky J. Frontal executive dysfunction in stroke-behaviours and cognitive neurology of stroke // Cambridge University Press. — 2007. — P. 378-80.
15. Haag M.D., Hofman A., Koudstaal P.J., Breteler M.M., Stricker B.H. Duration of antihypertensive drug use and risk of dementia: A prospective cohort study // Neurology. — 2009. — Vol. 72. — P. 1727-34.
16. Khedr Eman M., Hamed Sh.A., El-Shereef H.K. et al. Cognitive impairment after cerebrovascular stroke: Relationship to vascular risk factors // Neuropsychiatric. Disease and Treatment. — 2009. — № 5. — P. 103-116.
17. Lindeboom J., Weinstein H. Neuropsychology of cognitive ageing, minimal cognitive impairment, Alzheimer’s disease and vascular cognitive impairment // Eur. J. Pharmacol. — 2004. — Vol. 490. — P. 83-86.
18. Parmenter B.A., Denney D.R., Lynch S.G. The cognitive perfomance of patients with multiple sclerosis during periods of high and low fatigue // Multiple. Sclerosis. — 2003. — № 9. — Р. 111-118.
19. Parnetti L., Mignini F., Tomassoni D. et al. Cholinergic precursors in the treatment of cognitive impairment of vascular origin // J. Neurol. Sci. — 2007. — Vol. 257. — P. 264-9.
20. Patel M.D., Coshall C., Rudd A.G., Wolfe C.D. Cognitive impairment after stroke: Clinical determinants and its associations with long-term stroke outcomes // J. Am. Geriatr. Soc. — 2002. — Vol. 50(4). — P. 700-706.
21. Petersen R.S., Touchon J. Consensus of mild cognitive impairment // Research and practice in Alzheimer’s disease, E.A.D.C./A.D.C.S. Joint meeting. — 2005. — Vol. 10. — P. 24-32.
22. Peila R., White L.R., Masaki K., Petrovitch H., Launer L.J. Reducing the risk of dementia: efficacy of long-term treatment of hypertension // Stroke. — 2006. — Vol. 37. — P. 1165-7.
23. Rasquin S.M., Verhey F.R., van Oostenbrugge R.J. et al. Demographic and CT scan features related to cognitive impairment in the first year after stroke // J. Neurol. Neurosurg. Psychiat. — 2004. — Vol. 75. — P. 1562-7.
24. Sachdev P.S., Brodaty Н., Valenzuela M.J. et al. The neuropsychological profile of vascular cognitive impairment in stroke and TIA patients // Neurology. — 2004. — Vol. 62. — P. 912-9.
25. Secades J., Lorenzo J. Citicoline // Pharmacol. Clin. Rev. — 2006. — Vol. 27 (Suppl. B). — P. 1-56.
26. Snaphaan L., De Leeuv E. Poststroke memory function in nondemented patients // Stroke. — 2007. — Vol. 38. — P. 192 — 203.
27. Stroop J.R. Studies of interference in serial verbal reactions // J. Exp. Psychol. — 1975. — Vol. 18. — P. 643-62.
28. Sundar U., Adwani S. Post-stroke cognitive impairment at 3 months // Ann. Indian. Acad. Neurol. — 2010. — № 13(1). — P. 42-46.
29. Vataja R., Pohjaswaara T., Mantyla R. et al. MRI correlates of executive dysfunction in patients with ischemic strok // Eur. J. Neurol. — 2003. — № 10. — P. 625-31.