Международный неврологический журнал 6 (44) 2011
Вернуться к номеру
Современные представления о нейропсихологических нарушениях при болезни Паркинсона
Авторы: Хныкина Т.А., ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины», г. Киев
Рубрики: Неврология
Версия для печати
Нервно-психические нарушения сопровождают все стадии болезни Паркинсона, часто опережают манифестацию двигательных расстройств на 5–10 и более лет. Значительную роль в патофизиологии ряда нервно-психических симптомов (депрессии, тревоги, инсомнии, когнитивных расстройств) играет дегенерация ядер ствола мозга с развитием дисфункции нейромедиаторных систем. Для клинической объективизации эмоциональных, поведенческих, когнитивных нарушений необходимо использовать специальные психометрические шкалы, а также методы функциональной МРТ (functional MRI).
Традиционные представления о болезни Паркинсона (БП) как о заболевании преимущественно двигательной сферы, в основе которого лежит изолированное поражение дофаминергической системы, в настоящее время подвергнуты кардинальной коррекции. БП рассматривается как мультисистемное нейродегенеративное заболевание с поражением различных медиаторных систем и широким спектром как двигательных, так и недвигательных (нервно-психических, сенсорных, вегетативных) нарушений [1, 42, 44, 47, 48].
Значимое негативное влияние на качество жизни пациентов и их близких оказывают нервно-психические (эмоциональные, когнитивные, психотические, поведенческие) расстройства. Депрессия, деменция, психотическая симптоматика являются предикторами низкого качества жизни больных независимо от степени тяжести двигательных симптомов заболевания. Однако данные расстройства часто не диагностируются, что лишает пациентов адекватной терапии [44].
Известно, что нервно-психические нарушения сопровождают все стадии БП, их частота в целом возрастает по мере увеличения тяжести и длительности заболевания [2, 47, 48].
В ряде случаев нервно-психические нарушения опережают манифестацию двигательных расстройств на 5–10 и более лет, проявляясь на «додвигательной» стадии заболевания. Депрессия отмечается у 20 % пациентов с БП еще до постановки диагноза. Наличие депрессии у лиц среднего и пожилого возраста рассматривается как фактор, повышающий в 2–3 раза риск развития БП [40].
К возможным додвигательным нервно-психическим симптомам, связь которых с дальнейшим развитием БП уточняется, относят тревогу, дневную сонливость, утомляемость, апатию [47]. Возникновение нервно-психических симптомов на «додвигательной» фазе объясняет популярная концепция Н. Вraak с соавт., согласно которой одной из первых «мишеней» дегенеративного процесса при БП являются ядра нижнего отдела ствола мозга, что проявляется, в частности, депрессией, тревогой, нарушениями сна и бодрствования [7].
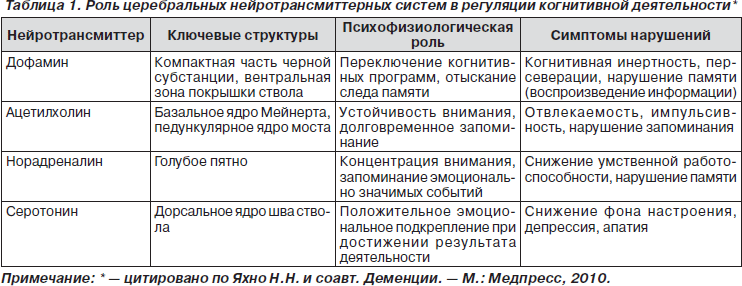
Патофизиология большинства нервно-психических симптомов БП многофакторна. Патоморфологической основой появления широкого спектра симптомов является распространение дегенеративного процесса (телец Леви) по мере прогрессирования заболевания на множество структур головного мозга с нарушением их функционального взаимодействия. Значимую роль в патофизиологии ряда нервно-психических симптомов (депрессия, тревога, инсомния, когнитивные расстройства) играет дегенерация ядер ствола мозга с развитием дисфункции нейромедиаторных систем (норадренергическая, серотонинергическая, ацетилхолинергическая, глутаматергическая) и нарушением функционирования стволово-подкорковых и стволово-корковых образований мозга (табл. 1). Преморбидные психологические особенности личности, двигательные и другие недвигательные симптомы БП, нежелательные воздействия противопаркинсонических препаратов могут являться дополнительными факторами, способствующими проявлению тех или иных нервно-психических расстройств [6, 8, 12].
Одним из наиболее частых и клинически значимых нервно-психических нарушений является депрессия [43]. Наличие депрессии является фактором, наиболее тесно сопряженным с низкими показателями качества жизни пациентов. Депрессия встречается у 40–50 % пациентов, что превышает частоту данного расстройства в популяции и при других хронических заболеваниях [43]. Ведущими симптомами депрессии при БП являются ощущение пустоты и безнадежности, снижение реактивности на эмоциональные стимулы, ограничение возможности испытывать радость и получать удовольствие (ангедония). Характерными проявлениями депрессии при БП являются дисфорические симптомы — раздражительность, грусть, пессимизм [43]. У большинства пациентов степень тяжести проявления депрессии оценивается как мягкая или умеренная. Депрессия тяжелой степени отмечается примерно в 10 % случаев [43]. Частота депрессии при БП не коррелирует с длительностью и тяжестью двигательных симптомов заболевания. Отмечена большая встречаемость депрессии на начальных этапах заболевания и поздних ее стадиях. В ряде случаев проявление симптомов депрессии тесно связано с колебаниями эффективности дофаминергических препаратов в течение суток — возникновение (усугубление) в период «выключения» и уменьшение тяжести (нивелирование) в фазе «включения» [43]. Наличие депрессии (умеренной или тяжелой степени) сочетается с более быстрым прогрессированием двигательных и когнитивных (познавательных) нарушений, появлением психотических симптомов (малых зрительных галлюцинаций, иллюзий) [43]. В качестве ведущих патогенетических факторов депрессии при БП рассматриваются дофаминергическая, норадренергическая и серотонинергическая дисфункции в лимбической системе мозга [43].
Депрессия часто сочетается с тревожными расстройствами. Так, симптомы тревоги выявляются у 60–75 % пациентов БП с депрессией [43], а частота тревожных расстройств при БП варьирует от 24–75 % [43]. Большинство исследований не выявляют зависимости выраженности тревоги от тяжести двигательных нарушений при БП. С другой стороны, тревога является частым и иногда ведущим проявлением периодов ограниченной двигательной активности — «выключения», реже — «включения» в рамках флюктуаций симптомов заболевания. Тревога при БП может проявляться паническими атаками, генерализованным тревожным расстройством, социальной фобией, обсессивно-компульсивными нарушениями. Согласно ряду наблюдений, в структуре тревожных расстройств при БП преобладают панические атаки [29]. В качестве факторов риска появления панических атак обсуждаются ранний возраст начала заболевания и тяжелые двигательные флуктуации [48]. Ключевым звеном патогенеза тревожных расстройств являются нарушения соотношения дофамина, норадреналина, серотонина, ГАМК в лимбической системе мозга [31].
С симптомами депрессии частично «перекрываются» проявления апатии, которая рассматривается как нарушение мотивации и характеризуется снижением целенаправленного поведения, эмоциональной и когнитивной активности, сужением круга интересов. Апатия наблюдается у 17–42 % пациентов с БП [22]. Прослежена корреляция частоты и тяжести апатии с наличием депрессии, когнитивных нарушений (преимущественно регуляторных лобных расстройств), в меньшей степени — с тяжестью двигательных симптомов заболевания. Согласно данным недавнего популяционного норвежского исследования, апатия отмечалась у 38 % пациентов, при этом в 5 % случаев этот симптом встречался как самостоятельный феномен независимо от наличия депрессии, умеренных или выраженных когнитивных нарушений, приема антидепрессантов и антипсихотических препаратов [20]. В качестве основного патогенетического механизма апатии рассматривается дефицит дофамина с нарушением нигростриарных и стриарно-лимбико-кортикальных взаимодействий. Помимо дофаминергической дисфункции в развитии апатии вероятно участие дефицита ацетилхолина в мезолимбических и мезокортикальных отделах мозга [14].
Когнитивные нарушения отмечаются на всех стадиях БП. Риск развития деменции при БП в шесть раз превышает вероятность ее появления в популяции. Умеренные когнитивные нарушения отмечаются у 39 % пациентов уже к моменту постановки диагноза [2, 40, 48]. Дисрегуляторные нарушения в виде расстройств памяти и внимания, а также зрительно-пространственная дисфункция характеризуют начальные проявления когнитивных нарушений [18]. К 3–5 годам от начала болезни у 57 % пациентов выявляются умеренные когнитивные нарушения, а у 10 % больных они достигают степени деменции [40]. Результаты проспективного популяционного исследования пациентов, страдающих БП, показали наличие деменции через 17 лет течения заболевания у 78 % больных [48]. Патофизиология когнитивных нарушений комплексна и включает нейромедиаторные нарушения (в первую очередь дефицит дофамина, ацетилхолина) с нарушением функциональных связей между базальными ганглиями и лобными долями мозга, дегенерацию ассоциативных зон коры, гиппокампа, влияние сопутствующих цереброваскулярных или дегенеративных заболеваний.
В качестве ведущего фактора риска развития деменции рассматривается пожилой возраст. Другими факторами, независимо связанными с более высоким риском развития деменции, являются предшествующие умеренные когнитивные нарушения, а также постуральная неустойчивость и нарушения речи [36, 39]. Дофаминергические препараты могут положительно влиять на некоторые аспекты когнитивной деятельности (регуляторные лобные и нейродинамические функции) при мягких или умеренных нарушениях [35]. Однако в случае деменции дофаминергические препараты (главным образом АДА) могут провоцировать появление при БП психотических расстройств.
С помощью нейропсихологических тестов те или иные когнитивные нарушения можно выявить у 95 % больных с болезнью Паркинсона. В первые 5 лет заболевания у подавляющего большинства больных преобладают легкие или умеренные нарушения, которые выявляются лишь при специальном исследовании и не оказывают явного влияния на повседневную жизнь больного. По мере прогрессирования заболевания нейропсихологические нарушения у больных БП имеют тенденцию к нарастанию, но у большинства из них они так и не достигают степени деменции. Лишь у 10–30 % больных прогрессирование когнитивных нарушений приводит к развитию слабоумия — обычно спустя 5 или более лет после появления первых симптомов заболевания [33].
Профиль когнитивных нарушений, выявляемых на ранней стадии БП, весьма характерен и отражает избирательное вовлечение подкорково-лобных систем. Наибольшие отклонения у больных БП выявляются при выполнении тестов на память, внимание, психомоторные, зрительно-пространственные и регуляторные функции, при этом общий уровень интеллекта существенно не страдает [16, 17]. Когнитивные нарушения обычно более выражены при более позднем начале заболевания (после 65 лет) и акинетико-ригидной форме БП и менее четко, чем двигательные расстройства, зависят от длительности заболевания.
Брадифрения. Фоновой характеристикой всех когнитивных процессов у больных БП является их замедленность (брадифрения), выражающаяся в увеличении времени выполнения нейропсихологических тестов. При этом снижение скорости когнитивных процессов тем более значимо, чем сложнее для решения оказывается задача. Брадифрению, являющуюся своеобразным аналогом моторной гипокинезии, объясняют ограниченностью «рабочего ресурса» когнитивных систем, прежде всего систем внимания и рабочей (оперативной) памяти. Выраженность брадифрении и выраженность гипокинезии часто не соответствуют друг другу, что указывает на различия в их патогенезе [12]. Для количественной оценки брадифрении обычно проводят измерение времени реакции на зрительные или слуховые стимулы. У больных с БП выявляется увеличение времени реакции на предъявляемый стимул, которое зависит от ограниченности как двигательных, так и когнитивных возможностей. Однако время выбора реакции у больных БП оказывается таким же, как и у здоровых, что указывает на то, что разные фазы обработки информации и принятия решений страдают в различной степени и процесс инициации реакций, во многом зависящий от состояния внимания, более дефектен, чем процесс выбора реакций, связанный с более высоким уровнем обработки информации [45].
Нарушение памяти характеризуется расстройством запоминания и воспроизведения новой информации. Значительное число больных БП уже на ранней стадии заболевания предъявляют жалобы на снижение памяти. Нейропсихологический анализ показывает, что нарушения памяти при БП имеют специфический, избирательный характер [40, 48]:
— способность к запоминанию и воспроизведению информации, как вербальной, так и зрительной, оказывается сниженной (вероятно, вследствие недостаточности систем систематического поиска информации в памяти), тогда как прочность хранения информации, зависящая от функции височных долей и рано страдающая при болезни Альцгеймера, остается сохранной (об этом свидетельствует возможность распознания запомненного материала, который больной не в состоянии свободно воспроизвести);
— механическая память (воспроизведение не связанных друг с другом слов или положения предметов в пространстве) страдает в меньшей степени, чем способность воспроизводить эмоционально значимые слова или слова, из которых можно выстроить ассоциативный ряд;
— больные часто не в состоянии правильно указать порядок запомненных ими стимулов или воспроизвести последовательность (хронологию) минувших событий, но могут подробно передать их содержание;
— процедурная (имплицитная) память, отражающая приобретение моторного или когнитивного навыка путем повторения и связанная с функцией стриатума, нарушена у больных с БП в большей степени, чем требующая сознательного усилия декларативная (эксплицитная) память, зависящая от функции гиппокампа.
Зрительно-пространственные функции. Весьма характерным когнитивным симптомом БП являются зрительно-пространственные расстройства. Они проявляются как в сфере восприятия, так и при исследовании пространственного праксиса. Нарушения восприятия пространственных отношений проявляются трудностями ориентации по географической карте, затруднениями при идентификации взаимно расположения предметов в мозаике, сопоставлении угла между линиями и др. Нарушение зрительного гнозиса отмечается также при узнавании зашумленных или наложенных друг на друга изображений. В двигательной сфере пространственные нарушения выявляются при перерисовывании сложных геометрических и объемных фигур. Весьма чувствительным является тест рисования часов. При этом пациенты испытывают значительные трудности при самостоятельном рисовании, но, как правило, без труда могут расположить стрелки на уже готовом циферблате. Есть указания на то, что выраженность зрительно-пространственных нарушений при БП коррелирует с риском развития психотических осложнений дофаминергической терапии [27, 31].
Эмоциональная сфера. Эмоциональная сфера, как уже указывалось выше, закономерно страдает при БП, что часто опережает формирование двигательных расстройств. Наиболее часто (примерно в 40–60 % случаев) у больных отмечаются нарушения настроения в виде малой или большой депрессии или отдельных депрессивных симптомов [24, 44]. Депрессия при БП развивается достоверно чаще, чем в популяции, и чаще, чем при других хронических инвалидизирующих двигательных нарушениях (геми- и параплегия). Эмоциональные нарушения при болезни Паркинсона редко достигают степени большой депрессии. Как правило, они расцениваются как дистимия. В структуре эмоциональных расстройств при болезни Паркинсона наиболее часто встречаются пониженное настроение и когнитивные симптомы депрессии, такие как повышенная утомляемость, замедленность реакций и мышления. Из соматических симптомов часто отмечается нарушение сна и, напротив, редко — потеря аппетита. Крайне редко имеют место чувство вины и суицидальные мысли. Последние признаки, как правило, отмечаются при большой депрессии. По данным большинства исследователей, выраженность депрессии при БП не соответствует тяжести двигательных нарушений в целом, в то же время наличие и тяжесть депрессии зависят от возрастных особенностей БП [21, 23].
Психотические нарушения при БП обычно возникают на поздней стадии под действием противопаркинсонических средств, чаще на фоне выраженных когнитивных нарушений. При этом более важное значение, по-видимому, имеет не столько степень общего снижения когнитивных функций, сколько определенный профиль нейропсихологических нарушений. В частности, при БП психотические расстройства чаще возникают на фоне более грубых зрительно-пространственных нарушений и дисфункции фронтостриарных систем [2, 6].
В последние годы особую популярность приобрела нейрохимическая гипотеза происхождения психотических расстройств при БП, согласно которой их причиной служит дисбаланс между холинергическими и моноаминергическими восходящими системами. Этот дисбаланс может характеризоваться недостаточностью холинергической системы (обычно вследствие дегенерации базального ядра Мейнерта) и относительным преобладанием дофаминергической и серотонинергической систем либо первичным усилением функции последних вследствие гиперстимуляции дофаминовых D4 или серотониновых 5-НТ3 рецепторов в коре и лимбической системе. Соответственно, для лечения психотических нарушений у больных БП применяются не только блокаторы дофаминовых рецепторов (нейролептики), но также антисеротониновые препараты и центральные холиномиметики [40, 47, 48].
Причиной нейропсихологических нарушений у больных с БП может быть поражение нескольких подкорково-лобных систем [21, 28, 31]. Как и двигательные нарушения, когнитивные расстройства могут быть связаны с дегенерацией нигростриарных нейронов и уменьшением содержания дофамина в стриатуме, что приводит к дисфункции проходящих через него параллельных кортико-стриато-паллидо-таламо-фронтальных кругов, которые обеспечивают активацию необходимых в данной ситуации корковых программ. В пользу этого предположения свидетельствует частое обнаружение у больных с выраженными когнитивными нарушениями снижение захвата [18F]-флуородопы в хвостатом ядре, через которое замыкаются все три круга, регулирующие различные аспекты нейропсихологических функций. Как показывают гистохимические исследования, при БП наряду со скорлупой, через которую замыкается моторный круг, выраженное уменьшение содержания дофамина обнаруживается в дорсомедиальной части головки хвостатого ядра, через которую замыкается дорсолатеральный префронтальный круг, играющий важную роль в обеспечении когнитивных функций [4, 9, 11, 15]. Как и двигательные расстройства, когнитивные нарушения могут быть связаны с изменением активности нейронов внутреннего сегмента бледного шара и ретикулярной части черной субстанции. Показано, что при выполнении тестов на планирование, оперативную память и зрительно-пространственные функции, зависящие от функционирования префронтальных отделов, у больных БП в отличие от контрольной группы, с помощью позитронно-эмиссионной томографии выявляется не повышение (как в норме), а снижение активности внутреннего сегмента правого бледного шара [25].
На роль дофаминергических механизмов в патогенезе когнитивных нарушений при БП указывает положительный эффект дофаминергических средств (леводопа, агонисты дофаминовых рецепторов) на некоторые нейродинамические и регуляторные функции, а также ухудшение результатов выполнения нейропсихологических тестов на фоне прекращения действия очередной дозы леводопы (у больных с флуктуациями) [39, 43, 48]. Таким образом, восполнение дефицита дофамина в стриатуме или активация дофаминовых рецепторов восстанавливает функционирование фронто-стриарных кругов, регулирующих когнитивные функции, и может приводить к улучшению выполнения некоторых нейропсихологических тестов, связанных с дисфункцией лобных долей [12].
Экспериментальные данные показывают, что недостаточность холинергической системы, которая при БП обусловлена дегенерацией базального ядра Мейнерта, и недостаточность норадренергической системы, вызванная поражением нейронов голубого пятна, приводят к снижению внимания, замедлению когнитивных процессов и относительно избирательному нарушению выполнения тестов, оценивающих функцию лобных долей, а их коррекция может улучшать когнитивные функции [12, 13].
Считается, что возраст начала болезни Паркинсона и скорость ее прогрессирования — более важные факторы риска деменции, чем продолжительность заболевания. Установлено, что риск развития деменции резко возрастает при начале заболевания после 70 лет. Различные по выраженности когнитивные нарушения встречаются почти у 70 % больных старше 80 лет, но всего лишь у 12 % больных в возрасте 50–59 лет. Кроме того, вероятность развития деменции выше при быстром прогрессировании двигательных нарушений (особенно гипокинезии и постуральной неустойчивости), сопутствующей депрессии, эпизодах спутанности сознания и психотических нарушений, вызванных приемом леводопы, низком образовательном и социально-экономическом уровне, более тяжелых регуляторных когнитивных расстройствах в первые годы болезни, при наличии близких родственников, страдающих деменцией [44, 48]. Деменция чаще встречается у больных с акинетико-ригидной формой БП, сопровождающейся выраженной гипомимией [39].
Диагностика когнитивных нарушений и, в частности, деменции при БП характеризуется рядом особенностей. Первым этапом диагностического поиска при подозрении на деменцию является объективизация когнитивных расстройств. С этой целью используются нейропсихологические методы исследования. Общее состояние когнитивных функций обычно оценивается по краткой шкале оценки психического статуса (Mini-mental State Examination — MMSE). Следует отметить, что чувствительность данной методики не является абсолютной, поскольку эта методика слабо чувствительна к диагностике так называемых симптомов лобной дисфункции. При деменции легкой степени выраженности суммарный балл может оставаться в пределах нормальных значений. Поэтому проведение только краткой шкалы оценки психического статуса, рекомендуемой для диагностики когнитивных расстройств, не всегда позволяет оценить степень выраженности у пациентов с БП [19]. Для проведения более точной оценки степени и характера когнитивных нарушений при БП требуется использование как минимум еще двух нейропсихологических методик («Батарея исследования лобной дисфункции» и тест рисования часов). Исследование таких регуляторных функций, как способность к обобщению, беглость речи, программирование двигательных актов и произвольное внимание с помощью подхода так называемой батареи исследования лобной дисфункции является обязательным у пациентов с БП [12, 13]. Тест рисования часов позволяет оценить организацию произвольной деятельности и пространственные функции [48].
Для объективизации эмоциональных и поведенческих нарушений используют специальные психометрические шкалы, которые представляют собой опросники для пациента: гериатрическая шкала депрессии, опросник Бека, шкала депрессии Гамильтона.
Важное диагностическое значение для прижизненной диагностики БП и сопутствующих когнитивных расстройств имеет нейровизуализация [3, 9, 11, 15]. Показано, что на начальных стадиях нейродегенеративных процессов метаболические и структурные атрофические изменения могут быть выражены в минимальной степени [5, 10, 25], что объясняется известным фактом о длительной, не менее 5–10 лет, удовлетворительной компенсации недостаточности дофаминергической нигростриатной системы, которая предшествует дебюту клинических симптомов БП [5, 37, 41]. Следует полагать, что современные методы нейровизуализации не только позволяют прижизненно диагностировать структурные изменения головного мозга по данным МРТ, но и дают возможность доклинической оценки с помощью МР-спектроскопии таких функциональных параметров деятельности центральной нервной системы, как метамеры и перфузия ткани в любой области головного мозга [10].
Электрофизиологические методы исследования играют вспомогательную роль в диагностике когнитивных нарушений у больных БП. Наиболее информативным из этих методов является исследование вызванных потенциалов [34, 38]. Наличие когнитивных нарушений сопровождается увеличением латентного периода компонента Р300 [38, 46], что в сопоставлении с результатами нейропсихологического исследования свидетельствует об изменениях корково-подкорковых взаимоотношений, являющихся электрофизиологическим подтверждением наличия у пациента нарушений когнитивных функций [34, 40].
Таким образом, применяя только комплексный подход в диагностике когнитивных нарушений, удается достаточно точно диагностировать их уже на начальных стадиях развития. Точная и своевременная диагностика когнитивных нарушений является важной и актуальной проблемой на развернутых стадиях БП как с медицинской, так и с этической и экономической точек зрения.
1. Aarsland D., Andersen K., Larsen J.P., Lolk A., Kragh-Sorensen P. Prevalence and characteristics of dementia in Parkinson disease: an 8-year prospective study // Arch. Neurol. — 2003. — 60. — 387-92.
2. Aarsland D., Bronnick K., Ehrt U. et al. Neuropsychiatric symptoms in patients with Parkinson’s disease and dementia: frequency, profile and associated caregiver stress // J. Neurol. Neurosurg. Psychiatry. — 2007. — 78. — 36-42.
3. Beyer M.K., Janvin C.C., Larsen J.P., Aarsland D. A magnetic resonance imaging study of patients with Parkinson’s disease with mild cognitive impairment and dementia using voxel-based morpho-metry // J. Neurol. Neurosurg. Psychiatry. — 2007. — 78. — 254-9.
4. Bihan D.L., Mangin J., Poupon C. et al. Diffusion tensor imaging: concepts and applications // J. Magn. Reson. Imaging. — 2001. — 13. — 534. — 546.
5. Bolinger L., Lenkinski R.E. Localization in clinical MR spectroscopy / L.J. Berliner, J. Reuben, eds. // Biological magnetic resonance. — NY: Plenum, 1992. — V. 2. — P. 1-53.
6. Bouchard T.P., Malykhin N., Martin W.R.W. et al. Age and dementia associated atrophy predominates in the hippocampal head and amygdale // Neurobiol. Aging. — 2008. — 29. — 1027-39.
7. Braak H., Del Tredici K., Bratzke H. et al. Staging of the intracerebral inclusion body pathology associated with idiopatic Parkinson’s disease (preclinical and clinical stages) // J. Neurology. — 2002. — Vol. 249 (S. 3). — P. 1-5.
8. Bronnick K., Emre M., Lane R., Tekin S., Aarsland D. Profile of cognitive impairment in dementia associated with Parkinson’s disease compared with Alzheimers disease // J. Neurol. Neurosurg. Psychiatry. — 2007. — 78. — 1064-8.
9. Chamuleau R.A., Bosman D.K., Bowee W.M., Luyten P.R., den Hollander J.A. What the clinician can learn from MR glutamine/glutamate assays // NMR in Biomedicine. — 1991. — 4. — 103-108.
10. Chang L., Ernst T., Poland R.E., Jenden D.J. In vivo proton magnetic resonance spectroscopy of the normal aging human brain // Life Sciences. — 1996. — 58. — P. 2049-2056.
11. Charlton R.A., Barrick T.R., McIntyre D.J. et al. White matter denage on diffusion tensor imaging correlates with age-related cognitive decline // Neurology. — 2006. — 66. — P. 217-222.
12. Dubois B., Pillon B. Cognitive deficits in Parkinson’s disease // J. Neurol. — 1997. — 244. — 2-8.
13. Dubois B., Slachevsky A., Litvan I., Pillon B. The FAB: a Frontal Assessment Battery at bedside // Neurology. — 2000. — Vol. 55, № 11. — P. 1621-1626.
14. Dujardin K., Sockeel P., Devos D. et al. Characteristics of apathy in Parkinsons disease // Mov. Disord. — 2007. — 22. — 778-84.
15. Eckert T., Eidelberg D. Neuroimaging and terapeutics in movement disorders // J. Am. Soc. Exper. Neurotherapeutics. — 2005. — V. 2. — P. 361-371.
16. Emre M., Aarsland D., Brown R. et al. Clinical diagnostic criteria for dementia associated with Parkinson’s disease // Mov. Disord. — 2007. — 22. — 1689-707; quiz 837.
17. Emre M. Dmentia associated with Parkinson’s disease // Lancet Neurology. — 2003. — 2. — P. 229-237.
18. Fellgiebel A., Wille P., Mueller M. et al. Ultrastructural Hippocampal and White Matter Alterations in Mild Cognitive Impairment: A Diffusion Tensor Imaging Study // Dement. Geriatr. Cogn. Disorders. — 2004. — 18. — P. 101-108.
19. Folstein M.F., Folstein S.E., McHugh P.R. «Mini-mental state». A practical method for grading the cognitive state of patients for the clinician // J. Psychiatr. Res. — 1975. — Vol. 12, № 3. — P. 189-198.
20. Hang C., Mattis P., Perrine K., Brown N., Dhawan V., Eidelberg D. Metabolic abnormalities associated with mild cognitive impairment in Parkinson disease // Neurology. — 2008. — 70. — 1470-7.
21. Higginson C.I., King D.S, Levine D., Wheelock V.L., Khamphay N.O., Sigvardt K.A. The relationship between executive function and verbal memory in Parkinson’s disease // Brain Cogn. — 2003. — 52. — 343-52.
22. Isella V., Melzi P., Grimaldi M. et al. Clinical, neuropsychological, and morphometric correlates of apathy in Parkinson’s disease // Mov. Disord. — 2002. — 17. — 366-71.
23. Janvin C.C., Larsen J.P., Aarsland D., Hugdahl K. Subtypes of mild cognitive impairment in Parkinson’s disease: progression to dementia // Mov. Disord. — 2006. — 21. — 1343-9.
24. Lieberman A. Are dementia and depression in Parkinson’s disease related? // Neurological Sciences. — 2006. — 248. — 138-42.
25. Mahlknecht Ph., Hotter A., Hussl A., Esterhammer R., Shocke M., Seppi K. Significance of MRI in diagnosis and differential diagnosis of Parkinson’s Desease // Neurodegenerstive Dis. — 2010. — 7. — Р. 300-318.
26. Matsui H., Nishinaka K., Oda M., Kubori T., Udaka F. Auditory event-related potentials in Parkinson’s disease: Prominent correlation with attention // Parkinsonism Relat Disord. — 2007, 26 February.
27. Monchi O., Petrides M., Mejia-Constain B., Strafella A.P. Cortical activity in Parkinson’s disease during executive processing depends on striatal involvement // Brain. — 2007. — 130. — 233-44.
28. Olanow C.W., Schapira A.H., Roth T. Waking up to sleep episodes in Parkinson’s disease // Mov. Disord. — 2000. — 15. — 212-5.
29. Pluck G.C., Brown R.G. Apathy in Parkinson’s disease // J. Neurol. Neurosurg. Psychiatry. — 2002. — 73. —636-42.
30. Poewe W., Wolters E., Emre M. et al. Long-term benefits of rivastigmine in dementia associated with Parkinson’s disease: an active treatment extension study // Mov. Disord. — 2006. — 21. — 456-61.
31. Ramirez-Ruiz B., Marti M.J., Tolosa E. et al. Longitudinal evaluation of cerebral morphological changes in Parkinson’s disease with and without dementia // J. Neurol. — 2005. — 252. — 1345-52.
32. Sitburana O., Ondo W.G. Brain magnetic resonance imagimg in parkinsonian disorders // Parkinsonism and Related Disorders. — 2009. — 15. — P. 165-174.
33. Starkstein S.E., Bolduc R.L., Mayberg H.S. et al. Cognitive impairments and depressin Parkinson’s disease: a follow-up study // J. Neurol. Neurosurg. Psychiatry. — 199. — Vol. 53. — P. 597-602.
34. Tanaka H., Koenig T., Pascual-Marqui R.D., Hirata K., Kochi K., Lehmann D. Event-related potential and EEG measures in Parkinson’s disease without and with dementia // Dement. Geriatr. Cogn. Disord. — 2000. — 11. — 39-45.
35. Valenzuela M.J., Sachdev P., Wen W. et al. Lifespan Mental Activity Predicts Deminished Rate of Hippocampal Atrophy // PNAS. — 2008. — V. 3. — No. 7. — P. 1-6.
36. Weintraub D., Moberg P.J., Duda J.E., Katz I.R., Stern M.B. Effect of psychiatric and other non-motor symptoms on disability in Parkinson’s disease // J. Am. Geriatr. Soc. — 2004. — 52. — 784-8.
37. Yong S.W., Yoon J.K., An Y.S., Lee P.H. A comparison of cerebral glucose metabolism in Parkinson’s disease, Parkinson’s disease dementia and dementia with Lewy bodies // Eur. J. Neurol. — 2007. — 14. — 1357-62.
38. Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике: Монография. — М.: Медпресс-информ, 2003. — 264 с.
39. Голубев В.Л., Левин Я.Н., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма. — М.: МЕДпресс, 1999. — 416 с.
40. Захаров В.В. Когнитивные нарушения у пациентов с болезнью Паркинсона // Журн. неврол. и психиатрии. — 2005. — № 1. — С. 13-19.
41. Карабань И.Н., Рожкова З.З., Карабань Н.В. Оценка степени выраженности когнитивного дефицита у пациентов с болезнью Паркинсона // Нейроnews. — 2011. — № 2/1. — С. 52-56.
42. Крыжановский Г.Н., Карабань И.Н., Мадаева С.В., Кучеряну В.Г., Карабань Н.В. Болезнь Паркинсона (этиология, патогенез, клиника, диагностика, лечение, профилактика). — М.: Медицина, 2002. — 335 с.
43. Левин О.С. Диагностика и лечение депрессии при болезни Паркинсона // Атмосфера. — 2006. — № 2. — С. 114-121.
44. Левин О.С. Психические расстройства при болезни Паркинсона и их коррекция // Экстрапирамидные расстройства: руководство по диагностике и лечению / Под ред. В.Н. Штока, И.А. Ивановой — Смоленской, О.С. Левина. — М.: МЕДпресс-информ, 2002. — С. 125-151.
45. Лурия А.Р. Основы нейропсихологии: Монография. — М.: МГУ, 1973. — 378 с.
46. Луханина Е.П., Карабань И.Н., Буренок Ю.А. Две фазы условной негативной волны у человека: связь с двигательными и ментальными функциями // Российский неврологический журнал им. И.М. Сеченова. — 2005. — Т. 91, № 4. — С. 364-373.
47. Нодель М.Р., Яхно Н.Н. Недвигательные (немоторные) нарушения при болезни Паркинсона и их влияние на качество жизни // Болезнь Паркинсона.
48. Яхно Н.Н., Захаров В.В., Локшина А.Б., Кобер- ская Н.Н., Мхитарян Э.А. Деменции: Руководство для врачей. — М.: МЕДпресс-информ, 2010. — 264 c.