Международный неврологический журнал 7 (45) 2011
Вернуться к номеру
Дифференцированное применение цитиколина для лечения инфарктов головного мозга
Авторы: УСОВА Н.Н., Учреждение «Гомельский областной клинический госпиталь ИОВ», Галиновская Н.В., Грицук А.И., Латышева В.Я., Учреждение образования «Гомельский государственный медицинский университет», Республика Беларусь
Рубрики: Неврология
Версия для печати
Целью исследования явилось дифференцированное использование цитиколина (Цераксона) у пациентов с инфарктом головного мозга с проведением отбора для лечения с помощью определения антиоксидантной активности сыворотки крови. Проведено когортное клиническое рандомизированное открытое исследование, в котором был обследован 121 человек. Цераксон назначали внутривенно по 1000 мг в течение 10 суток. Клинико-лабораторную эффективность терапии оценивали с помощью шкал NIHSS, Бартел и Ренкина на 1, 7 и 14-е сут., а также путем определения антиоксидантной активности крови на 1-е и 14-е сут. дифференцированно в группах с низкой (до 45 е.а.), нормальной (45–52 е.а.) и высокой (выше 52 е.а.) активностью супероксиддисмутазы. Была показана преимущественная клиническая эффективность Цераксона у пациентов с низкой и нормальной антиоксидантной активностью крови. Определение антиоксидантной активности сыворотки крови методом Т.В. Сироты может служить простым и общедоступным способом оценки эффективности нейропротективной терапии цитиколином у пациентов с инфарктом мозга.
Инфаркт мозга, цитиколин, антиоксиданты.
Введение
Проблема цереброваскулярных заболеваний имеет большое медико-социальное значение, их актуальность, к сожалению, возрастает с каждым годом. Выход на второе место среди причин смерти, огромные экономические затраты и значительные трудопотери, связанные с выходом на инвалидность, определяют научно-практическую и социально-экономическую значимость проблемы.
Заболеваемость инсультом в разных странах мира колеблется от 2,6 до 7,43 на 1000 жителей в год [3, 5, 8]. В 2005 г. инсульт был причиной 5,7 млн смертей в мире; исходя из прогнозов экспертов Всемирной организации здравоохранения, в 2015 г. смертность от острых нарушений мозгового кровообращения составит около 6,7 млн человек, а в 2030 г. увеличится до 7,7 млн человек [12]. В Республике Беларусь заболеваемость инсультом в 2008 г. составила 1,2 на 1000 населения [1]. До 10–12 % пациентов с инфарктом мозга (ИМ) — это лица в возрасте до 45 лет [5], а треть всех пациентов, перенесших инсульт, — лица трудоспособного возраста. К труду из них возвращается только каждый четвертый [5, 8].
В патогенезе ишемии головного мозга выделены два аспекта, на которые могут быть направлены активные терапевтические мероприятия: во-первых, это дефицит локального мозгового кровотока и энергии с формированием фокальной мозговой ишемии; во-вторых, патохимические и молекулярные реакции в очаге ИМ, обусловленные ишемическим и воспалительным каскадом [2, 3, 5, 8]. В связи с этим основными направлениями лечебного воздействия на сегодняшний день являются тромболитическая и нейропротекторная терапия.
Тромболитическая терапия используется для реканализации тромбированной церебральной артерии с целью восстановления адекватного кровоснабжения нейронов в зоне ишемической полутени, где есть депрессия их функции, но отсутствуют структурные изменения мозговой ткани [2]. Эта методика расширила терапевтические возможности лечения ишемии мозга. Однако проведение тромболизиса ограничено рамками 3-часового терапевтического окна и большим числом противопоказаний, а также необходимостью нейровизуализационной верификации вида инсульта, желательно с применением диффузионно- и перфузионно-взвешенных режимов магнитно-резонансной томографии, которые дороги и не всегда доступны [2, 7, 13]. В связи с вышеперечисленными трудностями даже в экономически развитых странах лишь 2–3 % пациентов получают тромболитическую терапию [14, 16].
В последние десятилетия интенсивно разрабатываются методы нейропротекторной терапии, которые направлены на предупреждение распространения деструкции нейронов вследствие активации каскада ишемических и воспалительных реакций, медикаментозную защиту и восстановление функции нервной ткани [2]. Нейропротекция может использоваться вместе с тромболизисом, что позволяет расширить рамки терапевтического окна [9]. К сожалению, в рандомизированных клинических испытаниях большинство препаратов с заявленными нейропротекторными свойствами оказались либо неэффективными, либо имели выраженное побочное действие [2, 11, 15]. Поэтому более 30 международных центров разных стран на сегодня продолжают экспериментальные и клинические исследования лекарственных средств с потенциальными нейропротекторными свойствами [2].
В настоящее время большое внимание уделяется фармакологическим препаратам, эффекты которых связаны с комплексным нейропротекторным действием на нейроны ишемического очага головного мозга, обладающие свойствами мембранопротекторов и антиоксидантов [2]. Среди них выделен цитиколин (цитидин-5¢-дифосфохолин), который относится к группе нуклеотидов и является незаменимым предшественником фосфатидилхолина, основного фосфолипида всех клеточных мембран, включая нейрональные мембраны [6]. Цитиколин обладает плейотропным нейропротективным действием (нейрометаболический, нейромедиаторный, антиагрегантный эффекты) [4, 10].
Целью нашего исследования явилось дифференцированное использование цитиколина (Цераксона) у пациентов с инфарктом головного мозга с проведением отбора для лечения путем определения антиоксидантной активности сыворотки крови (АОК).
Материалы и методы
На базе 1-го неврологического отделения для пациентов с нарушениями мозгового кровообращения Учреждения «Гомельский областной клинический госпиталь ИОВ» проведено когортное клиническое рандомизированное открытое исследование. Был обследован 121 человек, среди которых:
1-я группа (основная) — 32 пациента (средний возраст 50,09 ± 2,40 года; 15 мужчин и 17 женщин) в остром периоде ИМ, в терапию которых был дополнительно включен препарат Цераксон;
2-я группа (сравнения) — 75 пациентов (средний возраст 48,75 ± 1,64 года; 45 мужчин и 30 женщин) в остром периоде ИМ, получавших стандартную терапию согласно протоколам обследования и лечения, утвержденным Министерством здравоохранения Республики Беларусь;
3-я группа (контрольная) — включала 14 практически здоровых лиц (средний возраст 30,50 ± 1,43 года; 4 мужчины и 10 женщин). Данная группа была набрана с целью установления нормальных показателей АОК.
Диагноз ИМ выставлялся врачами-неврологами стационара на основании клинико-анамнестических данных и был верифицирован нейровизуализационными методиками (компьютерной и магнитно-резонансной томографией головного мозга).
Основными критериями включения пациентов в исследование были: наличие ИМ в острейшем периоде (поступление в стационар в течение 3 суток от момента появления очаговой неврологической симптоматики). Исключались пациенты с кровоизлиянием в головной мозг, лица в терминальной стадии соматических заболеваний. При проведении исследования у больных было получено устное или письменное информированное согласие.
Цераксон назначали в течение 10 дней в дозе 1000 мг в 200 мл физиологического раствора хлорида натрия внутривенно капельно 1 раз в сутки.
Клинико-лабораторную эффективность терапии оценивали по динамике неврологического дефицита с помощью шкалы инсульта Американского национального института здоровья (NIHSS), по шкалам нарушения жизнедеятельности Бартел и шкале Ренкина на 1, 7 и 14-е сут. от момента поступления в стационар и по изменению уровня АОК сыворотки крови. Определение АОК крови как метод выявления показаний к назначению и контроля эффективности терапии было выбрано в связи с тем, что оксидантный стресс является одним из основных механизмов повреждения головного мозга при ишемии, а плейотропные нейропротективные эффекты Цераксона включают в том числе и антиоксидантное действие.
АОК сыворотки венозной крови изучалась с помощью методики Т.В. Сироты на 1-е и 14-е сут. острого периода ИМ по ее способности влиять на скорость реакции автоокисления адреналина гидрохлорида, который в щелочной среде является супероксидгенерирующей и супероксиддетектирующей системой и позволяет определять активность антиоксидантного фермента супероксиддисмутазы (СОД) биологических материалов. Для этого в измерительную кювету с 2 мл 0,2 М карбонатного буфера (рН 10,55) вносили 0,1 мл раствора адреналина гидрохлорида, перемешивали и регистрировали его автоокисление на спектрофотометре Solar RV1251 при длине волны 347 нм. Изменение оптической плотности в единицу времени оценивали как скорость реакции автоокисления адреналина, затем измеряли этот же показатель при внесении в тест-систему сыворотки крови. Процент ингибирования реакции в присутствии сыворотки крови вычисляли по формуле:
Процент ингибирования (единицы активности) = [1 – (DЕопыт / DЕконтроль)] ´ 100 %,
где DЕопыт и DЕконтроль — скорости реакции автоокисления адреналина соответственно в присутствии и в отсутствие сыворотки крови.
Способность к ингибированию автоокисления адреналина оценивалась как активность СОД сыворотки крови в единицах активности (е.а.). Рост процента ингибирования реакции расценивался как увеличение антиоксидантной активности СОД.
Эффективность Цераксона оценивалась дифференцированно в подгруппах пациентов с различной антиоксидантной активностью сыворотки крови при поступлении в стационар. У лиц контрольной группы показатель АОК составил 52,42 ± 6,98 е.а. В соответствии с этим все пациенты с ИМ были разделены по уровню антиоксидантной активности сыворотки крови на подгруппы лиц с низкой АОК (показатель ниже 45 е.а.), нормальной АОК (45–52 е.а.) и высокой АОК (выше 52 е.а.). В выделенных подгруппах отдельно рассматривались лица, получавшие и не получавшие терапию Цераксоном.
Информацию о пациентах заносили в электронную базу данных, после чего осуществляли ее статистическую обработку с помощью программы Statistica 8.0 с использованием методов описательной статистики (М ± m), непараметрического U-критерия Mann — Whitney, Wilcoxon-test, корреляционного анализа Sperman. Различия считали статистически значимыми при р < 0,05.
Результаты и обсуждение
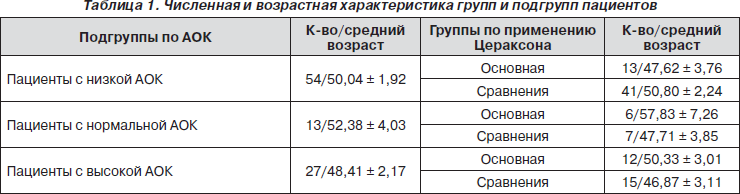
Численная и возрастная характеристика групп и подгрупп пациентов представлена в табл. 1.
Как показано в табл. 1, выделенные группы были сравнимы по возрастному составу.
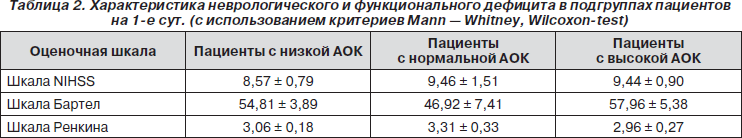
Характеристика неврологического и функционального дефицита на 1-е сут. острого периода ИМ у пациентов подгрупп с разной антиоксидантной активностью сыворотки крови представлена в табл. 2.
Исходя из табл. 2, группы были сравнимы между собой по выраженности неврологического и функционального дефицита на 1-е сут. острого периода ИМ.
Динамика АОК в исследуемых подгруппах представлена на рис. 1.
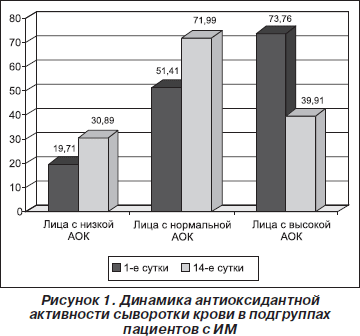
Антиоксидантная активность крови на 1-е сут. у пациентов разных подгрупп значимо отличалась (р < 0,001). Было показано, что в подгруппе лиц с низкой АОК на 1-е сут. острого периода ИМ ее уровень составил 19,71 ± 3,62 е.а., на 14-е сут. — 30,89 ± 4,89 е.а. У пациентов из подгруппы с нормальной активностью СОД на 1-е сут. она равнялась 51,41 ± 0,85 е.а., на 14-е сут. — 71,99 ± 5,03 е.а. (р < 0,01), а у лиц с изначально высокой АОК на 1-е сут. ее уровень составил 73,76 ± ± 3,15 е.а., на 14-е сут. — 39,91 ± 7,68 е.а. (р < 0,005). Показано снижение АОК у лиц с высокой АОК на 14-е сут. в отличие от пациентов других подгрупп.
На 14-е сут. сохранялась статистическая значимость показателей между подгруппами лиц с низкой и нормальной АОК (р < 0,001) и пациентов с высокой и нормальной АОК (р < 0,01). Подгруппы лиц с высокой и низкой активностью на 14-е сут. значимо не отличались.
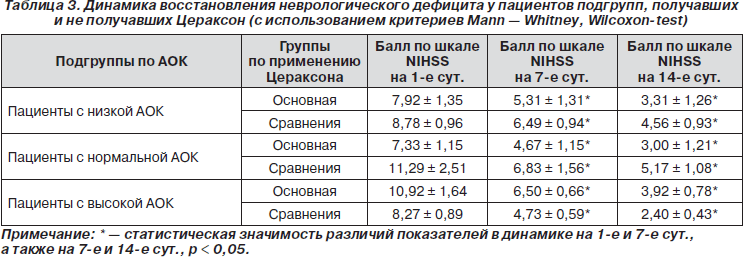
Динамика восстановления неврологического дефицита у пациентов подгрупп, получавших и не получавших Цераксон, представлена в табл. 3.
Из табл. 3 видно, что на первые сутки различий в изучаемом параметре выявлено не было, т.е. группы и подгруппы были сравнимы между собой. Продемонстрировано, что шкала NIHSS не отражает разницы в неврологическом дефиците при различном антиоксидантном статусе пациентов.
Во всех подгруппах показано статистически достоверное уменьшение степени тяжести неврологического дефицита на 7-е и 14-е сут. острого периода ИМ (р < 0,05).
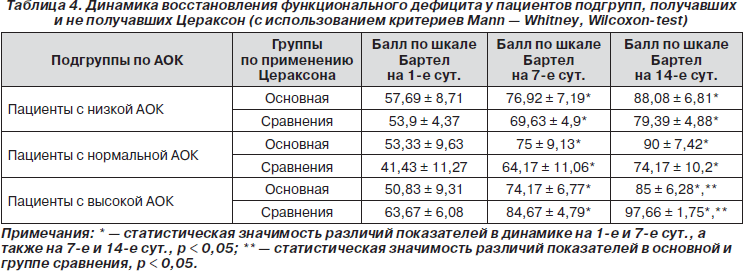
Динамика восстановления функционального дефицита у пациентов подгрупп, получавших и не получавших Цераксон, представлена в табл. 4.
Исходно и на 7-е сут. балл по шкале Бартел в подгруппах различий не имел. В подгруппе с высокой активностью СОД на 14-е сут. наблюдалось обратное соотношение показателей (85,00 ± 6,28 и 97,66 ± 1,75; р < 0,05), из чего с учетом данных табл. 4 можно сделать вывод, что применение препарата у данной категории лиц не является целесообразным.
Динамика антиоксидантной активности сыворотки крови в подгруппах пациентов, получавших и не получавших Цераксон, представлена на рис. 2.
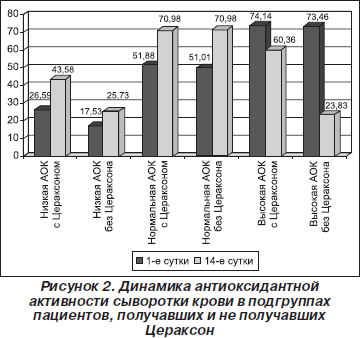
В подгруппе лиц с изначально низкой АОК крови, получавших Цераксон, на 1-е сут. активность СОД была равна 26,59 ± 4,36 е.а., на 14-е сут — 43,58 ± ± 5,85 е.а. (р < 0,05), а у пациентов этой же подгруппы без Цераксона показатели составили на 1-е сут. 17,53 ± 4,53 е.а., на 14-е сут. – 25,73 ± 6,29 е.а. У пациентов, принимавших Цераксон, происходила нормализация показателей АОК на 14-е сут. (p > 0,1 по сравнению с контролем) в отличие от группы, получавшей стандартную терапию (р < 0,05 по сравнению с контролем).
У пациентов с нормальной АОК, в терапию которых вошел Цераксон, наблюдалась следующая картина: на 1-е сут. – 51,88 ± 0,99 е.а., на 14-е сут. – 70,98 ± 3,69 е.а. (р < 0,05). У лиц данной подгруппы, получавших стандартное лечение, значения активности СОД на 1-е сут. равнялись 51,01 ± 1,38, на 14-е сут. — 73,52 ± 9,36 е.а. Статистически достоверной разницы между основной группой и группой сравнения выявлено не было. У лиц, принимавших Цераксон, показано значимое увеличение уровня АОК на 14-е сут. острого периода ИМ.
Значения АОК у пациентов подгруппы с высокой АОК, получавших Цераксон, на 1-е сут. — 74,14 ± ± 2,99 е.а., на 14-е сут. — 60,36 ± 7,39 е.а. (р < 0,05). У лиц с высокой изначально активностью СОД, которые не получали терапию Цераксоном, на 1-е сут. АОК равнялась 73,46 ± 5,25 е.а., на 14-е сут. — 23,83 ± ± 10,79 е.а. (р < 0,005). В обеих группах наблюдалось уменьшение АОК крови на 14-е сут., но у пациентов, получавших Цераксон, это снижение было значимо меньше, чем у лиц группы сравнения (60,36 ± 7,39 и 23,83 ± 10,79 е.а.; р < 0,05).
При проведении корреляционного анализа по Spearman была выявлена зависимость клинических и биохимических показателей только в группах пациентов, в лечении которых был использован Цераксон. У пациентов группы сравнения, которые получали стандартную терапию, связи между клиническими шкалами и антиоксидантной активностью крови выявлено не было.
У лиц с изначально низкой АОК, проходивших терапию Цераксоном, наблюдалась значимая положительная корреляционная связь между АОК на 14-е сут. и баллом по шкале Бартел на 7-е сут. (r = 0,59, р < 0,05), что является косвенным доказательством однонаправленной динамики функционального статуса и антиоксидантной активности крови.
В подгруппе пациентов с нормальной АОК, получавших Цераксон, показана статистически значимая отрицательная корреляционная связь между АОК на 14-е сут. и баллом по шкале NIHSS на 1-е сут. (r = –0,97, р < 0,05), что также свидетельствует о большей эффективности терапии Цераксоном у лиц с выраженным неврологическим дефицитом.
В подгруппе лиц с высокой активностью СОД также показана зависимость изменения АОК и тяжести ИМ, на что указывает отрицательная корреляционная связь между АОК на 1-е сут. и оценкой по шкале NIHSS на 7-е сут. (r = –0,62, р < 0,05).
Таким образом, продемонстрировано, что антиоксидантное действие Цераксона в большей степени проявляется при использовании его у пациентов с изначально низкой и нормальной активностью СОД крови.
Выводы
Исходя из вышеизложенного, показана преимущественная клиническая эффективность Цераксона при применении его у пациентов с низкой (до 45 е.а.) и нормальной (45–59 е.а.) антиоксидантной активностью сыворотки крови.
Установлено, что данный препарат увеличивает активность супероксиддисмутазы на 14-е сут. острого периода ИМ у лиц с низкой антиоксидантной активностью крови и предотвращает ее снижение во всех остальных группах и подгруппах пациентов.
Определение антиоксидантной активности сыворотки крови методом Т.В. Сироты может служить простым и общедоступным способом оценки эффективности нейропротективной терапии Цераксоном у пациентов с инфарктом мозга.