Журнал «» 6(20) 2011
Вернуться к номеру
Прогностическое значение васкулярного ремоделирования, ассоциированного с атеросклерозом и атеротромбозом
Авторы: Визир В.А., Березин А.Е., Запорожский государственный медицинский университет
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Обзор посвящен обсуждению некоторых вопросов, касающихся особенностей возникновения и прогрессирования васкулярного ремоделирования у пациентов с документированным атеросклерозом. Приводятся данные о взаимосвязи клинических исходов и различных типов васкулярного ремоделирования. Обсуждаются понятия угрожаемой атеромы, неадекватного и адекватного, конструктивного и экспансивного типов ремоделирования артерий.
Васкулярное ремоделирование, атеросклероз, атерома, коронарные артерии, клинические исходы.
Традиционно разрыв атеромы с формированием пристеночного тромба рассматривается как одно из наиболее частых осложнений атерогенеза, непосредственно связанных с клинической манифестацией большинства кардиоваскулярных атеротромботических событий [27, 42]. В связи с этим феномен васкулярного ремоделирования у пациентов с документированным атеросклеротическим поражением коронарных артерий преимущественно рассматривается как результат взаимодействия компонентов атеромы и структурных элементов сосудистой стенки [4, 18, 19]. В свою очередь, формирование фиксированного стеноза атеромой не исчерпывает всего многообразия вариантов коронарного ремоделирования, ассоциированного с атеросклеротическим поражением [4, 13, 14, 37]. Настоящий обзор посвящен обсуждению клинического значения различных типов васкулярного ремоделирования у пациентов с документированным атеросклеротическим поражением коронарных артерий.
Дефиниция васкулярного ремоделирования
Традиционно под ремоделированием артерий понимают динамические изменения цитоархитектоники стенки сосуда, приводящие к деформации наружной эластической мембраны и ассоциированные с изменением просвета артерии [4, 17, 37]. В качестве основных факторов, способствующих формированию этого феномена, рассматриваются воспалительные (васкулиты) и невоспалительные (атеросклеротические, гемодинамические, наследственные) причины [2, 3, 5]. Тем не менее возникновение атеромы индуцирует манифестацию своеобразных изменений в структуре сосудистой стенки, традиционно описываемых как позитивное (адекватное, экспансивное), негативное (неадекватное, интенсивное) ремоделирование и как вариант негативного — ремоделирование после компенсаторной дилатации [24, 28, 33, 38]. Все три варианта нарушений пространственной архитектоники коронарных артерий тесно ассоциированы с видом и тяжестью их атеросклеротического поражения, а также, как частный случай, с характером используемой реваскуляризационной процедуры (аортокоронарное шунтирование (АКШ), баллонная ангиопластика, стентирование) [4, 7, 43, 44].
Основные виды атером
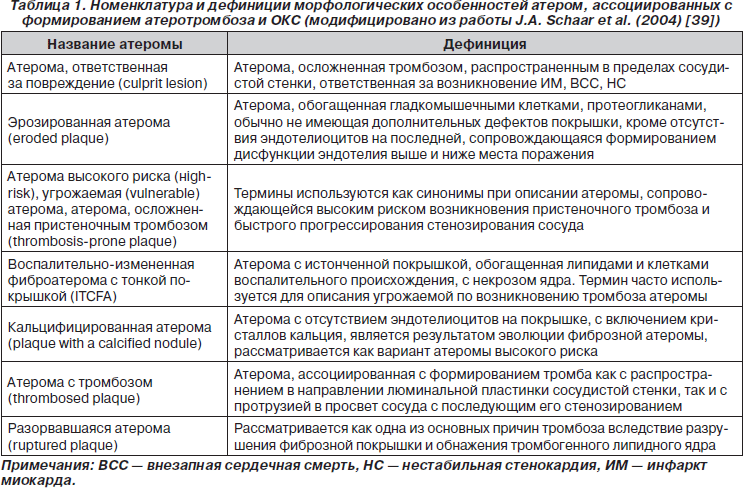
К основным видам атером принято относить липидные полоски, неосложненные и осложненные атеросклеротические бляшки. Липидные полоски представляют собой локально депонированные в субинтиме липиды, а также депозиты пенистых и гладкомышечных клеток (ГМК). Результатом эволюции липидной полоски является фиброзная атерома, которая отличается от последней наличием вступающей в просвет сосуда относительно жесткой фиброзной покрышки и сформированным липидным ядром, содержащим свободные липиды. Атерома, ассоциированная с формированием тромба, кальцификации или кровоизлияния в липидное ядро, рассматривается как осложненная [39].
Понятие угрожаемой и высокорисковой атеромы
Полагают, что прогрессирование атеросклероза осуществляется преимущественно за счет экспансии липидного ядра и аккумуляции пенистых клеток на его периферии в непосредственной близости от так называемой покрышки атеромы. При этом ее «жесткость», обусловленная накоплением коллагена, особенно в плечевой области, рассматривается как основной фактор, определяющий способность атеромы к разрыву [3]. Так, при аутопсии больных с верифицированной ишемической болезнью сердца (ИБС), умерших внезапно, разрыв атеромы ассоциировался с повышением соотношения «общий холестерин (ХС)/ХС липопротеидов высокой плотности», тогда как такие известные факторы риска кардиоваскулярной смерти, как курение и артериальная гипертензия, не продемонстрировали устойчивой корреляции с риском возникновения угрожаемой (vulnerable plaque) атеромы.
Несмотря на то что разрыв атеромы является одной из основных причин возникновения атеротромбоза, почти в 30–40 % случаев локализацию уязвимой атеромы установить не удается. Результаты исследования А. Farb et al. (1996) [6] показали, что только у 22 из 55 больных, умерших внезапно вследствие коронарного атеротромбоза, удалось идентифицировать поверхностно-эрозированную атерому, обогащенную протеогликанами с большим содержанием гладкомышечных клеток. При этом локализация атеромы соответствовала участку ишемии и некроза. У 28 пациентов структура атеромы не рассматривалась как потенциально угрожаемая к разрыву. Авторы пришли к заключению, что уязвимые атеромы обычно не подвержены выраженной кальцификации, не приводят к формированию гемодинамически значимых стенотических поражений артерий, менее инфильтрированы макрофагами, а также чаще идентифицируются у пост- и перименопаузальных женщин, чем у мужчин того же возраста.
Необходимо отметить, что покрышка атером, подвергшихся разрыву, обычно умеренно утолщена или истончена (в среднем 23 ± 19 µм) и в 95 % случаев имеет абсолютную толщину менее 64 µм. Кроме того, подобные атеромы густо инфильтрированы макрофагами и Т-лимфоцитами, а липидное ядро обогащено эстерифицированным холестерином [3]. Достаточно часто обнаруживается новообразование сосудов из vasa vasorum, прорастающих в интиму атеромы со стороны адвентиции сосуда.
Несколько реже (приблизительно в 30 % случаев) при проведении аутопсий встречается несколько иной вариант атером, обычно идентифицирующихся как эрозированные атеросклеротические бляшки. Для последних характерно образование тромбоза на поверхности покрышки, отсутствие эндотелиальной выстилки при сохранении толщины последней, липидное ядро может отсутствовать вообще или обогащено протеогликанами, обычно не определяется выраженная инфильтрация Тh1-зависимыми клетками. Подобные изменения часто обнаруживаются при проведении рентгенконтрастной ангиографии у пациентов с острым коронарным синдромом (ОКС) с элевацией сегмента ST на ЭКГ до возникновения указанного события в инфарктзависимой артерии. Причем подобные атеромы не создают гемодинамически значимого стеноза и часто локализуются либо в проксимальных сегментах крупных коронарных артерий, либо в участках их бифуркаций. Кроме того, по данным гистологических исследований, эрозированные атеромы являются достаточно частой находкой у женщин моложе 50 лет, умерших внезапно вследствие коронарных причин [1, 5, 20].
Таким образом, к настоящему времени удалось идентифицировать как минимум два типа потенциально угрожаемых атером: так называемая воспалительно-измененная фиброатерома с истонченной покрышкой и эрозированная атерома [21, 22].
Необходимо отметить, что оба типа атеросклеротических бляшек существенно отличаются друг от друга не только излюбленной локализацией в коронарных артериях, но и морфологически. В то же время полагают, что процессы разрыва и эрозирования покрышки атеромы, хотя и обусловлены двумя принципиально различными механизмами, обычно завершаются формированием тромба и окклюзии сосуда. В этом контексте термины «атерома высокого риска» (high-risk) и «угрожаемая атерома» обычно употребляются как синонимы, поскольку описывают риск возникновения атеротромбоза [39]. В то же время в клинической практике широко применяются сугубо морфологические термины, такие как «эрозированная атерома», «атерома, ответственная за повреждение», «воспалительно-измененная фиброатерома с тонкой покрышкой» (inflamed thin-cap fibroatheroma — ITCFA), «кальцифицированная атерома», «атерома с тромбозом», которые характеризуют различные стадии процесса дестабилизации атеросклеротической бляшки [5, 21, 22]. Тем не менее неоднозначность в понимании и множественность сочетаемых характеристик указанных дефиниций создавали некоторые проблемы в описании особенностей патологического процесса, что потребовало создания стандартизированной концепции, касающейся формирования представлений о наличии четко определенных критериев для так называемых осложненных атером [25]. Наиболее удачно эту задачу удалось выполнить коллективу экспертов J.A. Schaar, J.E. Muller, Е. Falk et al. (2004) [39], результаты работы которых представлены в табл. 1.
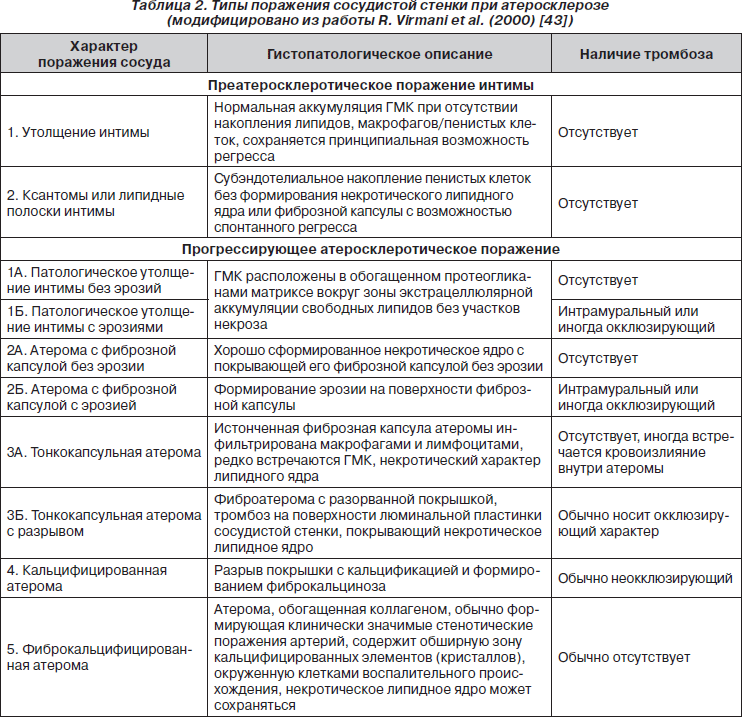
Вместе с тем существует и иной подход, позволяющий классифицировать типы атеросклеротического поражения, среди которых атерома не является единственной формой нарушения структуры и архитектоники сосудистой стенки [43]. При этом в качестве основных признаков, позволяющих идентифицировать высокорисковую атерому, является интрамуральный или окклюзирующий тромбоз (табл. 2).
Таким образом, общая концепция формирования атеротромбоза преимущественно основана на исключительной роли атеромы с эрозированной или разорванной покрышкой, презентирующей тромбогенное содержимое некротического липидного ядра, что приводит к формированию интрамурального или окклюзирующего тромбоза. Последний рассматривается как атрибут процессов про- и антикоагулянтного гемостаза, модулированного, в частности, тканевым тромбопластином липидного ядра. В результате этих процессов наблюдается появление клинических эквивалентов атеротромбоза. Восстановление целостности фиброзной покрышки атеромы, с одной стороны, способствует ее росту, кальцификации и формированию фиксированного клинически значимого стеноза, а с другой — снижает риск тромбообразования. Вместе с тем эта концепция, несмотря на ее высочайшую прогностическую ценность, не позволяет идентифицировать атерому, определяющую клинические исходы при прогрессировании атеротромбоза. С другой стороны, появление доступной техники для проведения внутрисосудистой эхолокации благоприятно отразилось на возможности индивидуализации оценки риска манифестации атеротромботических событий исходя из особенностей ремоделирования стенозированного сосуда.
Типы васкулярного ремоделирования, индуцированного формирующейся атеромой
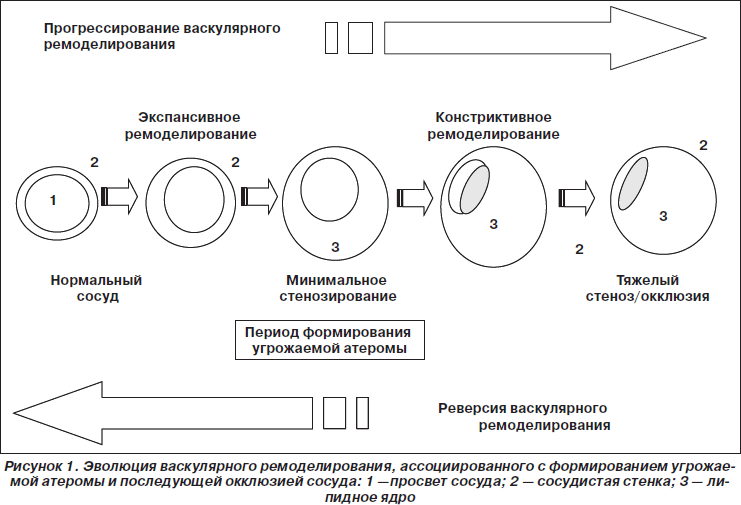
Принято выделять как минимум два типа васкулярного артериального ремоделирования — позитивный (адекватный, экспансивный) и негативный (неадекватный, интенсивный) (рис. 1), а также вариант, объединяющий некоторые характеристики обоих указанных типов (негативное ремоделирование после компенсаторной дилатации). К настоящему времени установлено, что констриктивный вариант васкулярного ремоделирования в значительной мере обусловливает возникновение фиксированного стеноза артерии, а также является компонентом ряда осложнений процедур реваскуляризации [4], таких как рестеноз или подострый тромбоз стента [30].
Экспансивный вариант, напротив, рассматривается как благоприятный процесс, возможно, носящий компенсаторный характер, повышающий демпфирующие свойства сосудистой стенки, способствующий сохранению ламинарного характера кровотока и препятствующий дальнейшему увеличению «жесткости» сосуда [17, 31].
В исследованиях in vivo с использованием внутрисосудистой эходопплерографии было показано, что ремоделирование артерий, ассоциированное с атеросклеротическим поражением, может носить двоякий характер. С одной стороны, существуют варианты этого процесса, при которых площадь наружной эластической мембраны стенки сосуда может увеличиваться за счет смещения ее липидным ядром проксимальнее и дистальнее локализации атеромы [1]. Этот тип ремоделирования принято называть позитивным или адекватным. С другой стороны, в некоторых случаях в области атеромы со стороны адвентиции сосуда формируется «провал» сосудистой стенки, что приводит к уменьшению площади наружной эластической мембраны. Это негативный или неадекватный тип васкулярного ремоделирования [7, 17, 23, 28, 31]. Причем в обоих случаях имеет место стенозирование сосуда атеромой. При проведении внутрисосудистого ультразвукового исследования наружная эластическая мембрана обычно хорошо лоцируется, а измерение ее площади в области атеромы дает возможность четко верифицировать характер и тип васкулярного ремоделирования [29].
Собственно термины «позитивный» и «негативный» типы ремоделирования являются атрибутами следующего математического отношения: площадь наружной эластической мембраны непосредственно над участком атеромы/ площадь наружной эластической мембраны над проксимально расположенным интактным участком [13, 14]. В первом или во втором случае соответственно результат этого отношения больше или меньше единицы. Именно эти особенности и были приняты во внимание S. Glagov et al. (1987) [11], выполнившими пионерские работы в этом направлении. Впоследствии оказалось, что описанные ими типы васкулярного ремоделирования в большей степени присущи периферическим артериям, чем коронарным, хотя и обнаруживаются при исследовании крупных коронарных артерий, в основном ствола левой или правой артерии [29].
Необходимо отметить, что достаточно часто (57 %) у пациентов с ангиографически интактными коронарными артериями при проведении внутрисосудистого ультразвукового исследования выявлялся адекватный вариант васкулярного ремоделирования, тогда как неадекватный тип встречался значительно реже. По данным G.S. Mintz et al. (1997) [24], неадекватный тип васкулярного ремоделирования встречается приблизительно у 15 % пациентов с документированной ИБС. В то же время стало известно, что позитивное васкулярное ремоделирование чаще наблюдается в проксимальных сегментах крупных и средних коронарных артерий, часто обнаруживается у пациентов с ОКС и инфарктом миокарда, ассоциируется с формированием нестабильной атеромы и рассматривается как предиктор неблагоприятного клинического исхода, что повышает диагностическую значимость идентификации подобных изменений [8, 38, 44, 45].
Механизмы, опосредующие формирование обоих типов васкулярного ремоделирования, сходны между собой, тогда как причины, приводящие к столь существенным различиям, до конца не определены [12, 21, 22]. Предполагается, что значительную роль в этом процессе могут играть генетические факторы, определяющие экспрессию ряда сигнальных молекул (трансформирующий фактор роста b, тромбоцитарный фактор роста, CD40-лиганд) и ферментных систем (металлопротеиназы, каспазы), принимающих участие в продукции и деградации внеклеточного коллагенового матрикса [2, 16]. Предпринимались попытки провести сопоставление экспансивного/конструктивного вариантов васкулярного ремоделирования с адекватным/неадекватным типом последнего. При этом оказалось, что экспансивный вариант ремоделирования часто обнаруживается на ранних стадиях атерогенеза, ассоциируется с формированием фиброзной атеромы с большим липидным ядром, смещающим наружную эластическую мембрану и формирующим адекватный тип васкулярного ремоделирования [19, 26]. Вместе с тем именно такие атеромы чаще всего и подвергаются эрозированию и разрыву, что не может рассматриваться как благоприятный или позитивный в клиническом отношении вариант ремоделирования сосуда [26]. Напротив, констриктивный тип ремоделирования чаще всего опосредован атеромой с «жесткой» покрышкой, редко подвергаемой дестабилизации и сопровождающейся неадекватным вариантом ремоделирования сосуда, хотя в клиническом смысле это далеко не так [32, 33, 46]. Негативное ремоделирование после компенсаторной дилатации как особый вариант нарушений цитоархитектоники сосудов чаще всего встречается после выполнения процедур реваскуляризации, особенно в графтах после АКШ или рестеноза после стентирования/ангиопластики [11, 15, 29, 34–36].
Двойственность представлений о клинической ценности вариантов ремоделирования артерий при атеросклерозе привела к формированию концепции об ассоциации стабильной атеромы с негативным вариантом ремоделирования, тогда как позитивный вариант ремоделирования, напротив, рассматривается в качестве предиктора высокого риска атеротромботических событий [1, 26].
Таким образом, внедрение в клиническую практику IVUS-технологии способствовало формированию мнения об отсутствии прямой и жесткой корреляции между появлением характеристик угрожаемой атеромы и прогностически неблагоприятным типом ремоделирования артерии. К сожалению, попытки создания индивидуализированной системы оценки кардиоваскулярного риска на основе концепции о ключевой роли угрожаемой атеромы в манифестации атеротромботических событий без учета типа васкулярного ремоделирования пока не привели к успеху. Очевидно, следует продолжить исследования в этом направлении, что позволит предложить более адекватную в прогностическом отношении модель и разработать методы достижения эффективной превенции прогрессирования васкулярного ремоделирования коронарных артерий.
1. Ambrose J.A., Srikanth S. Vulnerable Plaques and Patients: Improving Prediction of Future Coronary Events // Am. J. Med. — 2010. — 123. — 10-16.
2. Brasselet C., Durand E., Addad F., Zen A.A.H., Smeets M.B., Laurent-Maquin D., Bouthors S., Bellon G., de Kleijn D., Godeau G., Garnotel R., Gogly B., Lafont A. Collagen and elastin cross-linking: a mechanism of constrictive remodeling after arterial injury // Am. J. Physiol. Heart Circ. Physiol. — 2005. — 289(5). — H2228-H2233.
3. Burke A.P., Farb A., Malcom G.T., Liang Y.H., Smialek J., Virmani R. Coronary risk factors and plaque morphology in men with coronary disease who died suddenly // N. Engl. J. Med. — 1997. — 336. — 1276-1282.
4. De Smet B.J.G.L., Pasterkamp G., van der Helm Y.J., Borst C., Post M.J. The relation between de novo atherosclerotic remodeling and angioplasty-induced remodeling in an atherosclerotic yucatan micropig model // Arterioscl. Thromb. Vasc. Biol. — 1998. — 188. — 702-707.
5. Detrano R., Guerci A.D., Carr J.J. et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups // N. Engl. J. Med. — 2008. — 358. — 1336-1345.
6. Farb A., Burke A.P., Tang A.L. et al. Coronary plaque erosion without rupture into a lipid core. A frequent cause of coronary thrombosis in sudden coronary death // Circulation. — 1996. — 93. — 1354-1363.
7. Ge J., Erbel R., Zamoran J. et al. Coronary artery remodeling in atherosclerotic disease // Coron. Artery Dis. — 1993. — 4. — 981-986.
8. Gerber T.C., Erbel R., Gorge G., Ge J., Rupprecht H.J., Meyer J. Extent of atherosclerosis and remodeling of the left main coronary artery determined by intravascular ultrasound // Am. J. Cardiol. — 1994. — 73. — 666-671.
9. Gibbons G.H., Dzau V. The emerging concept of vascular remodeling // N. Engl. J. Med. — 1994. — 330. — 1431-1438.
10. Glagov S. Intimal hyperplasia, vascular modeling, and the restenosis problem // Circulation. — 1994. — 89(6). — 2888-2891.
11. Glagov S., Weisenberg E., Zarins C.K., Stankunavicius R., Kolettis G.J. Compensatory enlargement of human atherosclerotic coronary arteries // N. Engl. J. Med. — 1987. — 316. — 1371-1375.
12. Gurfinkel E., Vigliano C., Janavel J.V., Fornoni D., Caponi G., Meckert P.C., Bertolotti A., Favaloro R., Laguens R. Presence of vulnerable coronary plaques in middle-aged individuals who suffered a brain death // Eur. Heart J. — 2009. — 30(23). — 2845-2853.
13. Gyцngyцsi M., Yang P., Hassan A. et al. Arterial remodeling of native human coronary arteries in patients with unstable angina pectoris: a prospective intravascular ultrasound study // Heart. — 1999. — 82. — 68-74.
14. Gyцngyцsi M., Yang P., Hassan A. et al. Coronary risk factors influence plaque morphology in patients with unstable angina // Coron. Artery Dis. — 1999. — 10. — 211-219.
15. Hardt S.E., Bekeredjian R., Brachmann J. et al. Intravascular ultrasound for evaluation of initial vessel patency and early outcome following directional coronary atherectomy // Cathet. Cardiovasc. Interv. — 1999. — 47. — 14-22.
16. Hellings W.E., Moll F.L., de Vries J.-P.P.M., Ackerstaff R.G.A., Seldenrijk K.A., Met R., Velema E., Derksen W.J.M., De Kleijn D.P.V., Pasterkamp G. Atherosclerotic Plaque Composition and Occurrence of Restenosis After Carotid Endarterectomy // JAMA. — 2008. — 299(5). — 547-554.
17. Hermiller J.B., Tenaglia A.N., Kisslo K.B. et al. In vivo validation of compensatory enlargement of atherosclerotic coronary arteries // Am. J. Cardiol. — 1993. — 71. — 665-668.
18. Hong M.-K., Mintz G.S., Lee C.W., Kim Y.-H., Lee J.-W., Song J.-M., Han K.-H., Kang D.-H., Song J.-K., Kim J.-J. et al. Intravascular ultrasound assessment of patterns of arterial remodeling in the absence of significant reference segment plaque burden in patients with coronary artery disease // J. Am. Coll. Cardiol. — 2003. — 42(5). — 806-810.
19. Kaski J.C. Atheromatous plaque location and arterial remodeling // Eur. Heart J. — 2003. — 24(4). — 291-293.
20. Lakoske S.G., Greenland P., Wong N. et al. Coronary artery calcium scores and risk for cardiovascular events in women classified as «low risk» based on Framingham Risk Score // Arch. Intern. Med. — 2007. — 167. — 2437-2442.
21. Libby P. Act local, act global: inflammation and the multiplicity of «vulnerable» coronary plaques // J. Am. Coll. Cardiol. — 2005. — 45. — 1600-1602.
22. Libby P., Ridker P.M., Maseri A. Inflammation and atherosclerosis // Circulation. — 2002. — 105. — 1135-1143.
23. McPherson D.D., Sirna S.J., Hiratzka L.F. et al. Coronary arterial remodeling studied by high-frequency epicardial echocardiography // J. Am. Coll. Cardiol. — 1991. — 17. — 79-86.
24. Mintz G.S., Kent K.M., Pichard A.D., Satler L.F., Popma J.J., Leon M.B. Contribution of inadequate arterial remodeling to the development of focal coronary artery stenoses // Circulation. — 1997. — 95. — 1791-1798.
25. Naghavi M., Falk E., Hecht H.S. et al. From vulnerable plaque to vulnerable patient Part III: Executive summary of the Screening for Heart Attack Prevention and Education (SHAPE) task force report // Am. J. Cardiol. — 2006. — 98(suppl.). — 2H-15H.
26. Nakamura M., Nishikawa H., Mukai S., Setsuda M., Nakajima K., Tamada H., Suzuki H., Ohnishi T., Kakuta Y., Nakano T. et al. Impact of coronary artery remodeling on clinical presentation of coronary artery disease: an intravascular ultrasound study // J. Am. Coll. Cardiol. — 2001. — 37(1). — 63-69.
27. Nicholls S.J., Tuzcu E.M., Wolski K., Sipahi I., Schoenhagen P., Crowe T., Kapadia S.R., Hazen S.L., Nissen S.E. Coronary Artery Calcification and Changes in Atheroma Burden in Response to Established Medical Therapies // J. Am. Coll. Cardiol. — 2007. — 49(2). — 263-270.
28. Nishioka T., Luo H., Eigler N.L., Berglund H., Kim C.J., Siegel R.J. Contribution of inadequate compensatory enlargement to development of human artery stenosis // J. Am. Coll. Cardiol. — 1996. — 27. — 1571-1576.
29. Okura H., Morino Y., Oshima A., Hayase M., Ward M.R., Popma J.J., Kuntz R.E., Bonneau H.N., Yock P.G., Fitzgerald P.J. Preintervention arterial remodeling affects clinical outcome following stenting: an intravascular ultrasound study // J. Am. Coll. Cardiol. — 2001. — 37(4). — 1031-1035.
30. Ozaki Y., Violaris A.G., de Feyter P., Roelandt J. Role of underlying vascular remodeling mode in the mechanism of acute luminal gain and late restenosis after balloon angioplasty (BA) and directional coronary atherectomy (DCA) // Circulation. — 1996. — 94 Suppl. — I-134.
31. Pasterkamp G., de Kleijn D.P.V, Borst C. Arterial remodeling in atherosclerosis, restenosis and after alteration of blood flow: potential mechanisms and clinical implications // Cardiovasc. Res. — 2000. — 45(4). — 843-852.
32. Pasterkamp G., Schoneveld A., van der Wal A. et al. Relation of arterial geometry to luminal narrowing and histologic markers for plaque vulnerability: the remodeling paradox // J. Am. Coll. Cardiol. — 1998. — 32. — 655-662.
33. Pasterkamp G., Wensing P.J.W., Post M.J., Hillen B., Mali W., Borst C. Paradoxical arterial wall shrinkage may contribute to luminal narrowing of human atherosclerotic femoral arteries // Circulation. — 1995. — 91. — 1444-1449.
34. Pethig K., Heublein B., Meliss R.R., Haverich A. Volumetric remodeling of the proximal left coronary artery // J. Am. Coll. Cardiol. — 1999. — 34. — 197-203.
35. Pethig K., Heublein B., Wahlers T. Impact of plaque burden on compensatory enlargement of coronary arteries in cardiac allograft vasculopathy // Am. J. Cardiol. — 1997. — 79. — 89-92.
36. Pethig K., Heublein B., Wahlers T., Haverich A. Mechanism of luminal narrowing in cardiac allograft vasculopathy // Am. Heart J. — 1998. — 135. — 628-633.
37. Popma J., Bashore T. Qualitative and quantitative angiography. Topol E. Textbook of Interventional Cardiology. — Philadelphia: WB Saunders, 1994. — Р. 1052-1068.
38. Prati F., Arbustini E., Labellarte A., Sommariva L., Pawlowski T., Manzoli A. et al. Eccentric atherosclerotic plaques with positive remodelling have a pericardial distribution: apermissive role of epicardial fat? A three dimensional intravascular ultrasound study of left anterior descending artery lesions // Eur. Heart J. — 2003. — 24. — 329-336.
39. Schaar J.A., Muller J.E., Falk E. et al. Terminology for high-risk and vulnerable coronary artery plaques. Report of a meeting on the vulnerable plaque, June 17 and 18, 2003, Santorini, Greece // Eur. Heart J. — 2004. — 25. — 1077-1082.
40. Schoenhagen P., Ziada K.M., Vince D.G., Nissen S.E., Tuzcu E.M. Arterial remodeling and coronary artery disease: the concept of «dilated» versus «obstructive» coronary atherosclerosi // J. Am. Coll. Cardiol. — 2001. — 38. — 297-306.
41. Schoenhagen P., Zinda K.M., Kapadia S.R. et al. Extent and direction of arterial remodeling in stable versus unstable coronary syndrome: an intravascular ultrasound study // Circulation. — 2000. — 101. — 604-610.
42. Tuzcu E.M., Schoenhagen P. Acute coronary syndromes, plaque vulnerability, and carotid artery disease: The changing role of atherosclerosis imaging // J. Am. Coll. Cardiol. — 2003. — 42(6). — 1033-1036.
43. Virmani R., Kolodgie F.D., Burke A.P., Farb A., Schwartz S.M. Lessons from sudden coronary death: a comprehensive morphological classification scheme for atherosclerotic lesions // Arterioscler. Thromb. Vasc. Biol. — 2000. — 20. — 1262-1275.
44. Von Birgelen C., Klinkhart W., Mintz G.S., Papatheodorou A., Herrmann J., Baumgart D. et al. Plaque distribution and vascular remodeling of ruptured and nonruptured coronary plaques in the same vessel: an intravascular ultrasound study in vivo // J. Am. Coll. Cardiol. — 2001. — 37. — 1864-1870.
45. Ward M.R., Jeremias A., Hibi K. et al. The influence of plaque orientation (pericardial or myocardial) on coronary arterial remodeling // Atherosclerosis. — 2001. — 154. — 179-183.
46. Wexberg Р., Gyongyosi M., Sperker W., Kiss K., Yang P., Hassan A., Pasterkamp G., Glogar D. Pre-existing arterial remodeling is associated with in-hospital and late adverse cardiac events after coronary interventions in patients with stable angina pectoris // J. Am. Coll. Cardiol. — 2000. — 36(6). — 1860-1869.