Журнал «» 6(20) 2011
Вернуться к номеру
Вплив валсартану на клінічний перебіг артеріальної гіпертензії, зміни внутрішньосерцевої гемодинаміки та рівні прозапальних цитокінів у післяінфарктному періоді
Авторы: Батушкін В.В., Гема А.І., Купченко Г.М., Аждарі Хосрошахі М., Кузьменко В.В., Міська клінічна лікарня № 5 м. Києва
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
З метою визначення впливу шестимісячного призначення валсартану (Вальсакору) на клінічний перебіг артеріальної гіпертензії (АГ) у післяінфарктному періоді, динаміку артеріального тиску (АТ) та змiни внутрішньосерцевої гемодинаміки з аналізом показників функції ендотелію та лабораторних факторів запалення були обстежені 152 хворі на середню та тяжку АГ (середній вік 71,3 ± 6,8 року), які лікувалися з діагнозом «гострий інфаркт міокарда». Сімдесяти хворим був призначений Вальсакор у дозі 320 мг на добу, 82 хворим (контрольна група) — лізиноприл 40 мг на добу. Вихідні значення АТ становили: систолічного — 158,4 ± 12,2 мм рт.ст., діастолічного — 93,0 ± 6,2 мм рт.ст. та були порівнянні по групах.
Гіпотензивна терапія Вальсакором у дозі 244,6 ± 12,1 мг на добу не поступалася за ефективністю лізиноприлу в дозі 26,8 ± 2,6 мг на добу та сприяла зменшенню систолічного АТ на 28,7 ± 3,4 мм рт.ст., діастолічного АТ — на 14,6 ± 2,6 мм рт.ст., максимально впливаючи на добову варіабельність систолічного АТ, достовірно знижуючи її на 49,3–61,8 % (ніч/день), та індекс часу діастолічного АТ.
Запобігання прогресуванню ремоделювання лівого шлуночка при використанні Вальсакору у хворих на АГ в післяінфарктному періоді пов’язане перш за все з покращенням лівошлуночкової функції — зростання фракції викиду на 8,3 % (р < 0,05), гальмуванням лівошлуночкової дилатації, яке було порівнянним із таким під впливом ІАПФ лізиноприлу, та достовірним зменшенням маси міокарда лівого шлуночка у 74,6 % хворих.
Призначення Вальсакору або лізиноприлу активно впливало на динаміку прозапальних цитокінів, достовірно зменшуючи рівень показників системного запалення. Значення ТНФ-a протягом шестимісячного лікування зменшувалися достовірно краще саме в групі Вальсакору.
Терапія Вальсакором у хворих на АГ не гірше, ніж лізиноприлом, відновлювала ендотеліальну функцію судин у вигляді достовірного підвищення об’ємної швидкості кровотоку на 42,3 %, зросту індексу реактивності судин на 23,1 % протягом 6-місячного лікування.
При відсутності побічних дій Вальсакор у максимальній дозі краще переносився, ніж лізиноприл, особливо хворими з цукровим діабетом, ускладненим нефропатичним синдромом.
Артеріальна гіпертензія, інфаркт міокарда, валсартан, порушення ендотеліальної функції, маркери запалення.
Призначення гіпотензивної терапії у хворих у післяінфарктному періоді має свої певні особливості [2, 6, 11]. Після перенесеного гострого інфаркту міокарда (ГІМ) ризик розвитку наступної фатальної або нефатальної коронарної події більший, якщо рівень артеріального тиску (АТ) залишається підвищеним [11]. У великих плацебо- або активноконтрольованих рандомізованих дослідженнях, які проводили на етапі реабілітації після ГІМ, було показано, що призначення деяких бета-блокаторів, інгібіторів ангіотензинперетворюючого ферменту (ІАПФ), блокаторів рецепторів до ангіотензину ІІ (БРА ІІ) призводило до достовірного зменшення серцево-судинної захворюваності та смертності [1, 6, 11, 15].
На жаль, у більшості випадків дизайн досліджень був сфокусований на вивчення прямих органопротекторних властивостей препаратів, а не на зниження АТ. Тому в деяких із них дані про зміни АТ дуже скупі або про них не повідомляється [12]. Якщо ж зміни АТ відомі, то майже завжди виявляється, що АТ нижчий у групах активно лікованих пацієнтів. При аналізі результатів таких досліджень іноді тяжко визначити, чи пов’язане зменшення ризику ускладнень з дією самого препарату або зі змінами рівня АТ.
Незалежно від механізмів дії, існують безперечні докази на користь призначення ІАПФ, БРА ІІ у хворих на артеріальну гіпертензію (АГ) після перенесеного ГІМ, особливо ускладненого систолічною дисфункцією [11, 15]. Більше того, доведено, що окрім ренін-ангіотензин-альдостеронової системи (РААС) у системному кровотоці, активація якої призводить до короткострокових ефектів, таких як вазоконстрикція, підвищення АТ, секреція альдостерону, існують локальні (тканинні) РААС у різноманітних органах та тканинах, у тому числі в серці, нирках, мозку, кровоносних судинах. Підвищена активність тканинних РААС зумовлює тривалі ефекти ангіотензину II, що проявляються структурно-функціональними змінами в органах-мішенях та призводять до розвитку таких патологічних процесів, як гіпертрофія міокарда, міофіброз, атеросклеротичне ураження судин мозку, ураження нирок та інше.
З іншої сторони, на відміну від інгібіторів АПФ, блокатори АТ1-ангіотензинових рецепторів не впливають на розміри інфаркту міокарда (ІМ) після перев’язки вінцевої артерії у собак, кроликів та пацюків. У той же час у морських свинок вони обмежують розміри інфаркту міокарда так само ефективно, як і інгібітори АПФ, кардіопротективна дія яких пов’язана з потенціюванням ефектів калікреїн-кінінової системи. Ці та інші експериментальні дані дають підставу припускати, що у людини та деяких видів тварин блокатори АТ1-ангіотензинових рецепторів можуть мати кардіопротективні властивості, послабляючи серцево-судинні та цитотоксичні ефекти ангіотензину II, які опосередковуються АТ1-рецепторами, а також непрямим способом збільшуючи утворення брадикініну, оксиду азоту та простагландинів шляхом стимуляції АТ2-ангіотензинових рецепторів [10, 14].
Валсартан вважається активним препаратом (на відміну від кандесартану або лозартану), необоротним антагоністом АТ1-рецепторів (на відміну від лозартану або епросартану), його спорідненість до АТ1-рецепторів у 20 000 разів більша, ніж до рецепторів підтипу АТ2. Препарат не має спорідненості до a1-, a2- та b1-адренорецепторів, а також до гістамінових, субстанції Р, GABA A, GABA B, мускаринових, 5-НТ1 та 5НТ2, бензодіазепінових, m-опіатних, аденозин-1 рецепторів та кальцієвих каналів. Також валсартан пригнічує всі опосередковані АТ1-рецепторами ефекти ангіотензину II, включаючи вазопресорну відповідь та секрецію альдостерону, характеризується поєднанням більш високої афінності, ніж у інших представників сартанів, із доброю переносимістю, відсутністю ризику значущих лікарських взаємодій та простотою використання [14].
Призначення валсартану в гострому періоді ІМ є виправданим з точки зору його ефективного впливу на перебіг післяінфарктного ремоделювання, маркери запалення, ендотеліальну дисфункцію, гальмування процесів зросту, стимульованих безпосередньо ангіотензином II, та пригнічення патологічної нейрогуморальної активації у хворих на ГІМ похилого віку при значно меншій кількості випадків побічної дії або поганої переносимості [4, 12, 13].
Прозапальні цитокіни відіграють важливу роль у патологічному ремоделюванні лівого шлуночка (ЛШ), стимулюючи гіпертрофію, альтерацію та експресію фетального гена, що індукує апоптоз. Підвищення рівнів прозапальних інтерлейкінів і ТНФ-a у плазмі хворих на ішемічну хворобу серця (ІХС) вважають не тільки показниками активності запальних реакцій, порушення стабільності гемоваскулярного гемостазу, активації внутрішньосудинного тромбоутворення, а й фактором пошкодження кардіоміоцитів шляхом безпосереднього впливу цитокінів на геном, ферментативні реакції, обмінні та енергетичні процеси в них [9].
Останні літературні дані свідчать, що в людини, окрім АПФ-залежного шляху перетворення ангіотензину I в ангіотензин II, існують альтернативні шляхи — за участю хімаз, катепсину G, тоніну та інших серинових протеаз. Хімази, або хімотрипсиноподібні протеази, являють собою глікопротеїни з молекулярною масою близько 30 000 Да. Хімази мають високу специфічність щодо ангіотензину I. У різних органах та тканинах переважає або АПФ-залежний, або альтернативні шляхи утворення ангіотензину II. Так, у тканині міокарда людини знайдена кардіальна серинпротеаза, її ДНК та мРНК. При цьому найбільша кількість цього фермента міститься в міокарді лівого шлуночка, де на долю хімазного шляху припадає більше 80 %. Хімазозалежне утворення ангіотензину II переважає в міокардіальному інтерстиції, адвентиції та медії судин, тоді як АПФ-залежне — у плазмі крові.
Вивчення впливу шестимісячного призначення валсартану на клінічний перебіг АГ в післяінфарктному періоді, зміни АТ та внутрішньосерцевої гемодинаміки з аналізом змін функції ендотелію та лабораторних факторів запалення було метою нашого дослідження. Як препарат порівняння був обраний ІАПФ лізиноприл, який дозволений до використання в гострому періоді інфаркту міокарда.
Матеріали та методи дослідження
Нами обстежено 152 хворих на середню та тяжку АГ (середній вік 71,3 ± 6,8 року), які лікувалися з діагнозом ГІМ у кардіологічному відділенні для хворих на інфаркт міокарда КМКЛ № 5 у 2010–2011 роках. ГІМ був підтверджений клінічними, електрокардіографічними та лабораторними даними. Залежно від призначеної терапії всі хворі були розподілені на 2 групи: І групу складали 70 хворих, яким з метою гіпотензивного впливу був призначений Вальсакор® — валсартан компанії KRKA (Словенія), у ІІ групу увійшли 82 хворі, які приймали лізиноприл. Середня тривалість АГ становила 12,3 ± 4,6 року. Вихідний рівень АТ становив: систолічний (САТ) 158,4 ± 12,2 мм рт.ст., діастолічний (ДАТ) 93,0 ± 6,2 мм рт.ст. та був порівнянним по групах.
За клініко-анамнестичними характеристиками групи були подібні.
Після стабілізації стану пацієнта (перші 24–48 годин) хворим призначали: в І групі Вальсакор® 40 мг двічі на добу, у ІІ групі — лізиноприл 2,5 мг двічі на добу. Протягом першого тижня дози препаратів підвищували під контролем АТ до досягнення максимально переносимої або цільової: валсартану — 320 мг, лізиноприлу — 20 мг на добу. При необхідності, з метою кращої корекції АТ, хворим додавали 12,5–25 мг гідрохлортіазиду (Вальсакор Н, Ліпразид). Крім АТ, контролювали самопочуття хворих, зміни центральної та периферичної гемодинаміки, наявність порушень ниркової функції.
Під час дослідження оцінювали ефективність препаратів у плані попередження несприятливих подій протягом 6 місяців лікування, гіпотензивну дію, переносимість та безпечність тривалої терапії.
Добовий моніторинг АТ проводили за допомогою портативного регістратора «ДіаКард», АТ «Сольвейг», з автоматичними вимірюваннями АТ в денний час кожні 15 хв, у нічний час — кожні 30 хв. Цільовим вважався АТ вдень нижчий 140/90 мм рт.ст., вночі — 125/75 мм рт.ст. ЕхоКГ серця проводилося на апараті Phillips HD7 перед призначенням першої дози препарату, через 1 та 6 місяців. Визначали в динаміці зміни основних внутрішньосерцевих характеристик серця за загальноприйнятими методиками.
Визначення концентрації СРП проводили за допомогою імунотурбодиметричного методу діагностичним набором Cormay (Польща) на біохімічному аналізаторі Cobas. Середньомежові значення показника, попередньо визначені в 20 осіб віком 71,3 ± 8,6 року, становили 6,7 ± 1,4 мг/л.
Дослідження рівнів інтерлейкіну-6 (ІЛ-6) та тумор-некротичного фактора a (ТНФ-a) проводили за допомогою твердофазного імуноферментного методу реактивами ProCon (Росія). Середньомежові значення показників, попередньо визначених у 20 осіб віком 67,3 ± 4,7 року, відповідно становили 3,8 ± 0,7 пг/л та 51,0 ± 6,2 пг/л [4].
Функціональну активність ендотелію резистивних артеріол досліджували флоуметричним методом за допомогою тесту реактивної гіперемії.
Венозна оклюзивна флоуметрія характеризувалась вимірюванням об’ємної швидкості кровотоку до та на піку реактивної гіперемії з визначенням індексу реактивності (ІР) за оригінальною методикою [3].
Результати та їх обговорення
У процесі титрування гіпотензивної дози 58 (86,6 %) хворим І групи дозу Вальсакору® підвищували з 80 до 160 мг на добу. У 19 (28,4 %) хворих для досягнення цільових значень АТ доза валсартану зростала до 320 мг на добу. Таким чином, 67,2 % осіб продовжували приймати Вальсакор® 80 мг двічі на добу, у 28,4 % хворих ефективна доза препарату становила 160 мг двічі на добу. На кінець дослідження середня доза Вальсакору® становила 244,6 ± 12,1 мг на добу. На відміну від хворих І групи, ефективної або цільової дози лізиноприлу (20 мг на добу) з добрим гіпотензивним ефектом досягли 48 (57,1 %) хворих. У 24 (28,6 %) хворих ІІ групи протягом перших 10 днів призначена терапія не впливала ефективно на АТ — доза лізиноприлу була підвищена до 40 мг на добу. Середньоефективна доза лізиноприлу на кінець дослідження становила 26,8 ± 2,6 мг на добу. За рахунок доброї переносимості, передбачуваної гіпотензивної дії термін титрування Вальсакору® в середньому становив 8,3 дня, тоді як лізиноприлу — 9,7 дня. Така ефективна терапія обумовлювала стабілізацію АТ на цільових рівнях до кінця терміну дослідження.
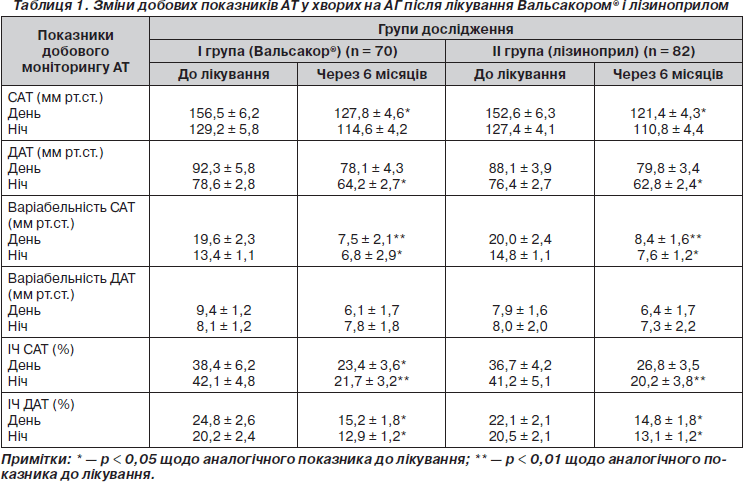
Динаміка показників 24-годинного моніторингу АТ після 6-місячного лікування наведена в табл. 1.
Як видно з даних табл. 1, гіпотензивна терапія Вальсакором® та лізиноприлом, призначена протягом 6 місяців після ГІМ, призвела до достовірного гіпотензивного ефекту, максимально знижуючи САТ вдень на 18,3 % (з 156,5 ± 6,2 мм рт.ст. до 127,8 ± 4,6 мм рт.ст.) у І групі та на 20,4 % (з 152,6 ± 6,3 мм рт.ст. до 121,4 ± 4,3 мм рт.ст.) в ІІ групі, ДАТ вночі на 18,0 % (з 78,6 ± 2,8 мм рт.ст. до 64,2 ± 2,7 мм рт.ст.) та на 18,5 % (з 76,4 ± 2,7 мм рт.ст. до 62,8 ± 2,4 мм рт.ст.) відповідно.
Аналіз варіабельності АТ передбачає оцінку його відхилень від кривої добового ритму, і на практиці показано, що при підвищенні варіабельності систолічного АТ більше 11,9 мм рт.ст. для денного періоду, 9,5 мм рт.ст. для нічного ризик виникнення серцево-судинних ускладнень збільшувався на 60–70 % [12]. Перед призначенням досліджуваної терапії варіабельність АТ протягом доби у хворих обох груп була значно підвищена, що є негативним фактором ризику ураження органів-мішеней, зокрема розвитку патологічного ремоделювання серця. У процесі лікування варіабельність САТ вдень вірогідно знизилась на 61,8 % у І групі та на 56,5 % — у другій. Відповідно, тривалість періоду, протягом якого рівень АТ перевищує нормальні величини (індекс часу (ЫЧ) АТ), як удень, так і вночі зменшувалася на 27,2–40,1 %. Причому в групі Вальсакору® денні зміни ІЧ САТ були дещо більшими та вірогідними. Існують дві фази дії ангіотензину II на судини — пресорна та депресорна. Перша відбувається за рахунок взаємодії з АТ1-рецепторами, друга — з АТ2-рецепторами. Депресорна фаза посилюється при лікуванні блокаторами ангіотензинових рецепторів. Aнгіотензин III утворюється переважно з ангіотензину II. Він взаємодіє і з АТ1-, і з АТ2-рецепторами. Aнгіотензини II та III стимулюють синтез альдостерону в клубочковій зоні кори надниркових залоз. АТ1-блокатори ангіотензинових рецепторів гальмують усі ефекти ангіотензину II та III, що викликаються взаємодією з АТ1-рецепторами. Спричиняючи реактивну гіперренінемію, вони збільшують утворення ангіотензину II та III. В умовах блокади АТ1-рецепторів надлишок ангіотензину III стимулює АТ2- й АТ3-рецептори, спричиняючи депресорну дію [9, 10]. Це сприяє додатковому гіпотензивному ефекту, зменшуючи частоту виникнення несприятливих подій у процесі тривалого спостереження.
Необхідно відмітити, що в процесі титрування лізиноприлу майже у кожного 4-го хворого визначалися епізоди симптомної гіпотензії. У 3 хворих віком понад 70 років призначення першої дози ІАПФ призвело до надмірного зниження САТ, що вимагало призначення додаткового лікування. У процесі подальшого спостереження цим хворим був призначений Вальсакор®, показники АТ нормалізувалися і були стабільними протягом усього терміну дослідження. Отримані результати вказують на те, що при виборі ІАПФ чи БРА ІІ з гіпотензивною метою у хворих після ГІМ повинен враховуватися старечий вік.
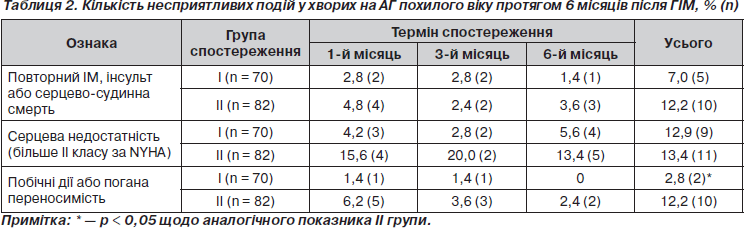
При аналізі клінічного перебігу АГ у хворих у післяінфарктному періоді зверталася увага на виникнення таких несприятливих подій, як серцево-судинна смерть, повторний ІМ, інсульт, розвиток ознак серцевоїх недостатності (СН). Отримані дані наведені в табл. 2.
Протягом періоду спостереження несприятливі події відмічалися у 35 (23,0 %) досліджуваних хворих. Серед них померли, мали повторний (нефатальний) ІМ або інсульт 15 (9,9 %) осіб. Як і очікувалося, маніфестація симптомів серцевої недостатності протягом періоду спостереження спостерігалася у 20 (13,1 %) пацієнтів. За жорсткими кінцевими точками (серцево-судинна смерть, повторний інфаркт, інсульт) серед хворих на АГ, які приймали різні види гіпотензивної терапії (Вальсакор®, лізиноприл), протягом 6 місяців після ГІМ достовірних розбіжностей не відмічалося (р = 0,3).
Прогресування симптомів СН під час терапії спостерігалося значно рідше, ніж в інших аналогічних дослідженнях [2, 5, 6]. Задуха при фізичному навантаженні, застійні явища у легенях, набряки нижніх кінцівок тощо відмічалися у 9 (12,9 %) хворих, які приймали Вальсакор®, та в 11 (13,4 %) з групи лізиноприлу. Із них 18 (90,0 %) було госпіталізовано. Важливість виявлення клінічних симптомів СН у ранній термін ГІМ широко дискутується в сучасній літературі [1, 6, 8]. На думку ряду провідних кардіологів, вони мають визначальний характер для призначення ІАПФ або БРА ІІ.
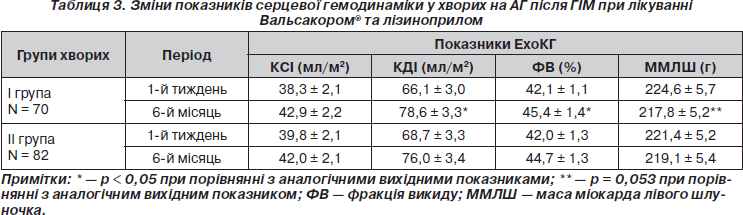
Клінічні результати відповідали змінам ЕхоКГ-показників внутрішньосерцевої гемодинаміки. Загалом ознаки дилатації порожнини лівого шлуночка вважаються основними маркерами післяінфарктного ремоделювання та спостерігаються у всіх хворих з ГІМ незалежно від призначеної терапії [8, 9]. Разом із тим головне завдання лікаря — зменшити ці процеси шляхом призначення відповідних препаратів [11]. Згідно з даними табл. 3, дилатація порожнини лівого шлуночка у хворих І та ІІ груп протягом терміну лікування зростала. Зокрема, ми визначали збільшення відповідно по групах кінцево-систолічного індексу на 10,8 % та 5,3 %, кінцево-діастолічного — на 16,0 % (р = 0,037) та 9,7 % (р > 0,05) щодо вихідного значення.
У шестимісячний термін інфаркту відновлення систолічної функції лівого шлуночка у хворих на АГ, як і очікувалося, було неповним, більший приріст фракції викиду (ФВ) визначався в групі Вальсакору®, ніж серед хворих ІІ групи (8,3 та 6,1 % відповідно). Важливо, що відновлення глобальної скоротливості відмічалось у 19 (27,1 %) хворих з групи Вальсакору® й тільки у 10 (12,2 %) пацієнтів, які приймали лізиноприл (р < 0,05). Отримані результати узгоджуються з даними T-VENTURE Study (2009), у якому тривале лікування 241 хворого на ГІМ призвело до достовірного зростання ФВ на 12,8 % в групі валсартану, тоді як у групі ІАПФ цей показник збільшувався лише на 7,4 % (р > 0,05) [13].
Перевага протекторних властивостей валсартану у випадках лівошлуночкової дисфункції внаслідок ГІМ пов’язана з гальмуванням альтернативних шляхів утворення ангіотензину II, які значно активуються під час ГІМ та відіграють велику роль у процесах сердцево-судинного ремоделювання [7, 8]. Поряд із корекцією динамічних показників серцевої скоротливості, які служать маркером післяінфарктного ремоделювання та предиктором розвитку застійної серцевої недостатності, факт зменшення маси міокарда лівого шлуночка (ММЛШ) вважається дуже важливим для оцінки подальшого прогнозу перебігу АГ у хворих на ГІМ. У Фремінгемському дослідженні було встановлено, що після появи електрокардіографічних ознак гіпертрофії лівого шлуночка 5-річна смертність досягає 35 % серед чоловіків та 20 % серед жінок 35–64 років; у більш старших вікових групах ці показники становлять 50 та 35 % відповідно [2, 5,11]. Значним є зв’язок електрокардіографічних ознак ГЛШ з розвитком мозкового інсульту та застійної серцевої недостатності. ГЛШ за ехокардіографічними критеріями асоціюється із значним зростанням ризику смерті незалежно від присутності або відсутності ІХС.
Кращий регрес ММЛШ відзначався після шестимісячної терапії Вальсакором®. У І групі значне зменшення (більше 10 %) ММЛШ визначалося у 52 (74,5 %) пацієнтів, тоді як у групі лізиноприлу тільки в половини. Таким чином, те, що в майже на 50 % більшої кількості хворих значно регресувала ММЛШ під впливом Вальсакору® при лікуванні АГ після ГІМ, повинно розглядатися не лише як наслідок гіпотензивної дії препарату, але й органопротекторної. Доведено, що блокатори рецепторів ангіотензину ІІ викликають зворотний розвиток гіпертрофії лівого шлуночка у хворих на АГ. Ці властивості у них більш виражені, ніж в атенололу. Дані препарати схожі за ефективністю до інгібіторів АПФ [11]. Зворотний розвиток гіпертрофії при лікуванні блокаторами АТ1-рецепторів зумовлений прямою антипроліферативною дією на кардіоміоцити та фібробласти, а також зниженням системного АТ. Препарати даної групи також сприяють новоутворенню капілярів [9].
Блокатори АТ1-рецепторів мають певну вазопротективну дію. Зокрема, вони відновлюють порушену вазомоторну функцію ендотелію, зменшують товщину внутрішньої оболонки (інтими) резистивних артерій та збільшують їх просвіт у хворих на АГ [11].
Покращення функціонального стану кардіоміоцитів сприяє зменшенню вираженості процесів післяінфарктного ремоделювання лівого шлуночка, клінічним проявом якого виступає серцева недостатність [5, 6, 11].
Дисфункція ендотелію при АГ характеризується ненормальною (порушеною) ендотелійзалежною релаксацією судин, що, з однієї сторони, призводить до стійкого підвищення АТ та неспроможності розширюватись та забезпечувати збільшення кровотоку серця під час навантаження — з іншої. Як свідчать результати флоуметрії під час госпіталізації, вихідні показники об’ємної швидкості кровотоку в усіх хворих на ГІМ були значно знижені. Це знаходить підтвердження і в роботі S. Verma, M. Strauss (2004), що показали порушення ендотелійзалежних судинних реакцій у хворих на АГ в післяінфарктному періоді, які не залежать від ступеня ураження міокарда [15].
Зменшення ендотелійзалежної вазодилатації та збільшення чутливості й вираженості відповіді при дії гуморальних вазоконстрикторів та інших факторів запалення можуть впливати на рівень АТ і погіршувати прогноз перебігу ГІМ у хворих із АГ. Доведений прямий взаємозв’язок між ступенем ендотеліальної дисфункції та негативним прогнозом перебігу ГІМ [8].
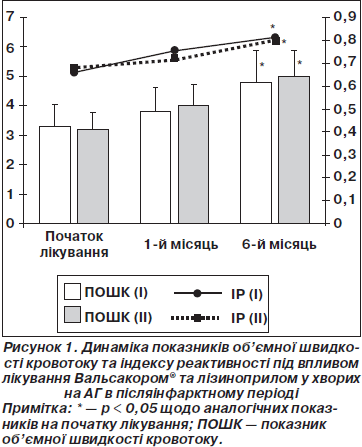
При сприятливому перебігу ГІМ внаслідок лікування ендотеліальна функція відновлюється, що видно на прикладі приросту об’ємної швидкості кровотоку та збільшення індексу реактивності (рис. 1).
В умовах підвищеного вмісту ангіотензину II на тлі блокади АТ1-рецепторів проявляються захисні властивості цього пептиду, що реалізуються за рахунок стимуляції АТ2-рецепторів і виражаються у вигляді вазодилатації, уповільненні проліферативних процесів. Крім того, на фоні підвищеного рівня ангіотензину I і II відбувається утворення ангіотензину-(1–7). Ангіотензин-(1–7) утворюється з ангіотензину I під дією нейтральної ендопептидази і з ангіотензину II під дією пролілової ендопептидази. Він є ще одним важливим ефекторним пептидом РААС, що справляє додаткову вазодилатуючу та натрійуретичну дію. Ефекти ангіотензину-(1–7), опосередковані через так звані АТx-рецептори, поки неідентифіковані [8].
Отримані експериментальні дані й результати окремих клінічних досліджень досить суперечливі. Можливо, на тлі блокади АТ1-рецепторів збільшується ендотелійзалежний синтез і вивільнення оксиду азоту, що сприяє вазодилатації, зменшенню агрегації тромбоцитів і зниженню проліферації клітин.
Додавання Вальсакору® або лізиноприлу до стандартної терапії сприяло скорішому відновленню функціонального стану ендотелію судин: збільшення приросту об’ємної швидкості кровотоку спостерігалося вже з перших днів прийому препаратів, на 30-й день цей показник в І та ІІ групах зростав відповідно на 24,9 та 26,1 % (р < 0,05) від вихідного рівня.
Недавні дослідження дисфункції ендотелію при артеріальній гіпертензії дозволяють припустити, що кардіоваскулярні ефекти блокаторів ангіотензинових рецепторів можуть бути також пов’язані з модуляцією ендотелію і впливом на продукцію оксиду азоту [7, 10].
Позитивні зміни ІР протягом 1 місяця лікування були дещо повільнішими (зростання на 17,4 % від вихідного в обох групах). У подальшому показники функціонального стану ендотелію продовжували зростати та наприкінці терміну спостереження (6 місяців) під впливом відповідної терапії, об’ємна швидкість кровотоку в І та ІІ групах збільшилася достовірно на 42,3 %, а ІР — на 23,1 % порівняно з даними при госпіталізації.
Наша практика показала, що додавання цільових доз Вальсакору® до стандартної терапії значно покращувало функцію ендотелію резистивних судин уже протягом перших тижнів лікування. Вазопротективна дія інгібітора рецепторів ангіотензину ІІ валсартан, пов’язана з блокадою АТ1-рецепторів і стимуляцією АТ2- і АТx-рецепторів, що супроводжується активацією В2-брадикінінових рецепторів і підвищеним утворенням оксиду азоту і простагландинів [11]. Під впливом препаратів цієї групи відбувається послаблення наявної у хворих на АГ, цукровий діабет і атеросклероз дисфункції ендотелію, що проявляється зменшенням вазоконстрикції та збільшенням вазодилатації.
Підвищення при СН рівня медіаторів запалення тісно корелює з погіршенням прогнозу. Їх негативна дія у хворих на ГІМ опосередкована активацією процесів ремоделювання.
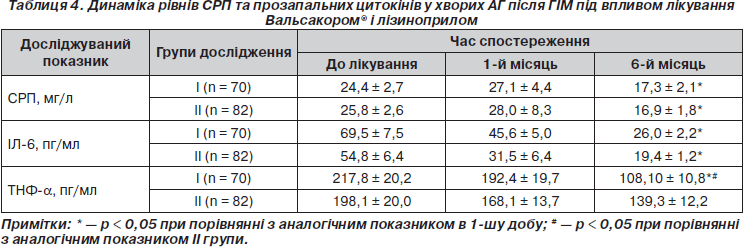
Вихідні значення СРП, ІЛ-6, ТНФ-a (табл. 4) були більше ніж утричі вищими порівняно з хворими на хронічну ішемічну хворобу серця аналогічного віку [4]. У процесі ефективного лікування показники прозапальної ланки цитокінів поступово зменшувались, набуваючи максимальної (достовірної) різниці наприкінці терміну дослідження. Необхідно відмітити, що ефективна терапія Вальсакором® за ефектом пригнічення таких факторів запалення, як СРП, ІЛ-6, не поступалася повнодозовому лікуванню ІАПФ. Разом із тим достовірні зміни рівня ТНФ-a спостерігались лише у хворих І групи: його значення зменшувалося на 40,6 % (р < 0,05) порівняно з хворими групи лізиноприлу (рис. 2).
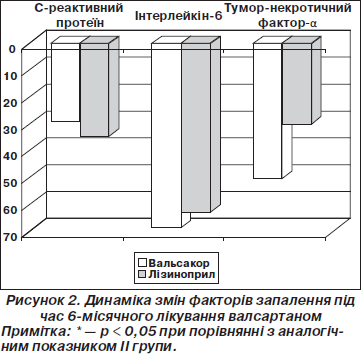
Griendling K.K., Marphy T.J., Wayne R. et al. (1993) раніше відмічали, що ангіотензин II безпосередньо моделює NF-kappa B у цитоплазмі зрілих фагоцитів, викликаючи початок транскрипції багатьох запальних хемокінів та цитокінів, включаючи ІЛ-1b, IЛ-6 та IЛ-8, MCP-1, CAM-1, IФН-g та ТНФ-a [7]. Механізм залучення ТНФ-б у процес дилатації лівого шлуночка пов’язаний з активацією та пошкоджуючою дією металопротеїназ. Активація останніх призводить до розчинення фібрилярного колагену, що огортає та зв’язує кардіоміоцити у волокна. Очевидно, це призводить до порушення структури міокардіальних волокон, деструкції та патологічного ремоделювання міокарда [9].
Негативне прогностичне значення підвищених рівнів прозапальних цитокінів відзначали й інші автори [1, 6].
У хворих із повторним ГІМ, а також померлих від серцево-судинних причин рівні СРП та ІЛ-6 були вищими в 2,1 та 1,5 раза відповідно, ніж у цілому по досліджуваній популяції.
Кардіотоксичний ефект СРП проявляється через активування системи комплементу в макроальбумінових комплексах, що призводить до змін іонної проникності мембран кардіоміоцитів [11]. Виникає підвищення внутрішньоклітинного вмісту кальцію та ушкодження клітини. Цей процес має провідне значення в патологічному ремоделюванні серця внаслідок ГІМ [4].
Таким чином, наше дослідження показало, що блокада рецепторів ангіотензину II за допомогою Вальсакору® редукує генерацію більшості вищенаведених цитокінів, і зокрема ТНФ-a, та гальмує запальний процес.
Хворі зазвичай краще переносили лікування Вальсакором®, ніж лізиноприлом. Найчастішим проявом негативної дії призначеного лікування була надмірна гіпотензивна дія, що супроводжувалася переважно загальномозковою симптоматикою. Вона відмічалася у 10 (14,3 %) хворих з І групи та 19 (23,2 %) — з другої (р = 0,17). Цей феномен переважно спостерігався протягом першого місяця лікування та вимагав тільки корекції дози препаратів.
Протягом 6 місяців лікування тільки у 2 (6,0 %) осіб з І групи зареєстрували погану переносимість призначеної терапії. В групі лізиноприлу цей показник у 2 рази був вищим (ВР 0,23; 95% ДІ 0,04–0,92; р = 0,033) (за Mantel — Haenszel).
За літературними даними, найбільш частими несприятливими ефектами БРА ІІ є головний біль, запаморочення, загальна слабкість. У нашому дослідженні ці симптоми спостерігалися у хворих, які приймали валсартан у дозі 320 мг на добу. Зменшення дози препарату в процесі титрування нівелювало неврологічні симптоми. Антагоністи ангіотензинових рецепторів не справляють прямого впливу на метаболізм брадикініну, субстанції Р, інших пептидів і внаслідок цього не спричиняють сухого кашлю, що нерідко з’являється при лікуванні інгібіторами АПФ. Як вже згадувалося, негіпотензивні побічні ефекти спостерігались в 11 (13,4 %) хворих, які приймали лізиноприл (табл. 3). Найбільш часто відмічався сухий кашель — у 4 (4,9 %) хворих та диспептичні розлади — у 3 (3,7 %) хворих. В інших 3 (3,7 %) хворих спостерігалося підвищення рівня креатиніну в півтора-два рази, що спонукало нас відмінити препарат у цих хворих. Іще в 1 хворого з ІІ групи відмічалася гіперкаліємія, що також потребувала корекції лікування. Треба зауважити, що решта 3 хворі страждали від супутнього цукрового діабету, ускладненого латентною нефропатією. Ми наголошуємо на приділенні особливої уваги контролю ниркової функції при призначенні високих доз ІАПФ лізиноприлу хворим на цукровий діабет, ускладнений нефропатичною протеїнурією. Протягом 6 місяців лікування кількість хворих із макропротеїнурією в ІІ групі зросла з 2 до 5 осіб, тоді як у групі Вальсакору® не збільшувалася. Більше того, в 1 хворого І групи з вихідною протеїнурією 0,102 г/л через 6 місяців гіпотензивного лікування Вальсакором® рівень білка в сечі зменшився втричі (до 0,033 г/л).
Враховуючи практичну доцільність, був розроблений композитний показник при використанні того чи іншого антигіпертензивного засобу — «користь/безпека», який включав випадки серцево-судинної смерті, реінфаркту, інсульту, кількість госпіталізацій внаслідок погіршення серцевої недостатності та частоту побічних ефектів протягом терміну дослідження.
Результати наведені на рис. 3.
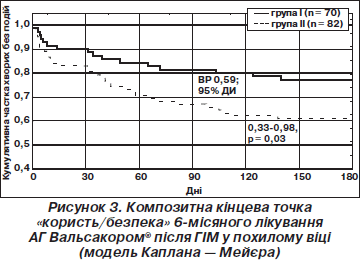
У шестимісячний термін композитна кінцева точка «користь/безпека» була визначена у 16 (22,9 %) хворих І групи та у 32 (39,0 %) другої (ВШ 0,46; 95% ДІ 0,24–0,99; р = 0,033). Цей факт означає, що відносний ризик розвитку випадків серцево-судинної смерті, реінфаркту, інсульту, кількість госпіталізацій внаслідок погіршення серцевої недостатності або частота побічних ефектів зменшується на 41 % (р = 0,03) при використанні в комплексній гіпотензивній терапії Вальсакору® замість лізиноприлу. Іншими словами, необхідно пролікувати 6 хворих на артеріальну гіпертензію з перенесеним ГІМ за допомогою Вальсакору® замість лізиноприлу, щоб попередити розвиток несприятливих подій в 1 хворого протягом 6 місяців.
Висновки
1. Гіпотензивна терапія блокатором рецепторів до ангіотензину ІІ Вальсакором® у дозі 244,6 ± 12,1 мг на добу не поступалася за ефективністю інгібітору ангіотензинперетворюючого ферменту лізиноприл у дозі 26,8 ± 2,6 мг на добу та сприяла зменшенню систолічного АТ на 28,7 ± 3,4 мм рт.ст., діастолічного АТ на 14,6 ± 2,6 мм рт.ст., максимально впливаючи на добову варіабельність систолічного АТ, достовірно знижуючи її на 49,3–61,8 % (ніч/день) та індекс часу діастолічного АТ.
2. Запобігання прогресуванню патологічного ремоделювання лівого шлуночка при використанні Вальсакору® у хворих на АГ в післяінфарктному періоді пов’язане перш за все із покращенням лівошлуночкової дисфункції: зростання фракції викиду на 8,3 % (р < 0,05), гальмування лівошлуночкової дилатації, яке було порівнянним з дією ІАПФ лізиноприл, та достовірне зменшення маси міокарда лівого шлуночка в 74,6 % хворих.
3. Призначення Вальсакору® або лізиноприлу активно впливало на динаміку прозапальних цитокінів, достовірно зменшуючи рівень показників системного запалення. Значення ТНФ-a протягом шестимісячного лікування зменшувалися достовірно краще саме в групі блокатора рецепторів до ангіотензину ІІ Вальсакор®.
4. Терапія Вальсакором® у хворих на АГ не гірше, ніж лізиноприлом, відновлювала ендотеліальну функцію судин у вигляді достовірного підвищення об’ємної швидкості кровотоку на 42,3 %, сприяла зростанню індексу реактивності судин на 23,1 % протягом 6-місячного лікування.
5. При відсутності побічних дій Вальсакор® у дозі 320 мг на добу краще переносився, ніж лізиноприл 40 мг на добу, особливо хворими з цукровим діабетом, ускладненим нефропатичним синдромом. На відміну від останнього Вальсакор® не впливав на розвиток нових випадків протеїнурії, сприяв зменшенню рівня білка в сечі, тим самим покращуючи прогноз лікування.
1. Амосова К.М., Чоп’як В.В., Рябцев О.В. та ін. Зміни показників системного запалення у хворих похилого віку з гострим інфарктом міокарда із зубцем Q під впливом лікування з включенням різних доз інгібітора ангіотензинперитворюючого ферменту // Український кардіологічний журнал. — 2005. — № 1. — С. 21-25.
2. Батушкін В.В. Вплив діротону у високих дозах на особливості перебігу гострого інфаркту міокарда без зубця Q у пацієнтів із супутньою гіпертонічною хворобою залежно від ступеня порушення функції ендотелію й тромбоцитарного гемостазу // Український медичний часопис. — 2005. — № 1. — С. 62-67.
3. Батушкін В.В., Мальчевський В.Л., Гема А.І. та ін. Спосіб діагностики порушення функціонального стану ендотелію периферичних артерій в осіб з гострим коронарним синдромом // Деклараційний патент на корисну модель 7425 7 А61В8/06 15.06.2005. Бюл. № 6. — С. 4-5.
4. Батушкин В.В., Мальчевский В.Л., Кузменко В.В. и др. Показатели функции левого желудочка и противовоспалительный эффект валсартана у больных с острым инфарктом миокарда пожилого и старческого возраста // Артериальная гипертензия. — 2009. — № 1 (приложение). — С. 11.
5. Батушкін В.В. Інгібітори ангіотензин-перетворюючого ферменту в корекції ендотеліальної дисфункції при гострому інфаркті міокарда без елевації сегменту ST // Український медичний альманах. — 2008. — № 5. — С. 15-18.
6. Пархоменко А.Н., Иркин О.И., Кушнир С.П. и др. Сравнительная оценка ингибиторов ангиотензинпревращающего фермента разных поколений у больных с острым инфарктом миокарда: влияние на процесс ранней дилатации полости левого желудочка сердца // Український кардіологічний журнал. — 2004. — № 3. — С. 26-29.
7. Flammer A.J., Steffel J. et al. Endothelium of vessels with hipertension: the target or a reason? // Hot topics in cardiolody / Ed. by S.D. Volta, P.A. Poole-Wilson. — 2009. — Issue 15. — Р. 9-19.
8. Griendling K.K., Marphy T.J., Wayne R. et al. Molecular biology of the rennin-angiotensin system // Clin. Invest. — 1993. — Vol. 87. — Р. 1816-1828.
9. Eleuteri E., DiStefano A., Genta F.T. et al. Stepwise increase of angiotensin II serum levels is related to haemodynamic and functional impairment in stable chronic heart failure // Cardiovascular prevention and rehabilitation. — 2011. — Vol. 18. — Р. 607-620.
10. Kurtz T.W. Молекулоспецифические эффекты блокаторов рецепторов ангиотензина, не связанные с их влиянием на РАС // Здоров’я України. — 2009. — № 3. — С. 1-3.
11. Mancia G., DeBacker G., Dominiczak A. et al. Guidelines for the management of arterial hypertension2007: Task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens. — 2007. — Vol. 5. — Р. 1105-1187.
12. Pfeffer M.A., McMurray J.J.V., Velazquez E.J. et al. Valsartan, Captopril, or Both in Myocardial Infarction Complicated by Heart Failure, Left Ventricular Dysfunction, or Both // N. Engl. J. Med. — 2003. — Vol. 13. — Р. 1893-1906.
13. Suzuki H., Geshi E., Nanjyo Sh. et al. // Inhibitory Effect of Valsartan Against Progression of Left Ventricular Dysfunction After Myocardial Infarction. T-VENTURE Study // Circ. J. — 2009. — Vol. 73. — Р. 918-924.
14. Tsutamoto T., Wada A., Maeda K. et al. Angiotensin II type receptor antagonists decreased plasma levels of tumor necrosis factor alpha, interleukin-6 and soluble adhesion molecules in patients with chronic heart failure // J. Am. Coll. Cardiovasc. — 2000. — Vol. 35. — Р. 714-721.
15. Verma S., Strauss M. Angiotensin receptor blockers and myocardial infarction // B.M.J. — 2004. — Vol. 329. — Р. 1248-1249.