Международный неврологический журнал 8 (46) 2011
Вернуться к номеру
Применение в практике врача скорой и неотложной помощи метаболических препаратов: эффективность и безопасность
Авторы: Данчинова А.А., Наумов А.В., Шамуилова М.М., Ховасова Н.О., ННПОСМП, г. Москва, Россия
Рубрики: Неврология
Версия для печати
Особенности отечественного опыта и системы здравоохранения определяют весьма надежную перспективу применения группы метаболических лекарственных препаратов в клинической практике. При этом следует отметить масштабность палитры показаний к применению этой группы лекарств: острые и хронические нарушения мозгового кровообращения, нейропатии (в т.ч. диабетическая автономная нейропатия и диабетическая дистальная полинейропатия), хронический болевой синдром, метаболическая энцефалопатия, пред- и постинтервенционное ведение тромболитических процедур и т.д.
Метаболические препараты, скорая помощь, догоспитальный этап, нейропатия, сахарный диабет, Актовегин, цитиколин, Цераксон, скорая медицинская помощь.
С позиций медицины, основанной на доказательствах, сегодня ни один препарат, претендующий на фармакологическую метаболическую, в частности нейропротективную, активность, за исключением цитиколина, не продемонстрировал своих преимуществ в широкомасштабных плацебо-контролируемых исследованиях. Однако это не может явиться поводом к отказу от назначения подобных средств как минимум в связи с многолетним отечественным опытом применения данных лекарственных препаратов (например, Актовегина) и большим числом российских и зарубежных открытых сравнительных проспективных исследований, демонстрирующих большую выживаемость, лучший уровень восстановления неврологического дефицита, снижение инвалидизации в группах пациентов, которым назначались метаболические средства. Другим аргументом является наличие у российского пациента коморбидных состояний, при которых назначение метаболической терапии играет важную роль в компенсации сопутствующей патологии.
При этом у большой группы метаболических препаратов, в частности нейрометаболических средств, существуют принципиальные различия в фармакологическом действии. Для понимания различий фармакологического действия необходимо представлять биохимические нарушения метаболизма клеток, в частности нейронов, приводящие к их гибели.
В целом для адекватного физиологического функционирования любой клетки, в том числе нейронов, принципиальным является адекватный энергетический статус, т.е. синтез 38 молекул АТФ.
Это возможно при наличии следующих условий:
1) адекватное поступление глюкозы в клетку;
2) адекватная утилизация кислорода клеткой;
3) низкий уровень активности свободных радикалов, образующихся в процессе окисления глюкозы. В норме высокая активность супероксиддисмутазы инактивирует свободные радикалы;
4) адекватное соотношение фосфолипидов мембраны для активности мембраны клетки и митохондрий.
При ишемии клетки различных органов и тканей, в частности нейронов, в надежде на восстановление нормального кровотока начинают приспосабливаться к условиям ишемии, в первую очередь перестраиваясь на анаэробное окисление глюкозы. Однако резервные возможности, исчерпав себя, приводят к апоптозу клетки.
Перестройка метаболизма клетки для анаэробного окисления глюкозы в общих чертах заключается в следующем:
1) системный синтез антиинсулиновых антител, блокирующих рецепторы к инсулину на мембране (физиологический смысл — уменьшить потребление глюкозы в условиях ишемии);
2) снижение числа и активности переносчиков глюкозы на мембране;
3) снижение активности пируватдегидрогеназы и замедление цикла Кребса (физиологический смысл — снизить потребление кислорода в условиях ишемии);
4) снижение активности супероксиддисмутазы, соответственно, увеличение числа свободных радикалов, повреждающих мембрану (физиологический смысл — «убить» больше клеток для снижения потребности в кислороде и глюкозе);
5) снижение синтеза фосфолипидов клеточной мембраны и нарушение ее транспортных и физиологических функций;
6) избыточное накопление возбуждающих аминокислот.
В соответствии с описанными патологическими изменениями формируется список требований к препаратам, претендующим на метаболическую, в частности нейропротективную, активность. В идеале лекарственный препарат должен обладать фармакологической активностью в отношении всех патологических изменений в метаболизме клетки при ишемии. Однако ни один из препаратов не отвечает полному списку требований.
Особо стоит остановиться на инсулиноподобном действии препаратов этой группы. Подчеркнем, что нарушение транспорта и утилизации глюкозы является ведущим патогенетическим механизмом апоптоза клетки. Подобным фармакологическим эффектом обладает лишь препарат Актовегин.
Активная фракция препарата оказывает инсулиноподобное действие. Об отличном от инсулина действии Актовегина свидетельствует то, что антитела к инсулину не блокируют этот эффект и не нарушают транспорт глюкозы, который под влиянием Актовегина усиливается в 5, а не в 10 раз, как под воздействием инсулина. Показано, что инсулиноподобное действие оказывают выделенные из Актовегина инозитолфосфат-олигосахариды (ИФО), активирующие переносчики глюкозы в плазматической мембране. К настоящему времени обнаружено 5 носителей глюкозы (GLUT 1–5).
Инсулиноподобное действие Актовегина было подтверждено и в клинических исследованиях. Так, в рандомизированное двойное слепое исследование, проведенное Heidrich и соавт. (1979), было включено 20 пациентов с сахарным диабетом и 20 лиц с нормальным метаболизмом углеводов. Исследовалось влияние на гликемию и сывороточный инсулин 14-дневного курса терапии Актовегином (0,5 мл/кг/день в/в), в качестве плацебо использовали эквивалентное количество физиологического раствора. У больных сахарным диабетом Актовегин значительно улучшал толерантность к глюкозе, не влияя на концентрацию сывороточного инсулина, при нормальном метаболизме углеводов содержание сахара в крови и инсулина сыворотки под воздействием Актовегина не изменилось.
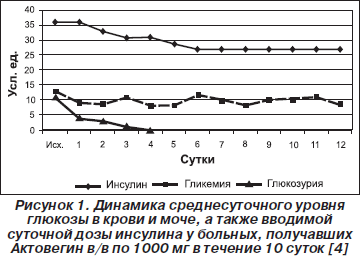
По данным В.Н. Оболенского и соавт. (2002), у пациентов с диабетической стопой (21 человек), которым проводилось внутривенное введение 1000 мг Актовегина, было отмечено снижение среднесуточного уровня гликемии с первых суток применения препарата, повлекшее за собой уменьшение суточной потребности в инсулине, а также купирование глюкозурии на 3-и сутки (рис. 1).
Одним из самых универсальных механизмов жизнедеятельности клетки и процессов, реализующихся в межклеточном пространстве, является образование свободных радикалов — неотъемлемых спутников окислительных реакций, обладающих мощной химической и биологической активностью.
Свободнорадикальное окисление следует рассматривать как необходимое метаболическое звено в окислительном фосфорилировании, биосинтезе простагландинов и нуклеиновых кислот, иммунных реакциях и т.д. В частности, свободные радикалы образуются в процессе перекисного окисления жирных кислот с изменением при этом физических свойств биологических мембран. Свободнорадикальное окисление является универсальным патофизиологическим феноменом при многих патологических состояниях, а также обязательной и существенной составляющей механизмов возрастных изменений организма и повреждающего действия хронического стресса.
Типичным явлением для всех перечисленных процессов является тканевый дефицит кислорода. При этом в условиях нарушений энергообразующих реакций и неполного восстановления кислорода происходит образование высокореактивных и потому токсичных свободных радикалов или продуктов, которые их генерируют. Патологическое воздействие свободных радикалов связано с их влиянием на структурно-функциональные характеристики биологических мембран, что приводит к нарушениям их естественной транспортно-защитной функции, повышению микровязкости, изменению проницаемости для различных ионов, а следовательно, изменениям в жизнедеятельности клетки и в дальнейшем — ее деструкции и гибели.
Особо опасны свободные радикалы для митохондрий, в частности митохондриальной ДНК (мтДНК). Поскольку митохондрии используют 85–99 % всего кислорода, потребляемого клетками, самые большие количества супероксидрадикала образуются именно в них. В результате отмечается окислительное повреждение молекулы мтДНК и, соответственно, повышение вероятности развития мутаций.
Исключительно важны упомянутые процессы для головного мозга ввиду последствий повреждения ДНК в постмитотических клетках, каковыми являются нейроны.
Повышенная продукция свободных радикалов — одна из существенных причин длительного спазма церебральных сосудов, прогрессирования постишемического отека и дегенерации нейронов вследствие нарушения целостности мембран.
В последнее время оксидативный стресс рассматривается как один из ведущих факторов патогенеза поражения головного мозга при сосудистых, метаболических и дегенеративных заболеваниях.
Именно антиоксидантная фармакотерапия является одним из оптимальных направлений развития стратегии нейропротекции, поскольку позволяет обеспечить защиту нейронов от действия универсальных повреждающих факторов, лежащих в основе большинства клинических форм патологии ЦНС.
По механизму действия все препараты с антиоксидантными и антигипоксантными свойствами делятся на первичные, препятствующие образованию новых свободных радикалов (это преимущественно средства ферментной природы), и вторичные, способные захватывать уже образовавшиеся радикалы, то есть работающие по принципу «ловушки» (scavengers). В настоящее время, несмотря на свою перспективность, прямые антиоксиданты редко используются в клинической практике вследствие быстрой инактивации ферментов, большого молекулярного веса и неспособности проникать через гематоэнцефалический барьер, высокого риска развития побочных эффектов.
В связи с этим наиболее широкое применение в практической медицине нашли антиоксиданты с непрямым механизмом действия. Единой классификации непрямых антиоксидантов на сегодня не существует. В настоящее время в клинической практике применяются витамин Е (токоферол) и его синтетические аналоги (азотокоферол и др.), ароматические фенолы и полифенолы (ионол, пробукол, дибунол), пептидные препараты (карнозин), органические кислоты и их производные (аскорбиновая, тиопропионовая, ретиноевая, липоевая и др. кислоты), коэнзим Q (убихинон) — каротин, производные 3-оксипиридина (эмоксипин, мексидол), производные мочевины (мебикар), фитопрепараты (препараты гинкго) и т.д.
Детальная характеристика фармакологического действия метаболических препаратов, в частности нейропротекторов, в отношении свободнорадикального окисления является особо важной. В литературе описана активность в отношении супероксиддисмутазы лишь небольшого числа препаратов.
При этом Актовегин обладает самым мощным стимулирующим эффектом в отношении активности супероксиддисмутазы.
Обсуждая проблему метаболических препаратов, нельзя не остановиться на препарате цитиколин (Цераксон, «Никомед»). Этот препарат имеет наиболее существенные доказательства эффективности при разных формах острого нарушения кровообращения.
Цитиколин — эндогенное вещество, промежуточный продукт в синтезе фосфатидилхолина — одного из основных структурных компонентов клеточной мембраны, в т.ч. нейрона.
В условиях ишемии под действием фосфолипаз, активированных резким повышением концентрации кальция в клетках, фосфатидилхолин распадается с образованием свободных жирных кислот (в том числе арахидоновой кислоты) и свободных радикалов, что ведет к перекисному окислению липидов и окислительному стрессу. Цитиколин в результате гидролиза в стенке кишечника и печени распадается на свои основные компоненты цитидин и холин, которые попадают в системный кровоток и участвуют в различных метаболических процессах. Они пересекают гематоэнцефалический барьер, после чего в клетках мозга из них вновь ресинтезируется цитиколин.
Экспериментальные данные свидетельствуют, что цитиколин оказывает плейотропный эффект при ишемии мозга, противодействуя прогрессированию ишемического повреждения тканей. Цитиколин, как источник фосфатидилхолина, участвует в репарации клеточных мембран, восстанавливая его уровень в нейронах, подвергнутых ишемии в экспериментах in vitro. Кроме того, было показано, что введение цитиколина в условиях ишемии восстанавливает уровни фосфолипида клеточной мембраны сфингомиелина и структурного фосфолипида внутренней мембраны митохондрий кардиолипина, разрушение которых происходит при участии активированной фосфолипазы А2 (И.М. Шетова, 2009).
С мембранотропным действием препарата может быть связана его способность восстанавливать активность Na+/K+-насосов. Кроме того, цитиколин может способствовать повышению уровня глутатиона и активности глутатионредуктазы, усиливая активность антиоксидантных систем. Благодаря снижению проницаемости гематоэнцефалического барьера препарат может способствовать уменьшению выраженности отека мозга, играющего важную роль в развитии вторичного повреждения мозга.
Нейропротекторный эффект может быть связан и со снижением выброса глутамата, что ослабляет ишемический каскад на его ранней стадии.
На экспериментальных моделях фокальной ишемии продемонстрирована способность цитиколина снижать активацию прокаспаз, что противодействует процессам апоптоза. Проведенное в эксперименте совместное введение цитиколина и тромболитика привело к снижению смертности животных по сравнению с одной тромболитической терапией и продемонстрировало способность цитиколина уменьшать выраженность реперфузионного повреждения мозга. Важное значение при ОНМК может также иметь способность цитиколина усиливать активность холинергической, дофаминергической и нор-адренергической систем, что на этапе восстановления функций способно усиливать процессы пластичности и уменьшать выраженность нейропсихологических нарушений (О.С. Левин, 2008).
Цитиколин (Цераксон) представляет собой препарат, дающий реальную и доступную возможность повлиять на исход инсульта, причем наиболее эффективным такое вмешательство является у пациентов с умеренным или тяжелым инсультом. Цитиколин — один из наиболее изученных нейропротекторных препаратов, в отношении которого накоплен большой опыт клинического применения у пациентов различного возраста и с различной церебральной патологией. Он обладает благоприятным профилем безопасности и переносимости, а также доказанной в крупных контролируемых исследованиях клинической эффективностью при лечении пациентов с ишемическим инсультом. Ввиду безопасности применения цитиколина в первые часы умеренного и тяжелого геморрагического инсульта препарат может использоваться уже на догоспитальном этапе в отсутствие данных нейровизуализации (М.А. Пирадов, 2010).
Резюмируя приведенные сведения, отметим, что наиболее адекватное действие на комплекс метаболических нарушений в клетках разных органов и тканей, в том числе нейронов, при ишемии (т.н. инсульт, причем вне зависимости от того, ишемический он или геморрагический) оказывают Актовегин и цитиколин (Цераксон), который непосредственно влияет на энергетическое обеспечение клеток в условиях гипоксии.
Существует множество мнений большинства экспертов-неврологов о совместном применении Актовегина и цитиколина в качестве недифференцированной терапии ОНМК вне зависимости от формы. Это обусловлено в первую очередь дополняющими эффектами обоих препаратов.
Такое сочетание открывает значительную перспективу патогенетической терапии на этапе СМП в отсутствие доступных методов визуализации.
Впервые опубликовано в журнале «Врач скорой помощи», 2011, № 1
