Международный неврологический журнал 8 (46) 2011
Вернуться к номеру
Современная интерпретация альфа-активности ЭЭГ1
Авторы: Базанова О.М. Учреждение РАМН Научно-исследовательский институт молекулярной биологии и биофизики Сибирского отделения РАМН, г. Новосибирск
Рубрики: Неврология
Версия для печати
На настоящий момент известно, что ни один из ритмов ЭЭГ не имеет такой функциональной значимости, как осцилляции альфа-частотного диапазона. Это заключение сделано на основе многочисленных результатов экспериментальных исследований, теоретических расчетов и изучения взаимосвязи между показателями функциональной магнитно-резонансной и позитронно-эмиссионной томографии и ЭЭГ. Однако великое множество литературных данных изучения роли альфа-осцилляций в механизмах переработки и восприятия информации, произвольного контроля когнитивных и физиологических функций порождает терминологические проблемы в установлении соответствия между изучаемыми феноменами даже в определении самого понятия «альфа-активность ЭЭГ». Более того, до настоящего времени существует пробел в наших знаниях о взаимосвязи феномена альфа-активности ЭЭГ и клеточно-молекулярных механизмов генерации, формирования и появления альфа-волн на электроэнцефалограмме. С целью определения природы и признаков ЭЭГ характеризуют альфа-активность. Для определения психофизиологического значения был предпринят анализ современных данных из 108 литературных источников, а также результатов собственных экспериментов, обобщенный в данном обзоре.
ЭЭГ, индивидуальная альфа-частота, зрительная активация, супрессия альфа-амплитуды, ширина индивидуального альфа-диапазона, длительность и вариабельность амплитуды альфа-веретена.
Введение
Известно, что ни один из других видов электрических осцилляций мозга от 10–2 до 103 Гц не имеет такой функциональной значимости в процессах внимания, памяти, эмоций и мотивации, как веретенообразные осцилляции в диапазоне 5–15 Гц2 (Иваницкий, 1997; Ливанов 1989; Nunez et al., 2001). Показано, что функциональное ядро, организующее биоэлектрическую активность мозга в других частотных диапазонах, формируется осцилляциями, обладающими альфа-активностью (Martнnez-Montes et al., 2004; Klimesch et al., 2007). Однако до сих пор не выяснено, какие именно количественные признаки электроэнцефалограммы характеризуют флуктуации альфа-активности: увеличение или снижение частоты, рост или депрессия амплитуды, синхронность или десинхронизация фаз колебаний и в каком частотном диапазоне они проявляются. Кроме того, в связи с тем что не до конца ясно, какие нейрофизиологические механизмы лежат в основе феномена альфа-активности, трудно интерпретировать психологические корреляты ЭЭГ-признаков альфа-активности, тем более в некоем стандартизованном частотном диапазоне.
Цель настоящей работы — на основе анализа современных данных литературы и результатов собственных экспериментов определить, какова природа альфа-активности, какие признаки ЭЭГ ее характеризуют и каково их психофизиологическое значение.
Феномен «альфа-активность ЭЭГ»
В 1966 г. Грей Уолтер высказывал предположение, что существует большое разнообразие альфа-ритмов, которые отличаются по амплитуде в зависимости от локализации в коре, наличию или отсутствию блокады амплитуды при открывании глаз или при умственной нагрузке (Уолтер, 1966). Для частотных компонентов ЭЭГ такого типа употребляется выражение «семейство альфа-ритмов», куда включают: а) классический теменно-затылочный визуальный альфа-ритм (Adrian & Mathew, 1934; Kirschfeld, 2005); б) ритм, чувствительный к проприоцептивным раздражениям, называемый либо ролландическим (Зенков, 1996), либо сенсомоторным (Sterman, 1996 ), либо мю (Гусельников и Изнак,1983; Muthukumaraswamy et al., 2004), либо временно появляющимся «третьим» (Neidermayer,1993–1997), или лямбда-ритмом (Schomer, 2007); в) сонные веретено- образные волны (Ishii & Dziewas, 2001; Nunez et al., 2001). Кастро-Аламанкос и соавторы предпочитают не использовать термины «альфа-волны» или «сенсомоторный ритм», обозначая такие колебания как «приблизительно десятигерцевые осцилляции моторной коры» (Castro-Alamancos et al., 2007). Недавно гонконгскими исследователями Фонг была описана ритмическая альфа-подобная активность мозга в необычных диапазонах: при медленных (4–5 Гц) и быстрых (16–20 Гц) частотах ЭЭГ (Fong & Fong, 2001). Чапман и Лакелли называют ритм диапазона 4–12 Гц, зарегистрированный в гиппокампе, тета-ритмом (Chapman & Lacaille, 1999), а Моретти и соавторы тот же частотный диапазон, зарегистрированный в затылочных областях, называют альфа-ритмом (Moretti et al., 2004). Само существование семейства альфа-ритмов без четко определенных частотных и топографических границ приводит к предположению, что не только амплитуда и мощность осцилляций в неком стандартном диапазоне характеризуют альфа-активность, но и индивидуальное сочетание нескольких физических характеристик волнового процесса, имеющего четко определенную физиологическую значимость.
Изначально Ганс Бергер (1873–1941) определил альфа-активность как: 1) ритмический компонент ЭЭГ, частота которого лежит в интервале между 8 и 12 Гц; 2) колебания с наибольшей амплитудой в затылочной области коры, которые снижаются по амплитуде при открывании глаз и любых когнитивных нагрузках (Adrian & Matthews, 1934). В 1979 году группа чешских исследователей при анализе эффективности альфа-стимулирующего тренинга биоуправления установила, что доминирование по амплитуде в теменно-затылочной области может быть критерием для оценки альфа-активности только в случае, если параллельно оценивать длину альфа-веретена (Lansky & Bohdaneck, 1979). Теоретические расчеты (Осовец, 1983; Русинов и др., 1987; Hooper, 2005; Kirschfeld, 2005–2008; Tenke & Kayser, 2006) и анализ молекулярно-клеточных механизмов генерации альфа-осцилляций (Sherman & Guillery 2006; Steriade et al., 2001; Timofeev & Bazhenov, 2005) дали основание считать, что одной из наиболее информативных феноменологических характеристик альфа-активности является авторитмичность или веретенообразная организация этих волн (Ливанов, 1989; Каплан, 2005, Timofeev & Bazhenov, 2006).
Таким образом, в современной литературе термин «альфа-ритм» применяется к любым компонентам ЭЭГ со следующими характеристиками: 1) частота доминирующего ритма ЭЭГ в теменно-затылочной области; 2) веретенообразность колебаний и 3) снижение амплитуды при реакции зрительной и когнитивной активации (Ливанов, 1989; Barry et al., 2007; Klimesh et al., 2007; Nunez et al., 2001; Thatcher et al., 2008) (рис. 1).
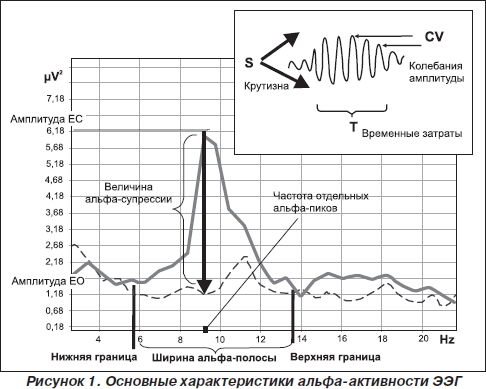
Природа альфа-осцилляций
Очевидно, что вышеперечисленные феноменологические характеристики альфа-активности обусловлены уникальной природой альфа-колебаний. Описание природы волнового процесса предполагает выяснение источника его генерации. В 1968 году П. Андерсен и С. Андерссон пришли к заключению, что ядра таламуса являются первичным генератором всех видов ритмической веретенообразной активности мозга (Andersen & Andersson, 1968). С тех пор исследователи добавили к гипотезе таламического источника генерации альфа-осцилляций только то, что в различных ядрах таламуса возникают веретенообразные электрические волны приблизительно раз в 100 мс, которые через таламокортикальные волокна формируют ритмическую активность соответствующих зон коры, так называемые кортикальные двойники (Andersen & Andersson, 1968; Jones et al., 2000; Contreras et al.,1997; Sherman S.M., Guillery R.W), и что эти волновые вспышки в каждой области коры контролируются определенным ядром таламуса (Hughes & Crunellia, 2007; Schreckenberger et al., 2004). Отличием таламических релейных клеток, в которых возникают эти волны, от других нейронов является повышенная плотность кальциевых T-каналов на мембранах поверхности клетки и эндоплазматической сети (Berridge et al., 2003; Sherman & Guillery, 2006). Установлено, что кальциевые каналы Т-типа, регулируя концентрацию кальция, могут тормозить передачу сигнала активации через таламус и тем самым стабилизировать состояние покоя (Page et al., 2006). Внутриклеточный кальциевый ток производит временную деполяризацию мембраны клетки с частотой приблизительно 10 раз в секунду, поскольку рефрактерность активации кальциевых каналов составляет приблизительно 100 мс (то есть это частота альфа-волн) Эти экспериментальные данные подтвердили гипотезу, выдвинутую М.Н. Ливановым в середине XX века и позднее лауреатом нобелевской премии Дж. Экклсом, о том, что организация ритмической активности мозга обусловлена рефрактерными свойствами возбуждения кальциевого тока, определяющими частоту ритмического разряда нейронов (Ливанов, Eccles, 1994). Таким образом, частота изменения концентрации кальция в цитоплазме нейрона является ключевым звеном изменения частоты альфа-активности мозга (Luthi et al., 1998).
1. Частота альфа-ритма. Наследуемость частоты доминантного ритма ЭЭГ и его межиндивидуально типологическая изменчивость доказаны многими исследованиями (Anokhin et al., 2006; Nunez et al., 2001; Smit et al., 2006; Thatcher et al., 2008). При этом среди разных показателей частоты альфа-активности (средней, средневзвешенной в альфа-диапазоне и частоты максимального пика) только индивидуальная частота максимального пика отражает единый агрегированный ресурс альфа-активности, а частоты других спектральных пиков из диапазона осцилляций, обладающих альфа-активностью, определяются интенсивностью стимула и длительностью его воздействия (Hooper, 2005). Грег Хупер теоретически рассчитал, что статистическое поведение величины индивидуальной частоты максимального альфа-пика в состоянии покоя в наибольшей степени соответствует законам нормального распределения по сравнению с показателями средней частоты и средневзвешенной в альфа-диапазоне (Hooper, 2005). Наши данные экспериментально подтверждают это положение (Базанова, 2010). Действительно, индивидуальная частота максимального спектрального пика альфа-ритма в задних отделах головного мозга в состоянии покоя с закрытыми глазами — показатель инвариантный, высоковоспроизводимый в тест-ретест-исследованиях и составляет 10,0 ± 0,5 Гц у большинства индивидов 25–40 лет (Bazanova, 2008a, Базанова, 2011; Kaiser, 2005; Nuwer, 2003; Thatcher et al., 2008). Наиболее вероятной причиной генетической детерминированности альфа-частоты является структурная организация кальциевых каналов, которая определяет частоту альфа-осцилляций (Anderson et al., 2005). Связь частоты генерации веретенообразных альфа-осцилляций со структурными носителями генетической информации — нуклеиновыми кислотами была продемонстрирована в 1965 году М.Б. Штарком (Штарк М.Б, 1965). Оказалось, что для лиц, отличающихся по показателю частоты максимального пика альфа-активности, характерны разные поведенческие стратегии (Базанова и Афтанас, 2006; Jin et al., 2006; Regehr & Kaplan, 1988). Однако наряду с этим установлена внутрииндивидуальная вариабельность частоты максимального пика альфа в зависимости от факторов возраста (Строганова и Цетлин, 1998; Bazanova, 2008a; Clarck et al., 2001), нейрогуморального статуса (Bazanova et al., 2008b; Creutzfeldt et al., 1976; Kamijo & Murakami, 2009; Korol, 2004; Tops et al., 2006), характера психофармакологического воздействия (Tops et al., 2006), выраженности процессов утомления (Kamei et al., 2000) (рис. 2 и 3). При этом беглость выполнения когнитивных (Doppelmayr et al., 2005; Klimesh et al., 2007; Moretti et al., 2007) и психомоторных заданий (Базанова и др., 2008; Hummel et al., 2004), а также степень владения профессиональными навыками (Базанова и др., 2008; Кураев и др., 2006) выше у лиц с высокой (> 10 Гц), чем с низкой (< 10 Гц) альфа-частотой. Вышеперечисленные внутрииндивидуальные флуктуации альфа-частоты обусловлены влиянием эпигенетических факторов, осуществляемым либо посредством воздействия на активность кальциевых каналов (Riegel & Williams, 2008), либо на процессы фосфорилирования протеинкиназ, участвующих в биосинтезе кальциевых каналов (Koulen et al., 2008), либо через действие на активность нейрональных рецепторов (Huang et al., 2007). При этом механизм формирования альфа-осцилляций, переданных посредством ионотропных рецепторов, иной, чем посредством метаботропных рецепторов (Pin & Duvoisin, 1995) — блокирование ионотропных рецепторов, через которые осуществляется генерация веретеноподобных волн, инициирует проведение осцилляций через метаботропные рецепторы (Lukatch et al., 2005). Метаботропные рецепторы, составляя 90–95 % синаптических входов, имеют проекцию по типу обратной связи в шестом слое коры и в стволовой ретикулярной формации (Pin & Duvoisin, 1995). Этим объясняется их ключевая роль в процессах торможения или так называемого нисходящего контроля (Klimesh et al., 2007). Так, недавними исследованиями П. Эмсона было продемонстрировано, что у нокаутных мышей по субъединицам метаботропных ГАМК-Б-рецепторов, как и ожидалось, нарушаются процессы их ингибиторного эффекта на активность кальциевых каналов, соответственно, отсутствует период рефрактерности, увеличивается частота и нарушается веретенообразность альфа-осцилляций (Emson, 2007).
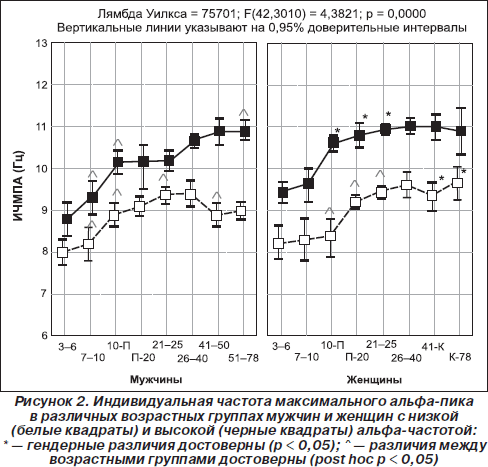
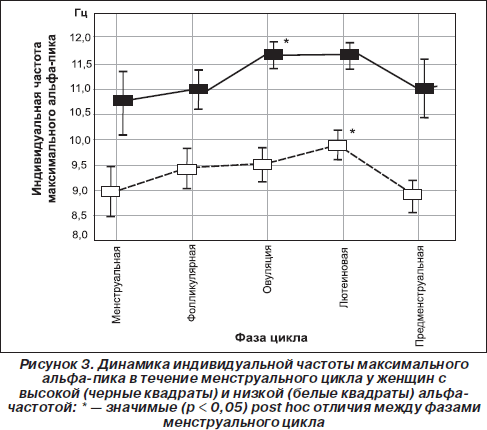
Интересно, что и сама частота нейрональных осцилляций может влиять на мембранную проводимость и чувствительность рецепторов к нейрогуморальным стимулам (Chi Ping et al., 2003; Destexhe & Sejnowski, 2003). Так, Чи Пинг и соавторы показали, что процесс эстрогеновой активации специфической Са2+-кальмодулинзависимой протеинкиназы, влияющей на частоту колебания концентрации кальция, линейно зависит от частоты входящих импульсов (Chi Ping et al., 2003). Возможно, поэтому повышение индивидуальной альфа-частоты при овуляции (когда происходит резкое увеличение концентрации эстрогенов) наблюдается только у женщин с высокой (≥ 10 Гц) альфа-частотой. А у женщин с низкой (< 10 Гц) альфа-частотой повышение частоты максимального пика происходит только на лютеиновой фазе (рис. 3), что наиболее вероятно связано с увеличением концентрации прогестерона (Baker et al., 2007; Bazanova et al., 2008b; Creutzfeldt et al., 1976). Другим примером того, что внутрииндивидуальные флуктуации альфа-частоты проявляются по-разному в зависимости от альфа-частотного паттерна ЭЭГ, является влияние возраста: снижение индивидуальной частоты альфа-пика после сорока лет происходит только у низкочастотных, но не наблюдается у высокочастотных испытуемых (Bazanova, 2008a). Это снижение тем более выражено, чем более ослабляются когнитивные способности (Сlarck et al., 2004) и увеличиваются показатели артериального давления (Bazanova, 2008a) (рис. 3).
Таким образом, в основе внутрииндивидуальной изменчивости частоты альфа-пика лежат механизмы молекулярной и структурно-рецепторной организации генерации и проведения импульса. В состоянии покоя индивидуальная частота максимального альфа-пика ЭЭГ отражает генетически детерминированные особенности структурной и молекулярной организации нейронов, а внутрииндивидуальная вариабельность этого показателя — изменения в кортикально-таламических и нейрогуморальных взаимодействиях, которые, в свою очередь, зависят от уровня индивидуальной частоты в состоянии покоя.
Возникает вопрос: отражаются ли генетически детерминированные различия по индивидуальной частоте максимального пика на других характеристиках альфа-активности?
2. Веретенообразность (авторитмичность) альфа-осцилляций отражает способность нейронных популяций к самонастройке или «модуляции фазы» — подстройке частоты осцилляций данного нейронального ансамбля к частоте другого, и тем самым координации их деятельности (Ливанов, 1989; Осовец, 1983). С.М. Осовец с соавторами (1983) на основании теоретических расчетов предположил, что взаимодействие ряда таких осцилляторов приводит к амплитудной и частотно-фазовой модуляции, поэтому веретена альфа-ритма носят нерегулярный характер и длительность их меняется в довольно широких пределах (Осовец, 1983; Kirschfeld, 2005; Лебедев и Луцкий, 1972; Каплан и др., 2002). При этом связи между отдельными осцилляторами внутри данного диапазона частот, очевидно, таковы, что система еще не входит в стохастический режим, но уже вышла из периодического. Такой процесс полностью соответствует современным представлениям о существовании промежуточных состояний при переходе от периодического к стохастическому процессу (или, на языке гидродинамики, — от ламинарного течения к турбулентному) (Осовец, 1983; Kirschfeld, 2005), что является следствием различной передачи импульсов, генерируемых по залповому или тоническому типу (Sherman & Guillery, 2006). Поскольку залпы или веретенообразные волны лучше распознаются корой и вызывают кортикальную активацию, их представляют как стимулы пробуждения — wake-up call коры, что может быть полезным для автоматически выполняемых действий (Steriade, 2001). Как только затрагиваются процессы внимания, начинает работать тонический запуск, для того чтобы максимизировать безукоризненную передачу информации по таламо-кортикально-таламическим цепям (Sherman & Guillery, 2006). На основании экспериментальных данных И. Тимофеев и М. Баженов пришли к заключению, что способность клеток продуцировать веретенообразные осцилляции зависит как от вида клеток, так и от условий, при которых эти осцилляции генерируются (Timofeev I., Bazhenov, 2005; Berridge et al., 2003).
До недавнего времени предполагалось, что сонные веретена и веретена альфа-осцилляций — совершенно разные феномены (Lopes da Silva, 1991, Steriade et al., 1990). Недавние работы, однако, показали, что залповый вид генерации колебаний отмечается не только во время сна, но и при бодрствовании ( Sherman & Guillery, 2006). C одной стороны, веретена ассоциируются с тормозящими процессами в таламусе и могут рассматриваться как входной механизм для блокирования процесса обработки информации из внешнего мира (Bazhenov et al., 2000; Berridge et al., 2003), а с другой, наоборот, выполняют роль зондирующего или контролирующего механизма связи организма с окружающей средой (например, веретенообразная электрическая активность мозга, отмечаемая с периодичностью раз в сутки у зимнеспящих животных (Штарк, 1970)).
Таким образом, наличие хорошо выраженных альфа-веретен на ЭЭГ свидетельствует об отлаженности адаптивных механизмов восходящего и нисходящего контроля (Giesbrecht et al., 2006), а их исчезновение сигнализирует о нарушениях механизмов контроля сенсомоторной интеграции у больных со спинальными травмами при отсутствии афферентации (Middleton et al., 2004) или при маниакально-депрессивном синдроме шизоидного типа (Каплан и др., 2005). Наши результаты свидетельствуют о том, что достижение успеха в тренинге оптимального психомоторного функционирования с помощью биоуправления соотносится с увеличением длительности и амплитуды альфа-веретена (Bazanova et al., 2008c). Как и ожидалось, вследствие различия формирования веретен при разных типах генерации и, соответственно, разной частоте импульсов мы отмечаем U-образную зависимость длительности веретенообразных сегментов от индивидуальной альфа-частоты. Самые короткие веретена отмечаются у лиц с крайне низкими и с крайне высокими значениями частоты альфа-пика (рис. 4). Эти же испытуемые со значениями индивидуальной частоты альфа-пика, наиболее отклоняющимися от среднего уровня, характеризуются наиболее высокими показателями оригинальности решения заданий в тесте Торренса (Базанова и Афтанас, 2007). Аналогичную инвертированную U-образную зависимость средней длины веретена альфа-ритма от его доминирующей частоты отметили А.Н. Лебедев и его сотрудники (Мальцева и Маслобоев, 1996). Предполагается, что более длительные альфа-веретена свидетельствуют о большей эмоциональной устойчивости и уравновешенности индивидов (Базанова и Афтанас, 2007, Лебедев и др., 2002). По данным А.Н. Лебедева, такие люди более дружелюбны и менее доминируют в межличностном общении (тест О. Лири), характеризуются большей гибкостью мышления, легкостью переключения с одного вида деятельности на другой и стремлением к разнообразию форм деятельности (Лебедев и др., 2002). Интересно, что у лиц с разной частотой альфа-активности в состоянии покоя с закрытыми глазами (то есть с различными молекулярно-генетическими механизмами генерации и передачи импульсов) веретна формируются и живут за счет различных механизмов, то есть одинаковая длительность альфа-веретена коррелирует с разными ЭЭГ-характеристиками (Bazanova et al., 2008c): у испытуемых низкочастотной группы длительность веретена тем больше, чем больше вариабельность амплитуды внутри веретена, а в высокочастотной группе — чем шире частотный диапазон, включаемый в реакцию активации. Что касается другой микроструктурной характеристики веретена — вариабельности амплитуды, которая свидетельствует о более интенсивном процессе фазовых перестроек (Oprisan et al., 2004), было обнаружено, что наиболее высокий коэффициент вариабельности и более широкий альфа-частотный диапазон на энцефалограмме покоя отмечается у лиц, характеризующихся более высокими коэффициентами невербальной креативности Торренса (Базанова и Афтанас, 2007–2008), а также у музыкантов, обладающих наиболее высоким уровнем исполнительского мастерства (Bazanova et al., 2003).
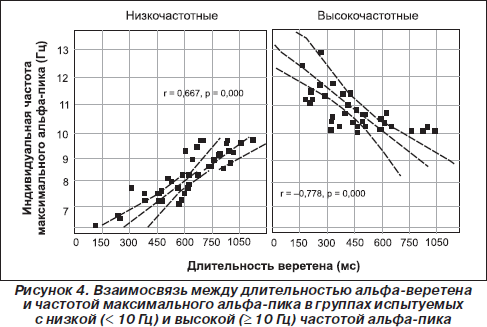
Таким образом, важнейшей особенностью альфа-осцилляций является их веретенообразность, или высокая фазическая изменчивость, отражающая динамику ансамблевой организации корковой нейронной активности. При этом 1) длительность веретена соотносится со временем жизни нейронного ансамбля, что может служить маркером когнитивной работоспособности, эмоциональной устойчивости; 2) внутрисегментная амплитудная вариативность или интенсивность фазовой перестройки в рамках ансамбля соответствует поиску оптимальных условий контроля процессов восходящей и нисходящей информации и свидетельствует об уровне креативности; 3) крутизна межсегментных переходов позволяет судить о скорости формирования или распада нейронных ансамблей.
Наконец, третья функциональная особенность альфа-осцилляций, которая была описана еще в 1934 г. Е. Эдриан и Б. Матьюс, — это снижение амплитуды альфа-волн в ответ на открывание глаз, названное Berger effect (Adtian & Matthew, 1934). Роберт Барри предложил для обозначения реактивности альфа-ритма на зрительную стимуляцию использовать термин «активация» (Barry et al., 2007). Глубина снижения альфа-амплитуды ЭЭГ принимается за интенсивность активации (Barry et al., 2007) (рис. 1). Установлено, что сила реакции активации меньше у испытуемых в состоянии покоя по сравнению с условиями, при которых необходим процесс внутренней переработки информации (Cooper et al., 2006). Поскольку было показано, что длительная зрительная стимуляция не только вызывает потенциал действия, но и снижает чувствительность нейронов к свету (Kirschfeld, 2008; Lansky et al., 1979), длительность супрессии альфа-амплитуды при открывании глаз является одним из информативных признаков стабильности реакции активации и вместе с глубиной десинхронизации соотносится с эффективностью интеллектуальной деятельности (Shmelkina, 1999; Stipacek et al., 2003). Неудивительно, что ряд исследователей используют показатели супрессии амплитуды в ответ на открывание глаз в качестве индивидуально-типологических признаков, имеющих отношение как к общей адаптивности (Arikan et al., 2006; Bazanova et al., 2003), так и к формированию изменений когнитивной деятельности (Alexander et al., 2006; Stipacek et al., 2003) и успешности в обучении с использованием адаптивной обратной связи (Базанова и др., 2007; Shmelkina, 1999). Так же, как другие характеристики альфа-активности ЭЭГ, процесс активации, с одной стороны, в значительной мере определяется генетическими факторами (Малых и др., 1998; Anokhin et al., 2006), а с другой — варьирует в зависимости от возраста (Andersonr et al., 2005; Bazanova et al., 2008а), нейрогуморального статуса (Bazanova et al., 2008b; Goldstein et al., 2005) и частоты доминирующих альфа-осцилляций (Gebber et al., 1999; Mazaheri and Jensen, 2006). Однако утверждение, что амплитуда альфа-ритма снижается только вследствие стимуляции светом, становится сомнительным, когда открывание глаз в абсолютно темной комнате также сопровождается снижением амплитуды альфа-осцилляций, и не только в зрительной коре (Klimesch et al., 2001; Toscani et al., 2010). Согласно данным М. Мусманн и соавторов, снижение альфа-амплитуды в темной комнате происходит не вследствие первичной сенсорной стимуляции, а, что более вероятно, отражает нисходящее контролирующее влияние коры (Moosmann et al., 2003). Депрессия амплитуды линейно зависит от активности рецепторов, величины стимула и, соответственно, типа генерации (Sherman & Guillery, 2006). Поэтому ЭЭГ-ответы на зрительную стимуляцию могут быть как аддитивными, так и являться результатом фазовой перестройки (David et al., 2005; Kirschfeld, 2005, 2008). Эти различные механизмы активации мы наблюдаем у лиц с разной частотой альфа в состоянии покоя. Множественный регрессионный анализ показал, что сила реакции зрительной активации у низкочастотных испытуемых была тем больше, чем больше амплитудная вариативность альфа-веретена (то есть интенсивность фазовых перестроек), а у высокочастотных — чем выше амплитуда альфа-осцилляций (Bazanova et al., 2008c).
На основании вышесказанного можно предположить, что изучение реакции на зрительную стимуляцию позволяет выявить индивидуальные частотные компоненты ЭЭГ, которые обладают альфа-активностью и которые, соответственно, можно назвать альфа-ритмом. Однако до настоящего времени определение частотных диапазонов проводится согласно договоренностям и стандартам (Kaiser, 2004), не учитывающим индивидуальные проявления реакции снижения амплитуды в ответ на зрительную стимуляцию. Между тем в недавних пионерских исследованиях в условиях сочетанной регистрации ЭЭГ и ф-МРТ убедительно показано, что эпизоды спонтанного снижения альфа-мощности ЭЭГ в состоянии физиологического покоя ассоциируются с усилением мозговой активности (Laufs et al., 2006). Авторы этого и других аналогичных исследований предполагают, что картина мозговой активации во время снижения альфа-мощности зависит от фонового уровня мозговой активности, наблюдаемой в более широком (не только в стандартном альфа) спектральном диапазоне ЭЭГ (Jones et al., 2000; Kaiser, 2005). Результатами наших исследований также продемонстрировано, что индивидуальная ширина альфа-диапазона варьирует на меж- и внутрииндивидуальном уровне и зависит от многих факторов: возраста, нейрогуморального статуса, уровня профессионального мастерства и пр. (Bazanova et al., 2008 a, b, c). Поскольку границы тета- и бета-частотных диапазонов ЭЭГ будут определяться в зависимости от границ альфа-полосы, учет значений индивидуальной ширины альфа-диапазона становится особенно актуальным при проведении тренингов нейробиоуправления, организованных при использовании мощности не только альфа-, но и тета- и бета-диапазонов ЭЭГ в качестве сигналов обратной связи (Базанова и Афтанас, 2007; Kaiser, 2005).
Таким образом, характеристики реактивности на зрительную стимуляцию — глубина и длительность снижения мощности альфа-осцилляций и ширина диапазона, в котором отмечается реакция активации, могут служить индивидуальными маркерами альфа-активности мозга. Так же, как длительность альфа-веретена, сила активации не отличается по средним значениям у испытуемых с различной индивидуальной частотой альфа-осцилляций, но она обусловлена различными механизмами.
Представленные выше нейрофизиологические механизмы альфа-активности и их взаимосвязь с когнитивными и физиологическими функциями дают основание считать, что для количественной оценки альфа-активности мозга необходимо выяснить как минимум величину трех основных ЭЭГ-признаков:
1) амплитуды и частоты доминирующих осцилляций в теменно-затылочной области в состоянии покоя с закрытыми глазами;
2) авторитмичности — по характеристикам микроструктуры альфа-веретена: внутрисегментной вариабельности амплитуды, длительности, средней амплитуде и крутизне нарастания веретена;
3) зрительной активации по показателям глубины и стабильности снижения амплитуды, а также по ширине частотного диапазона, в котором происходит активация.
Очевидно, что измерение какой-либо отдельной характеристики, например частоты или амплитуды, не может претендовать на полноту оценки альфа-активности, а анализ вместе взятых индивидуальных параметров альфа-активности ЭЭГ и их взаимосвязей может привести к выяснению особенностей работы психофизиологических механизмов поведения и адаптации.
1. Базанова О.М., Афтанас Л.И. Использование индивидуальных характеристик ЭЭГ для повышения эффективности нейробиоуправления // Журн. невропатол. и психиатр. им. С.С. Корсакова. — 2006. — Т. 106, № 2. — С. 31-36.
2. Базанова О.М., Афтанас Л.И. Показатели невербальной креативности и индивидуальная частота максимального пика альфа-активности электроэнцефалограммы // Функциональная диагностика. — 2006. — № 4. — С. 43-47.
3. Базанова О.М., Штарк М.Б. Биоуправление в оптимизации психомоторной реактивности. Сообщение 1. Сравнительный анализ биоуправления и обычной исполнительской практики // Физиол. чел. — 2007. — Т. 33, № 3. — С. 1-9.
4. Базанова О.М., Mерная Е.М., Штарк М.Б. Биоуправление в психомоторном обучении: электрофизиологическое обоснование // Рос. физиол. журн. им. И.М. Сеченова. — 2008. — 94(5). — 539-56.
5. Базанова О.М. Вариабельность и воспроизводимость индивидуальной частоты максимального пика в различных экспериментальных условиях // Журнал выс. нервн. деят. им. П.И. Павлова. — 2010. — Т. 60, № 6. — С. 767-776.
6. Гусельников В.И., Изнак А.Ф. Ритмическая активность в сенсорных системах. — М.: Изд-во МГУ, 1983. — 214 с.
7. Евтушенко С.К., Омельяненко А.А. Клиническая электроэнцефалография в педиатрии. — Донецк: Донбасс. — 865 с.
8. Зенков Л.Р. Клиническая электроэнцефалография с элементами эпилептологии. — Таганрог: изд-во ТРТУ, 1996. — 358 с.
9. Иваницкий A.M. Синтез информации в ключевых отделах коры как основа субъективных переживаний // Журн. высш. нервн. деят. им. И.П. Павлова. — 1997. — Т. 47, № 2. — С. 209-225.
10. Каплан А.Я., Борисов С.В., Желиговский В.А. Классификация ЭЭГ подростков по спектральным и сегментным характеристикам в норме и при расстройстве шизофренического спектра // Журн. высш. нервн. деят. им. И.П. Павлова. — 2005. — Т. 55, № 4. — С. 450-458.
11. Кураев Г.А., Иваницкая Л.Н., Бондин В.И., Покуль С.Ю. Особенности суммарной электрической активности мозга здоровых юношей, регулярно занимающихся физической культурой // Физ. культура. — 2006. — № 1. — С. 43-47.
12. Лебедев А.Н., Мышкин И.Ю., Бовин Б.Г. Оценка психологических параметров личности по электроэнцефалограмме // Психол. журн. — 2002. — Т. 23, № 3. — С. 96-104.
13. Ливанов М.Н. Избранные труды. Пространственно временная организация потенциалов и системная деятельность головного мозга. — М., 1989. — 400 с.
14. Малых С.Б., Егорова М.С., Мешкова Т.А. Основы психогенетики. — М., 1998. — 729 с.
15. Мальцева И.В., Маслобоев Ю.П. Параметры альфа-ритма и продуктивность запоминания // Физиол. человека. — 1996. — Т. 22, № 3. — С. 11-17.
16. Осовец С.М., Гинзбург Д.А., Гурфинкель В.С. и др. Электрическая активность мозга: механизмы и интерпретация // Успехи физич. наук. — 1983. — Т. 141, № 1. — С. 103-150.
17. Русинов В.С., Гриндель О.М., Болдырева Г.Н., Вакар Е.М. Биопотенциалы мозга человека: математический анализ. — М.: Медицина, 1987. — 253 с.
18. Строганова Т.А., Цетлин М.М. Психофизиологические характеристики индивидуальных особенностей темперамента детей первых лет жизни, перенесших раннюю зрительную депривацию // Физиол. чел. — 1998. — Т. 24, № 3. — С. 27-33.
19. Уолтер Г. Живой мозг. — М.: Мир, 1966. — 300 с.
20. Штарк М.Б. Об участии нуклеинового обмена в формировании электрических свойств апикальных дендритов коры больших полушарий // БЭМиМ. — 1965. — Т. 3. — С. 9-14.
21. Штарк М.Б. Мозг зимнеспящих. — Новосибирск: Наука, 1970. — 240 с.
22. Adrian E.D., Matthews B.H. The Berger rhythm: potential changes from the occipital lobes in man // Brain. — 1934. — V. 57. — P. 355-385.
23. Alexander D.M., Arns M.W., Paul R.H. et al. EEG markers for cognitive decline in elderly subjects with subjective memory complaints // J. Integr. Neurosci. — 2006. — V. 5, № 1. — P. 49-74.
24. Andersen P., Andersson S.A. Physiological Basis of the Alpha Rhythm. — N.-Y.: Appleton-Century-Crofts, 1968. — 384 p.
25. Anderson M.P., Mochizuki T., Xie J. et al. Thalamic Cav3.1 T-type Ca2+ channel plays a crucial role in stabilizing sleep // Proc. Nat. Acad. Sci. USA. — 2005. — V. 102, № 5. — P. 1743-1748.
26. Anokhin A.P., Muller V., Lindenberger U. et al. Genetic influences on dynamic complexity of brain oscillations // Neurosci. Lett. — 2006. — V. 397, № 1–2. — P. 93-98.
27. Arikan K., Boutros N.N., Bozhuyuk E. et al. EEG correlates of startle retlex with reactivity to eye opening in psychiatric disorders: preliminary results // Clin. EEG Neurosci. — 2006. — V. 37, № 3. — P. 230-234.
28. Baker F.C., Kahan T.L., Trinder J., Colrain I.M. Free in PMC Sleep quality and the sleep electroencephalogram in women with severe premenstrual syndrome // Sleep. — 2007 Oct 1. — 30(10). — 1283-91.
29. Barry R.J., Clarke A.R., Johnstone S.J. еt al. EEG differences between eyes-closed and eyes-open resting conditions // Clinical Neurophysiology. — 2007. — V. 118. — P. 2765-2773.
30. Basar E. The theory of the whole-brain-work // Int. J. Psychophysiol. — 2006. — V. 60, № 2. — P. 133-138.
31. Bazanova O.M., Gvozdev A.V., Mursin F.A. et al. EEG–EMG Dimensionality of the musical performance // Cogn. Proces. — 2003. — V. 4, № 3. — P. 33-47.
32. Bazanova O.M. Age related alpha activity change differs for males and females and for low and high alpha frequency EEG pattern // Revista Espanola de Neuropsicologia. — 2008. — V. 10, № 1. — P. 82-83.
33. Bazanova O.M., Jafarova O.A., Mernaya E.M., Mazhorina K.V., Stark M.B. Optimal functioning psychophysiological bases and neurofeedback training // International J. of Psychophysio-logy. — 2008. — 69(3). — 164.
34. Bazanova O.M., Mernaya E.M. Alpha-activity fluctuations in various hormonal states and associated with them musical performance proved differently in the opposite individual alpha peak frequency groups // Revista Espanola de Neuropsicologia. — 2008. — 10(1). — 100-101.
35. Bazhenov M., Timofeev I., Steriade M., Sejnowski T. Patterns of spiking-bursting activity in the thalamic reticular nucleus initiate sequences of spindle oscillations in thalamic network // J. Neurophysiol. — 2000. — 84. — P. 1076-1087.
36. Berger H. Ьber das Elektroenkephalogramm des Menschen // Archiv fьr Psychiatrie und Nervenkrankheiten. — 1929. — V. 87. — P. 527-570.
37. Berridge M.J., Bootman M.D., Roderick H.L. Calcium signalling: dynamics, homeostasis and remodelling // Nat. Rev. Mol. Cell. Biol. — 2003. — V. 4. — P. 517-529.
38. Castro-Alamancos M.A., Rigas P., Tawara-Hirata Y. Resonance (~10 Hz) of excitatory networks in motor cortex: effects of voltage-dependent ion channel blockers // J. Physiol. — 2007. — V. 1, № 578 (Pt. 1). — P. 173-191.
39. Chapman C.A., Lacaille J.-C. Cholinergic Induction of Theta-Frequency Oscillations in Hippocampal Inhibitory Interneurons and Pacing of Pyramidal Cell Firing // J. Neurosci. — 1999. — V. 19, № 19. — P. 8637-8645.
40. Chi Ping, Greengard P., Ryan T.A. Synaptic Vesicle Mobilization Is Regulated by Distinct Synapsin I phosphorylation pathways at different frequencies // Neuron. — 2003. — V. 38, № 1. — P. 69-78.
41. Clark R.C., Veltmeyer D., Hamilton R.J. et al. Spontaneous alpha peak frequency predicts working memory pertormance across the age span // Int. J. Psychophysiol. — 2004. — V. 53. — P. 1-9.
42. Contreras D., Destexhe A., Sejnowski T.J., Steriade M. Spatiotemporal patterns of spindle oscillations in cortex and thalamus // J. Neurosci. — 1997. — V. 17, № 3. — P. 1179.
43. Cooper N.R., Burgess A.P., Croft R.J., Gruzelier J.H. Investigating evoked and induced electroencephalogram activity in task-related alpha power increases during an internally directed attention task // NeuroReport. — 2006. — V. 17. — P. 205-208.
44. Corsi-Cabrera M., Galindo-Vilchis L., Del-Rio-Portilla Y. et al. Within-subject reliability and inter-session stability of EEG power and coherent activity in women evaluated monthly over nine months // Clin. Neurophysiol. — 2007. — V. 118. — P. 9-21.
45. Creutzfeldt O.D., Arnold P.M., Becker D. et al. ЕEG changes during spontaneous and controlled menstrual cycles and their correlation with psychological performance // Electroencephalogr. Clin. Neurophysiol. — 1976. — V. 40, № 2. — P. 113-131.
46. David O., Harrison L., Friston K.J. Modelling event-related responses in the brain // NeuroImage. — 2005. — V. 25. — P. 756-770.
47. Destexhe A., Sejnowski T.J. Interactions between membrane conductances underlying thalamocortical slow-wave oscillations // Physiol. Rev. — 2003. — V. 83, № 4. — P. 1401-1453.
48. Doppelmayr M., Klimesch W., Pachinger T., Ripper B. Individual differences in brain dynamics: important implications for the calculation of event-related band power // Biol. Cybern. — 1998. — V. 79, № 1. — P. 49-57.
49. Eccles J.C. How the Self Controls its Brain. — Berlin: Springer-Verlag, 1994. — 197 p.
50. Emson P.C. GABA (B) receptors: structure and function // Prog. Brain Res. — 2007. — V. 160. — P. 43-57.
51. Fong G.C.Y., Fong J.K.Y. Recent advances in the diagnosis and management of epilepsy // Hong Kong Med. J. — 2001. — V. 7. — P. 73-84.
52. Gebber G.L., Zhong S., Lewis C., Barman S.M. Human brain alpha rhythm: nonlinear oscillation or filtered noise? // Brain Res. — 1999. — V. 818, № 2. — P. 556-560.
53. Giesbrecht T., Jongen E.M., Smulders F.T., Merckelbach H. Dissociation, resting EEG, and subjective sleep experiences in undergraduates // J. Nerv. Ment. Dis. — 2006. — V. 194, № 5. — P. 362-368.
54. Goldstein J.M., Jerram M., Poldrack R. et al. Hormonal cycle modulates arousal circuitry in women using functional magnetic resonance imaging // J. Neurosci. — 2005. — V. 25, № 40. — P. 9309-9316.
55. Hooper G.S. Comparison of the distributions of classical and adaptively aligned EEG power spectra // Int. J. Psychophysiol. — 2005. — V. 55, № 2. — P. 179-189.
56. Huang Y., Huang Y.L., Lai B. et al. Raloxifene acutely reduces glutamate-induced intracellular calcium increase in cultured rat cortical neurons via inhibition of high-voltage-activated calcium current // Neurosci. — 2007. — V. 147, № 2. — P. 334-341.
57. Hughes S.W., Crunellia V. Just a phase they’re going through: The complex interaction of intrinsic high-threshold bursting and gap junctions in the generation of thalamic a and q rhythms // Int. J. Psychophysiol. — 2007. — V. 64, № 1. — P. 3-17.
58. Hummel F., Saur R., Lasogga S., Plewnia C., Erb M., Wildgruber D., Grodd W., Gerloff C. To act or not to act: neural correlates of executive control of learned motor behavior // Neuro-Image. — 2004. — 23. — 1391-1401.
59. Ishii R., Dziewas R., Chau W. et al. The generator of MEG sleep spindle // Brain Cogn. — 2004. — V. 54, № 2. — P. 157-159.
60. Jin Y., O’Halloran J.P., Plon L., Sandman C.A., Potkin S.G. Alpha EEG predicts visual reaction time // Int. J. Neurosci. — 2006 Sep. — 116(9). — 1035-44.
61. Jones S.R., Pinto D.J., Kaper T.J., Koppell N. Alpha-frequency rhythms desynchronize over long cortical distances: a modeling study // Comput. Neurosci. — 2000. — V. 9. — P. 271-291.
62. Kaiser D.A. Basic Principles of Quantitative EEG // J. Adult Develop. — 2005. — V. 12, № 2/3. — P. 99-104.
63. Kamei T., Toriumi Y., Kimura H., Ohno S., Kumano H., Kimura K. Decrease in serum cortisol during yoga exercise is correlated with alpha wave activation // Percept. Mot. Skills. — 2000. — V. 90, № 3 (Pt. 1). — P. 1027-32.
64. Kamijo T., Murakami M. Regular physical exercise improves physical motor functions and biochemical markers in middle-age and elderly women // J. Phys. Act. Health. — 2009. — V. 6, № 1. — P. 55-62.
65. Kirschfeld K. The physical basis of alpha waves in the electroencephalogram and the origin of the «Berger effect» // Biol. Cybern. — 2005. — V. 92. — P. 177-185.
66. Kirschfeld K. Relationship between the amplitude of alpha waves and reaction time // Neuroreport. — 2008. — V. 19, № 9. — P. 907-910.
67. Klimesch W., Doppelmayr M., Wimmer H. et al. Alpha and beta band changes in normal and dyslexic children // Clin. Neurophysiol. — 2001. — V. 112. — P. 1186-1195.
68. Klimesch W., Sauseng P., Hanslmayr S. EEG alpha oscillations: The inhibition-timing hypothesis // Brain Res. Rev. — 2007. — V. 53. — P. 63-88.
69. Korol D.L. Role of estrogen in balancing contributions from multiple memory systems // Neurobiol. Learn. Mem. — 2004. — V. 82, № 3. — P. 309-323.
70. Koulen P., Madry C., Duncan R.S. et al. Progesterone potentiates IP(3)-mediated calcium signaling through Akt/PKB // Cell. Physiol. Biochem. — 2008. — V. 21, № 1–3. — P. 161-172.
71. Lansky P., Bohdaneck Z., Indra M., Radii-Weiss T. Some Comments on Hardt and Kamiya, «Conflicting Results in EEG Alpha Feedback Studies» // Biofeedback and Self-Regulation. — 1979. — V. 4, № 2. — P. 127-131.
72. Laufs H., Holt J.L., Eltont R. et al. Where the BOLD signal goes when alpha EEG leaves // Neuroimage. — 2006. — V. 31, № 4. — P. 1408-1418.
73. Lopes da Silva F.H. Neural mechanisms underlying brain waves: from neural membranes to networks // Electroencaphalogr. Clin. Neurophysiol. — 1991. — V. 79. — P. 81-93.
74. Lotze G.M., Schelera H., Tand R.M. et al. The musician’s brain: functional imaging of amateurs and professionals during performance and imagery // Neuroimage. — 2003. — V. 20, № 11. — P. 1817-1829.
75. Lukatch H.S., Kiddoo C.E., Macive M.B. Anesthetic-induced burst suppression EEG activity requires glutamate-mediated excitatory synaptic transmission // Cereb. Cortex. — 2005. — V. 15. — P. 1322-1331.
76. Luthi A., McCormick D.A. Periodicity of thalamic synchronized oscillations: the role of Ca2+-mediated upregulation of Ih // Neuron. — 1998. — V. 20. — P. 553-563.
77. Martнnez-Montes E., Valdйs-Sosa P.A., Miwakeichi T. et al. Concurrent EEG/FMRI analysis by multiway Partial Least Squares // NeuroImage. — 2004. — V. 22, № 3. — P. 1023-1034.
78. Mazaheri A., Jensen O. Posterior activity is not phase-reset by visual stimuli // PNAS. — 2006. — 103(8). — 2948-2952.
79. Middleton J., Craig A. Levels of brain wave activity (8-13 Hz) in persons with spinal cord injury // Spinal. Cord. — 2004. — V. 42, № 2. — P. 73-79.
80. Moosmann M., Ritter P., Krastel I. et al. Correlates of alpha rhythm in functional magnetic resonance imaging and near infrared spectroscopy // NeuroImage. — 2003. — V. 20. — P. 145-158.
81. Moretti D.V., Babiloni C., Binetti G. et al. Individual analysis of EEG frequency and band power in mild Alzheimer’s disease // Clin. Neurophysiol. — 2004. — V. 115, № 2. — P. 299-308.
82. Moretti D.V., Miniussi C., Frisoni G.B., Geroldi C., Zanetti O., Binetti G., Rossini P.M. Hippocampal atrophy and EEG markers in subjects with mild cognitive impairment // Clin. Neurophysiol. — 2007. — V. 118, № 12. — P. 2716-2729.
83. Muthukumaraswamy S.D., Johnson B.W., McNair N.A. Mu rhythm modulation during observation of an object-directed grasp // Cogn. Brain Res. — 2004. — V. 19. — P. 195-201.
84. Nicolelis M.A.L., Fanselow E.E. Thalamcortical optimization of tactile processing according to behavioural state // Nature Neurosci. — 2002. — V. 5, № 6. — P. 517-523.
85. Nicoll R.A. My close encounter with GABA(B) receptors // Biochem. Pharmacol. — 2004.
86. Niedermeyer E. EEG patterns and genetics // Electroence-phalography: basic principles, clinical applications and related fields (3 ed.) / Ed. by E. Niedermeyer, F. Lopes da Silva. — Baltimore: Williams & Wilkins, 1993. — P. 192-195.
87. Niedermeyer E. Alpha rhythms as physiological and abnormal phenomena // Int. J. Psychophysiol. — 1997. — V. 26. № 1–3. — P. 31-49.
88. Ng S.C. & Raveendran P. EEG Peak Alpha Frequency as an Indicator for Physical Fatigue // Medicon. — 2007. — V. 16. — P. 517-520.
89. Nunez P., Wingeier B., Silberstein R. Spatial-temporal structures of human alpha rhythms: theory, microcurrent sources, multiscale measurements, and global binding of networks // Hum. Brain Mapp. — 2001. — V. 13. — P. 125-164.
90. Nuwer M. Clinical use of QEEG // Clin. Neurophysiol. — 2003. — V. 114, № 12. — P. 22-25.
91. Oprisan S.A., Prinz A.A., Canavier C.C. Phase resetting and phase locking in hybrid circuits of one model and one biological neuron // Biophys. J. — 2004. — V. 87. — P. 2283-2298.
92. Page A.J., O’Donnell T.A., Blackshaw L.A. Inhibition of mechanosensitivity in visceral primary afferents by GABAB receptors involves calcium and potassium channels // Neurosci. — 2006. — V. 137, № 2. — P. 627-636.
93. Pin J.P., Duvoisin R. The metabotropic glutamate receptors: structure and functions // Neuropharmacol. — 1995. — 34. — 1-26.
94. Riegel A.C., Williams J.T. CRF facilitates calcium release from intracellular stores in midbrain dopamine neurons // Neuron. — 2008. — V. 57, № 4. — P. 559-570.
95. Schomer D.L. The Normal EEG in an Adult // Clin. Neurophysiol. — Primer Humana Press, 2007. — P. 57-71.
96. Schreckenberger M., Lange-Asschenfeld C., Lochmann M. et al. The thalamus as the generator and modulator of EEG alpha rhythm: a combined PET/EEG study with lorazepam challenge in humans // NeuroImage. — 2004. — V. 22. — P. 637-644.
97. Sherman S.M., Guillery R.W. Exploring the thalamus and its role in cortical function. — Cambridge, MA: MIT Press, 2006.
98. Shmelkina R. Some EEG findings caused by real and imaginary stimuli in patients and healthy Subjects // Applied Psychophysiol. and Biofeedback. — 1999. — V. 24, № 2. — P. 143.
99. Smit C.M., Wright M.J., Hansell N.K. et al. Genetic variation of individual alpha frequency (IAF) and alpha power in a large adolescent twin sample // Int. J. Psychophysiol. — 2006. — V. 61, № 2. — P. 235-243.
100. Steriade M., Gloor P., Llinas R.R. et al. Basic mechanisms of cerebral rhythmic activities // Electroencaphalogr. Clin. Neurophysiol. — 1990. — V. 76. — P. 481-508.
101. Steriade M. Impact of network activities on neuronal properties in corticothalamic systems // J. Neurophysiol. — 2001. — V. 86. — P. 1-39.
102. Sterman M.B. Physiological origins and functional correlates of EEG rhythmic activities: Implications for self-regulation // Biofeedback Self-Regul. — 1996. — V. 21. — P. 3-33.
103. Stipacek A., Grabner R.H., Neuper C. et al. Sensitivity of human EEG alpha band desynchronization to different working memory components and increasing levels of memory load // Neurosci. Lett. — 2003. — V. 353, № 3. — P. 193-196.
104. Tenke C.E., Kayser J. Reference-free quantification of EEG spectra: Combining current source density (CSD) and frequency principal components analysis (fPCA) // Clin. Neurophysiol. — 2005. — V. 116. — P. 2826-2846.
105. Thatcher R.W., North D.M., Biver C.J. Intelligence and EEG phase reset: a two compartmental model of phase shift and lock // Neuroimage. — 2008. — V. 42, № 4. — P. 1639-1653.
106. Timofeev I., Bazhenov M. Mechanisms and biological role of thalamocortical oscillations // Trends in Chronobiol. Res. — 2005. — P. 1-47.
107. Toscani M., Marzi T., Righi S., Viggiano M.P., Baldassi S. Alpha waves: a neural signature of visual suppression // Exp. Brain. Res. — 2010 Dec. — 207(3–4). — 213-9.
108. Tops M., van Peer J.M., Wester A.E. еt al. State-dependent regulation of cortical activity by cortisol: An EEG study // Neuroscience Letters. — 2006. — V. 404, № 2. — P. 39-43.
