Журнал «Боль. Суставы. Позвоночник» 4 (04) 2011
Вернуться к номеру
Антиостеопоротические препараты в лечении остеоартроза у женщин в постменопаузальном периоде
Авторы: Поворознюк В.В., Григорьева Н.В., ГУ «Институт геронтологии НАМН Украины», Украинский научно-медицинский центр проблем остеопороза, г. Киев
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
В статье обобщены существующие данные литературных источников о влиянии антиостеопоротических препаратов на клетки хрящевой ткани и возможность использования данных препаратов в лечении остеоартроза.
Summary. The article summarizes the literary source data on impact of antiosteoporotic drugs on cartilaginous tissue cells and possibility of these drugs use in treatment of osteoarthrosis.
Резюме. У статті узагальнені існуючі данні літературних джерел щодо впливу антиостеопоротичних препаратів на клітини хрящової тканини і можливість використання даних препаратів у лікуванні остеоартрозу.
Остеопороз, препараты, бисфосфонаты, кальцитонин, стронция ранелат, заместительная гормональная терапия, деносумаб.
Key words: osteoporosis, drugs, bisphosphonates, calcitonin, Strontium ranelate, hormone replacement therapy, denosumab.
Ключові слова: остеопороз, препарати, бісфосфонати, кальцитонін, стронцію ранелат, замісна гормональна терапія, деносумаб.

Остеоартроз (ОА) — хроническое прогрессирующее дегенеративное заболевание суставов, характеризующееся деградацией суставного хряща с последующими изменениями в субхондральной кости и развитием краевых остеофитов, приводящее к потере хряща и сопутствующему поражению других компонентов сустава (синовиальная оболочка, связки). По влиянию на состояние здоровья ОА занимает на Западе четвертое место среди всех заболеваний у женщин и восьмое — у мужчин. Частота ОА прогрессирующе увеличивается с возрастом. В целом 10–15 % людей старше 60 лет имеют остеоартроз, и с постарением населения он приобретает все большую актуальность. Остеоартроз является одной из основных причин хронического болевого синдрома, нарушений трудоспособности, что значительно снижает качество жизни пациентов.
Основу поражения при ОА составляют изменения в хрящевой ткани, важнейшая функция которой — адаптация сустава к механической нагрузке. При ОА происходит дегенерация и гибель хондроцитов, развивается деполимеризация основного вещества, продуцируемого ими, снижается количество гликозаминогликанов (Насонов Е.Л., 2001; Поворознюк В.В., 2003; Lawrence R.C., Helmick C.G., 1996). Потеря протеогликанов ведет к уменьшению прочности хряща и его дегенерации (Pelletier J.P. et al., 1993; Коваленко В.Н., Борткевич О.П., 2003).
На сегодняшний день оптимальное лечение ОА предусматривает комбинацию немедикаментозных и медикаментозных методов. Согласно рекомендациям EULAR по лечению остеоартроза коленных и тазобедренных суставов (Jordan K.M., Arden N.K., Doherty M. et al. EULAR recommendations, 2003; Jordan K., Doherty M., Arden N. et al., EULAR recommendations, 2005), немедикаментозная терапия должна включать обучение пациента, физические упражнения и физиотерапевтические методы, использование вспомогательных средств (супинаторы, фиксаторы коленного сустава и др.) и снижение массы тела. Медикаментозная терапия предусматривает использование неопиоидных и опиоидных анальгетиков, глюкозамина и хондроитина, гиалуроновой кислоты, кортикостероидов и др. Однако в последнее время в литературе все чаще появляются сообщения о возможном положительном влиянии различных классов антиостеопоротических препаратов на течение остеоартроза коленных и тазобедренных суставов.
Чрезвычайно важную роль в ремоделировании костной ткани играют системы RANK/RANKL/OPG, Wnt и костных морфогенетических протеинов. Исследования последних лет свидетельствуют о возможном влиянии антиостеопоротических препаратов посредством модулирования хондрогенеза, в том числе через изменение экспрессии RANKL (Tat S.K., Pelletier J.P., Velasco C.R. et al., 2009). Кроме того, исследования патогенеза ОА показали, что Wnt-b-катениновый сигнал (Dell’Accio F., De Bari C., MF El Tawil N. et al., 2006; Diarra D., Stolina M., Polzer K. et al., 2007; Schett G., Zwerina J., David J.P., 2008; Polzer K., Diarra D., Zwerina J., Schett G., 2008) и другие сигнальные молекулы могут играть важную роль в развитии ОА посредством влияния на процессы эндохондрального окостенения, включая влияние на мутации определенных генов и апоптоз хондроцитов. Также в некоторых исследованиях показано, что моделирование продукции костных морфогенетических белков является важным фактором не только в ремоделировании костной ткани, но и в индукции остеоартроза, связанного с травматическим повреждением хряща (Dell’Accio F., De Bari C., MF El Tawil N. et al., 2006).
Согласно обновленным Европейским рекомендациям по лечению остеопороза у женщин в постменопаузальном периоде (2008), все препараты разделены на две группы: препараты первой линии (бисфосфонаты (алендронат, ризендронат, ибандронат, золендронат), стронция ранелат, препараты паратиреоидного гормона, селективные модуляторы эстрогенных рецепторов) и препараты второй линии (заместительная гормональная терапия (ЗГТ), кальцитонин, некоторые бисфосфонаты (этидронат, клодронат) и производные витамина D).
Цель данной статьи — обобщить существующие данные литературных источников о влиянии антиостеопоротических препаратов на клетки хрящевой ткани и возможности использования этих препаратов в лечении остеоартроза.
Бисфосфонаты
В настоящее время наибольшим классом антиостеопоротических препаратов являются бисфосфонаты, семь соединений из них доступны для лечения заболеваний костной ткани: этидронат, клодронат, памидронат, алендронат, ибандронат, ризедронат и золендронат. Главное действие бисфосфонатов на скелет — замедление минерализации кости и хряща и ингибирование вызываемой остеокластами резорбции костной ткани. Механизм действия различных бисфосфонатов на процессы резорбции костной ткани существенно различается: это воздействие на ферментативную активность остеокласта (ингибирование активности фарнезилпирофосфатсинтетазы), инактивацию щеточной каймы остеокластов, индукцию апоптоза остеокластов и др.
В последнее время ряд экспериментальных исследований с моделированием ОА показали, что бисфосфонаты могут быть потенциальными болезнь-модифицирующими агентами в лечении остеоартроза (Spector T.D., 2003; Hayami T., Pickarski M., Wesolowski G.A. et al., 2004; Muehleman C., Green J., Williams J.M. et al., 2002).
В экспериментальном исследовании (Hayami T., Pickarski M., Wesolowski G.A. et al., 2004) на крысах-самцах линии Sprague-Dawley с использованием хирургической модели остеоартроза коленного сустава (пересечение передней крестовидной связки) изученно влияние введения алендроната (0,03 и 0,24 мкг/кг/нед подкожно) на состояние субхондральной кости. Эффект лечения оценивали через 2 и 10 нед. Оценивали состояние субхондральной костной ткани и степень выражености остеофитоза (гистоморфометрически), локальный уровень трансформирующего фактора роста b (TGF-b), матриксных металлопротеиназ (MMP-9 и -13).
В данном исследовании авторами подтверждено положительное хондропротективное влияние обеих доз алендроната как на гистоморфометрические параметры субхондральной кости, так и на уровень маркеров деградации коллагена. Отмечено дозозависимое уменьшение частоты формирования и площади остеофитов при использовании алендроната в отличие от группы нелеченых животных. Лечение алендронатом предупреждало темпы сосудистой инвазии в кальцифицированный хрящ животных с остеоартрозом и блокировало активацию остеокластов в субхондральной кости и остеофитах. Применение алендроната приводило к уменьшению локального содержания TGF-b, что, возможно, по мнению авторов, связано с угнетением экспрессии MMP-13 в суставном хряще и MMP-9 в субхондральной кости.
Влияние алендроната на состояние хряща и субхондральной костной ткани у трехмесячных кроликов с моделью травматического остеоартроза (при пересечении передней крестовидной связки) изучено в исследованиях Hu H., Zhang L., Li B. et al. (2009). Авторами установлено, что подкожное введение алендроната приводило к угнетению темпов деградации хряща, предотвращению потери костной ткани и улучшению микроархитектоники субхондральной кости животных. В исследованиях in vitro и in vivo установлено положительное влияние алендроната на экспрессию MMP-13 в хондроцитах.
При моделировании спонтанного ОА у морских свинок линии Dunkіn-Hartley (модель первичного нетравматического остеоартроза) применение бисфосфонатов, в частности ризедроната, приводило к замедлению прогрессирования заболевания, которое оценивали путем измерения размеров повреждения хряща и величины остеофитов. Авторами отмечено улучшение параметров суставного хряща у леченных животных на 30–40 % по сравнению с контролем (Bendele A.M., Hulman J.F., 1988).
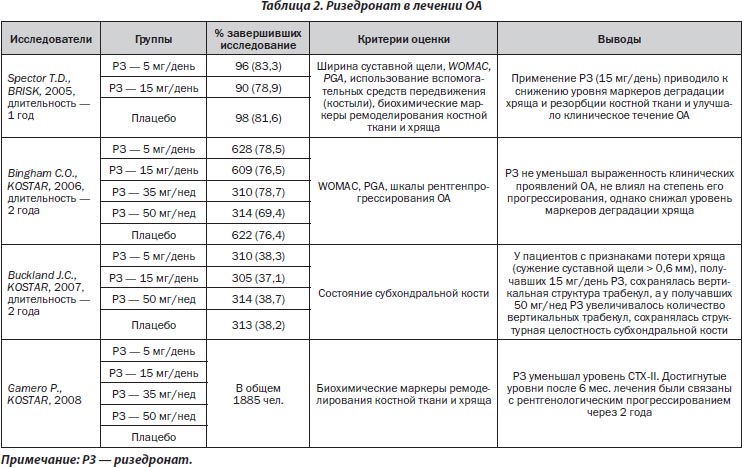
В настоящее время существует два проспективных двойных слепых плацебо-контролированных исследования, свидетельствующих о положительном влиянии ризедроната на клинические симптомы, функциональную активность и темпы прогрессирования ОА у пациентов с гонартрозом. В данных исследованиях принимали участие больные в возрасте 40–80 лет с легкой и умеренной степенью тяжести ОА. В одном из них, проведенном в Великобритании (British study of risedronate in structure and symptoms of knee OA — BRISK) оценены эффективность и безопасность применения ризедроната у пациентов с гонартрозом, в другом (Knee OA Structural Arthritis — KOSTAR) у пациентов Северной Америки и Европы оценивали симптоматический и потенциальный структурно-модифицирующий эффект ризедроната при OА коленных суставов. Два других описанных в литературе исследования — Buckland-Wright J.C. и соавт. и Garnero Р. и соавт. — являются субанализами вышеуказанного исследования KOSTAR.
В исследовании BRISK (Spector T.D., Conaghan P.G., Buckland-Wright J.C. et al., 2005) установлено дозозависимое снижение в моче уровня С-терминального телопептида коллагена II типа (CTX-II) и N-терминального телопептида коллагена І типа (NTX-I). Также выявлено снижение уровня боли в коленном суставе по шкале PGA (Patient Global Asssesment), но не по шкале WOMAC. Кроме того, установлено уменьшение количества пациентов, использующих вспомогательные средства передвижения (костыли), однако не выявлено достоверного уменьшения ширины суставной щели коленного сустава.
В двухлетнем многоцентровом рандомизированном исследовании KOSTAR (Bingham C.O. 3rd, Buckland-Wright J.C., Garnero P. et al., 2006) с участием 1896 пациентов показано, что использование ризедроната приводило к уменьшению уровня CTX-II и NTX-I в моче, однако не способствовало достоверному улучшению клинического течения ОА (по шкалам WOMAC, PGA, среднее количество дней нетрудоспособности, среднее количество используемых анальгетических средств) и его рентгенпрогрессированию (ширина суставной щели, количество и размер остеофитов).
В последующем в субанализе данного исследования, проведенном Buckland-Wright J.C., Messent E.A., Bingham C.O. 3rd et al. (2007) с использованием компьютеризированного метода фрактального анализа (fractal signature analysis), позволяющего отдельно оценить изменения в горизонтальных и вертикальных трабекулах костной ткани в определенной зоне исследования (в медиальном отделе верхней трети большеберцовой кости), выявлено, что у пациентов с выраженной потерей хряща (сужение суставной щели ≥ 0,6 мм), получавших ризедронат в дозе 15 мг/день, отмечено сохранение вертикальной трабекулярной структуры костной ткани, а у больных, получавших ризедронат в дозе 50 мг/нед, отмечалось увеличение показателя вертикальной трабекулярной структуры, что свидетельствовало о сохранении структурной целостности субхондральной кости.
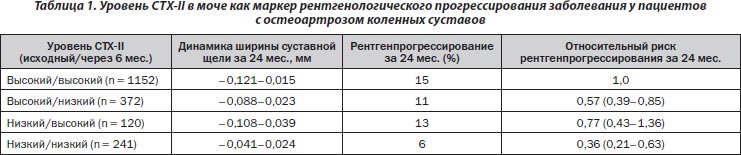
В другом субанализе исследования KOSTAR (при оценке данных 1885 пациентов) показано дозозависимое снижение в моче уровней CTX-II, NTX-І и -ІІ при использовании терапии ризедронатом (Garnero P., Aronstein W.S., Cohen S.B. et al., 2008). Применение более высокой дозы ризедроната (15 мг/день) приводило к достоверному снижению уровней CTX-II и NTX-I в моче (рис. 1). У пациентов со значимым снижением уровня CTX-II через 6 мес. лечения риск рентгенологического прогрессирования на 24-м месяце исследования был достоверно ниже по сравнению с больными, у которых уровень CTX-II был высоким как в начале исследования, так и на 6-м месяце терапии (относительный риск (ОР) — 0,57; 95% ДИ 0,39–0,85). Еще более значимое снижение риска рентгенпрогрессирования отмечено у больных, у которых уровень CTX-II в моче был низким как в начале лечения, так и через 6 мес. (ОР — 0,36, 95% ДИ 0,21–0,63). Таким образом, по мнению авторов, измерение уровня CTX-II в моче в начале терапии ризедронатом и в динамике лечения может быть важным прогностическим маркером рентгенпрогрессирования остеоартроза (табл. 1).
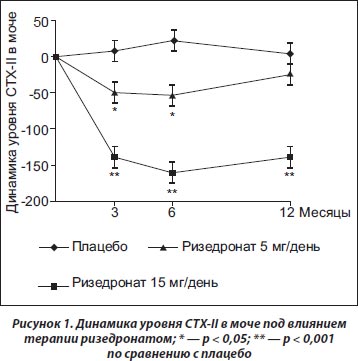
Таким образом, результаты существующих рандомизированных исследований свидетельствуют о том, что более высокие дозы ризедроната (15 мг/день) достоверно уменьшают уровень маркера деградации хряща (CTX-II), что может способствовать замедлению темпов рентгенпрогрессирования ОА путем сохранения структурной целостности субхондральной кости (табл. 2). Тем не менее существующие неоднозначные данные о влиянии ризедроната на динамику болевого синдрома и функциональной активности у пациентов с ОА коленного сустава затрудняют оценку клинической значимости его применения у пациентов с гонартрозом.
Кальцитонин
Первичным местом влияния кальцитонина (его органом-мишенью) является костная ткань. Основной эффект кальцитонина проявляется гипокальциемией и гипофосфатемией, а его биологическое действие состоит в торможении резорбтивных процессов в кости. Кальцитонин ингибирует не только спонтанную резорбцию костной ткани, но и остеолизис, стимулированный паратиреоидным гормоном, витамином D и другими факторами (Старкова Н.Т., 1996; Поворознюк В.В., Евтушенко О.А., 2000; Поворознюк В.В., Григорьева Н.В., 2002).
Эффекты кальцитонина модулируются посредством воздействия на высокоаффинные рецепторы семейства GPCR, однако если действие кальцитонина в костной ткани опосредовано прямым воздействием на специфические рецепторы, расположенные на базолатеральной мембране остеокластов (Nicholson G.C., Moseley J.M., Sexton P.M. et al., 1986), то наличие специфических рецепторов в хрящевой ткани до сих пор является предметом оживленных дискуссий. Одни исследователи подтверждают их наличие (Sondergaard B.C., Wulf H., Henriksen K. et al., 2006; Segovia-Silvestre T., Bonnefond C., Sondergaard B.C. et al., 2011), другие при использовании методов полимеразной цепной реакции, иммунохимического анализа и других методов исследования (Lin Z., Pavlos N.J., Cake M.A. et al., 2008) не подтверждают эти данные.
В исследованиях іn vitro показано, что кальцитонин лосося влияет на процессы протеолиза в суставном хряще, ингибирует активность коллагеназы и фосфолипазы A2 (Hellio M.P., Peschard M.J., Cohen C. et al., 1997; Sondergaard B.C., Wulf H., Henriksen K. et al., 2006). Кроме того, введение кальцитонина в культуре хондроцитов бычьего хряща стимулирует синтез важного внутриклеточного мессенджера — циклического аденозин-3’5’-монофосфата (цAMФ), что ведет к угнетению процессов деградации хрящевого матрикса, опосредованной снижением синтеза металлопротеиназ. При этом не установлено изменение темпов деградации хряща, опосредованной изменением синтеза аггрекана (Karsdal M.A., Sumer E.U., Wulf H. et al., 2007). В экспериментальных исследованиях отмечен анаболический эффект кальцитонина лосося и человека на формирование хряща, синтез протеогликанов и глюкозаминов в хондроцитах в культуре клеток различных линий (Suzuki F., Yoneda T., Shimomura Y., 1976; Kato Y., Nasu N., Takase T. et al., 1980; Burch W.M., 1984; Franchimont P., Bassleer C., Henrotin Y. et al., 1989). In vivo длительное использование кальцитонина лосося приводило к увеличению количества гипертрофированных хондроцитов и толщины эпифизарного хряща у молодых крыс (Khaldi L., Karachalios T., Galanos A., Lyritis G.P., 2005). В последние десятилетия положительная роль кальцитонина подтверждена на различных экспериментальных моделях остеоартроза (Manicourt D.H., Altman R.D., Williams J.M. et al., 1999; El Hajjaji H., Williams J.M., Devogelaer J.P. et al., 2004; Behets C., Williams J.M., Chappard D. et al., 2004; Nielsen R.H., Bay-Jensen A.C., Byrjalsen I., Karsdal M.A., 2011).
В настоящее время положительный эффект кальцитонина на течение остеоартроза подтвержден и в клинических исследованиях. Так, установлена его положительная роль в снижении выраженности болевого синдрома и улучшении альгофункционального индекса Лекена у пациентов с ОА коленных суставов (Manicourt D.H., Azria M., Mindeholm L. et al., 2006; Bagger Y.Z., Tanko L.B., Alexandersen P. et al., 2006).
В одном из литературных обзоров, опубликованном в 2005 году (Manicourt D.-H., Devogelaer J.-P., Azria M., Silverman S., 2005), суммированы положительные эффекты кальцитонина в лечении пациентов с ОА. Экспериментальные исследования in vivo и in vitro подтверждают влияние кальцитонина как на суставной хрящ, так и на субхондральную кость. Кальцитонин не только положительно влияет на темпы ремоделивания субхондральной костной ткани у пациентов с ОА, но и достоверно снижает выраженность повреждения хряща при некоторых моделях ОА, уменьшая выраженность его альтерации и влияя на показатели биохимической и супрамолекулярной организации хрящевого матрикса.
Выраженный анальгетический эффект кальцитонина чрезвычайно важен у пациентов с ОА при наличии болевого синдрома. При сравнении анальгетического эффекта кальцитонина и напроксена показано преимущество кальцитонина у пациентов с гонартрозом (Badurski J., Jeziernicka E., Naruszewicz K., Racewicz A., 1995).
В трехмесячном рандомизированном двойном слепом плацебо-контролированном исследовании изучен дозозависимый (0,15; 0,4; 1,0 и 2,5 мг) эффект перорального кальцитонина у 152 датских женщин в постменопаузальном периоде, в возрасте 55–85 лет, при лечении остеоартроза (Bagger Y.Z., TankоL.B., Alexandersen P. et al., 2006). Установлено, что применение кальцитонина приводило к дозозависимому снижению суточной экскреции CTX-II. У пациенток, у которых уровень СТХ-ІІ был наиболее высоким (верхняя тертиль, 391 ± 18 нг/ммоль) и которые получали 1,0 мг кальцитонина, отмечено наиболее значимое снижение уровня CTX-II. Авторы подтверждают наличие клинически значимого эффекта кальцитонина в уменьшении степени деградации хряща, особенно у пациенток с высоким уровнем ремоделирования хрящевой ткани.
Таким образом, существующие данные экспериментальных и клинических исследований свидетельствуют о потенциальном положительном эффекте кальцитонина в лечении пациентов с остеоартрозом.
Заместительная гормональная терапия
В настоящее время известно, что частота остеоартроза крупных суставов, а также суставов кисти прогрессивно возрастает у женщин после наступления менопаузы, поэтому в мировой литературе продолжается активная дискуссия о роли дефицита половых гормонов и менопаузы в развитии ОА различной локализации.
Еще в 1940 году Silberberg M. и Silberberg N. показали, что введение животным экстракта гипофиза приводит к дистрофии суставных хрящей, а введение эстрогенов благоприятно влияет на их метаболизм. В 1966 году Seze S. и Ryskewaert A. высказали точку зрения о том, что нарушения в системе «гипоталамус — гипофиз — яичники», особенно возникающие в постменопаузальном периоде, могут быть патогенетическим звеном в развитии ОА (Дедух Н.В. и др., 1992). В более поздних работах было показано, что рецепторы к эстрогенам существуют в клетках и тканях сустава, а именно в синовиоцитах, хондроцитах (Tsai C.L., Liu T.K., 1992), фибробластах, макрофагах (Cutolo M., Accardo S., Villaggio B. et al., 1996), синовиальном эпителии, стенках сосудов сустава, суставной строме. По данным некоторых исследований, эстрогены способны модулировать воспалительные реакции в суставе через синовиоциты и макрофагальные клетки.
В настоящее время доказано, что эстрадиол и тестостерон проникают в хрящевые клетки, в которых подвергаются метаболическим превращениям (Pewuim Т., Adams J.J., 1979; Takahashi Y. et al., 1984). При этом, по данным некоторых авторов (Strickland A.L., Sprintz H.J., 1973; Дедух Н.В., Панков Е.Я., 1988), основной аспект их влияния на метаболизм хрящевой ткани — участие в ростовых процессах и созревании. Доказано, что эстрогены могут оказывать выраженное ингибирующее действие на рост и метаболизм хрящевой ткани, а их высокие концентрации вызывают эрозирование хрящей (Дедух Н.В. и др., 1992; Silberberg R. et al., 1965; Roshel J.A. et al., 1979).
Эстрогены влияют на субхондральную кость и хондроциты хряща как непосредственно, так и опосредованно, через вторичные мессенджеры, например трансформирующий фактор роста b, инсулиноподобный фактор І и II (Tsai C.L., Liu T.K., 1992; Fernihough J.K., Richmond R.S., Carlson C.S. et al., 1999). In vitro эстрогены оказывают модулирующий эффект на хондроциты посредством своего влияния на синтез и активность ИЛ-6 (Guerne P.A., Carson D., Lotz M., 1990). In vitro на некоторых моделях экспериментальных животных доказан положительный эффект эстрогенов на течение ОА (Silberberg M., Silberberg R., 1963; Rosner I.A., Goldberg V.M., Getzy L., Moskowitz R.W., 1979; Turner A.S., Athanasiou K.A., Zhu C.F. et al., 1997).
Экспериментальные работы были подтверждены и эпидемиологическими исследованиями, свидетельствующими о снижении риска рентгенологически установленного ОА у пациентов, принимающих ЗГТ (Hannan M.T., Felson D.T., Anderson J.J. et al., 1990; Samanta A., Jones A., Regan M. et al., 1993; Nevitt M.C., Cummings S.R., Lane N.E. et al., 1996; Spector T.D., Nandra D., Hart D.J., Doyle D.V., 1997).
На сегодняшний день данные об эффекте ЗГТ в предупреждении и прогрессировании ОА коленного и тазобедренного суставов противоречивы. Некоторые эпидемиологические исследования подтверждают достоверное снижение этого риска у женщин, принимающих ЗГТ (Hannan M.T., Felson D.T., Anderson J.J. et al., 1990; Nevitt M.C., Cummings S.R., Lane N.E. et al., 1996; Spector T.D., Nandra D., Hart D.J., Doyle D.V., 1997; Vingard E., Alfredsson L., Malchau H., 1997), другие свидетельствуют о статистически недостоверном снижении или отсутствии такового (Samanta A., Jones A., Regan M. et al., 1993; Nevitt M.C., Cummings S.R., Lane N.E. et al., 1996; Spector T.D., Nandra D., Hart D.J., Doyle D.V., 1997; Zhang Y., McAlindon T.E., Hannan M.T. et al., 1998; Sahyoun N.R., Brett K.M., Hochberg M.C., Pamuk E.R., 1998; Dennison E.M., Arden N.K., Kellingray S. et al., 1998; Sandmark H., Hogstedt C., Lewold S., Vingard E., 1999).
Метаанализ (Nevitt M.C., Felson D.T., 1996) четырех исследований, касающихся риска ОА коленных и тазобедренных суставов у женщин, принимающих ЗГТ, показал, что ОР ОА у них несколько ниже и составляет 0,76 (95% ДИ 0,63–0,91).
Spector T.D., Nandra D., Hart D.J., Doyle D.V. (1997) изучили эффект ЗГТ в прогрессировании ОА кистей и коленных суставов среди 1003 пациенток в возрасте 45–64 лет (средний возраст 54,2 года), принимавших участие в Chingford Study. В анализ были включены результаты исследования 606 женщин в постменопаузальном периоде с установленным ОА (рентгенологическая стадия ОА по классификации Kellgren — Lawrence II). Пациентки были разделены на три группы: І — женщины, никогда не использовавшие ЗГТ; ІІ — пациентки, принимающие ЗГТ на момент исследования (более 12 мес.); ІІІ — больные, использовавшие гормонотерапию в прошлом (более 12 мес. назад). У женщин, применявших гормонотерапию на момент исследования (более 12 мес., средняя продолжительность ЗГТ (М ± SD) — 33,4 ± 26,5 мес.), выявлен ее значительный протекторный эффект в прогрессировании OA КС (для стадии остеоартроза ОР = 0,31 (95% ДИ 0,11–0,93). Менее выраженный недостоверный эффект обнаружен для показателя сужения суставной щели — ОР = = 0,41 (95% ДИ 0,05–3,15) и для межфалангового OA — ОР = 0,48 (95% ДИ 0,17–1,42). Не выявлен достоверный эффект ЗГТ при ОА карпо-метакарпальных суставов (ОР = 0,94 (95% ДИ 0,44–2,03). При включении в анализ всех женщин, когда-либо принимавших ЗГТ, выраженность протекторного эффекта гормонотерапии уменьшалась. У женщин, принимавших ЗГТ в прошлом (более 12 мес. назад), не обнаружен ее защитный эффект на течение ОА. Таким образом, полученные результаты указывают на существование обратной связи между текущим использованием ЗГТ и рентгенологическими признаками гонартроза, что подтверждает ее защитный эффект. Для ОА кистей это влияние слабее.
Исследование (Croft P., Cooper C., Wickham C., Coggon D., 1990; Nevitt M.C., Cummings S.R., Lane N.E. et al., 1996), опубликованное по результатам Study of Osteoporotic Fractures, которое включало 4366 женщин, показало, что у пациенток, принимающих ЗГТ на момент исследования, относительный риск OA тазобедренного сустава составлял 0,62 (95% ДИ 0,49–0,86) с тенденцией к увеличению защитного влияния при прогрессировании заболевания. Эффект использования ЗГТ в прошлом на возникновение и прогрессирование ОА также не был обнаружен.
Таким образом, в больших эпидемиологических исследованиях подтверждена обратная связь между применением ЗГТ и частотой остеоартроза коленных (Chingford Study) и тазобедренных (Study of Osteoporotic Fractures) суставов.
В исследовании, проведенном Wluka A.E., Davis S.R., Bailey M. et al. (2001), с помощью магнитно-резонансной томографии изучена величина объема хрящевой ткани у 81 женщины, 42 из которых более 5 лет принимали эстроген-заместительную терапию, а 39 — никогда не использовали ее. Установлено, что у пациенток, принимавших ЗГТ, объем хрящевой ткани в коленном суставе больше, чем у женщин, не использующих ее, независимо от возраста менопаузы, длительности постменопаузального периода, ИМТ и физической активности. Общий объем хрящевой ткани коленного сустава был на 7,7 % (0,23 мл) больше у женщин, принимавших эстроген-заместительную гормонотерапию.
У 600 пожилых женщин в возрасте 63 лет и старше, принимавших участие во Framingham OA Study и использовавших ЗГТ более 2 лет, выявлено снижение частоты рентгенологически установленного ОА КС на одну треть, однако эта разница не была статистически достоверной по сравнению с пациентками, не принимавшими ЗГТ (Hannan M.T., Felson D.T., Anderson J.J. et al., 1990). Статистически достоверная обратная связь между применением ЗГТ и возникновением ОА КС выявлялась только у женщин с двусторонним OA (OР = 0,52 (95% ДИ 0,25–1,09). В проспективном исследовании женщин, принимавших участие во Framingham OA Study, через 8 лет наблюдения установлено снижение риска рентгенологически установленного ОА КС у женщин, принимающих ЗГТ на момент исследования (OР = 0,4 (95% ДИ 0,1–3,0) (Zhang Y., McAlindon T.E., Hannan M.T. et al., 1998).
Механизм протекторного влияния ЗГТ неясен (Nevitt M.C., Felson D.T., 1996), некоторые авторы (Guerne P.-A., Carson D.A., Lotz M., 1990) высказывают предположение о возможной роли цитокинов, в частности ИЛ-6, в повреждении самого хряща или нарушении костного ремоделирования в субхондральной кости.
Другие исследования, проведенные среди женщин в постменопаузальном периоде с ОА коленных суставов (Hannan M.T., Felson D.T., Anderson J.J. et al., 1990; Samanta J., Regan M., Wilson S., Doherty M., 1993; Oliveria S.A., Felson D.T., Klein R.A. et al., 1996; Spector T.D., Nandra D., Hart D.J., Doyle D.V.; 1997; Zhang Y., McAlindon T.E., Hannan M.T. et al., 1998), подтверждают наличие незначительного, статистически недостоверного протекторного эффекта ЗГТ, однако исследуемые группы в этих наблюдениях малочисленны для того, чтобы сделать какие-либо выводы о влиянии длительности использования ЗГТ на течение ОА.
Некоторые исследователи отрицают положительный эффект гормонотерапии в предупреждении и прогрессировании ОА. Так, в исследовании Ulm Osteoarthritis Study принимали участие 475 женщин в возрасте 50 лет и старше, 11,6 % из которых применяли ЗГТ (средняя длительность приема составила 5,4 года) (Erb A., Brenner H., Gьnther K.-P., Stьrmer T., 2000). Частота билатерального или генерализованного остеоартроза составляла 86,3 и 27,5 % соответственно у женщин, использующих ЗГТ, и 88,7 и 35,7 % у пациенток, не принимающих ее. Риск билатерального и генерализованного остеоартроза составил соответственно (OР = 1,21 (95% ДИ 0,48–3,03) и 1,21 (95% ДИ 0,53–2,74). Таким образом, авторами был сделан вывод о том, что ЗГТ не обладает протекторным влиянием на развитие артроза у женщин в постменопаузальном периоде.
Применение ЗГТ не было связано с риском возникновения карпо-метакарпального остеоартроза кистей (Spector T.D., Nandra D., Hart D.J., Doyle D.V., 1997), межфалангового остеоартроза (Samanta A., Jones A., Regan M. et al., 1993). Еще одно проведенное исследование «случай-контроль» также не выявило взаимосвязи между текущим приемом ЗГТ и риском возникновения ОА тазобедренных, коленных суставов и суставов кисти (Oliveria S.A., Felson D.T., Klein R.A. et al., 1996). Однако была установлена высокая частота ОА у пациентов, принимающих эстрогенотерапию.
Эффект ЗГТ на возникновение симптоматического остеоартроза тазобедренных суставов изучен в исследовании с участием 413 женщин старших возрастных групп (Dennison E.M., Arden N.K., Kellingray S. et al., 1998). Так, установлено, что риск ОА тазобедренных суставов достоверно возрастал после перенесенной овариоэктомии (отношение шансов (OШ) = 1,9 (95% ДИ 1,0–3,7). Кроме того, установлен слабый недостоверный эффект длительного курса ЗГТ (более 5 лет), связанный с 40% снижением риска ОА тазобедренных суставов (OШ = 0,6 (95% ДИ 0,2–1,8). Парадоксально, однако, что кратковременная ЗГТ (до 5 лет) приводила к увеличению риска ОА тазобедренного сустава (OШ = 1,7 (95% ДИ 0,9–3,3). Кроме того, в данном исследовании не выявлено связи между риском ОА и приемом контрацептивов, количеством родов.
На основании того, что минеральная плотность костной ткани выше у женщин с ОА (Hart D.J., Mootooswamy I., Doyle D.V., Spector T.D., 1994), некоторыми исследователями (Spector T.D., 1988) была выдвинута гипотеза о том, что использование ЗГТ может играть определенную роль в возникновении OA, а OA является заболеванием, развитие которого обусловлено избытком эстрогенов, что подтверждалось результатами экспериментальных и эпидемиологических исследований (Spector T.D., Campion G.D., Generalised O.A., 1989).
Высказываются предположения о том, что эффект комбинированной ЗГТ на состояние суставов у женщин в постменопаузальном периоде отличается от эффекта монотерапии эстрогенами (Fernihough J.K., Richmond R.S., Carlson C.S. et al., 1999). Исследование Nevitt M.C., Cummings S.R., Lane N.E. et al. (1996) подтверждает факт снижения положительного влияния эстрогенов на течение тазобедренного ОА при комбинированной эстроген-гестагенной терапии, однако результаты других исследований (Wluka A.E., Davis S.R., Bailey M. et al., 2001) не подтверждают данное предположение.
Таким образом, на сегодняшний день результаты многочисленных исследований относительно взаимосвязи ЗГТ и риска ОА неоднозначны, а терапевтическая целесообразность применения эстрогенов в клинике при остеоартрозах дискутируется, особенно учитывая ряд побочных эффектов со стороны сердечно-сосудистой системы и молочной железы при длительном использовании ЗГТ, необходимом для профилактики и лечения остеоартроза.
Стронция ранелат
В настоящее время среди всех антиостеопоротических препаратов стронция ранелат является единственным средством, влияющим как на резорбцию костной ткани, так и на ее формирование. В последние годы подробно изучены механизмы его разнопланового влияния посредством воздействия на систему RANK/RANKL/OPG,Wnt-b-катениновый путь и кальций-сенсорные рецепторы. Раскрытие подобных путей влияния дало основание для изучения влияния стронция ранелата не только на костную, но и на хрящевую ткань.
В настоящее время в экспериментальных исследованиях in vitro изучено влияние стронция ранелата на хондроциты здоровых пациентов и больных остеоартрозом (Henrotin Y., Labasse A., Zheng S.X. et al., 2001). Было продемонстрировано, что соли стронция (ранелат и хлорид) в отличие от кальция ранелата не влияют на активацию стромелизина, однако оба достоверно стимулируют продукцию протеогликанов и усиливают стимулирующий эффект инсулиноподобного фактора роста I (IGF-I) на синтез протеогликанов за счет уменьшения окислительного повреждения хряща и не влияют на повреждающие эффекты интерлейкина-1b (ИЛ-1b). Таким образом, было сделано заключение о важном стимулирующем влиянии стронция ранелата in vitro на формирование хрящевого матрикса непосредственно путем защитного антиоксидантного эффекта без стимуляции хондрорезорбтивных процессов.
В экспериментальных исследованиях также было показано, что существующие фенотипические особенности субхондральной кости у пациентов с ОА могут быть связаны с темпами резорбтивных процессов в ней. Важную роль в резорбции костной ткани играют протеолитические ферменты, в частности металлопротеиназы (MMP-2 и -9), a также RANKL, который синтезируется остеобластами. При исследовании модулирующего эффекта стронция ранелата на функционирование остеобластов субхондральной кости больных ОА (Tat S.K., Pelletier J.P., Mineau F. et al., 2011) в клетках пациентов с ОА уровень экспрессии MMP-2 и -9 был достоверно ниже при введении стронция ранелата (для ММР-2 — 1 мM: p ≤ 0,005 и p ≤ 0,02 соответственно и 2 мM: p ≤ 0,003 и p ≤ 0,007 и для ММР-9 — 0,1 мM (p ≤ 0,05). В клетках здоровых пациентов отмечалось повышение экспрессии остеопротегерина (OPG) при добавлении стронция ранелата в дозе 2 мM, а у больных уровень экспрессии и синтез OPG были достоверно повышены (соответственно p ≤ 0,02 и p ≤ 0,002) при использовании стронция ранелата в дозе 1 и 2 мг.
Таким образом, авторами сделан вывод о том, что стронция ранелат в дозах 1 и 2 мг достоверно влияет на уровень экспрессии общего RANKL и его изоформ (RANKL-1 и RANKL-3), что связано с протеолитическими процессами в клетке, однако не влияет на уровень других мессенджеров (MT1-MMP, ADAM-17 и ADAM-19). Кроме того, в настоящем исследовании установлено, что применение стронция ранелата в исследуемых концентрациях достоверно снижает уровень резорбции в субхондральной кости (p ≤ 0,002).
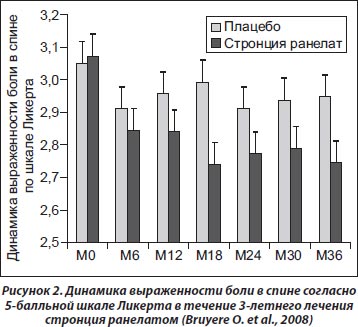
При проведении post-hoc aнализа исследований SOTI (Spinal Osteoporosis Therapeutic Intervention) и TROPOS (TReatment Of Peripheral OSteoporosis) на основании результатов 1105 женщин с остеопорозом и сопутствующими рентгенологическими признаками OA межпозвоночных суставов в начале лечения оценка его прогрессирования проводилась через 3 года применения стронция ранелата (Bruyere O., Delferriere D., Roux C. et al., 2008). Оценивали наличие и размеры остеофитов, ширину суставной щели и выраженность склероза замыкательных пластинок. Кроме того, выраженность вертебрального болевого синдрома оценивали по 5-балльной шкале Ликерта (в исследовании SOTI) и качество жизни по анкете SF-36. Данные пациентов с новыми вертебральными переломами в течение периода исследования не включали в анализ.
В данном исследовании было продемонстрировано, что использование стронция ранелата у пациентов с остеопорозом приводило к замедлению прогрессирования ОА межпозвоночных суставов в целом на 42 % (табл. 3) по сравнению с группой плацебо (ОР — 0,58; 95% ДИ 0,42–0,79; p = 0,0005).
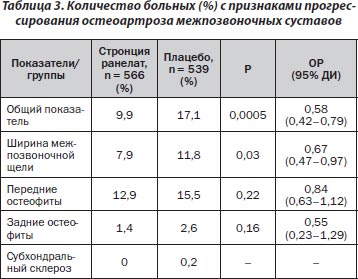
Через 3 года исследования установлено достоверное уменьшение выраженности вертебрального болевого синдрома (рис. 2) у пациентов, принимавших стронция ранелат, по сравнению с группой плацебо (p = 0,03), однако достоверные различия по шкале SF-36 не выявлены.
В другом post-hoc анализе рандомизированного плацебо-контролированного исследования эффективности стронция ранелата TROPOS при анализе результатов 2617 женщин в постменопаузальном периоде (средний возраст 75,7 ± 4,4 года) с остеопорозом (Alexandersen P., Karsdal M.A., Qvist P. et al., 2007; Alexandersen P., Karsdal M.A., Byrjalsen I., Christiansen C., 2011) оценивали его эффективность на уровень маркеров деградации хряща (соотношение в моче уровня CTX-II к креатинину (CTX-II/cr) и костной ткани (уровень CTX-I в сыворотке крови).
В настоящем исследовании показано, что уровень CTX-II у пациентов с ОА в начале лечения был достоверно выше по сравнению с показателями пациентов без остеоартроза (p < 0,0001), тогда как уровень CTX-I не зависел от наличия остеоартроза. Применение стронция ранелата приводило к снижению уровня CTX-II с 3-го мес. исследования по сравнению с исходными данными, с достоверным снижением показателя на 36-м мес. лечения (p < 0,001). Уровень соотношения CTX-II к креатинину был на 15–20 % ниже в группе пациентов, получавших стронция ранелат, по сравнению с данными женщин без ОА в течение всего периода наблюдения.
При post-hoc анализе украинских многоцентровых исследований «Баланс» и «Один год жизни с Бивалосом» нами подтверждена положительная роль стронция ранелата в снижении выраженности болевого синдрома у пациентов с остеоартрозом коленных суставов ІІ–ІІІ ст. (Поворознюк В.В. и др., 2011). Результаты пилотного исследования, проведенного в Институте геронтологии НАМН Украины (Григорьева Н.В., Поворознюк В.В., Крочак С.П., Дзерович Н.И., 2011) у женщин в постменопаузальном периоде с гонартрозом, свидетельствуют о положительной динамике выраженности болевого синдрома в коленных суставах (средний уровень боли, боль при подъеме по ступенькам) через 6 мес. терапии Бивалосом. Полученные результаты свидетельствуют о положительном симптом-модифицирующем и структурно-модифицирующем влиянии стронция ранелата у пациентов с остеоартрозом.
Деносумаб
В последнее время в литературных источниках появляются сведения о положительной роли еще одного антиостеопоротического средства, к сожалению, не зарегистрированного в Украине, — деносумаба. Деносумаб — это полностью человеческое моноклональное антитело (изотип иммуноглобулина IgG) к RANKL, механизм действия которого заключается в связывании с RANKL и предотвращении взаимодействий RANK/RANKL. Деносумаб является новым антирезорбтивным лекарственным средством, обладающим прямым воздействием на ключевую систему RANK/RANKL/OPG, регулирующую резорбцию костной ткани. Возрастание RANKL и его взаимодействие с RANK приводят к каскадным геномным трансформациям в костно-мозговых предшественниках остеокластов, превращающихся последовательно в преостеокласты, затем в зрелые активные многоядерные остеокласты, осуществляющие резорбцию костной ткани.
Усиленный синтез цитокинов, играющих важную роль в развитии остеопороза (ИЛ-1, ИЛ-6, ФНО-a), а также дисбаланс в системе RANK/RANKL/OPG имеют особое значение при развитии артритов, в частности, ревматоидного артрита. В связи с этим в настоящее время проводятся многочисленные исследования эффективности деносумаба у пациентов с ревматоидным артритом, однако результаты его положительной роли в предупреждении остеоартроза на сегодняшний день отсутствуют.
Таким образом, данные литературных источников свидетельствуют о потенциальной роли различных классов антиостеопоротических препаратов в лечении пациентов с остеоартрозом. Результаты существующих и проводимых в настоящее время рандомизированных плацебо-контролированных исследований позволят накопить доказательную базу для использования препаратов этой группы, особенно у пациентов с сочетанным развитием остеопороза и остеоартроза.
1. Alexandersen P., Karsdal M.A., Byrjalsen I., Christiansen C. Strontiumranelate effect in postmenopausal women with different clinical levels of osteoarthritis // Climacteric. — 2011. — 14(2). — P. 236-243.
2. Alexandersen P., Karsdal M.A., Qvist P. et al. Strontium ranelate reduces the urinary level of cartilage degradation biomarker CTX-II in postmenopausal women // Bone. — 2007. — 40(1). — Р. 218-222.
3. Bagger Y.Z., Tanko L.B., Alexandersen P. et al. The long-term predictive value of bone mineral density measurements for fracture risk is independent of the site of measurement and the age at diagnosis: results from the Prospective Epidemiological Risk Factors study // Osteoporos. Int. — 2006. — 17(3). — Р. 471-477.
4. Behets C., Williams J.M., Chappard D. et al. Effects of calcitonin on subchondral trabecular bone changes and on osteoarthritic cartilage lesions after acute anterior cruciate ligament deficiency // J. Bone Miner. Res. — 2004. — 19(11). — Р. 1821-1826.
5. Bendele A.M., Hulman J.F. Spontaneous cartilage degeneration in guinea pigs // Arthritis Rheum. — 1988. — 31. — Р. 561-565.
6. Bingham C.O., 3rd, Buckland-Wright J.C., Garnero P. et al. Risedronate decreases biochemical markers of cartilage degradation but does not decrease symptoms or slow radiographic progression in patients with medial compartment osteoarthritis of the knee: results of the two-year multinational knee osteoarthritis structural arthritis study // Arthritis Rheum. — 2006. — 54. — Р. 3494-3507.
7. Bruyere O., Delferriere D., Roux C. et al. Effects of strontium ranelate on spinal osteoarthritis progression // Ann. Rheum. Dis. — 2008. — 67(3). — Р. 335-339.
8. Buckland-Wright J.C., Messent E.A., Bingham C.O. et al. A 2 yr longitudinal radiographic study examining the effect of a bisphosphonate (risedronate) upon subchondral bone loss in osteoarthritic knee patients // Rheumatology (Oxford). — 2007. — 46. — P. 257-264.
9. Burch W.M. Calcitonin stimulates growth and maturation of embryonic chick pelvic cartilage in vitro // Endocrinology. — 1984. — 114(4). — P. 1196-1202.
10. Cooper C., Reginster J.Y., Chapurlat R. et al. Efficacy and safety of oral strontium ranelate for the treatment of knee osteoarthritis: rationale and design of randomised, double-blind, placebo-controlled trial // Curr. Med. Res. Opin. — 2012. — 28(2). — P. 231-239.
11. Dell’Accio F., De Bari C., MF El Tawil N. et al. Activation of WNT and BMP signaling in adult human articular cartilage following mechanical injury //Arthritis Res. Ther. — 2006. — 8(5). — R. 139.
12. Diarra D., Stolina M., Polzer K. et al. Dickkopf-1 is a master regulator of joint remodelling // Nat. Med. — 2007. — 13(2). — Р. 156-163.
13. El Hajjaji H., Williams J.M., Devogelaer J.P. et al. Treatment with calcitonin prevents the net loss of collagen, hyaluronan and proteoglycan aggregates from cartilage in the early stages of canine experimental osteoarthritis // Osteoarthritis Cartilage. — 2004. — 12(11). — P. 904-911.
14. Franchimont P., Bassleer C., Henrotin Y. et al. Effects of human and salmon calcitonin on human articular chondrocytes cultivated in clusters // J. Clin. Endocrinol. Metab. — 1989. — 69(2). — P. 259-266.
15. Garnero P., Aronstein W.S., Cohen S.B. et al. Relationships between biochemical markers of bone and cartilage degradation with radiological progression in patients with knee osteoarthritis receiving risedronate: the Knee Osteoarthritis Structural Arthritis randomized clinical trial // Osteoarthritis Cartilage. — 2008. — 16. — P. 660-666.
16. Hayami T., Pickarski M., Wesolowski G.A. et al. The role of subchondral bone remodeling in osteoarthritis: reduction of cartilage degeneration and prevention of osteophyte formation by alendronate in the rat anterior cruciate ligament transection model // Arthritis Rheum. — 2004. — 50(4). — P. 1193-1206.
17. Hayami T., Pickarski M., Wesolowski G.A. et al. The role of subchondral bone remodeling in osteoarthritis: reduction of cartilage degeneration and prevention of osteophyte formation by alendronate in the rat anterior cruciate ligament transection model // Arthritis Rheum. — 2004. — 50. — P. 1193-1206.
18. Hellio M.P., Peschard M.J., Cohen C. et al. Calcitonin inhibits phospholipase A2 and collagenase activity of human osteoarthritic chondrocytes // Osteoarthritis Cartilage. — 1997. — 5(2). — P. 121-128.
19. Henrotin Y., Labasse A., Zheng S.X. et al. Strontium ranelate increases cartilage matrix formation // J. Bone Miner. Res. — 2001. — 16(2). — P. 299-308.
20. Hu H., Zhang L., Li B. et al. In vitro effect of alendronate on chondrocytes and articular cartilage and subchondral bone in rabbit anterior cruciate ligament transection model // Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. — 2009. — 23(12). — Р. 1474-1481.
21. Jun Iwamoto, Tsuyoshi Takeda, Yoshihiro Sato, Hideo Matsumoto. Effects of Risedronate on Osteoarthritis of the Knee // Yonsei Med. J. — 2010. — 51(2). — P. 164-170.
22. Karsdal M.A., Sumer E.U., Wulf H. et al. Induction of increased cAMP levels in articular chondrocytes blocks matrix metalloproteinase-mediated cartilage degradation, but not aggrecanase-mediated cartilage degradation // Arthritis Rheum. — 2007. — 56. — P. 1549-1558.
23. Kato Y., Nasu N., Takase T. et al. A serum-free medium supplemented with multiplication-stimulating activity (MSA) supports both proliferation and differentiation of chondrocytes in primary culture // Exp. Cell Res. — 1980. — 125(1). — P. 167-174.
24. Khaldi L., Karachalios T., Galanos A., Lyritis G.P. Morphometric changes in the epiphyseal plate of the growing and young adult male rat after long-term salmon calcitonin administration // Calcif. Tissue Int. — 2005. — 76(6). — P. 426-432.
25. Manicourt D.H., Altman R.D., Williams J.M. et al. Treatment with calcitonin suppresses the responses of bone, cartilage, and synovium in the early stages of canine experimental osteoarthritis and significantly reduces the severity of the cartilage lesions // Arthritis Rheum. — 1999. — 42(6). — P. 1159-1167.
26. Manicourt D.H., Azria M., Mindeholm L. et al. Oral salmon calcitonin reduces Lequesne’s algofunctional index scores and decreases urinary and serum levels of biomarkers of joint metabolism in knee osteoarthritis // Arthritis Rheum. — 2006. — 54(10). — P. 3205-3211.
27. Muehleman C., Green J., Williams J.M. et al. The effect of bone remodeling inhibition by zoledronic acid in an animal model of cartilage matrix damage // Osteoarthritis Cartilage. — 2002. — 10. — Р. 226-233.
28. Nielsen R.H., Bay-Jensen A.C., Byrjalsen I., Karsdal M.A. Oral salmon calcitonin reduces cartilage and bone pathology in an osteoarthritis rat model with increased subchondral bone turnover // Osteoarthritis Cartilage. — 2011. — 19(4). — Р. 466-473.
29. Schett G., Zwerina J., David J.P. The role of Wnt proteins in arthritis // Nat. Clin. Pract. Rheumatol. — 2008. — 4(9). — Р. 473-480.
30. Segovia-Silvestre T., Bonnefond C., Sondergaard B.C. et al. Identification of the calcitonin receptor in osteoarthritic chondrocytes // BMC Res. Notes. — 2011. — 4. — P. 407.
31. Sondergaard B.C., Wulf H., Henriksen K. et al. Calcitonin directly attenuates collagen type II degradation by inhibition of matrix metalloproteinase expression and activity in articular chondrocytes // Osteoarthritis Cartilage. — 2006.— 14(8). — Р. 759-768.
32. Spector T.D. Bisphosphonates: potential therapeutic agents for disease modification in osteoarthritis // Aging Clin. Exp. Res. — 2003. — 15(5). — Р. 413-418.
33. Spector T.D., Conaghan P.G., Buckland-Wright J.C. et al. Effect of risedronate on joint structure and symptoms of knee osteoarthritis: results of the BRISK randomized, controlled trial // Arthritis Res. Ther. — 2005. — 7. — R. 625-633.
34. Suzuki F., Yoneda T., Shimomura Y. Calcitonin and parathyroid-hormone stimulation of acid mucopolysaccharide synthesis in cultured chondrocytes isolated from growth cartilage // FEBS Lett. — 1976. — 70(1). — Р. 155-158.
35. Tat S.K., Pelletier J.P., Mineau F. et al. Strontium ranelate inhibits key factors affecting bone remodeling in human osteoarthritic subchondral bone osteoblasts // Bone. — 2011. — 49(3). — Р. 559-567.
36. Tat S.K., Pelletier J.P., Velasco C.R. et al. New perspective in osteoarthritis: the OPG and RANKL system as a potential therapeutic target? // Keio J. Med. — 2009. — 58(1). — P. 29-40.