Журнал «Боль. Суставы. Позвоночник» 4 (04) 2011
Вернуться к номеру
Зависимость течения ревматоидного артрита от экологии атмосферы регионов проживания больных
Авторы: Синяченко О.В., Петренко Е.А., Науменко Н.В., Донецкий национальный медицинский университет имени М. Горького
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
Степень загрязнения атмосферы ксенобиотиками влияет на интегральные сонографические признаки артикулярного синдрома у больных ревматоидным артритом, частоту воспаления пястно-фаланговых, голеностопных и коленных сочленений, формирование тендовагинитов, энтезопатий, лигаментоза, внутрисуставных кальцинатов, системного остеопороза, кист Бейкера и хондромных тел, изменения рогов менисков при гоните, поражение периферической нервной системы, темпы прогрессирования заболевания. Характер течения ревматоидного артрита зависит от концентраций аммиака, 3,4-бензпирена, фенола, диоксида азота, серы и углерода в воздухе отдельных городов и сельских районов.
Summary. The pollution rate of atmosphere with xenobiotics influences the integral sonographic signs of articular syndrome in patients with rheumatoid arthritis, frequency of metacarpophalangeal, talocrural and knee joints inflammation, forming of tendovaginites, enthesopathies, ligamentosis, intra-articular calcifications, systemic osteoporosis, Baker’s cysts and cartilage flaps, changes of meniscal horns at gonitis, the peripheral nervous system lesions, rates of disease progression. The characteristics of rheumatoid arthritis course depend on ammonia, 3,4-benzpyrene, phenol, nitrogen dioxide, sulfur and carbon concentrations in the air of certain cities and rural districts.
Резюме. Ступінь забруднення атмосфери ксенобіотиками впливає на інтегральні сонографічні ознаки артикулярного синдрому у хворих на ревматоїдний артрит, частоту запалення п’ясно-фалангових, гомілковостопних й колінних зчленувань, формування тендовагінітів, ентезопатій, лігаментозу, внутрішньосуглобових кальцинатів, системного остеопорозу, кист Бейкера та хондромних тіл, зміни рогів менісків при гоніті, ураження периферичної нервової системи, темпи прогресування захворювання. Характер перебігу ревматоїдного артриту залежить від концентрацій аміаку, 3,4-бензпірену, фенолу, діоксиду азоту, сірки і ву
Ревматоидный артрит, течение, экология, атмосфера.
Key words: rheumatoid arthritis, course, ecology, atmosphere.
Ключові слова: ревматоїдний артрит, перебіг, екологія, атмосфера.
Введение
В настоящее время началось обсуждение возможной связи развития и особенностей последующего течения ревматоидного артрита (РА) с неблагоприятными факторами окружающей среды [1, 6, 12]. Роль загрязняющих экологических агентов (ксенобиотиков) в развитии данного заболевания рассматривается даже в рамках отдельного научного направления — геоэпидемиологии [14, 15]. Уже широко изучается взаимодействие экологических и генетических составляющих в патогенетических построениях РА [2, 5, 11, 16].
Распространенность РА определяется экологической ситуацией в том или ином регионе [3, 9], от чего зависит и дальнейший прогноз заболевания [10]. Считается, что определение влияния неблагоприятных факторов окружающей среды (атмосфера, почва, подземные грунтовые воды) на организм больных РА будет способствовать пониманию новых звеньев патогенеза заболевания [8]. Целью и задачами данной работы стали оценка клинико-лабораторных и инструментальных (рентгенологического, ультразвукового, денситометрического) признаков течения РА в зависимости от загрязнения атмосферы зон проживания больных ксенобиотиками.
Материал и методы
В Донецкой области сконцентрировано около 2000 промышленных предприятий черной и цветной металлургии, угледобывающей, химической (коксохимической), машиностроительной и других отраслей промышленности, а суммарная техногенная антропогенная нагрузка на единицу территории вчетверо выше средней по государству. Вот почему Донецкую область можно считать некой моделью оценки влияния неблагоприятной экологической ситуации на здоровье человека в целом и больных РА в частности. Гигиеническая оценка антропогенного загрязнения окружающей среды проводилась на основании определения ксенобиотиков в атмосферном воздухе. Данные были получены в результате лабораторных исследований санитарно-гигиенических станций, региональных отделений Государственных комитетов по гидрометеорологии, контролю природной среды и экологической безопасности.
Под наблюдением находились 293 больных РА в возрасте от 17 до 79 лет (в среднем 46,0 ± 0,7 года). Среди обследованных было 20 % мужчин и 80 % женщин. Длительность заболевания составила в среднем 9,0 ± 0,4 года. У 20 % обследованных пациентов констатирована I степень активности патологического процесса, у 46 % — II, у 34 % — III. I рентгенологическая стадия РА установлена в 9 % наблюдений, II — в 39 %, III — в 34 %, IV — в 19 %. Индекс прогрессирования артрита (X), как частное от деления квадрата стадии на продолжительность заболевания, был равен 1,520 ± 0,103 о.е. Серопозитивный вариант заболевания имел место у 3/4 больных. Системный процесс отмечен у 29 % пациентов. Параметры суставного счета составили 20,60 ± 0,51, индекса Ричи — 40,20 ± ± 1,18 у.е., индекса Лансбури — 156,80 ± 4,19 у.е. Поражение верхнечелюстных суставов отмечено в 9 % наблюдений, грудино-ключичных — в 3 %, проксимальных межфаланговых кистей — в 84 %, пястно-фаланговых — в 88 %, лучезапястных — в 81 %, локтевых — в 38 %, плечевых — в 40 %, проксимальных межфаланговых стоп — в 61 %, плюснефаланговых — в 70 %, голеностопных — в 75 %, коленных — в 86 %, тазобедренных — в 19 %, крестцово-подвздошных — в 16 %, позвонковых дугоотросчатых — в 41 %. Эпифизарный остеопороз (ОП) диагностирован у 46 % пациентов, системный ОП — у 48 %. Тендовагиниты обнаружены у 46 % больных, энтезопатии — у 26 %, субхондральный склероз — у 64 %, остеофитоз — у 42 %, остеокистоз — у 90 %, остеоузуры — у 50 %, суставные подвывихи — у 27 %, лигаментоз — у 27 %, асептический некроз — у 5 %, суставные кальцинаты — у 36 %, изменения рогов менисков — у 52 %, кисты Бейкера — у 21 %, у 22 % — хондромные тела, у 5 % — тела Гоффа. Среди системных (экстраартикулярных) признаков РА дигитальный артериит и синдром Шегрена выявлены в 4 % случаях, поражение скелетных мышц — в 11 %, лимфоузлов — в 6 %, миокарда — в 19 %, эндокарда и клапанов сердца — в 15 %, серозных оболочек — в 5 %, легких — в 9 %, почек (гломерулонефрит, интерстициальный нефрит, вторичный амилоидоз-АА, подтвержденный нефробиопсией) — в 12 %, печени — в 9 %, центральной нервной системы — в 3 %, периферической — в 13 %.
Жители городов составили 71 % наблюдений, а сельских районов — 29 %. Уровень выбросов в атмосферу на одного больного РА составляет в среднем 1474,40 ± ± 85,15 кг, а показатели накопления промышленных отходов — 738,80 ± 34,72 т. Средняя концентрация аммиака в воздухе регионов проживания больных РА составила 115,40 ± ± 3,93 мкг/м3, 3,4-бензпирена — 5,60 ± 0,22 нг/м3, диоксида азота — 97,20 ± 3,65 мкг/м3, диоксида серы — 178,50 ± ± 6,25 мкг/м3, диоксида углерода — 2,80 ± 0,13 мкг/м3, оксида углерода — 10,50 ± 0,26 мг/м3, сероводорода — 41,70 ± 1,78 мкг/м3 и фенола — 8,60 ± 0,24 мкг/м3. Превышение предельно допустимых концентраций (ПДК) аммиака и 3,4-бензпирена в воздухе постоянно испытывали 93 % больных, диоксида азота — 84 %, диоксида серы и оксида углерода — 98 %, диоксида углерода — 56 %, сероводорода и фенола — 99 %. Интегральная степень загрязнения атмосферного воздуха составила 1,040 ± 0,031 у.е.
Пациентам выполняли рентгеновское (аппарат Multix-Compact, Siеmens, Германия) и ультразвуковое (аппарат Envisor, Philips, Голландия) исследование периферических суставов, крестцово-подвздошных сочленений и позвоночника, а также двухэнергетическую рентгеновскую остеоденситометрию проксимального отдела бедренной кости (аппарат QDR-4500-Delphi, Hologic, США).
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения, их ошибки, среднеквадратические отклонения, коэффициенты корреляции, критерии дисперсии (D), Стьюдента, Уилкоксона — Рао (WR), хи-квадрат (c2) Макнемара — Фишера и достоверность статистических показателей (р).
Результаты
По данным однофакторного дисперсионного анализа, интегральный показатель выбросов ксенобиотиков в атмосферу (W) не влияет на стадию РА, X, серопозитивность заболевания, наличие системных проявлений, распространенность суставного синдрома, индексы Ричи и Лансбури. Необходимо отметить, что существует прямая корреляционная связь между значениями W и суставного счета. Многофакторный дисперсионный анализ демонстрирует высокую степень воздействия W на суммарные сонографические признаки РА, но не на характер вовлечения в патологический процесс суставов, рентгено-остеоденситометрические и системные (экстраартикулярные) признаки.
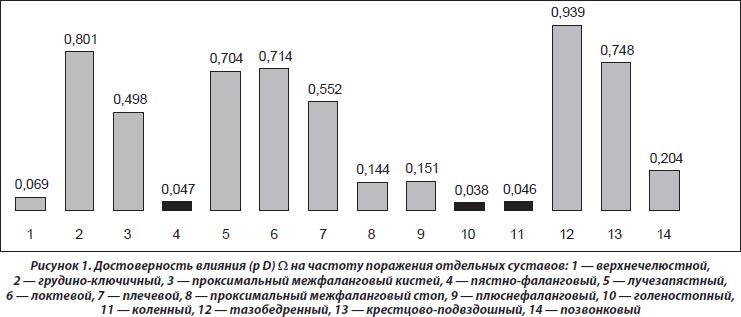
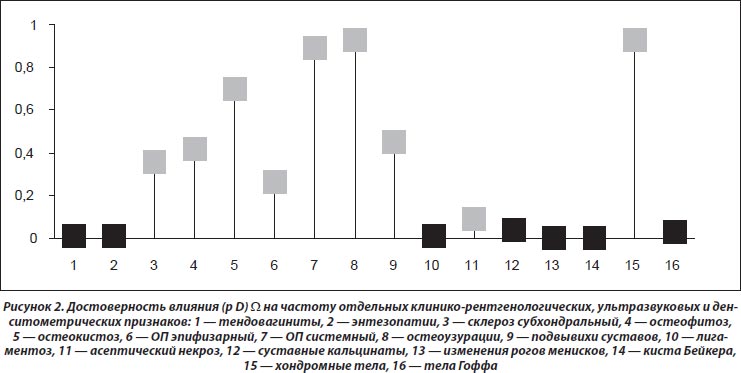
Как видно из рис. 1, степень выраженности загрязнения атмосферы ксенобиотиками достоверно влияет (на рисунке обозначено черным цветом) на частоту поражения плюснефаланговых, голеностопных и коленных суставов. При этом отмечается зависимость развития тендовагинитов, энтезопатий, лигаментоза, интраартикулярных кальцинатов, изменений рогов менисков, кист Бейкера и тел Гоффа от параметров W. Эти данные нашли свое отражение на рис. 2.
Мы распределили всех обследованных пациентов с РА на две группы: с нормальными показателями W (< 2 о.е., 84 % больных) и с высоким уровнем ксенобиотиков в атмосфере (> 2 о.е., 16 %). Оказалось, что в зонах проживания больных РА на 14 % достоверно чаще констатируется вовлечение в патологический процесс коленных суставов, на 41 % — развитие тендовагинитов, на 70 % — лигаментоза, на 67 % — изменений рогов менисков, в 2 раза — кист Бейкера. На основании полученных данных можно говорить о связях тяжести РА с неблагоприятным экологическим состоянием атмосферы. Необходимо отметить, что у больных из неблагоприятных регионов в 4,6 раза чаще отмечается поражение центральной нервной системы, на что, по результатам ANOVA, влияет показатель W.
Обсуждение результатов
Однофакторный дисперсионный анализ позволил установить высокую степень воздействия концентрации аммиака в воздухе на темпы прогрессирования РА, его серонегативность, поражение пястно-фаланговых, крестцово-подвздошных сочленений и рогов менисков коленных сочленений, на развитие энтезопатий и системного ОП. Следует отметить, что хроническая интоксикация организма аммиаком (карбонатом аммония) может вызывать склонность людей в этих регионах к артралгиям, оссалгиям и энтезитам, что зачастую списывают на прием различных медикаментозных препаратов по поводу сопутствующей патологии. ANOVA показывает достоверную связь частоты формирования тендовагинитов и энтезопатий, внутрисуставных кальцинатов и системного ОП с уровнем диоксида азота в воздухе.
Высокое содержание в атмосфере диоксида серы в зонах проживания больных РА достоверно влияет на вовлечение в процесс пястно-фаланговых и коленных суставов, развитие энтезитов, интраартикулярных кальцинатов и системного ОП. Диоксид серы (сернистый газ, сернистый ангидрид) при хроническом влиянии на больных РА якобы может вызывать у них постоянную одышку и диспептические расстройства, но мы такой связи у обследованных пациентов с РА не обнаружили.
Если содержание оксида углерода (как и сероводорода) в атмосфере регионов проживания больных РА не оказывает влияния на частоту структурных изменений костей, суставов и периартикулярных тканей, то концентрация диоксида углерода значительно влияет на развитие тендовагинитов, энтезопатий, субхондрального склероза и артикулярных кальцинатов. Газообразная и жидкая двуокись углерода (диоксид углерода, углекислый газ, углекислота) происходит из отбросных газов производства аммиака и образуется при сжигании топлива. Двуокись углерода применяется: для создания защитной среды при сварке металлов, сушки литейных форм, пожаротушения и других целей во всех отраслях промышленности.
Особое внимание обращают на себя очень токсичные 3,4-бензпирен и фенол. Содержание первого из них в атмосфере отдельных регионов оказывает достоверное воздействие на развитие у больных РА тендовагинитов, энтезопатий и повреждение рогов менисков коленных суставов, а второго — на воспаление грудино-ключичных сочленений и энтезисов. Бензпирен представляет собой полициклический ароматический углеводород, образующийся при воздействии высокой температуры на некоторые органические вещества, в большом количестве содержится в выхлопных газах. До 40 % выбросов 3,4-бензпирена приходится на черную металлургию, 26 % — на бытовое отопление, 16 % — на химическую промышленность. Подчеркнем, что концентрация фенола прямо коррелирует с тяжестью РА, оцененной по индексу Лансбури.
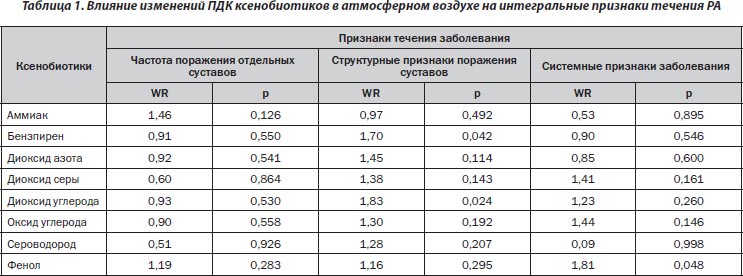
По данным многофакторного дисперсионного анализа, отдельные ксенобиотики в атмосфере не оказывают достоверного влияния на интегральный характер поражения суставов при РА (табл. 1). Вместе с тем рентгенологические, денситометрические и ультразвуковые признаки заболевания тесно связаны с показателями 3,4-бензпирена и диоксида углерода, а системные (внесуставные) — с содержанием фенола.
Мы дополнительно проанализировали степень воздействия на клинические, рентгенологические, денситометрические и ультразвуковые признаки заболевания места проживания больных — город или село. Оказалось, что этот фактор достоверно определяет X, но не влияет на распространенность и тяжесть суставного синдрома. Отметим, что если X у сельских жителей составил 1,200 ± 0,125 о.е., то у городских — 1,650 ± 0,136 (p = 0,048).
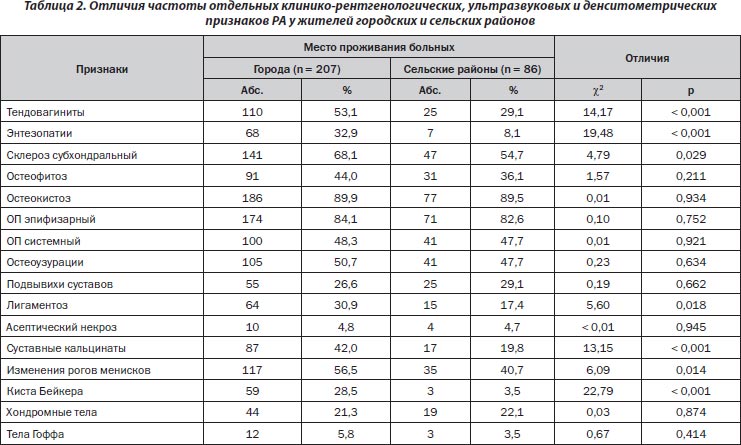
Поражение грудино-ключичных сочленений зарегистрировано только у больных РА из городов. Как показывает метод непараметрической статики Макнемара — Фишера, у городских пациентов на 57 % чаще отмечается воспаление локтевых суставов, а у сельских — на 18 % лучезапястных. По данным литературы, отмечается большая распространенность РА в городах по сравнению с сельской местностью [13], хотя A.J. De Ross et al. [4] безапеляционно утверждают, что занятие сельским хозяйством существенно увеличивает риск развития у людей РА. S.R. Kirkhorn et al. [7] отмечают большую распространенность РА именно у представителей аграрно-промышленного комплекса, но этот факт авторы связывают не с экологической ситуацией на местах, а со спецификой трудовой деятельности больных.
У городских больных на 83 % чаще диагностируются тендовагиниты, в 4,1 раза — энтезопатии, на 25 % — субхондральный склероз, в 1,8 раза — лигаментоз, в 2,1 раза — кальцинаты, на 39 % — изменения рогов менисков, в 8,1 раза — кист Бейкера. Специфичность поражения локтевых и грудино-ключичных суставов у горожан равна соответственно 61 и 100 %, а значимость этого признака — 16 и 4 %. Специфичность тендовагинитов, энтезопатий, лигаментоза, интраартикулярных кальцинатов, изменений рогов менисков и формирования кист Бейкера для больных из городов составляет соответственно 82, 91, 75, 81, 77 и 95 %, а относительная значимость этих признаков — 35, 27, 38, 20, 34 и 26 %.
Выводы
1. Степень загрязнения атмосферы ксенобиотиками достоверно влияет на интегральные сонографические признаки артикулярного синдрома у больных РА, частоту воспаления пястно-фаланговых, голеностопных и коленных сочленений, формирование тендовагинитов, энтезопатий, лигаментоза, внутрисуставных кальцинатов, системного ОП, кист Бейкера и хондромных тел, изменения рогов менисков при гоните, поражение периферической нервной системы, темпы прогрессирования заболевания.
2. Характер течения РА зависит от концентраций аммиака, 3,4-бензпирена, фенола, диоксида азота, серы и углерода в воздухе отдельных городов и сельских районов.
3. От степени накопления отходов деятельности человека в регионах зависят сонографические признаки суставного синдрома при РА, изменения со стороны верхнечелюстных и коленных суставов, периартикулярных тканей и периферической нервной системы.
4. Представленные данные будут полезными при проведении эпидемиологических, профилактических и реабилитационных мероприятий в рамках изучения РА, а результаты проведенных исследований откроют новые звенья патогенетических построений заболевания.
1. Синяченко О.В. Ревматические заболевания и экология // Укр. ревматол. журн. — 2007. — 30 (4). — С. 64-68.
2. Adams D.D. Autoimmune diseases: Solution of the environmental, immunological and genetic components with principles for immunotherapy and transplantation / D.D. Adams, J.G. Knight, A. Ebringer // Autoimmun. Rev. — 2010. — 9 (8). — P. 525-530.
3. Carmona L. Rheumatoid arthritis / L. Carmona, M. Cross, B. Williams, M. Lassere // Best Pract. Res. Clin. Rheumatol. — 2010. — 24 (6). — P. 733-745.
4. De Roos A.J. Rheumatoid arthritis among women in the Agricultural Health Study: risk associated with farming activities and exposures / A.J. De Roos, G.S. Cooper, M.C. Alavanja, D.P. Sandler // Ann. Epidemiol. — 2005. — 15 (10). — P. 762-770.
5. Engelman C.D. Detecting gene-environment interactions in genome-wide association data / C.D. Engelman, J.W. Baurley, Y.F. Chiu, B.R. Joubert // Genet. Epidemiol. — 2009. — 33 (1). — P. 68-73.
6. Holmberg S. Is there an increased risk of knee osteoarthritis among farmers? A population-based case-control study / S. Holmberg, A. Thelin, N. Thelin // Int. Arch. Occup. Environ Health. — 2009. — 77 (5). — P. 345-350.
7. Kirkhorn S. The epidemiology of agriculture-related osteoarthritis and its impact on occupational disability / S. Kirkhorn, R.T. Greenlee, J.C. Reeser // WMJ. — 2008. — (102) 7. — P. 38-44.
8. Kobayashi S. Molecular aspects of rheumatoid arthritis: role of environmental factors / S. Kobayashi, S. Momohara, N. Kamatani, H. Okamoto // FEBS J. — 2008. — 275 (18). — P. 4456-4462.
9. Markatseli T.E. Prognostic factors for erosive rheumatoid arthritis / T.E. Markatseli, C. Papagoras, A.A. Drosos // Clin. Exp. Rheumatol. — 2010. — 28 (1). — P. 114-123.
10. Meziani R.A trans-ethnic genetic study of rheumatoid arthritis identified FCGR2A as a candidate common risk factor in Japanese and European populations / R. Meziani, R. Yamada, M. Takahashi, K. Ohigash // Mod. Rheumatol. — 2011. — 24 (5). — P. 92-99.
11. Oliver J.E. What epidemiology has told us about risk factors and aetiopathogenesis in rheumatic diseases / J.E. Oliver, A.J. Silman // Arthritis Res. Ther. — 2009. — 11 (3). — P. 223-229.
12. Proffitt F. Ecology. Circling in on a vulture killer / F. Proffitt, P. Bagla // Science. — 2009. — 306 (5694). — P. 223-233.
13. Rodriguez-Amado J. Epidemiology of rheumatic diseases. A community-based study in urban and rural populations in the state of Nuevo Leon, Mexico / J. Rodriguez-Amado, I. Pelaez-Ballestas, L.H. Sanin, J.A. Esquivel-Valerio // J. Rheumatol. Suppl. — 2011. — 86 (1). — P. 9-14.
14. Shapira Y. Geoepidemiology of autoimmune rheumatic diseases / Y. Shapira, N. Agmon-Levin, Y. Shoenfeld // Nat. Rev. Rheumatol. — 2010. — 6 (8). — P. 468-476.
15. Toboіn G.J. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis / G.J. Toboіn, P. Youinou, A. Saraux // J. Autoimmun. — 2010. — 35 (1). — P. 10-14.
16. Trenkmann M. Epigenetics in rheumatoid arthritis / M. Trenkmann, M. Brock, C. Ospelt, S. Gay // Clin. Rev. Allergy Immunol. — 2010. — 39 (1). — P. 10-19.