Журнал «Боль. Суставы. Позвоночник» 4 (04) 2011
Вернуться к номеру
Изучение эффективности и безопасности медицинского средства Гиалгель в лечении пациентов с остеоартрозом коленных суставов II–III степени
Авторы: Поворознюк В.В., Орлик Т.В., Козицкая С.В., ГУ «Институт геронтологии АМН Украины», Международный остеоартрологический центр, г. Киев
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
В статье освещены вопросы лечения остеоартроза коленных суставов. Особое внимание уделено средствам, обладающим модифицирующим действием на суставной хрящ. Представлены результаты исследования эффективности, безопасности, переносимости медицинского средства Гиалгель в лечении пациентов старших возрастных групп. Установлено положительное влияние медицинского средства Гиалгель на интенсивность болевого синдрома в коленных суставах, физическую активность и функциональное состояние.
Summary. The article deals with questions of treatment of osteoarthrosis of the knee. Special attention was paid to agents, which has modifying influence on articular cartilage. There were presented the results of the investigation of efficacy, safety, tolerance of Hyalgel agent in treatment of patients from senior age groups. The positive effect of Hyalgel agent on pain intensity in knee joints, physical activity and functional state was ascertained.
Резюме. У статті висвітлені питання лікування остеоартрозу колінних суглобів. Особлива увага приділяється засобам, які мають модифікуючу дію на суглобовий хрящ. Подано результати дослідження ефективності, безпеки, переносимості медичного засобу Гіалгель у лікуванні пацієнтів старших вікових груп. Встановлено позитивний вплив медичного засобу Гіалгель на інтенсивність больового синдрому в колінних суглобах, фізичну активність і функціональний стан.

Остеоартроз — наиболее распространенная форма суставной патологии. В западных странах рентгенологические признаки остеоартроза встречаются у большинства лиц старше 65 лет и приблизительно у 80 % людей старше 75 лет [4, 11]. Около 11 % лиц старше 60 лет имеют симптоматический (с клиническими проявлениями) остеоартроз коленных суставов. Среди жителей США старше 30 лет симптоматический остеоартроз коленных суставов встречается у 6 %. Из-за распространенности и частой нетрудоспособности, которая сопровождает заболевание при локализации в коленных суставах, остеоартроз обусловливает большее количество проблем, связанных с ходьбой и передвижением по лестнице, чем какая-либо другая болезнь [10, 16].
Основу поражения при остеоартрозе составляют изменения в хрящевой ткани, важнейшая функция которой — адаптация сустава к механической нагрузке. При остеоартрозе происходит дегенерация и гибель хондроцитов, развивается деполимеризация основного вещества, продуцируемого ими, снижается количество гликозаминогликанов. Потеря протеогликанов ведет к уменьшению прочности хряща и его дегенерации. Ответная реакция костной ткани выражается в ее разрастании и образовании остеофитов [4, 10, 16].
В июне 2003 года в Лиссабоне состоялся очередной конгресс EULAR (Европейской антиревматической лиги), на котором были предложены новые рекомендации по лечению остеоартроза коленных суставов. Отличительной особенностью данных рекомендаций является то, что впервые указано модифицирующее действие на суставной хрящ таких лекарственных средств, как глюкозамин, хондроитин, гиалуроновая кислота. Согласно современной классификации препаратов, используемых в лечении остеоартроза, их подразделяют на следующие группы [20]:
— симптоматические средства быстрого действия (НПВП, ацетаминофен, опиоидные анальгетики, кортикостероиды и др.), оказывающие влияние на клинические симптомы заболевания (боль, воспаление и др.);
— модифицирующие средства замедленного действия (глюкозамин, хондроитин, гиалуроновая кислота), эффект которых проявляется более медленно по сравнению с симптоматическими средствами и длится после окончания их применения. По мнению некоторых исследователей, указанные фармакологические агенты обладают хондромодифицирующим действием, предупреждая деградацию суставного хряща.
Проведено много исследований по изучению эффективности глюкозамина и хондроитина в лечении остеоартроза коленных и тазобедренных суставов. Результаты исследований были обобщены в обзорах и метаанализах [21, 22, 25, 27]. Симптоматическая эффективность глюкозамина и хондроитина была доказана в обзорах [21, 22]. В метаанализе F. Richi et al. [25] показано, что глюкозамин имеет структурно-модифицирующее и симптоматическое действие, хондроитин — симптоматическое. Доказан положительный эффект в лечении ОА коленных суставов гиалуроновой кислоты [18, 28].
В последние годы препараты глюкозамина и хондроитина активно используются на украинском рынке лекарственных средств. Недавно в Украине появилось новое медицинское средство для местного применения при остеоартрозе суставов Гиалгель — бесцветный прозрачный гель вязкой консистенции, действующими веществами которого являются гиалуронат натрия с молекулярным весом 1100 кДа (80 мг), аквакомплекс глицеросольвата титана (тизоль, 1600 мг), хондроитина сульфат (80 мг), экстракт босвелии (40 мг).
Гиалуронат натрия (биологический аналог гиалуронана, натриевая соль гиалуроновой кислоты) представляет собой несульфатированный гликозаминогликан, полисахарид животного происхождения, состоящий из повторяющихся дисахаридных звеньев N-ацетилгликозамина и глюкуроната натрия. Применяется в ревматологии при артрозах крупных суставов и в офтальмологии при оперативном лечении.
Гиалуроновая кислота (водный раствор гиалуроната натрия) — основа протеогликанов — является природным полимером, обеспечивающим вязкоупругие свойства синовиальной жидкости. Гиалуроновая кислота постоянно циркулирует в полости сустава, но ее концентрация и профиль молекулярного веса остаются постоянными. В случае развития патологических процессов в суставах гиалуроновая кислота деполимеризуется и расщепляется, синовиальная жидкость становится менее вязкой и ее смазывающие, «ударопоглощающие» и фильтрующие способности уменьшаются.
Терапевтический эффект гиалуроната натрия связан с восстановлением вязкости, вследствие чего улучшается физиологический и реологический статус тканей пораженного сустава. В процессе лечения восстанавливается способность сустава вырабатывать эндогенный гиалуронат. Как показывают накопленные клинические данные, применение гиалуроната натрия способствует повышению вязкости синовиальной жидкости, восстановлению ее физико-химических свойств, повышению связывания свободных радикалов, что улучшает защитные функции хрящевой ткани. Замедление разрушения суставного хряща в комплексе с процессами восстановления гомеостаза синовиальной жидкости приводит к купированию болевых симптомов и регрессу явлений ограниченной подвижности в суставе. Положительный эффект гиалуроната натрия проявляется постепенно в течение курса лечения и сохраняется на протяжении нескольких месяцев.
Хондроитин сульфат — сульфатированный гликозаминогликан, который состоит из дисахаридных остатков D-глюкуроновой кислоты и N-ацетилгалактозамина. Это вещество необходимо для формирования протеогликанов. Оно относится к группе модифицирующих средств, является стимулятором регенерации тканей, способствует удержанию воды и восстановлению амортизирующих функций хрящевой ткани. Механизм действия хондроитина сульфата подобен глюкозамину, так как он обеспечивает дополнительный субстрат для формирования здоровой суставной матрицы [10, 23]. Хондроитина сульфат оказывает непосредственное влияние на метаболические процессы. Способствует синтезу и защите коллагена, который является структурной основой всех соединительнотканных структур.
Эффективность хондроитина сульфата в лечении остеоартроза активно исследуется. Morreale et al. провели рандомизированное мультицентровое двойное плацебо-контролируемое исследование, чтобы оценить эффективность хондроитина сульфата при приеме внутрь по сравнению с диклофенаком натрия у пациентов с остеоартрозом коленного сустава. В течение первого месяца пациенты первой группы (НПВП) принимали диклофенак натрия (50 мг) и плацебо (400 мг) три раза в день. В течение второго-третьего месяца пациентам назначали только плацебо в дозе 400 мг три раза в день. Во второй группе (НПВП + хондроитин) пациенты принимали 50 мг диклофенака и 400 мг хондроитина сульфата три раза в день в течение первого месяца. В течение второго-третьего месяца пациенты получали только хондроитина сульфат в дозе 400 мг три раза в день. Пациенты, принимавшие диклофенак натрия, отмечали быстрое уменьшение клинических признаков, однако признаки вновь быстро появлялись после прекращения лечения. Пациенты, принимавшие хондроитина сульфат, имели более медленный ответ на лечение, но благоприятный эффект оставался до трех месяцев после прекращения терапии.
Хондроитин хорошо переносится при приеме внутрь, данных о каких-либо признаках и симптомах токсичности не установлено. Приблизительно 3 % лиц сообщают о небольших диспептических явлениях или тошноте после приема внутрь хондроитина сульфата.
Аквакомплекс глицеросольвата титана (тизоль) — металлоорганический комплекс на основе титана, в котором атом титана химически связан с атомами глицерина и является комплексообразующим центром для составляющих молекул титана и воды. Представляет собой густую, нетекучую, непрозрачную массу белого цвета с сероватым оттенком. Данное средство на основе титана создано сотрудниками «Общества лабораторных исследований медицинских препаратов» (ООО «ОЛИМП», г. Екатеринбург) под руководством Г.П. Лопатиной. Как металлокомплексное соединение, тизоль обладает противовоспалительным действием, а наличие связанных молекул глицерина и атома титана обеспечивает протекторное, дегидратирующее, противоотечное и местное анальгезирующее, увлажняющее, противозудное действие, ускоряет репаративные процессы в коже; обладает стерильностью и микробиологической чистотой [13].
Высокая эффективность применения препарата подтверждена клиническими исследованиями российских ученых. По актуальным вопросам применения данного средства в медицинской практике в Российской Федерации защищено более 20 диссертационных работ. На сегодняшний день тизоль используется в терапии [5], хирургии [6], ревматологии [14], онкологии [2], педиатрии [3], стоматологии [1], офтальмологии [7], гинекологии [9], физиотерапии [12], радиологии [8]. Проведены биофармацевтические исследования комбинированных препаратов на основе тизоля по оценке высвобождения лекарственных веществ из его лекарственных форм. Наиболее изученной лекарственной формой, в которой тизоль успешно применяется в качестве основы, является мазь. При разработке лекарственных препаратов на основе тизоля показана возможность сочетания его с лекарственными веществами разной химической природы с получением устойчивых при хранении лекарственных форм.
Основным свойством тизоля является его проводимость через мягкие ткани. Легкие молекулы он способен транспортировать на глубину до 12 см, тяжелые — до 7 см через различные ткани, включая костную. В сравнении димексид — транскутол — тизоль по силе транскутанного действия соотносятся как 1 : 4 : 30. Тизоль в течение 20–30 минут всасывается через кожу, распределяясь в подкожной клетчатке и подлежащих тканях на глубину до 4–5 см. Повышение концентрации тизоля в крови (оценка по содержанию титана) наблюдается через один час после нанесения препарата, достигает максимума к 7 часам, но не выходит за пределы показателя нормы титана в крови и равномерно убывает до 20–24 часов. Продолжительность поддержания терапевтической концентрации в очаге составляет 8–12 часов. Тизоль не метаболизируется в тканях организма, выделяется в неизменном виде с мочой, желчью, в небольших количествах — через кожу и слизистые оболочки в течение 20–24 часов, в организме не кумулируется.
Тизоль доставляет в патологический очаг действующие вещества, не разрушает их и полностью высвобождает. Установлено, что аквакомплекс глицеросольвата титана при смешивании с лекарственными веществами сохраняет свои лечебные свойства, образует с ними устойчивые гели, способствует повышению их активности за счет транскутанных свойств и транспортировки к патологическому очагу. Благодаря своим основным свойствам тизоль используется как самостоятельное медицинское средство, как проводник для других лекарственных средств и как основа для приготовления мягких лекарственных средств.
Экстракт босвелии — компонент растительного происхождения, который получают из смолы листопадного дерева Boswellia Serrata L. семейства бурзеровых (Burseraceae), произрастающего в горных районах Индии. Индусы применяли босвелию как средство от всевозможных воспалений, за что ее называли «борцом с воспалениями»; она даже была включена в Аюрведу. В Африке с помощью коры этого растения лечили кишечные инфекции, ревматизм, лихорадку, а с помощью смолы — почечную патологию. Босвелия ингибирует провоспалительные медиаторы, особенно лейкотриены.
Босвелиевые кислоты вместе с другими тритерпеновыми кислотами являются активными компонентами босвелии. Механизм их действия основан на ингибировании синтеза провоспалительных медиаторов, в частности лейкотриенов, и подобен механизму действия нестероидных противовоспалительных препаратов, при этом средство проявляет хондронейтральность, не влияя на синтез гликозаминогликанов. Босвелиевые кислоты не вызывают раздражения слизистой желудочно-кишечного тракта, крапивницы, бронхоспазмов и др. Кроме того, босвелия способствует укреплению и восстановлению стенок сосудов, снижает признаки воспаления при артритах.
Экстракт босвелии включает эфирные масла — пинен и камфен и кислоты — тритерпеновые и босвелиевые. На сегодняшний день босвелия ценится во всем мире, поскольку терапия препаратами на основе ее экстракта эффективна и практически не имеет противопоказаний и побочных эффектов. Она обладает выраженными антисептическими, противомикробными и седативными свойствами, широко применяется при воспалительных заболеваниях суставов, улучшает обмен веществ.
В последнее время босвелия привлекает пристальное внимание мирового медицинского сообщества благодаря своим противовоспалительным свойствам. Современная медицина после ряда клинических исследований признала эффективность и безопасность экстракта босвелии. Исследования, проведенные в Индии, установили, что босвелия более эффективна и менее токсична, чем стандартные аптечные лекарственные средства для лечения ревматоидного артрита, такие как кетопрофен, индометацин или аспирин. В ходе клинических испытаний было установлено, что при приеме босвелии в течение 3 месяцев отмечалось эффективное уменьшение отечности и болевых ощущений у больных ревматоидным артритом.
В рандомизированном двойном слепом плацебоконтролируемом перекрестном исследовании оценивались эффективность, безопасность и переносимость экстракта Boswellia Serrata у 30 пациентов с остеоартритом коленных суставов в течение восьми недель. Установлено достоверное снижение боли в коленных суставах, увеличение объема сгибания/разгибания, продолжительности ходьбы, снижение частоты выявления жидкости в коленном суставе [24].
Согласно обзору неопубликованных предварительных двойных слепых исследований, установлена эффективность Boswellia в лечении ревматоидного артрита [15]. В двух плацебо-контролируемых исследованиях с участием 81 пациента с ревматоидным артритом установлено значительное уменьшение отека и боли в течение 3 месяцев. Кроме того, сравнительное исследование 60 человек в течение 6 месяцев установило, что симптоматический эффект применения экстракта Boswellia сопоставим с пероральной терапией препаратами золота. Однако проведенное недавно двойное слепое плацебоконтролируемое исследование, в котором принимали участие 78 человек, страдающих ревматоидным артритом, не показало достоверных результатов эффективности Boswellia [25]. В 6-недельном двойном слепом плацебо-контролируемом исследовании 80 пациентов с бронхиальной астмой легкой степени выраженности установлено, что лечение с применением Boswellia в дозе 300 мг 3 раза в день уменьшает частоту приступов бронхиальной астмы и улучшает параметры дыхательного объема [18].
В двойном слепом исследовании 30 человек с остеоартритом коленного сустава исследователи сравнили эффект Boswellia с плацебо в течение 8 недель [23]. В результатах исследования показано значительное снижение выраженности боли в коленных суставах, улучшение мобильности и ходьбы у пациентов, принимавших Boswellia, по сравнению с плацебо.
Также доказан противовоспалительный эффект экстракта Boswellia у пациентов с болезнью Крона в 8-недельном двойном слепом плацебо-контролируемом исследовании с участием 102 пациентов по сравнению с месалазином [17]. Во всех исследованиях отмечались хорошая клиническая переносимость и отсутствие побочных эффектов или нежелательных явлений.
Несмотря на достаточное количество клинических исследований по изучению препаратов, в состав которых входят отдельные компоненты Гиалгеля, на сегодняшний день недостаточно информации о совместном их применении, тем более в составе одного медицинского средства. Вышеописанные клинические эффекты действующих компонентов медицинского средства Гиалгель послужили основанием для проведения данного исследования.
Цель работы — изучить эффективность, переносимость, безопасность, эффект последействия медицинского средства Гиалгель в лечении пациентов старших возрастных групп с первичным остеоартрозом коленных суставов II–III степени по Kellgren — Lawrence.
Объект исследования
В клинике ГУ «Институт геронтологии НАМН Украины» обследовано 40 пациентов 50–74 лет с первичным остеоартрозом коленных суставов II–III степени по Kellgren — Lawrence, подтвержденным клиническими и рентгенологическим диагностическими методами. В исследование включались женщины и мужчины с болевым синдромом по ВАШ 4–6 см и более при первичном остеоартрозе коленных суставов. На момент включения все пациенты находились под амбулаторным наблюдением в Международном остеоартрологическом центре, но не принимали в данный момент или в течение последних 4 недель какие-либо медикаментозные или немедикаментозные средства для лечения остеоартроза. В исследование также не включались пациенты с вторичным остеоартрозом коленных суставов, повышенной чувствительностью к любому компоненту исследуемого препарата, а также с какими-либо нарушениями целостности кожных покровов в области коленных суставов. В зависимости от дизайна исследования пациенты были разделены на группы:
— I группа — 15 пациентов, применявших Гиалгель один раз в два дня, 8 аппликаций на курс;
— II группа — 15 пациентов, применявших Гиалгель один раз в два дня, 8 аппликаций на курс, в комплексе с диклофенаком натрия ежедневно по 50 мг два раза в день в течение 16 дней;
— III группа — 10 пациентов, принимавших диклофенак натрия ежедневно по 50 мг два раза в день в течение 16 дней.
Диклофенак натрия принимался по 50 мг per os два раза в день после еды в течение 16 дней. Применение Гиалгеля: небольшое количество геля (половина содержимого одной тубы — 2 г) равномерно наносилось тонким слоем на очищенную кожу по окружности коленного сустава массирующими движениями без усиленного втирания 1 раз в 2 дня. Курс применения Гиалгеля составил 8 аппликаций. Общий курс лечения для всех групп пациентов составил 16 дней, период наблюдения — 2 месяца. Пациенты различных групп не различались между собой по возрасту, основным антропометрическим показателям, а также по уровню выраженности болевого синдрома в коленных суставах (табл. 1).
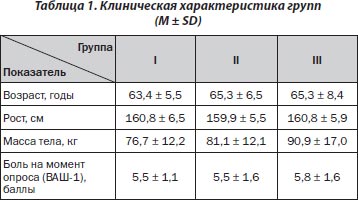
Таким образом, группы пациентов в начале исследования были идентичны по основным критериям включения.
Методы исследования
Проводилось клиническое и ортопедическое обследование с целью установления диагноза первичного остеоартроза коленных суставов. Рентгенография коленных суставов проводилась в вертикальном положении. Выраженность изменений в суставах оценивали по классификации Kellgren — Lawrence. Оценка выраженности и динамики болевого синдрома в коленных суставах проводилась методом анкетирования с помощью опросника Мак-Гилла, визуально-аналоговой шкалы (ВАШ), уровень боли ежедневно оценивался пациентом индивидуально и фиксировался в дневнике боли. Альгофункциональное состояние пациентов оценивали с помощью индекса Лекена и опросника WOMAC. Функциональное состояние коленных суставов определяли с помощью функциональных тестов — 15-метрового и 6-минутного. Качество жизни пациентов оценивали с помощью опросника EuroQol5D (1), а изменение этого показателя на фоне лечения — EuroQol5D (2). Оценка переносимости и контроль побочных реакций проводились при каждом визите. Фиксировались нежелательные явления и побочные эффекты проводимой терапии. Все обследования, оценивающие состояние пациента в течение исследования, проводились до начала лечения, через 16 дней, 1 и 2 месяца от начала лечения.
Результаты исследования
Одним из основных клинических проявлений остеоартроза крупных суставов, особенно коленных, является болевой синдром. В зависимости от стадии и течения заболевания болевой синдром в суставах может быть постоянным или возникать при определенных условиях. Поэтому в оценке эффективности проводимого лечения остеоартроза коленных суставов является рациональным использование усредненного показателя за последние три дня — индекса боли по Хачкинсону. Так, в результате нашего исследования установлено снижение указанного показателя на фоне проведенного лечения: достоверное снижение индекса боли в I группе уже по окончании курса лечения (16 дней, р < 0,000003) и на протяжении всего периода наблюдения через 1 (р < 0,00002) и 2 (р < 0,000002) месяца. Во II группе установлено достоверное снижение данного показателя только через 16 дней (р < 0,01), а в течение периода наблюдения через 1 (р < 0,3) и 2 (р < 0,1) месяца зафиксирована только тенденция к снижению. В III группе на протяжении всего периода исследования (лечения и наблюдения) не установлено достоверного снижения индекса боли (рис. 1А).
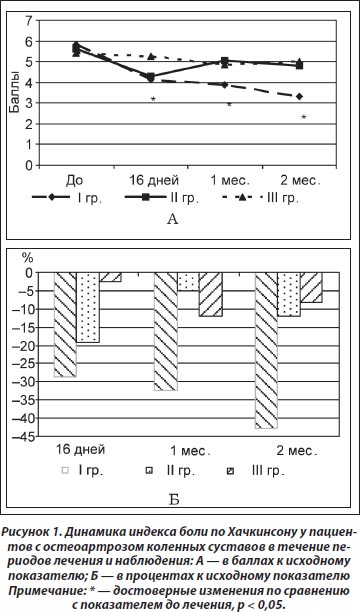
Сравнительный анализ показателя индекса боли между группами установил достоверно большее снижение интенсивности болевого синдрома в I группе по окончании курса терапии (р = 0,02) по сравнению с III группой, а также во время периода наблюдения через 1 месяц (р = 0,03) по сравнению со II группой и через 2 месяца — по сравнению со II (р = 0,003) и III (р = 0,005) группами. В целом снижение индекса боли по отношению к исходному показателю за период лечения (16 дней) и период наблюдения (2 месяца) составило соответственно для I группы 28,5 и 42,7 %, для II группы — 19,04 и 11,98 %, для III группы — 2,38 и 8,3 % (рис. 1Б).
В случаях, когда боль постоянная и выраженная (оценивается по ВАШ как 4 балла и более), к субъективным ощущениям пациента присоединяется эмоциональная окраска боли, что определяется количеством дескрипторов (слов, характеризующих боль) и рангов (суммарный порядковый номер всех отмеченных дескрипторов) по опроснику Мак-Гилла. Так, в нашем исследовании по результатам изучения эмоциональных составляющих болевого синдрома у пациентов, применявших Гиалгель (I группа), установлено достоверное снижение дескрипторного индекса через 1 (р < 0,05) и 2 (р < 0,01) месяца наблюдения, а также рангового индекса через 2 (р < 0,01) месяца, в то время как у пациентов, применявших Гиалгель в комплексе с диклофенаком (II группа), и пациентов, принимавших только диклофенак (III группа), не установлено достоверного снижения данных показателей в течение как периода лечения, так и периода наблюдения (рис. 2А, Б).
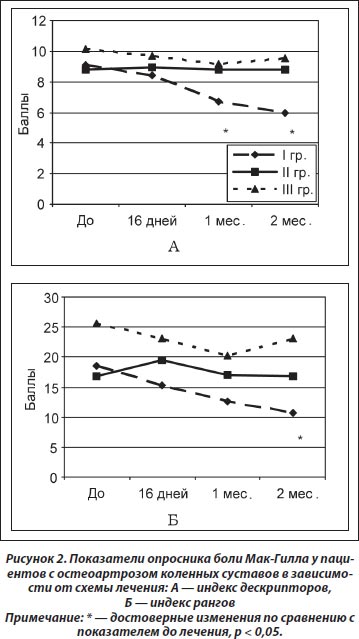
По результатам сравнительного анализа эффективности терапии между группами не установлено достоверных различий по индексам дескрипторов и рангов на протяжении всего периода лечения и наблюдения. По индексу боли установлено, что достоверно ниже показатель в I (р = 0,02) и II (р = 0,03) группах через 16 дней терапии, через 1 месяц — в I (р = 0,03) группе, через 2 месяца — в I (р = 0,003) и II (р = 0,005) группах по сравнению с III группой. Динамика индекса дескрипторов по отношению к исходному показателю за период лечения и период наблюдения составила соответственно для I группы 8,2 и 29,8 %, для II группы — 32,1 и 0,48 %, для III группы — 0,16 и 2,7 %; для индекса рангов — соответственно 5,2 и 40,7 %, 49,8 и 6,4 %, 10,7 и 12,8 %.
Коленные суставы являются самыми крупными суставами скелета, на которые приходится наибольшая вес-несущая нагрузка, поэтому болевой синдром при остеоартрозе данных суставов наиболее многогранен и может проявляться с различной выраженностью (интенсивностью) как в покое, так и при физической нагрузке. По результатам изучения особенностей изменения выраженности болевого синдрома при различных статико-динамических условиях на фоне проводимого лечения установлены достоверные различия между группами в эффективности терапии (табл. 2).
Уровень боли на момент опроса (ВАШ-1) достоверно снизился в I группе по окончании курса лечения (t = 3,00, р = 0,009). Эффект проведенной терапии удерживался на протяжении периода наблюдения через 1 (t = 5,29, р < 0,001) и 2 месяца (t = 5,42, р < 0,001). Во II группе достоверное снижение боли на момент опроса наблюдалось по окончании курса лечения (t = 2,91, р = 0,05) и через 2 месяца наблюдения (t = 3,04, р = = 0,02), в то время как в группе сравнения — только по окончании курса лечения (t = 2,5, р = 0,05). По окончании курса лечения (16 дней) уровень боли на момент опроса был достоверно ниже в I (р = 0,02) и II (р = 0,03) группах по сравнению с таковым показателем в III группе и не различался между группами, применявшими Гиалгель. На протяжении периода наблюдения установлена достоверно более низкая выраженность боли через 1 (р = 0,05) и 2 (р = 0,04) месяца в I группе по сравнению с таковым показателем в III группе. Динамика показателя ВАШ-1 по отношению к исходному показателю составила по окончании периода лечения и наблюдения соответственно для I группы 21,5 и 39,7 %, для II группы — 15,5 и 24,5 %, для III группы — 14,6 и 13,3 %.
Средний (типичный) уровень боли (ВАШ-2) достоверно снизился через 16 дней терапии в I (t = 2,87, р = 0,01) и III (t = 2,83, р = 0,03) группах. Через 1 месяц не установлено достоверного снижения данного показателя ни в одной из групп. Через 2 месяца периода наблюдения боль по ВАШ2 оказалась достоверно ниже по сравнению с показателями до лечения во всех исследуемых группах (I гр.: t = 3,03; р = 0,01; II гр.: t = 2,63; р = 0,03; III гр.: t = 2,46; р = 0,05). Не установлено достоверных различий по данному показателю между группами на протяжении всего периода исследования. Динамика показателя ВАШ-2 по отношению к исходному показателю составила по окончании периода лечения и наблюдения соответственно для I группы 21,3 и 33,1 %, для II группы — 6,6 и 18,2 %, для III группы — 10,2 и 21,4 %.
Минимальный уровень боли (в наилучшие периоды болезни, ВАШ-3) через 16 дней достоверно снизился только во II группе (t = 2,56, р = 0,02). В I группе этот показатель достоверно ниже по сравнению с показателем до лечения в период наблюдения через 1 (t = 2,83, р = 0,03) и 2 (t = 2,83, р = 0,03) месяца. В III группе не установлено достоверной динамики на протяжении всего исследования. В группе, применявшей только Гиалгель, достоверные различия по данному показателю установлены только через 2 месяца наблюдения по сравнению со II (р = 0,03) и III (р = 0,03) группами. Динамика показателя ВАШ-3 по отношению к исходному показателю составила по окончании периода лечения и наблюдения соответственно для I группы 12,5 и 40,3 %, для II группы — 18,9 и 7,7 %, для III группы — 19,6 и 23,2 %.
Максимальный уровень боли (боль в наихудшие периоды болезни, ВАШ-4) был достоверно ниже по сравнению с показателем до лечения в I (t = 3,5, р = 0,004) и II (t = 2,48, р = 0,04) группах только через 2 месяца, хотя по результатам сравнительного анализа влияния терапии на данный показатель между группами не установлено достоверных различий. Динамика показателя ВАШ-4 по отношению к исходному показателю составила при завершении периода лечения и наблюдения соответственно для I группы 1,6 и 22,6 %, для II группы — 5,4 и 14,5 %, для III группы — 4,8 и 13,7 %.
Уровень стартовой боли (ВАШ-5) достоверно снизился по сравнению с показателями до лечения в I (t = 2,46, р = 0,03) и II (t = 2,4, р = 0,04) группах через 2 месяца, однако только в I группе был достоверно ниже по сравнению со II группой через 1 (р = 0,04) месяц и с III группой — через 2 (р = 0,04) месяца наблюдения. Динамика показателя ВАШ-5 по отношению к исходному составила по окончании периода лечения и наблюдения соответственно для I группы 11,8 и 17,8 %, для II группы — 13,3 и 25,1 %, для III группы — 6,9 и 16,8 %.
Боль при продолжительной ходьбе (ВАШ-6) достоверно снизилась на фоне проводимой терапии через 16 дней только во II группе (t = 4,01, р = 0,004), однако в течение периода наблюдения достоверное снижение показателя наблюдалось в I группе через 1 (t = 4,13, р = 0,001) и 2 (t = 5,23, р < 0,001) месяца по сравнению с исходными показателями и соответствующими показателями во II (р = 0,02 и р < 0,001) и III группе (р = 0,05 и р = 0,009). В группе сравнения не установлено достоверной динамики данного показателя боли. Динамика показателя ВАШ-6 по отношению к исходному показателю составила по окончании периода лечения и наблюдения соответственно для I группы 11,8 и 39,6 %, для II группы — 16,9 и 7,7 %, для III группы — 6,2 и 10,8 %.
Боли при продолжительном отдыхе (ночные, ВАШ-7) также достоверно снизились только во II группе по сравнению с исходным показателем через 16 дней лечения (t = 4,01, р = 0,004), а в течение периода наблюдения через 1 и 2 месяца — в I группе (t = 2,87; р = 0,01 и t = 3,44; р = 0,005 соответственно). По сравнению с III группой достоверно лучший показатель выраженности боли при продолжительном отдыхе установлен в I (р = = 0,03) и II (р = 0,05) группах через 16 дней лечения. Через 1 и 2 месяца наблюдения установлен достоверно более низкий показатель боли в I (р = 0,01 и р = 0,002) и II (р = 0,04 и р = 0,01) группах. Не установлено достоверных различий в изменении показателя на протяжении всего исследования между II и III группами. Динамика показателя ВАШ-7 по отношению к исходному составила по окончании периода лечения и наблюдения соответственно для I группы 30,4 и 39,1 %, для II группы — 15,5 и 4,4 %, для III группы — 1,4 и 21,1 %.
Постоянные непрекращающиеся боли (ВАШ-8) достоверно снизились от начала лечения в I группе через 16 дней (t = 3,13; р = 0,007), 1 и 2 месяца (t = 2,52; р = = 0,02 и t = 2,63; р = 0,02 соответственно). Во II группе достоверные различия наблюдались только по завершении периода наблюдения через 2 месяца (t = 2,83; р = 0,02). По эффективности влияния терапии на уровень постоянных болей установлено, что достоверно выше эффект в I группе по сравнению как со II, так и с III группами в течение всего периода исследования: после 16 дней терапии — с III группой (р = 0,02), через 1 месяц — со II и III группами (р = 0,03 и р = 0,05 соответственно), через 2 месяца — со II и III группами (р = 0,04 и р = 0,03 соответственно). Динамика показателя ВАШ-8 по отношению к исходному показателю составила по окончании периода лечения и наблюдения соответственно для I группы 25,2 и 27,7 %, для II группы — 8,2 и 19,1 %, для III группы — 14,3 и 1,2 %.
Уровни боли при ходьбе по лестнице вверх (ВАШ-9), по лестнице вниз (ВАШ-10), по ровной местности (ВАШ-11) в I группе изменялись в течение исследования идентично. Так, установлено достоверное снижение уровня боли при передвижении по сравнению с показателями до лечения уже через 16 дней терапии (ВАШ-9: t = 2,73; р = 0,02; ВАШ-10: t = 2,49; р = 0,03; ВАШ-11: t = 2,47; р = 0,03), эффект сохранялся на протяжении всего периода наблюдения (1 месяц — ВАШ-9: t = 4,25; р = 0,001; ВАШ-10: t = 2,88; р = 0,01; ВАШ-11: t = 4,32; р = 0,001; 2 месяца — ВАШ-9: t = 4,19; р = 0,001; ВАШ-10: t = 3,69; р = 0,003; ВАШ-11: t = 4,05; р = 0,002). Во II группе установлено достоверное снижение показателей уровня боли при передвижении по лестнице вверх и вниз через 16 дней (ВАШ-9: t = 3,06; р = 0,009; ВАШ-10: t = 4,12; р = 0,001), а также через 1 (ВАШ-10: t = 2,84; р = 0,02) и 2 (ВАШ-9: t = 2,94; р = 0,02; ВАШ-10: t = l,97; р = 0,04) месяца наблюдения. Также установлено, что в I группе эффективность снижения боли при передвижении по ровной местности (ВАШ-11) была выше по сравнению с III группой через 16 дней (р = 0,05), 1 (р = 0,04) и 2 (р = 0,01) месяца, а по сравнению со II группой — через 1 (р = 0,02) и 2 (р = 0,001) месяца наблюдения. По показателям ВАШ-9 и ВАШ-10 наблюдались достоверные различия между I и II, III группами в течение периода наблюдения. Не установлено достоверных различий между II и III группами. Динамика показателя ВАШ-9 по отношению к исходному показателю составила по окончании периода лечения и наблюдения соответственно для I группы 19,1 и 27,1 %, для II группы — 18,2 и 22,6 %, для III группы — 7,3 и 0,7 %. ВАШ-10: I группа — 16,2 и 23,3 %, II группа — 21,3 и 15,3 %, III группа — 13,7 и 19,4 %. ВАШ-11: I группа — 25,1 и 41,3 %, II группа — 2,2 и 4,7 %, III группа — 6,5 и 7,1 %.
Согласно международной шкале Womac по изучению динамики альгофункционального состояния, установлено достоверное улучшение в I и II группах. Так, по данным подшкалы болевого синдрома (Womac 1–5) установлено достоверное снижение выраженности боли в коленных суставах через 16 дней лечения в I (t = 4,16; р = 0,001) и II (t = l,88; р = 0,05) группах. Через 1 месяц наблюдалось достоверное снижение показателя по сравнению с исходными данными только в I группе (t = 4,86; р < 0,001), а через 2 месяца эффект сохранялся как в I (t = 3,74; р = 0,003), так и во II (t = l,87; р = 0,05) группах (рис. 3А). По результатам сравнения эффективности терапии между группами установлен достоверно более низкий показатель Womac 1–5 в I (р = 0,007) группе через 16 дней по сравнению с пациентами III группы, а в течение периода наблюдения — как со II (1 месяц — р = 0,02 и 2 месяца — р = 0,01), так и с III (1 месяц — р = 0,01 и 2 месяца — р = 0,02) группами (рис. 3Б).
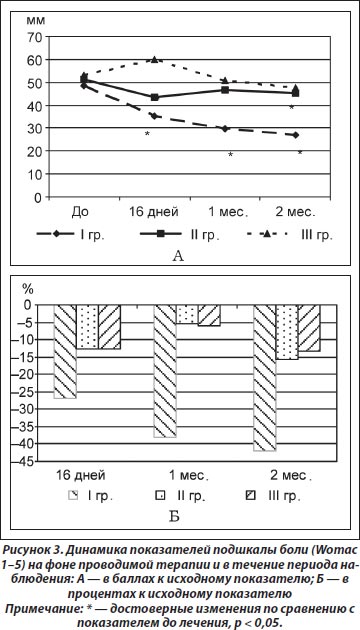
По результатам анализа динамики подшкалы скованности (Womac 6–7) установлено достоверное снижение показателя через 16 дней терапии только в I группе (t = 3,64; р = 0,002). Полученный эффект в I группе сохранялся и на протяжении периода наблюдения через 1 (t = 3,07; р = 0,008) и 2 (t = 2,79; р = 0,02) месяца. Достоверной динамики показателя во II и III группах не выявлено (рис. 4А). Результаты сравнительного анализа данных между группами показали достоверно лучшие результаты в I группе по сравнению с аналогичным показателем в III группе через 16 дней (р = 0,002), а через 1 и 2 месяца — с показателями как III (р = 0,01 и р = 0,04 соответственно), так и II (р = 0,01 и р = 0,01 соответственно) групп (рис. 4Б).
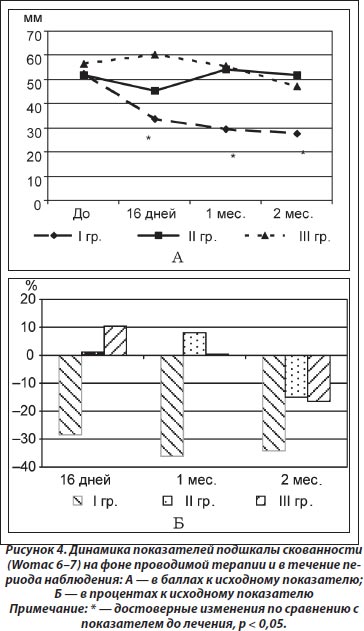
Результаты изменения подшкалы повседневной активности (Womac 8–24) показали достоверное улучшение состояния пациентов, применявших Гиалгель, по окончании курса терапии (16 дн.) в I (t = 3,86; р = 0,002) и II (t = 3,34; р = 0,005) группах. Через 1 месяц эффект удерживался только в I группе (t = 4,64; р < 0,001), хотя через 2 месяца достоверное уменьшение показателя повседневной активности наблюдалось как в I (t = 4,81; р < 0,001), так и во II (t = 5,18; р = 0,001) группе (рис. 5А). Несмотря на полученную положительную динамику показателя Womac 8–24, не выявлено достоверных различий в эффективности терапии между группами через 16 дней, но через 1 и 2 месяца в I группе пациентов показатель был достоверно ниже по сравнению с аналогичными показателями как III (р = 0,01 и р = 0,05 соответственно), так и II (р = 0,02 и р = 0,03 соответственно) группы (рис. 5Б).
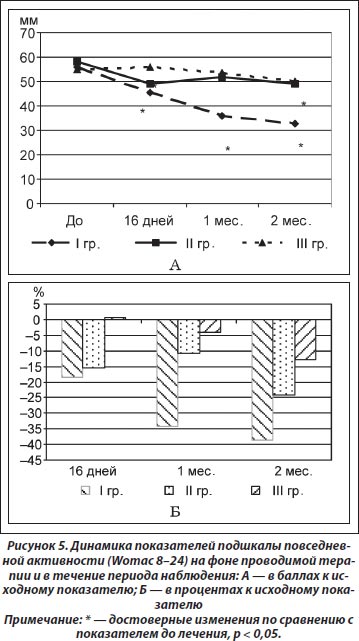
Также установлено достоверное улучшение альгофункционального индекса Лекена на фоне проводимой терапии через 16 дней во II группе (снижение индекса от 14,13 ± 2,97 до 12,47 ± 2,64, t = 3,37; р = 0,005), в то время как в I группе наблюдалась только тенденция (от 13,69 ± 3,48 до 12,19 ± 3,27, t = l,79; р = 0,09). В течение периода наблюдения установлено достоверное снижение индекса Лекена в I группе через 1 (11,27 ± 3,37, t = 2,9; р = 0,01) и 2 (10,54 ± 3,1, t = 3,2; р = 0,008) месяца, а во II группе наблюдалась только тенденция (1 месяц — 12,85 ± 2,54, t = 2,019; р = 0,07; 2 месяца — 13,78 ± 2,59, t = l,9; р = 0,09). В III группе не выявлено достоверных различий по сравнению с показателем до начала лечения. Однако при сравнении полученных результатов между группами не выявлено достоверных различий, кроме показателя через 2 месяца в I группе, который был достоверно лучше по сравнению с показателем пациентов III группы (р = 0,02). Динамика индекса Лекена по отношению к исходному показателю составила по окончании периода лечения и наблюдения соответственно для I группы 5,8 и 19,0 %, для II группы — 11,1 и 8,8 %, для III группы — 3,9 и 13,1 %.
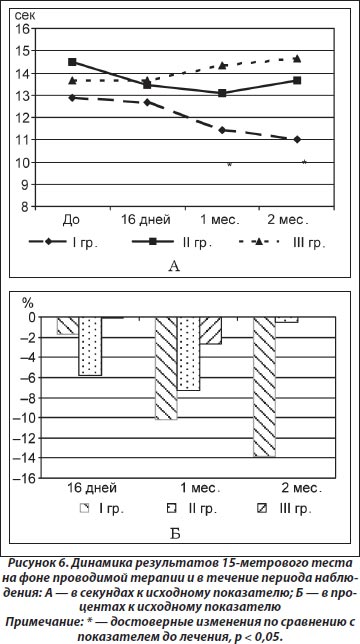
По результатам изучения динамики функциональных тестов на фоне лечения и в период наблюдения установлены особенности влияния терапии на физические возможности пациентов, в частности ходьбу на расстояние и по времени. Так, по результатам 15 метрового теста (время прохождения пациентом расстояния в 15 метров обычным шагом) не выявлено достоверных изменений показателя через 16 дней терапии во всех исследуемых группах. Однако в течение периода наблюдения установлено достоверное уменьшение времени в I группе через 1 (от 12,89 ± 0,93 до 11,44 ± 1,13 с, t = 3,27; р = 0,01) и 2 (до 11,00 ± 1,26 с, t = 2,8; р = 0,04) месяца по сравнению с исходным показателем (рис. 6А), что было достоверно лучше по сравнению с результатами III группы через 1 месяц (р = 0,005), а также через 2 месяца — с результатами II (р = 0,03) и III (р = 0,01) групп (рис. 6Б).
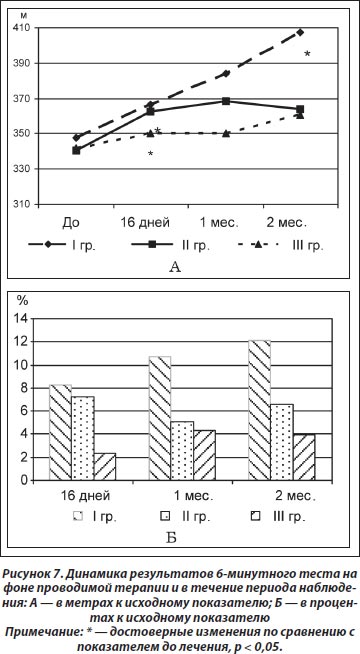
Анализ полученных результатов 6-минутного теста (расстояние, преодолеваемое пациентом за 6 минут ходьбы в обычном темпе) показал достоверное улучшение показателя во II (от 340,50 ± 51,98 до 362,79 ± 45,89 м, t = 2,9; р = 0,01) и III (от 342,00 ± 28,62 до 350,0 ± 30,0 м, t = 4,62; р = 0,04) группах через 16 дней терапии, в то время как в течение периода наблюдения установлено достоверное увеличение преодолеваемого расстояния только в I группе через 2 месяца (от 363,67 ± 49,97 до 407,17 ± 55,18 м, t = 5,42; р = 0,003) (рис. 7А). По результатам сравнительного анализа между группами не установлено достоверных различий (рис. 7Б).
После проведенного лечения установлено улучшение качества жизни пациентов по данным опросника EuroQol5D (1): в I группе — через 1 (от 5,3 ± 1,1 до 3,8 ± 1,8, t = 3,9; р = 0,002) и 2 (до 3,2 ± 1,7, t = 5,3; р < 0,001) месяца, во II — через 2 месяца (от 5,7 ± 0,7 до 4,9 ± 0,9, t = 2,8; р = 0,02), в III группе не установлено достоверного изменения показателя в течение всего периода исследования. По результатам изучения влияния терапии на качество жизни пациентов (EuroQol5D (2)) установлено достоверное улучшение во всех исследуемых группах через 16 дней терапии и через 1 месяц наблюдения. Через 2 месяца достоверное улучшение наблюдалось только в группах, применявших Гиалгель, в группе сравнения достоверных изменений от исходного показателя не выявлено. Однако по результатам сравнения влияния терапии на показатели качества жизни пациентов не установлено достоверных различий между группами, хотя в I группе по истечении 2 месяцев наблюдаются достоверно лучшие показатели по сравнению с пациентами II (р = 0,01) и III (р = 0,01) групп.
В течение периода терапии отмечена хорошая переносимость исследуемых препаратов, однако было зафиксировано два случая нежелательных явлений. Во II группе у одной пациентки через 7 дней терапии (комбинированное применение Гиалгеля и диклофенака) развилась аллергическая реакция на коже ладоней и в области коленных суставов в виде крапивницы. Нежелательное явление было расценено как возможно связанное с применяемым медицинским средством, но не требующее отмены лечения. Однако пациентка по личным соображениям (в анамнезе отмечала наличие подобных аллергических состояний) отказалась от дальнейшего курса терапии, но завершила период наблюдения. Ей были назначены антигистаминные препараты, что дало возможность быстро купировать развившееся состояние и завершить исследование. Вторая пациентка из III группы имела случай однократных болей в эпигастрии на 5-й день приема диклофенака. Был назначен регулярный прием гастропротекторов (омепразола) в течение последующих 2 недель, что дало возможность завершить курс терапии и период наблюдения. Каких-либо других нежелательных явлений в течение исследования зафиксировано не было. В целом выраженность и частота нежелательных явлений не отличались от описанных в литературе.
Выводы
В результате проведенного исследования установлено достоверное положительное влияние применения медицинского средства Гиалгель в течение 16 дней по одной аппликации через день на выраженность и интенсивность болевого синдрома в коленных суставах, функциональное состояние и физическую активность пациентов как во время терапии, так и в течение 2 месяцев наблюдения. Комбинация Гиалгеля с диклофенаком (50 мг два раза в день) также оказывает положительное влияние на клинические проявления остеоартроза коленных суставов, но эффект последействия менее продолжителен. Применение Гиалгеля как модифицирующего средства при остеоартрозе коленных суставов является эффективным и безопасным.
1. Еловикова Т.М. Заболевания пародонта при гипофункции слюнных желез (клинические проявления, диагностика, профилактика, лечение): Автореф. дис… д-ра мед. наук. — Екатеринбург, 2000.
2. Замятин А.В. Совершенствование адъювантной внутрипузырной химиотерапии немышечно-инвазивного рака мочевого пузыря: Автореф. дис… канд. мед. наук. — Уфа, 2008.
3. Зеленцова В.Л. Нефропатии перинатального периода, особенности течения, исходы: Автореф. дис… д-ра мед. наук. — Екатеринбург, 2003.
4. Коваленко В.Н., Борткевич О.П. Остеоартроз: Практическое руководство. — К.: Морион, 2003. — 448 с.
5. Козин В.А. Фармакотерапевтическое действие геля Тизоль при лечении язвенной болезни желудка и 12-перстной кишки: Автореферат дис… канд. мед. наук. — Улан-Удэ, 2008.
6. Применение водорастворимого лекарственного геля Тизоль и его лекарственных композиций в местном лечении хирургической инфекции: Практическое руководство. — Екатеринбург: ГОУ ВПО УГМА Росздрава, 2008.
7. Применение аквакомплекса Тизоль в практике глазных заболеваний: Практическое руководство. — Екатеринбург: ГОУ ВПО УГМА Росздрава, 2001.
8. Применение гелевого препарата Тизоль в онкологии, радиологии и маммологической практике: Практическое руководство. — ГОУ ВПО УГМА Росздрава, ОГУЗ «Свердловский областной онкологический диспансер», 2007.
9. Применение гидрофильного геля Тизоль в местном лечении гинекологических заболеваний: Практическое руководство. — Екатеринбург: ГОУ ВПО УГМА Росздрава, 2001.
10. Поворознюк В.В., Григорьева Н.В. Остеоартроз и постменопауза. Медицина климактерия / Под ред. В.П. Сметник. — Ярославль: ООО «Издательство Литера», 2006. — С. 728-747.
11. Поворознюк В.В. Остеоартроз: современные принципы лечения // Здоровье Украины. — 2003 (ноябрь).
12. Самойлов Д.С. Экспериментальное обоснование применения Тизоль/ультрафонофореза для коррекции восстановительных процессов: Автореф. дис… д-ра мед. наук. — Екатеринбург, 2009.
13. Смагина Т.А., Бекетов Б.Н. Перспективы использования в медицине аквакомплекса глицеросольвата титана и препаратов на его основе // Бюллетень сибирской медицины. — 2006.
14. Соколова Л.А. Реактивный и ревматоидный артриты; триггерная роль инфекционных факторов и новые подходы к диагностике, оценке тяжести и лечению: Автореф. дис... д-ра мед. наук. — Ярославль, 2002.
15. Etzel R. Special extract of Boswellia serrata (H 15) in the treatment of rheumatoid arthritis // Phytomedicine. — 1996. — 3. — P. 91-94.
16. Felson D.T. Osteoarthritis of the knee // N. Engl. J. Med. — 2006. — 354. — P. 841-848.
17. Gerhardt H., Seifert F., Buvari P., Vogelsang H. et al. Therapy of active Crohn disease with Boswellia serrata extract H 15 // Z. Gastroenterol. — 2001. — 39. — P. 11-17.
18. Goldberg V.M., Goldberg L. Intraarticular hyaluronans: the treatment of knee pain in osteoarthritis // Journal of Pain Research. — 2010. — 3. — P. 51-56.
19. Gupta I., Gupta V., Parihar A. et al. Effects of Boswellia serrata gum resin in patients with bronchial asthma: results of a doubleblind, placebocontrolled, 6week clinical study // Eur. J. Med. Res. — 1998. — 3. — 511-514.
20. Jordan K.M., Arden N.K., Doherty M. EULAR recommendations 2003: an evidence based approach to the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann. Rheum. Dis. — 2003. — 62. — P. 1145-1155.
21. Leeb B.F., Schweitzer H., Montag K., Smolen J.S. A metaanalysis of chondroitin sulfate in the treatment of osteoarthritis // J. Rheumatol. — 2000. — 27. — P. 205-211.
22. McAlindon Т.Е., LaValley M.P., Gulin J.P., Felson D.T. Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and metaanalysis // JAMA. — 2000. — 283. — P. 1469-1475.
23. Michel B.A., Stucki G., Frey D. Chondroitins 4 and 6 sulfate in osteoarthritis of the knee: a randomized, controlled trial // Arthritis Rheum. — 2005. — 52. — P. 779-786.
24. Kimmatkar N., Thawani V., Hingorani L. et al. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee — a randomized double blind, placebo controlled trial // Phytomedicine. — 2003. — 10. — P. 37.
25. Richy F., Bruyere O., Ethgen О. Structural and symptomatic efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive metaanalysis // Arch. Intern. Med. — 2003. — 163. — P. 1514-1522.
26. Sander O., Herborn G., Rau R. Is H15 (resin extract of Boswellia serrata, «incense») a useful supplement to established drug therapy of chronic polyarthritis? Results of a doubleblind pilot study [in German, English abstract] // Z. Rheumatol. — 1998. — 57. — P. 1116.
27. Towheed Т.Е., Maxwell L., Anastassiades T.P. Glucosamine therapy for treating osteoarthritis // Cochrane Database Syst. Rev. — 2005. — CD002946-CD002946.
28. Wang С.Т., Lin J., Chang C.J., Lin Y.T., Hou S.M. Therapeutic effects of hyaluronic acid on osteoarthritis of the knee. A metaanalysis of randomized controlled trials // J. Bone Joint Surg. Am. — 2004. — 86A (3). — P. 538-545.