Журнал «Боль. Суставы. Позвоночник» 4 (04) 2011
Вернуться к номеру
Влияние некоторых остеотропных препаратов на консолидацию псевдоартрозов длинных костей и минеральную плотность поврежденной конечности
Авторы: Гюльназарова С.В., Кузнецова О.А., Трифонова Е.Б., Зельский И.А., ФГУ «Уральский НИИ травматологии и ортопедии им. В.Д. Чаклина» Минздравсоцразвития России, г. Екатеринбург
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
73 пациентам в возрасте от 20 до 55 лет с псевдоартрозами бедра и костей голени, осложненными иммобилизационным остеопорозом, проведено лечение методом чрескостного остеосинтеза. В послеоперационном периоде пациенты основной группы (n = 17) получали препарат остеогенон, пациенты группы сравнения (n = 23) принимали препараты кальция с витамином D, 33 пациента составили контрольную группу (только хирургическое лечение). Исследовали динамику костных маркеров ремоделирования, минеральную плотность кости (МПК) пораженной конечности методом двухфотонной рентгеновской денситометрии, сроки консолидации псевдоартрозов. В результате проведенного исследования выявлено, что пациенты с псевдоартрозами длинных костей нижних конечностей и остеопорозом в процессе хирургического лечения продолжают терять костную массу, что удлиняет сроки консолидации. Нормализация сроков сращения достигается при комбинации хирургического лечения с медикаментозной коррекцией остеопороза. Использование с этой целью остеогенона либо препаратов кальция с витамином D предотвращает потерю костной массы в послеоперационном периоде и оказывает положительное влияние на течение репаративного процесса, что проявляется сокращением сроков консолидации по сравнению с контрольной группой. Кроме того, остеогенон способствует увеличению МПК оперированной конечности.
Summary. 73 patients aged 20–55 years old with pseudarthrosis of tibia and hip complicated by the immobilization osteoporosis were treated by percutaneous osteosynthesis. In a postoperative period the basic group patients (n = 17) received osteogenon, the patients of the comparative group (n = 23) took calcium and D vitamin containing agents. 33 patients formed a control group (just surgical treatment). There were studied the dynamics of bone remodeling markers, bone mineral density (BMD) of an injured extremity by dual energy x-ray densitometry as well as pseudarthrosis consolidation terms. The study results demonstrated that the patients with pseudarthrosis of long bones of lower extremities and osteoporosis are still wasting bone mass during surgical treatment that delays consolidation. A surgical treatment combined with drug correction of osteoporosis provides optimal terms of consolidation. Using osteogenon or calcium or D vitamin containing agents prevents bone mass wasting in postoperatine period and has a positive effect on reparative process namely the consolidation becomes faster in comparison with a control group. Moreover osteogenon provides enhance of BMD of operated extremity.
Резюме. 73 пацієнтам віком від 20 до 55 років із псевдоартрозами стегна і кісток гомілки, ускладненими іммобілізаційним остеопорозом, проведено лікування методом черезкісткового остеосинтезу. У післяопераційному періоді пацієнти основної групи (n = 17) отримували препарат остеогенон, пацієнти групи порівняння (n = 23) приймали препарати кальцію з вітаміном D, 33 пацієнти склали контрольну групу (лише хірургічне лікування). Досліджували динаміку кісткових маркерів ремоделювання, мінеральну щільність кістки (МЩК) ураженої кінцівки методом двохфотонної рентгенівської денситометрії, терміни консолідації псевдоартрозу. У результаті проведеного дослідження виявлено, що пацієнти з псевдоартрозом довгих кісток нижніх кінцівок і остеопорозом у процесі хірургічного лікування продовжують втрачати кісткову масу, що подовжує терміни консолідації. Нормалізація термінів зрощення досягається при комбінації хірургічного лікування з медикаментозною корекцією остеопорозу. Використання з цією метою остеогенону або препаратів кальцію з вітаміном D запобігає втраті кісткової маси в післяопераційному періоді і позитивно впливає на перебіг репаративного процесу, що виявляється скороченням термінів консолідації порівняно з контрольною групою. Крім того, остеогенон сприяє збільшенню МПК оперованої кінцівки.
Иммобилизационный остеопороз, минеральная плотность костной ткани, псевдоартроз, чрескостный остеосинтез.
Key words: immobilization osteoporosis, bone mineral density, pseudarthrosis, percutaneous osteosynthesis.
Ключові слова: іммобілізаційний остеопороз, мінеральна щільність кісткової тканини, псевдоартроз, черезкістковий остеосинтез.
Введение
Псевдоартрозы (ПА) являются тяжелыми последствиями переломов длинных костей конечностей, которые приводят к значительным нарушениям функции опорно-двигательного аппарата. Чаще всего страдают лица работоспособного возраста, вынужденные годами пребывать на инвалидности [1–4]. При ПА вследствие длительного отсутствия или снижения нагрузки на поврежденную конечность, как правило, развивается иммобилизационный остеопороз (ОП). Авторами в ранее проведенном исследовании было обнаружено снижение минеральной плотности кости (МПК) у 91,7 % пациентов с ПА бедра и костей голени, при этом у 74,1 % был выявлен остеопороз [5]. По данным А.В. Калашникова, остеопороз и остеопения встречаются у 88 % пациентов с замедленной консолидацией переломов [6].
Наличие остеопороза увеличивает сроки консолидации костных отломков [7–10], повышает риск повторного перелома или недостаточной фиксации уже имеющегося повреждения [11, 12]. Поэтому актуальны исследования, посвященные влиянию препаратов для лечения остеопороза на процесс консолидации переломов [13–16].
Цель исследования: оценить эффективность использования остеогенона и препаратов кальция с витамином D при хирургическом лечении пациентов с псевдоартрозами бедра или костей голени, осложненными иммобилизационным остеопорозом.
Материалы и методы исследования
Проведено проспективное рандомизированное открытое контролируемое исследование, в которое были включены пациенты с диафизарными ПА бедра либо костей голени, осложненными иммобилизационным остеопорозом.
Критерии включения в исследование: пациенты, не принимавшие ранее медикаменты, влияющие на МПК, а также не страдающие заболеваниями, ведущими к развитию вторичного остеопороза. В исследование не включали пациентов старше 55 лет и женщин в менопаузе, пациентов с маркерными остеопоротическими переломами и псевдоартрозами проксимального отдела бедренной кости.
Материал исследования составили 73 пациента (56 мужчин и 17 женщин) в возрасте от 20 до 55 лет (средний возраст 41,3 ± 11,4 года) с ПА бедра и костей голени, осложненными регионарным остеопорозом (Z-критерий от –2,0 до –4,8 SD). Давность травмы составляла в среднем 17,4 ± 10,0 месяца. ПА бедра были у 25 пациентов, а костей голени — у 48. У всех больных ПА сформировались в результате ранее полученных переломов при высокоэнергетической травме.
Клинически у пациентов определялись выраженная патологическая подвижность в зоне повреждения, невозможность нагрузки конечности, необходимость использования костылей при ходьбе. На рентгенограммах пораженного сегмента четко прослеживалась щель или диастаз между отломками. Концы их были истончены, неправильной формы, костномозговые каналы отломков замкнуты компактным слоем костного вещества. Рентгенологические признаки остеопороза были отмечены у всех больных: повышенная прозрачность костного рисунка, увеличение костномозгового пространства, истончение кортикального слоя обоих отломков на всем протяжении, положительный признак Kohler.
Исследование минеральной плотности кости проводили методом двухэнергетической рентгеновской абсорбциометрии (DXA) на денситометре DPX-A (LUNAR, США), исследовали МПК в поясничном отделе позвоночника (L1-L4) и проксимальных отделах обоих бедер (total hip). МПК оценивали как в абсолютных значениях г/см2 (BMD), так и в величинах стандартного отклонения (SD) по Z-критерию. Исследования проводили до операции, к моменту сращения отломков и через 6, 12 и 18 месяцев после достижения консолидации ПА.
В сыворотке крови унифицированными методами изучали активность общей и костной фракций щелочной и кислой фосфатаз, концентрации свободного гидроксипролина, ионизированного кальция, неорганического фосфата, паратгормона; в суточной моче — концентрации общего гидроксипролина, креатинина (Сr), кальция и неорганического фосфата, С-концевых телопептидов коллагена I типа (СТПмочи). Исследования проведены до операции и в течение года после нее с интервалом в три месяца.
Оценку статистической значимости полученных данных проводили с использованием программы BIOSTAT (версия 4.03). При анализе сроков консолидации использовали непараметрические критерии: для сравнения 3 групп применяли критерий Крускала — Уоллиса, при обнаружении различий между группами устанавливали, в чем состоят эти различия с помощью критерия Данна, различия считали значимыми при p < 0,05. С целью оценки динамики МПК использовали дисперсионный анализ повторных измерений. При выявлении отличий между группами применяли критерий Ньюмена — Кейлса, различия считали значимыми при p < 0,05.
В течение 2006–2009 гг. все пациенты были оперированы в одной клинике Уральского НИИ травматологии и ортопедии с использованием однотипного хирургического пособия: открытого чрескостного остеосинтеза аппаратом Илизарова, без костной пластики. Фиксацию отломков обеспечивали аппаратом Илизарова до наступления консолидации.
Для распределения пациентов по группам (основная, контрольная, группа сравнения) применен метод стратификационной рандомизации. Между пациентами трех групп не было достоверных различий по полу, возрасту, локализации псевдоартроза, давности травмы.
В послеоперационном периоде пациентам основной группы (n = 17) назначали препарат остеогенон: в течение первых 3 месяцев в дозе 6 таблеток в сутки, в следующие 3 месяца — по 3 таблетки в день. Пациентам группы сравнения (n = 23) в течение первых 3 месяцев назначали препараты Са по 1000 мг и витамина D по 400 МЕ в сутки, в следующие 3 месяца доза была уменьшена вдвое. Таким образом, пациенты основной группы и группы сравнения получали ежесуточно одинаковое количество элементарного кальция. Пациенты контрольной группы (n = 33) данных препаратов не получали.
Послеоперационное ведение больных во всех трех группах не отличалось, за исключением вышеуказанной медикаментозной терапии. С первых-вторых суток после операции пациентам разрешали вставать, нагрузку оперированной конечности с костылями разрешали к концу первой недели с постепенным ее увеличением. Через 2–3 месяца после остеосинтеза костей голени пациенты нагружали ногу полностью, а при остеосинтезе бедра позже — через 4–5 месяцев после операции. После завершения стационарного лечения пациенты динамически наблюдались в течение всего периода фиксации костей аппаратом Илизарова, а после его демонтажа — в течение 1,5 года.
Результаты и обсуждение
Изучение динамики костных маркеров ремоделирования выявило, что у пациентов контрольной группы в процессе лечения уменьшалась активность костного изофермента щелочной фосфатазы (ЩФтерм) в сыворотке крови, а также резорбтивная активность, о чем свидетельствовало снижение экскреции кальция и С-концевых телопептидов коллагена I типа в течение полугода после операции.
На фоне терапии остеогеноном у пациентов было отмечено увеличение активности костного изофермента кислой фосфатазы (КФтарт) и активности ЩФтерм с преобладанием последней, а также увеличивалась экскреция СТПмочи, кальция и фосфата по сравнению с контрольной группой. У больных, получавших остеогенон, в первые 3 месяца после операции была выявлена более низкая концентрации паратиреоидного гормона по сравнению с контрольной группой, что свидетельствовало об анаболическом эффекте остеогенона. Очевидно, что остеогенон способствует стимуляции процессов костного ремоделирования с преобладанием в нем костеобразования, т.е. переходу из стадии «ленивой кости» к активным перестроечным процессам.
У пациентов, принимавших препараты кальция и витамина D, так же как и у больных, получавших остеогенон, было отмечено повышение активности костного изофермента щелочной фосфатазы, носившее, однако, кратковременный характер (1–3 месяца после остеосинтеза) и увеличение активности КФтарт в течение полугода после операции. Экскреция кальция возрастала только в первые 1–3 месяца после остеосинтеза, а достоверного изменения экскреции неорганического фосфата и С-концевых телопептидов коллагена I типа в группе, принимавшей препараты кальция и витамина D, не было отмечено. Исследование в динамике концентрации паратиреоидного гормона в сыворотке крови выявило достоверно более низкую его концентрацию в течение 1–3 месяцев после операции у больных, получавших препараты кальция и витамина D, по сравнению с пациентами контрольной группы.
Сравнение метаболических показателей у пациентов, получавших препараты кальция с витамином D и остеогенон, показало, что активизация метаболической активности остеобластов у пациентов, получавших препараты кальция и витамина D, была менее продолжительной в отличие от больных, принимавших остеогенон.
В результате проведенного лечения у пациентов всех групп были ликвидированы ПА, восстановлены опороспособность и функция пораженной конечности без повторных оперативных вмешательств. Анализ сроков консолидации у пациентов разных групп выявил их достоверные различия. У пациентов, принимавших остеогенон или препараты кальция с витамином D, по сравнению с больными контрольной группы сращение наступало в более ранние сроки (табл. 1).
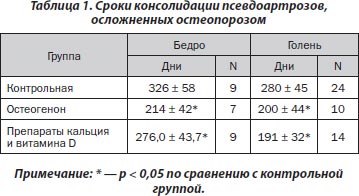
Таким образом, применение в послеоперационном периоде остеогенона и препаратов кальция с витамином D у пациентов с псевдоартрозами бедра и костей голени, осложненных остеопорозом, позволило значительно сократить сроки консолидации (на 28,6–34,3 %) и общую продолжительность лечения по сравнению с контрольной группой.
Изменения МПК внутри групп как у пациентов с ПА бедра, так и костей голени, имели однонаправленный характер, что позволило объединить полученные результаты по динамике МПК у больных с разной локализацией псевдоартрозов. Анализ показателей МПК контралатеральной конечности и поясничного отдела позвоночника показал, что у всех больных они достоверно не менялись как в процессе лечения, так и в течение последующих 1,5 года наблюдения после сращения псевдоартроза. Динамика МПК поврежденной конечности имела принципиальные отличия у пациентов разных групп.
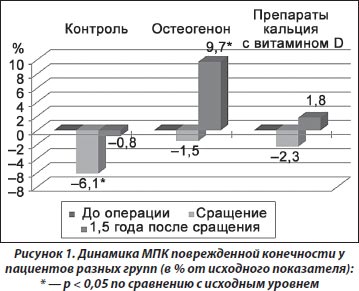
У больных контрольной группы в процессе лечения потеря МПК в оперированной конечности к моменту сращения прогрессировала, о чем свидетельствовало снижение МПК, которое составило 6,1 % по сравнению с дооперационными значениями (р < 0,05). У этих пациентов в последующем в условиях полной функциональной нагрузки МПК поврежденной конечности постепенно увеличивалась, но и через 1,5 года лишь достигала исходных дооперационных значений. У больных, получавших препараты кальция с витамином D, достоверного изменения МПК пораженной конечности не было отмечено как во время лечения, так и в течение последующего периода наблюдения. У пациентов, получавших остеогенон, уже через 6 месяцев после завершения лечения был отмечен прирост МПК на 5,5 % (р = 0,011), через 12 месяцев — на 7,1 % (р = 0,01), а через 1,5 года минеральная плотность в пораженной конечности увеличилась на 9,7 % (р = 0,000) относительно дооперационных значений (рис. 1).
Заключение
Проведенное исследование показало, что пациенты с псевдоартрозами длинных костей нижних конечностей и сопутствующим остеопорозом в процессе хирургического лечения продолжают терять костную массу, что удлиняет сроки консолидации. Нормализация сроков сращения у этой категории больных достигается при комбинации хирургического лечения с медикаментозной коррекцией остеопороза. Использование с этой целью остеогенона либо препаратов кальция с витамином D предотвращает потерю костной массы в послеоперационном периоде и оказывает положительное влияние на течение репаративного процесса, что проявляется сокращением сроков консолидации по сравнению с контрольной группой. Кроме того, остеогенон способствует увеличению МПК оперированной конечности, которая в условиях полной функциональной нагрузки через 1,5 года после сращения составляет 9,7 % по сравнению с фоновыми показателями. Это позволяет обоснованно рекомендовать при хирургическом лечении пациентов с несращениями костей, осложненными иммобилизационным остеопорозом, назначение вышеуказанных остеотропных препаратов для повышения эффективности оперативных вмешательств.
1. Гюльназарова С.В., Штин В.П. Лечение ложных суставов. Теория и практика метода дистракции. — Екатеринбург: Изд-во Уральского государственного университета, 1992. — 143 с.
2. Зоря В.И., Ярыгин Н.В., Склянчук Е.Д., Васильев А.П. Ферментная стимуляция остеогенеза при лечении несросшихся переломов и ложных суставов костей конечностей // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 2007. — № 2. — С. 80-85.
3. Piriou P., Martin J.N., Garreau de Loubresse C., Judet T. Tibia nonunion after intramedullar nailing for fracture: decortication and osteosynthesis by medial plating // Rev. Chir. Orthop. Rep. Appar. Mot. — 2005. — 91, № 3. — P. 222-231.
4. Koprowski P., Golec M., Dybek W. et al. Evaluation of nonunions of the tibia diaphysis — own experience // Ortop. Traum. Rehabil. — 2007. — 9, № 3. — P. 246-253.
5. Гюльназарова С.В., Кузнецова О.А. Остеопороз и остеопения у пациентов с несращениями бедра и костей голени // III Российский конгресс по остеопорозу с международным участием, Россия, г. Екатеринбург, 6–8 октября 2008 г.: тезисы докладов. — Екатеринбург: Изд. дом «Алфавит+», 2008. — С. 123.
6. Калашников А.В. Расстройства репаративного остеогенеза у больных с переломами длинных костей (диагностика, прогнозирование, лечение, профилактика): Автореф. дис… д-ра мед. наук. — К., 2003. — 35 с.
7. Гюльназарова С.В., Мамаев В.И., Трифонова Е.Б. и др. Об особенностях лечения ложных суставов, осложненных остеопорозом // Проблеми остеологiї: науково-практичний журнал. — 1999. — Т. 2, № 3. — С. 121-122.
8. Котельников Г.П., Яшков А.В., Панкратов С.А. Новое в лечении посттравматического локального остеопороза // Проблемы остеопороза в травматологии и ортопедии: тезисы II научно-практической конференции с международным участием, г. Москва, 12–13 февраля 2003 г. — М.: ЦИТО, 2003. — С. 99-100.
9. Гюльназарова С.В. Иммобилизационный остеопороз и особенности консолидации переломов в этих условиях // Проблеми остеологiї: науково-практичний журнал. — 2004. — Т. 7, № 3–4. — С. 96-97.
10. Леонова С.Н. Остеопороз при лечении переломов // Проблема остеопороза в травматологии и ортопедии: 3-я конференция с международным участием, 14–15 февраля 2006 года: тезисы. — М., 2006. — С. 52-53.
11. Горидова Л.Д., Романенко К.К. Тактика лечения больных с переломами длинных костей на фоне остеопороза // Проблеми остеологiї: науково-практичний журнал. — 2001. — Т. 4, № 1–2. — С. 49-50.
12. Goldhahn J., Mitlak B., Aspenberg P. et al. GREES Working Group on Bone Fracture-Healing. Critical issues in translational and clinical research for the study of new technologies to enhance bone repair // J. Bone Jt. Surg. Am. — 2008. — 90 (Suppl. 1). — P. 43-47.
13. Goldhahn J., Scheele W.H., Mitlak B.H. et al. Clinical evaluation of medicinal products for acceleration of fracture healing in patients with osteoporosis // Bone. — 2008. — 43. — P. 343-347.
14. Aspenberg P. Drugs and fracture repair // Acta Orthop. — 2005. — 76. — P. 241-248.
15. Bhandari M., Guyatt G.H., Swiontkowski M.F. et al. A lack of consensus in the assessment of fracture healing among orthopedic surgeons // J. Orthop. Traum. — 2002. — 16. — P. 562-566.
16. Ciprano C.A., Issack P.S., Shindle L. et al. Recent advances toward the clinical application of PTH (1-34) in fracture healing // HSS J. — 2009. — Vol. 5. — P. 149-153.
