Газета «Новости медицины и фармации» Неврология (405) 2012 (тематический номер)
Вернуться к номеру
Многоцентровое (пилотное) исследование эффективности Глиатилина при остром ишемическом инсульте
Авторы: М.М. Одинак1, И.А. Вознюк1, М.А. Пирадов2, С.А. Румянцева3, А.Н. Кузнецов4, С.Н. Янишевский1, С.Ю. Голохвастов1, Н.В. Цыган1 1Военно-медицинская академия им. С.М. Кирова, г. Санкт-Петербург 2Научный центр неврологии РАМН, г. Москва 3ГУЗ «ГКБ № 15 им. О.М. Филатова», г. Москва 4ФГУ «Национальный медико-хирургический центр им. Н.И. Пирогова Росздрава», г. Москва
Версия для печати
Разнообразие факторов риска, этиологии, особенности церебральной ангиоархитектоники определяют гетерогенность инсульта и прогредиентность течения острой цереброваскулярной патологии. Существование областей с различной степенью повреждения в регионе нарушенного кровообращения — «ядерной» зоны ишемии и ишемической полутени — обусловлено тем, что помимо некротического распада роль в регуляции клеточного гомеостаза играет процесс отсроченной, программированной гибели (апоптоз) нейронов и нейроглии [5, 9, 13, 14, 24, 27]. Экспериментальные модели с постоянной и преходящей окклюзией, ряд МРТ-исследований (с оценкой диффузионно-взвешенного изображения), выполненных на животных, демонстрируют, что после первоначального восстановления кровотока развивается отсроченное повреждение ткани мозга. Совокупностью причин реперфузионного повреждения является высокая активность метаболических процессов, вызванных гипоксией, гипогликемией, метаболическим ацидозом, перифокальным (или диффузным) отеком мозгового вещества и вторичной гипоперфузией, а также продолжающимся воздействием факторов риска/патогенеза [10, 11, 13, 19].
Тем не менее церебральная ишемия в области обратимого повреждения, запущенная гипоксическим каскадом кальциевой гибели, имеет пространственные и временные границы. Длительность периода обратимости (терапевтическое окно) индивидуальна и учитывается современной тактикой лечения инсульта. Эта тактика подразумевает решение двух основных задач: максимально раннее восстановление мозгового кровотока и/или проведение нейропротективной терапии [1–4, 6, 9, 24, 27, 32]. Большинство специалистов по нейропротективной терапии выделяют несколько целей при борьбе за выживаемость нейроцитов при состоявшейся ишемии: снижение экспрессии глутамата, нормализация работы ионных насосов и активности Na+-К+-АТФазы, восстановление уровня фосфатидилхолина, ослабление активности фосфолипазы и снижение уровня арахидоновой кислоты и других медиаторов воспаления [15–18, 21, 22, 25, 26, 37].
Подтверждение способности фосфолипидов и деацитилированных фосфолипидов поддерживать целостность мембран нервных клеток путем восстановления синтеза фосфолипидов и нейротрансмиттера ацетилхолина в поврежденном мозге стало основанием в предположении, что эти соединения могут использоваться в качестве нейрозащитных агентов. Центральные холиномиметики (Глиатилин — холина альфосцерат), являясь источниками холина и фосфатидилхолина, поддерживая физиологический уровень ацетилхолина, обладают мембраностабилизирующими свойствами, служат средствами, восстанавливающими межнейрональную трансмиссию. Их цитопротективные свойства многократно изучались и были доказаны в эксперименте и в клинических условиях. В большинстве работ подчеркивается эффективность и дозозависимость терапевтического воздействия нейропротекторов.
Среди рассматриваемых препаратов, выдержавших более десятка рандомизированных и так называемых слепых исследований, уже с 1990-х гг. особое внимание уделяется препаратам экзогенного холина: CDP-холину (цитиколин), GPS-холину (холина альфосцерат — Глиатилин), рекогнану. Центральные холиномиметики, являясь источниками холина и фосфатидилхолина, участвуют в поддержании физиологических уровней ацетилхолина, обладают мембраностабилизирующими свойствами, нормализуя энергетику митохондрий и восстанавливая функционирование Na+-К+-АТФазы, воздействуют (CDP-холин) на восстановление сниженного ишемией уровня АТФ, уменьшают выброс глутамата. Несмотря на снижение синтеза фосфолипидов в условиях острой ишемии, нейроны используют экзогенный холин и ускоренно синтезируют фосфолипиды. Использование экзогенного холина увеличивает доступность продуктов распада фосфолипидов мембран для синтеза ацетилхолина и снижает энергоемкий хо- линергический синтез предшественников, контролирующих выработку транс-миттеров [15, 16, 20, 23, 28–31, 33–36].
Метаанализ четырех крупных клинических исследований (1652 пациента), проведенный для уточнения способности CDP-холина улучшать общий показатель восстановления функций через 3 мес. после начала терапии, подтвердил эффективность препарата. При лечении инсульта отмечен достоверно лучший исход в сравнении с плацебо при использовании дозы 2 г/сут — повышение шансов благоприятного исхода в сравнении с плацебо на 38 %. Warach et al. (2000), объединив данные диффузионно-взвешенной магнитно-резонансной томографии двух клинических исследований, выявили значительное влияние дозы препарата на изменение объема очага поражения: если в группе плацебо размер очага увеличивался в среднем на 84,7 %, то у пациентов, получавших цитиколин в дозе 0,5 г/сут, — на 34 %, а у получавших препарат в дозе 2,0 г/сут — всего на 1,8 % [20, 31].
Клиническая эффективность и переносимость холина альфосцерата была изучена в нескольких клинических исследованиях, наиболее крупным из которых было исследование S.G. Barbagallo et al. (1994), включавшее в себя 2058 пациентов. Лечение начиналось не позднее 10 дней после инсульта или транзиторной ишемической атаки. Все результаты подтверждают эффективность холина альфосцерата при восстановлении неврологических и психических расстройств, являющихся следствием цереброваскулярных нарушений, что наиболее очевидно к 3-му месяцу наблюдений. Нами в период с 1997 по 2005 г. проводились сравнительные клинико-морфологические исследования эффективности применения Глиатилина при острой церебральной ишемии, подтвердившие высокую клиническую эффективность препарата в достижении регресса как общемозговой, так и грубой очаговой неврологической патологии. Собственные экспериментальные работы, сопровождавшиеся ультраструктурным и гистологическим контролем, позволили обнаружить подтверждения цитопротективным свойствам Глиатилина в момент гипоксического повреждения и стимуляции регенеративных/репаративных процессов в случае стабилизации энергетического гомеостаза мозгового вещества в регионе повреждения [7, 8, 12]. Однако рандомизированных исследований по изучению влияния Глиатилина на область формирующегося ишемического инфаркта и сопоставлению с клиническими изменениями при начале лечения с первых суток возникновения симптомов острого заболевания не было.
Цель исследования
Цель данного исследования заключалась в оценке влияния холина альфосцерата (Глиатилина) при парентеральном (внутривенном) и пероральном назначении на острое ишемическое повреждение головного мозга и на его клинический исход.
Задачи:
— оценить влияние Глиатилина на степень неврологического дефицита и способность пациентов к самообслуживанию к концу 3-го месяца наблюдения;
— количественно оценить динамику объема церебрального инфаркта в конце 30-дневного периода парентерального лечения;
— оценить уровень летальности в группе обследуемых спустя 6 месяцев после рандомизации;
— выявить наличие побочных действий препарата в процессе лечения.
Организация исследования
Исследование GLIA проводилось в 2006–2008 гг. в России на базе следующих клинических центров:
1. Государственное образовательное учреждение высшего профессионального образования «Военно-медицинская академия им. С.М. Кирова», г. Санкт-Петербург.
2. Государственное учреждение здравоохранения г. Москвы «Городская клиническая больница № 15 им. О.М. Филатова».
3. Федеральное государственное учреждение «Национальный медико-хирургический центр им. Н.И. Пирогова Росздрава», г. Москва.
4. Государственное учреждение «Научный центр неврологии РАМН», г. Москва.
Дизайн исследования
В ходе исследования было обследовано 800 больных.
Критериями включения пациентов в исследуемую группу явились:
— умеренный или значительный неврологический дефицит (по NIHSS — от 6 до 21 балла) в течение первых суток после дебюта заболевания;
— исключение субарахноидального кровоизлияния, заболевания центральной нервной системы с псевдоинсультным течением, инфаркта мозга стволовой локализации по данным компьютерной томографии либо магнитно-резонансной томографии головного мозга в течение 24 часов после дебюта заболевания;
— функциональная независимость пациента до инсульта: при первичном инсульте — способность к самообслуживанию и повседневной деятельности по шкале Rankin менее 2 баллов, при повторном инсульте — менее 3 баллов;
— уровень образования не менее 5 классов школы.
Критериями исключения пациентов из исследуемой группы явились:
— спонтанное исчезновение большинства неврологических симптомов в течение 24 часов после дебюта заболевания;
— кома;
— эпилепсия;
— деменция;
— черепно-мозговые травмы либо нейрохирургические вмешательства в течение последних 3 лет;
— онкологические заболевания;
— декомпенсированное течение соматических заболеваний;
— получение пациентом других ноо-тропных препаратов после дебюта заболевания;
— беременность;
— лактация.
Пациенты, которые соответствовали критериям включения и у которых не было выявлено критериев исключения, вошли в состав исследуемой группы (группа GLIA-1, 122 больных). В соответствии с целью исследования и для повышения эффективности статистического анализа из числа отобранных пациентов дополнительно были выделены подгруппы:
— GLIA-2 — пациенты с неврологическим дефицитом по NIHSS более 9 баллов в первые сутки после дебюта инсульта (n = 46);
— GLIA-3 — пациенты, которым было выполнено расширенное нейровизуализационное обследование с уточнением объема обратимых повреждений (n = 25);
— GLIA-4 — пациенты группы GLIA-3, у которых не было выявлено дополнительных1 критериев исключения (n = 15).
Дизайн исследования не включал формирование группы плацебо. В связи с этим при проведении статистического анализа были использованы представленные в литературе результаты клинико-инструментальных обследований пациентов групп плацебо в других клинических исследованиях.
Источники данных группы плацебо
В ходе анализа отечественной и зарубежной литературы было изучено 35 журнальных статей (1999–2008), содержавших информацию о результатах клинико-инструментального обследования пациентов с ишемическим инсультом, вошедших в состав групп плацебо. В результате анализа литературы было установлено, что по дизайну исследования и по степени неврологического дефицита в первые сутки после дебюта инсульта пациентам группы GLIA-1 в наибольшей степени соответствовали пациенты группы плацебо исследования W.M. Clark et al. (1999). При анализе результатов расширенного нейровизуализационного исследования в качестве данных группы плацебо были использованы результаты обследования пациентов группы плацебо исследования S. Warach et аl. (2000) [19, 38].
Статистический анализ полученных результатов
Результаты клинико-инструментального обследования накапливались в электронной базе данных с помощью табличного редактора Microsoft Excel в составе Microsoft Office 2007 с последующим переводом в математико-статистический пакет StatSoft Statistica v. 6.0.
В ходе статистического анализа результатов исследования применялись следующие процедуры и методы:
— проверка гипотезы о происхождении групп, сформированных по качественному признаку, из одной и той же популяции, на основе построения таблиц наблюдаемых частот с применением критерия Pearson Chi-square;
— сравнение независимых групп по количественному признаку при помощи параметрического t-критерия Стьюдента (для двух групп);
— корреляционный анализ с использованием коэффициента ранговой корреляции t Кендалла.
Применение непараметрических методов сравнения независимых групп было затруднено в связи с тем, что при описании результатов обследования пациентов групп плацебо по данным литературы во всех случаях были представлены результаты, учитывающие только средние значения и стандартные отклонения показателей.
Назначение препарата
Все пациенты группы GLIA-1 получали Глиатилин по следующей схеме:
— с 1-х по 15-е сутки после дебюта инсульта — 2000 мг внутривенно капельно 1 раз в сутки;
— с 16-х по 30-е сутки после дебюта инсульта — 1000 мг внутривенно капельно либо внутримышечно 1 раз в сутки;
— с 31-х по 90-е сутки после дебюта инсульта — 400 мг внутрь 2 раза в сутки.
Также всем пациентам проводилась базисная терапия, направленная на коррекцию показателей гемодинамики, реологических свойств крови, осложнений инсульта.
Клинико-инструментальное обследование
Согласно протоколу исследования, клиническое обследование на 1, 30 и 90-е сутки после дебюта инсульта включало:
— неврологический осмотр;
— оценку неврологического дефицита по NIHSS;
— оценку способности пациентов к самообслуживанию и повседневной деятельности по индексу Barthel и шкале Rankin.
Всем пациентам группы GLIA-1 осуществлялись:
— стандартное лабораторное обследование;
— комплексная сосудистая диагностика с применением церебральной допплерографии и дуплексного сканирования брахиоцефальных артерий;
— компьютерная томография либо магнитно-резонансная томография головного мозга в течение 24 часов после дебюта заболевания.
Пациентам группы GLIA-3 было проведено расширенное нейровизуализационное обследование, направленное на оценку динамики ишемического повреждения головного мозга и включавшее:
— в 1-е и 3-и сутки после дебюта инсульта — Т1- и Т2-взвешенную магнитно-резонансную, диффузионно-взвешенную, перфузионно-взвешенную томографию;
— на 30-е сутки после дебюта инсульта — Т1- и Т2-взвешенную магнитно-резонансную томографию.
Протокол выполнения магнитно-резонансной томографии включал получение Т2- и Т1-взвешенных изображений в аксиальной плоскости, Т1-взвешенных изображений в сагиттальной плоскости и Т2-взвешенных изображений в коронарной плоскости. В большинстве случаев объем сформировавшегося ишемического очага рассчитывался по данным Т2-взвешенных изображений в аксиальной плоскости.
По данным диффузионно-взвешенных изображений с фактором диффузионного взвешивания b = 1000 производился расчет объема выявленных изменений интенсивности магнитно-резонансного сигнала, соответствовавших ядру инфаркта мозга (рис. 1).

По данным перфузионно-взвешенной магнитно-резонансной томографии оценивали объем и характер перфузионных нарушений, по данным диффузионно-взвешенной магнитно-резонансной томографии — объем необратимого повреждения нервной ткани, по данным Т2-взвешенной магнитно-резонансной томографии — объем инфаркта мозга. При построении перфузионных карт рассчитывали следующие показатели мозгового кровотока:
— ТТР — время до прибытия конт-растного вещества;
— МТТ — среднее время прохождения контрастного вещества;
— CBF — мозговой кровоток;
— CBV — объем мозгового кровотока.
Расчет объема морфологических и перфузионных изменений проводили с использованием возможностей томо-графической станции и специально созданной программы, учитывая данные всей серии аксиальных срезов, число и шаг которых являлись постоянными для всех исследований у каждого пациента.
Оценка выживаемости выполнялась через 6 месяцев после дебюта заболевания.
Результаты исследования
В состав группы GLIA-1 вошли 122 человека (80 мужчин, 42 женщины), средний возраст — 63,78 ± 11,10 года. В 1-е сутки после дебюта инсульта неврологический дефицит по NIHSS составил 10,78 ± 4,13 балла, способность пациентов к самообслуживанию и повседневной деятельности по индексу Barthel — 45,92 ±28,12 балла, по шкале Rankin — 3,60 ± 1,06 балла.
Наиболее адекватной для сравнения, сопоставимой по неврологическому дефициту в дебюте инсульта с группой плацебо (W.M. Clark et al., 1999) явилась подгруппа пациентов с неврологическим дефицитом по NIHSS более 9 баллов в дебюте заболевания (GLIA-2). В табл. 1 показана однородность сравниваемых групп пациентов по степени выраженности неврологических симп-томов в 1-е сутки заболевания.
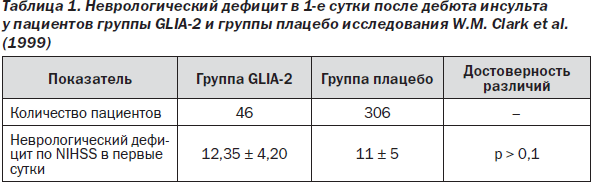
В ходе анализа результатов клиничес- кого обследования с использованием NIHSS, индекса Barthel, шкалы Rankin изучались показатели в 1, 30 и 90-е сутки после дебюта заболевания, их абсолютная и относительная динамика, а также частоты значений шкал менее пороговых уровней.
В результате проведенного анализа установлено, что к 30-м суткам после дебюта инсульта у пациентов группы GLIA-2 достоверно чаще отмечалось значимое клиническое улучшение, проявлявшееся уменьшением выраженности инвалидизирующих симптомов, значимым повышением способности пациентов к самообслуживанию (менее 2 баллов по шкале Rankin) (рис. 2).
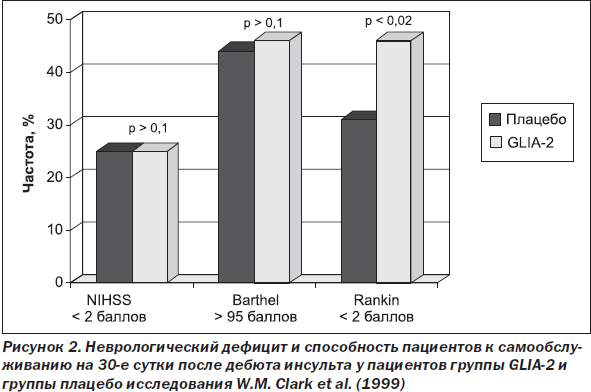
Степень выраженности положительных изменений, наблюдавшаяся в остром периоде инсульта, существенно возрастала к концу 3-го месяца восстановительного лечения. На основании анализа можно было утверждать, что к 90-м суткам после дебюта инсульта у пациентов группы GLIA-2 не только формировалась высокая способность к самообслуживанию (менее 2 баллов по шкале Rankin), но и достоверно чаще, чем в группе плацебо, отмечался умеренный неврологический дефицит (менее 2 баллов по NIHSS) (рис. 3).

Таким образом, применение Глиатилина для лечения пациентов с ишемическим инсультом способствовало уменьшению выраженности неврологических симптомов, увеличивало степень их независимости от помощи персонала и родственников, способствуя формированию самообслуживания.
При анализе результатов магнитно-резонансной томографии, полученных в группе пациентов GLIA-3, в качестве плацебо-контроля использовались результаты обследования пациентов плацебо-группы в исследовании S. Warach et al. (2000).
Для повышения достоверности полученных данных кроме фактических данных магнитно-резонансной томо-графии было проведено тщательное сопоставление характеристик пациентов по всевозможным параметрам, в том числе по возрасту и степени выраженности неврологических расстройств (табл. 3).

Как следует из табл. 3, наличие достоверных различий в возрасте пациентов и степени неврологического дефицита в 1-е сутки после дебюта инсульта не позволило сравнивать результаты обследования пациентов группы GLIA-3 и группы плацебо-контроля. Кроме того, в исследование S. Warach et al. (2000) были включены пациенты с объемом необратимого повреждения нервной ткани по данным диффузионно-взвешенной магнитно-резонансной томографии от 1 до 120 см3 в 1-е сутки после дебюта заболевания.
Для достижения большей однородности анализируемого материала и выделения группы, более сравнимой с группой плацебо-контроля, нами были установлены дополнительные критерии исключения:
— возраст пациентов менее 55 лет;
— наличие стенозирующего атеросклеротического поражения магистральных артерий каротидного бассейна с формированием хронической гипоперфузии;
— объем диффузионно-взвешенной магнитно-резонансной томографии в дебюте инсульта более 120 см3;
— отношение объема перфузионно-диффузионной разницы к объему необратимо поврежденной нервной ткани по данным магнитно-резонансной томографии в дебюте инсульта более чем 17 : 1.
Таким образом, опираясь на дополнительные критерии, из числа пациентов группы GLIA-3 выделили группу GLIA-4, которая оказалась однородной с группой плацебо-контроля по основным клинико-неврологическим и инструментальным показателям. Проведенное сравнение позволило подтвердить отсутствие достоверных различий между пациентами, выбранных для анализа групп (табл. 4). Сравнительному анализу были подвергнуты объемные характеристики инфаркта мозговой ткани, полученные при исследовании в 1-е и 30-е сутки наблюдения. А именно — для оценки степени изменений объема необратимого повреждения нервной ткани использовалась относительная разница:
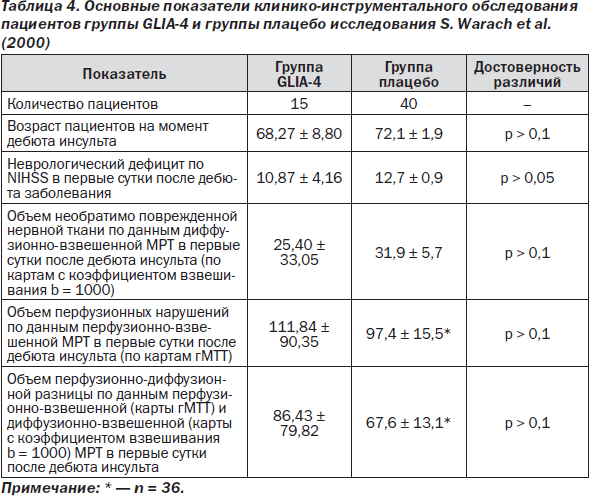
— между объемом необратимого повреждения по данным диффузионно-взвешенной МРТ в 1-е сутки после дебюта инсульта по картам (ДВИ МРТ) с коэффициентом взвешивания b = 1000;
— объемом инфаркта мозга по данным Т2-взвешенной МРТ на 30-е сутки после дебюта инсульта (группа GLIA-4) и на 90-е сутки после дебюта инсульта (плацебо-группа). Указанная динамика в сравнении с данными плацебо представлена в табл. 5.
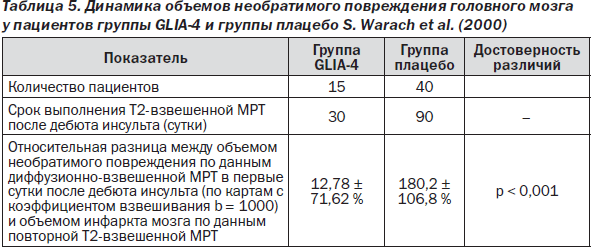
Примененный сравнительный анализ позволяет считать, что использование Глиатилина по предложенной схеме оказалось эффективным. Лечение с применением Глиатилина, начатое с 1-х суток острого периода ишемического инсульта, достоверно предотвращало ожидаемое (потенциально возможное) значительное увеличение конечных размеров мозгового инфаркта — морфологического дефекта мозговой ткани. В среднем у пациентов группы GLIA-4 к концу острого периода наблюдалось увеличение конечного объема инфаркта мозга по сравнению с объемом необратимого повреждения в 1-е сутки только на 13 %, в то время как у пациентов плацебо-группы конечный объем повреждения к концу периода наблюдения достоверно возрастал на 180 %.
Для выявления зависимостей, связанных с динамикой размеров необратимого повреждения нервной ткани, в группе GLIA-4 был проведен корреляционный анализ с использованием коэффициента ранговой корреляции t Кендалла. В ходе проведенного анализа не было установлено зависимостей, связанных с динамикой размеров необратимого повреждения нервной ткани. При анализе результатов обследования пациентов группы GLIA-3 были установлены корреляционные связи, отражающие зависимость клинического исхода от динамики объемов ишемического повреждения головного мозга:
— отрицательная умеренной силы (t = –0,3, р = 0,04) корреляционная связь между преобладанием конечного объема инфаркта над объемом необратимо поврежденной ткани в 1-е сутки после дебюта заболевания и относительной динамикой неврологического дефицита по NIHSS с 1-х по 30-е сутки после дебюта инсульта;
— отрицательная умеренной силы (t = –0,34, р = 0,035) корреляционная связь между преобладанием конечного объема инфаркта над объемом необратимо поврежденной ткани в 1-е сутки после дебюта заболевания и относительной динамикой способности пациента к самообслуживанию и повседневной деятельности с 1-х по 90-е сутки после дебюта инсульта.
Нежелательные явления и клинические исходы
В ходе исследования было зарегистрировано 7 случаев нежелательных явлений (пароксизм мерцательной аритмии, острые эрозии желудка и двенадцатиперстной кишки, пневмония, гидроторакс), не связанных с приемом препарата Глиатилин. Один пациент отказался от продолжения участия в исследовании, в 6 случаях отмечался летальный исход.
Заключение
Проведенное исследование позволило установить, что применение Глиатилина для лечения пациентов с острым ишемическим инсультом способствует уменьшению неврологического дефицита и увеличению способности пациентов к самообслуживанию. Количественная оценка конечного объема инфарктной зоны в группе обследованных больных дает возможность говорить об эффективном сохранении массы мозгового вещества в области обратимых изменений у больных с ишемическим инсультом средней степени тяжести. Полученные результаты также позволяют предположить, что большая степень восстановления нарушенных функций при использовании Глиатилина в лечении пациентов с ишемическим инсультом может быть объяснена меньшим конечным объемом поражения мозга.
Для уточнения полученных результатов и более глубокой клинической и фармакологической оценки многогранного действия Глиатилина при остром ишемическом повреждении головного мозга необходимы дальнейшие исследования.
1. Верещагин Н.В., Пирадов МЛ. Принципы ведения и лечения больных в острейшем периоде инсульта. Интенсивная терапия острых нарушений мозгового кровообращения. — Орел, 1997. — 3-11.
2. Виленский Б.С. Инсульт: профилактика, диагностика и лечение. — СПб.: Фолиант, 2002. — 397.
3. Виленский Б.С. Современная тактика борьбы с инсультом. — СПб.: Фолиант, 2005. — 288.
4. Вознюк И.А., Голохвастов С.Ю., Фокин В.А. и др. Нарушения церебрального кровотока и перфузионные расстройства в остром периоде ишемического инсульта // Инсульт (прил. к Журн. неврологии и психиатрии им. С.С. Корсакова). — 2007. — Спец. вып. — 242-243.
5. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2001. — 327.
6. Инсульт: диагностика, лечение, профилактика / Под ред. З.А. Суслиной, М.А. Пирадова. — М.: МЕДпресс-информ, 2008. — 283.
7. Одинак М.М., Вознюк И.А. Новое в терапии при острой и хронической патологии мозга. — СПб.: ВМедА, 2000. — 31.
8. Одинак М.М., Вознюк И.А., Янишевский С.Н. Ишемия мозга (нейропротективная терапия, дифференцированный подход). — СПб.: ВМедА, 2002. — 75.
9. Одинак М.М., Вознюк И.А. Ишемия мозга — преемственность в решении проблемы // Мед. акад. журн. — 2006. — Т. 6, № 3. — 88-94.
10. Одинак М.М., Вознюк И.А., Голохвастов С.Ю. и др. Мониторинг перфузионных нарушений в острейшую стадию ишемического инсульта // Вестн. Рос. воен.-мед. акад. — 2005. — 2. — 25-30.
11. Одинак М.М., Вознюк И.А., Голохвастов С.Ю. и др. Особенности ранней нейровизуализационной диагностики при острых нарушениях мозгового кровообращения // Регионарное кровообращение и микроциркуляция. — 2007. — 1. — 113-114.
12. Одинак М.М., Вознюк И.А., Янишевский С.Н. Инсульт. Вопросы этиологии, патогенеза. Алгоритмы диагностики и терапии. — СПб.: ВМедА, 2005. — 192.
13. Труфанов Г.Е., Одинак М.М., Фокин В.А. Магнитно-резонансная томография в диагностике ишемического инсульта. — СПб.: ЭЛБИ-СПб., 2008. — 271.
14. Труфанов Г.Е., Фокин В.А., И.В. Пьянов и др. Рентгеновская компьютерная и магнитно-резонансная томография в диагностике ишемического инсульта. — СПб.: ЭЛБИ-СПб, 2005. — 192.
15. Barbagallo S.G., Barbagallo М., Giordano U. et al. Glycerophosphocholine in the mental recovery of cerebral ischemic attacks. An Italian multicenter clinical trial // Pharmacology of Aging Process (Annals of the New York Academv of Sciences). — 1994. — 717. — 253-269.
16. Bergamaschi M., Piccolo O. Dea-cylated phospholipids: Chemistry and therapeutic potential. Phospholipids: characte-rization, metabolism, and novel biological applications / Ed. by G. Cvec, F. Paltauf. — AOCS Press, USA 1995. — 228-247.
17. Blusztajn J.K., Wurtman R.J. Choline and cholinergic neurons // Science. — 1983. — 221. — 19-22.
18. Casamenti F., Mantovani P., Ama-ducci L., Pepeu G. Effect of phosphatidylserine on Ach output from the cerebral cortex of the rat // J. Neurochem. — 1979. — 32. — 529-533.
19. Clark W.M., Wissman S., Albers G.W. et al. Recombinant Tissue-Type Plasminogen Activator (Altepiase) for Ischemic Stroke 3 to 5 Hours After Symptom Onset. The ATLANTIS Study // J. Am. Med. Association. — 1999. — 282, 21. — 2019-2026.
20. D’Orlando J.K., Sandage B.W. Citicoline (CDP-choline): mechanism of action and effects in ischemic brain injury // Neurol. Res. — 1995. — 17. — 281-284.
21. Delwaide P.J., Gyeselynck A.M., Hurlet A., Ylieff M. Double-blind rando-mized controlled study of phosphatidylserine in senile patients // Acta Neurol. Scand. — 1986. — 73. — 136-140.
22. Dorman P.J., Sandercock P.A. Considerations in the design of clinical trials of neuroprotective therapy in acute stroke // Stroke. — 1996. — 27, 9. — 1507-1515.
23. Dross K., Kevitz H. Concentration and origin of choline in the rat brain // N.S. Arch. Pharmacol. — 1972. — 274. — 91-10.
24. Fisher M., Takano K. The penumbra, therapeutic time window and acute ischemic stroke // Baillieres Clin. Neurol. — 1995. — 4, 2. — 279-295.
25. Flentge F., Van Der Berg C.J. Choline administration and Ach in brain // J. Neurochem. — 1979. — 32. — 1331-1333.
26. Freeman J.J., Jenden D.J. The source of choline for Ach synthesis in brain // Life Science. — 1976. — 19. — 949-962.
27. Heiss W.-D. Detection of the penum-bra as a rationale for therapy of ischemic stroke // Журн. неврол. и психиат. (прил. «Инсульт»). — 2003. — 9. — 13-15.
28. Jope R.S. Effects of phosphatidylcholine administration to rats on choline in blood and choline and Ach in brain // J. PET. — 1982. — 220. — 322-328.
29. Jope R.S., Jenden D.J. Choline and phospholipid metabolism and synthesis of Ach in rat brain // J. Neuroscience Res. — 1979. — 4. — 69-82.
30. Loffelholtz K. Receptor regulation of choline phospholipid hydrolysis // Bioche-mical Pharmacol. — 1989. — 38. — 1543-1544.
31. Sandage Jr. et al. Reduction of infarct volume using citicoline // United States Patient. — 1999. — 5. — 872.
32. Schehr R.S. New treatments for acute stroke // Nature Biotechnol. — 1996. — 14. — 1549-1554.
33. Schmidt D.E., Wecker L. CNS effects of choline administration : evidence for temporal dependence // Neuropharmacol. — 1981. — 20. — 535-539.
34. Secades J.J., Frontera G. CDP-choline: Pharmacological and clinical review // Methods Find Exp. Clin. Pharmacol. — 1995. — 17 (suppl. В). — 2-54.
35. Studies on the pharmacological and biochemical effects of aifa-glycerylphospho-rylcholine in experimental animals. Report from Shionogy Research Laboratories.
36. Tommasina C., Manzino M., Novello P., Pastorino P. Studio clinico dell’efficacia terapeutica e della tollerabilita della colina alfos-cerato in 15 soggetti con compromissione delle funzioni cognitive successiva ad ischemia cerebrale focale acuta // Rivista di Neuropsichiatria e Scienze Affmi. — 1991. — 37. — 21-28.
37. Wurtmann R.J., Heftl F., Melamed E. Precursor control of neurotransmitter synthesis // Pharmacological Rev. — 1981. — 32. — 331-335.
38. Warach S., Pettigrew L.C, Dashe J.F. et al. Effect of citicoline on ischemic lesions as measured by diffusion-weighted magnetic resonance imaging. Citicoline 010 Investigators // Ann. Neurol. — 2000. — 48, 5. — 713-722.
