Газета «Новости медицины и фармации» Офтальмология (417) 2012 (тематический номер)
Вернуться к номеру
Коллагенопластика с Ретиналамином в лечении возрастной макулодистрофии
Авторы: М.В. Дунаева, к.м.н., ассистент кафедры неврологии и офтальмологии, ГУ «Днепропетровская медицинская академия» МЗ Украины
Версия для печати
Впервые возрастная макулярная дегенерация была описана в 1885 г. Отто Хаабо как болезнь, заключающаяся в истощении сосудов и нарушении питания центральной части сетчатки глаза. По данным экспертов Всемирной организации здравоохранения, в наступившем столетии дистрофические заболевания сетчатки являются одним из наиболее часто встречающихся заболеваний людей пожилого и старческого возраста и стали главной причиной слабовидения и слепоты [23]. Возрастная макулодистрофия (ВМД) — это инволютивное заболевание центральной области сетчатки, развивающееся у лиц старшего возраста. В наше время проблема ВМД обрела особую актуальность в связи с увеличением продолжительности жизни людей и повышением удельного веса лиц пожилого возраста в структуре всей популяции в странах с высоким уровнем экономического развития. По статистическим данным, во всем мире около 30 % людей старше 70 лет страдают этим заболеванием. ВМД имеет хронический прогрессирующий характер и при отсутствии адекватного лечения приводит к значительному снижению зрения вплоть до слепоты и, как следствие, к инвалидизации [15, 18]. В Украине ситуация с распространенностью ВМД неизменно ухудшается. В общей структуре слепоты более 60 % приходится на дистрофические изменения сетчатки. Так, за последние 20 лет ежегодное количество пациентов с этой патологией, впервые признанных инвалидами по зрению, увеличилось в 2,5 раза [2].
Патогенез ВМД окончательно не изучен. Установлено, что заболевание генетически детерминировано. Однако известны также многие факторы, способствующие развитию заболевания. К ним относятся нарушения обмена веществ, ожирение, атеросклероз сосудов головного мозга, артериальная гипертензия, аутоиммунные заболевания, курение, несбалансированное питание [20, 24]. Пусковым механизмом развития ВМД является нарушение гемодинамики в сосудистой оболочке глаза, что приводит к нарушению трофики и дегенеративным изменениям пигментного эпителия сетчатки (ПЭС) и мембраны Бруха. ПЭС составляет основу гематоретинального барьера и защищает глаз от проникновения токсических веществ из крови. Если пигментный эпителий не в состоянии полноценно выполнять эти функции, в нем и мембране Бруха скапливаются конгломераты продуктов метаболизма, так называемые друзы. На более поздних стадиях ВМД происходит врастание новообразованных патологических сосудов из хориоидеи через повреждения в мембране Бруха под сетчатку. Эти измененные сосуды служат источником отека и кровоизлияний в макулярной области. Процесс завершается разрастанием рубцовой ткани под сетчаткой и гибелью нейроэпителия, вследствие чего возникает слепота. Некоторые ученые рассматривают ВМД как нейровоспаление сетчатки. Так как сетчатка является иммунопривилегированным органом, нарушение тонкого баланса иммунных реакций может запустить целый каскад патологических процессов, результатом которого является формирование друз [16, 25]. По мнению других, есть параллели между ВМД и болезнью Альцгеймера, так как оба процесса заканчиваются дегенерацией нервных клеток [22].
Согласно международной классификации выделяют две стадии ВМД — возрастную макулопатию (ВМП) и собственно ВМД. Последнюю разделяют на сухую и экссудативную формы [11]. ВМП представляет начальную стадию заболевания, основным критерием которой являются влажные сливные друзы в макулярной области сетчатки. На этом этапе жалобы могут отсутствовать, острота зрения, как правило, остается высокой. При прогрессировании процесса ВМП переходит в одну из форм ВМД — сухую или экссудативную. Сухая форма ВМД характеризуется появлением на фоне сливающихся друз очагов деструкции ПЭС округлой или овальной формы, которые медленно увеличиваются по площади. Снижение остроты зрения происходит медленно и необратимо вплоть до сотых. Утрачивается способность к чтению, но сохраняется периферическое зрение — ориентация в пространстве. ВМП и сухая форма ВМД являются наиболее распространенными и диагностируются практически в 90 % клинических случаев. Экссудативная форма ВМД характеризуется наличием новообразованных сосудов, растущих из хориоидеи под сетчатку, подвергающуюся дистрофическому процессу. По сути, рост новообразованных сосудов является попыткой компенсации дистрофического процесса со стороны организма пациента. Разрастаясь, новообразованные сосуды формируют сплетения, так называемые субретинальные неоваскулярные мембраны.
Клинические признаки возрастной макулодистрофии:
1. Друзы.
2. Изменение пигментации.
3. Экссудативные изменения:
— геморрагии;
— твердые экссудаты;
— скопление жидкости в суб- и интраретинальном пространстве.
4. Атрофия:
— начальная;
— географическая.
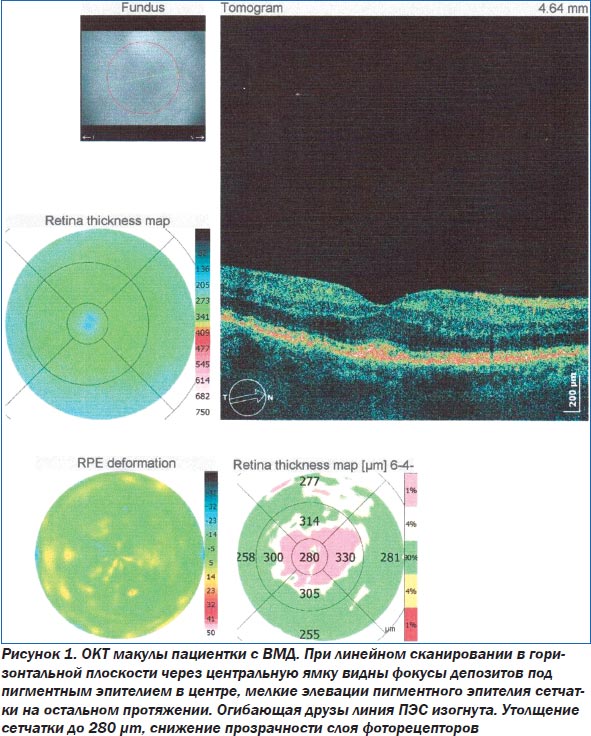
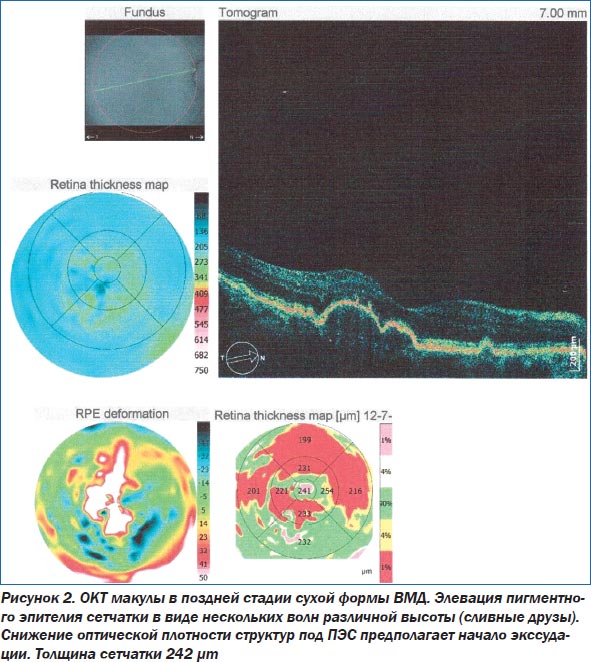
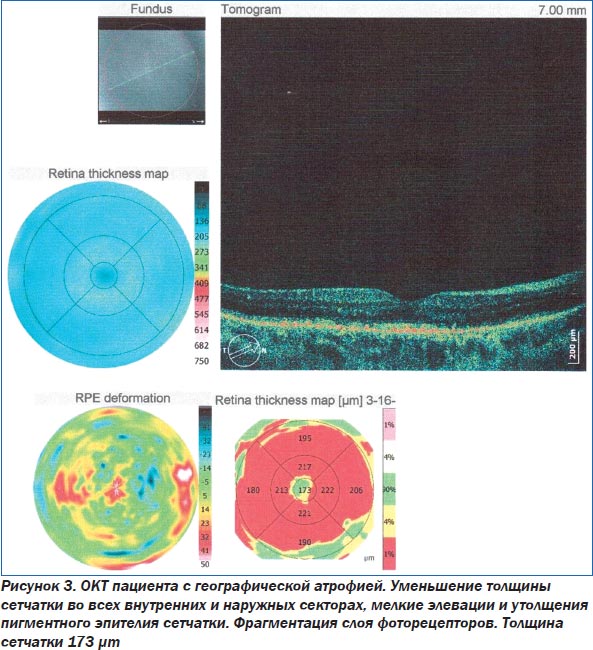
Основным методом диагностики ВМД является офтальмоскопия. Такие современные методы исследования, как флюоресцентная ангиография глаза (ФАГ) и оптическая когерентная томография (ОКТ), помогают уточнить степень поражения сетчатки (рис. 1–3). При проведении ОКТ видны друзы, модулирующие сигнал высокой рефлективности, элевация пигментного эпителия сетчатки. При этом толщина центральной зоны может быть увеличена. При развитии географической атрофии ретина утончается, происходит гипопигментация и деструкция ПЭС. Поздние формы ВМД ведут к развитию географической атрофии — это атрофия пигментного эпителия, слоя хориокапилляров и нейросенсорной сетчатки. Появляются гиперрефлективные зоны.
На сегодняшний день разработаны комплексные методы лечения хориоретинальных дистрофий, включающие в себя медикаментозные, лазерные, хирургические и физиотерапевтические [3–7, 29]. Это соблюдение диеты, физическая активность, отказ от курения, прием статинов, лютеина и зеаксантина [21, 28, 30]. Офтальмологическая наука в настоящее время не располагает достаточно эффективными способами лечения хориоретинальных дистрофий, которые могут привести к ощутимому результату в связи с тяжелыми органическими изменениями в макулярной области. Все методы приводят лишь к стабилизации зрительных функций, достоверно доказанного лечения ВМД не существует [19]. Перспективными являются работы в области генной инженерии [24]. Клинические испытания проходит электрический протез сетчатки, который передает сигнал нейронам второго порядка, стимулируя таким образом зрительный путь и восстанавливая зрительные функции у людей со слабым зрением [17]. Трансплантация аутологичных стволовых клеток позволит предотвратить гибель фоторецепторов и стимулировать зрительные функции [26]. Однако все эти методы войдут в клиническую практику лишь в будущем, а количество людей с ВМД увеличивается ежегодно. Поэтому по-прежнему актуальным остается поиск новых лекарственных средств для лечения.
Одним из современных и перспективных направлений в биологии и клинической медицине является изучение закономерностей пептидной регуляции в норме и при различных патологических состояниях [1, 5, 8, 12–14, 27]. Пептидные биорегуляторы (ПБР) — цитомедины обладают регулирующим действием на уровне специализированных клеточных популяций, регулируют процессы синтеза белка, что позволяет избирательно восстанавливать нарушенные функции клеток в условиях патологии. На сегодняшний день Ретиналамин — единственный в мире, уникальный офтальмопротектор, оказывающий выраженный терапевтический эффект при различных заболеваниях сетчатки. Разработка Ретиналамина была начата в Военно-медицинской академии (Санкт-Петербург). Это комплекс полипептидов, выделенных из сетчатки глаз крупного рогатого скота не старше 12-месячного возраста или свиней методом уксуснокислой экстракции. Полученный экстракт проходит многоступенчатую очистку для получения фракции полипептидов с молекулярной массой, не превышающей 10 000 Да.
Ретиналамин применяется в виде парабульбарных, внутримышечных, субтеноновых инъекций. Однако все перечисленные методы введения не обеспечивают достаточно высокой концентрации препаратов в тканях глазного яблока, так как значительная их часть уходит в общее сосудистое русло. При атрофиях зрительного нерва эффективным методом лечения явилась субтеноновая имплантация коллагеновой губки [9]. Можно предположить, что применение Ретиналамина при введении в субтеноново пространство на коллагеновой губке в лечении макулодистрофий позволит более эффективно воздействовать на сетчатку, повышая ее функциональную активность и задерживая прогрессирование патологического процесса. Надо также отметить, что введение ПБР в субтеноново пространство под контролем микрохирургической техники позволяет дозированно и целенаправленно вводить препараты, избегая таких осложнений, как ишемия тканей глазного яблока при многократных парабульбарных инъекциях и его прободение. Кроме того, для субтеноновой инъекции достаточно одной ампулы лекарственного вещества, так как парабульбарно проводится минимум 10 инъекций.
Цель исследования: изучить эффективность лечебного применения коллагенопластики с пептидным биорегулятором Ретиналамином при лечении возрастной макулодистрофии.
Материал и методы
Под наблюдением находилось 18 больных (28 глаз) с ВМД, которым проводилась коллагенопластика с Ретиналамином (группа 1), в группе 2 Ретиналамин использовался в виде парабульбарных инъекций ежедневно № 10 — 16 больных (30 глаз), для контроля ретроспективно проанализировано 30 историй болезней больных (45 глаз) без лечения (группа 3).
Всем больным проводились общеклинические исследования: визометрия, биомикроскопия, статическая периметрия на периметре Humphrеy, тонометрия, офтальмоскопия, аутофлюоресценция глазного дна, оптическая когерентная томография на томографе Soct Copernicus фирмы Optopol. Результаты оценивались через 1, 3 и 6 месяцев. Статиcтичеcкая обработка материалов проводилась при помощи программы Statistica for Windows.
Техника операции: из стандартной коллагеновой губки формировали имплант длиной 12 мм и шириной 5 мм. Глаз анестезировался троекратным закапыванием р-ра алкаина, затем в нижненосовом квадранте в 5–6 мм от лимба рассекалась конъюнктива и тенонова оболочка. Шпателем формировался туннель между склерой и теноновой оболочкой. Губка смачивалась в физиологическом растворе, затем отжималась и смачивалась раствором Ретиналамина. Лоскут коллагеновой губки имплантировали в подготовленный канал. На конъюнктиву накладывали шов из бионити. Шов рассасывался самостоятельно.
Влияние коллагеновой губки, вводимой в теноново пространство, объясняется расширением сосудов микроциркуляторного русла и выбросом в теноново пространство вазоактивных и других физиологически активных веществ — гистамина, серотонина, кининов. Развитие иммунной реакции приводит к усилению васкуляризации тканей глаза. Через 1–2 месяца губка полностью рассасывается, однако и через 6 мес. остается новообразованная эписклеральная соединительная ткань. Улучшение кровотока в сосудистой оболочке приводит к улучшению зрительных функций. Академик А.П. Нестеров считал, что возможен и другой механизм влияния имплантированной коллагеновой губки — это всасывание через склеру лекарственных веществ. Пропитывание коллагеновой губки Ретиналамином усиливает этот механизм. Таким образом, применение трофической коллагенопластики с препаратом Ретиналамин достаточно эффективно, продолжительность лечебного действия более длительна, чем при проведении обычной консервативной терапии.
Результаты и их обсуждение
Во всех группах острота зрения до лечения была одинаковой. Коллагенопластика с Ретиналамином проводилась на 2-е — 3-и сутки после поступления в стационар. После операции в течение 5 дней местно применялись растворы антисептиков и кортикостероидов. В контрольной группе Ретиналамин назначался в виде парабульбарных инъекций по 1,0 мл № 10 ежедневно. Через месяц после лечения в группе 1 и группе 2 зрительные функции повысились в среднем на 0,1, тогда как в группе 3 отмечалось незначительное снижение остроты зрения. Через 3 и 6 месяцев только в группе, где была проведена коллагенопластика, острота зрения оставалась прежней (табл. 1).
При периметрии периферические поля зрения оставалось без изменений во всех группах больных. Отмечалось повышение контрастной чувствительности через 6 мес. при исследовании на периметре Humphrеy: группа 1 — 4,51 ± 1,5 дБ; группа 2 — 3,75 ± 1,25 дБ; группа 3 — 2,87 ± 1,03 дБ.
При проведении ОКТ в динамике оценивались толщина центральной области сетчатки, увеличение или уменьшение друз, состояние пигментного эпителия сетчатки (табл. 2). Нормальное значение толщины фовеолы варьирует в диапазоне 175–180 микрон. Увеличение толщины свидетельствует о накоплении интра- или субретинальной жидкости, образовании субретинальной мембраны. Уменьшение говорит об атрофии пигментного эпителия сетчатки и хориокапилляров. Нами были разработаны критерии прогрессирования ВМД по данным ОКТ:
1. Конфигурация фовеа. По толщине сетчатки количественно выражается степень макулярного отека.
2. Субклинически определяют количество субретинальной жидкости. Оценивают локализацию и объем просачивания.
3. Разрывы и отслойки ПЭС — неблагоприятный фактор течения болезни.
Таким образом, наиболее низкая вероятность прогрессирования в группе с применением коллагенопластики с Ретиналамином, наиболее высокая — в группе без лечения.
Клинические примеры
Клинические примеры пациентов с ВМД представлены ниже.
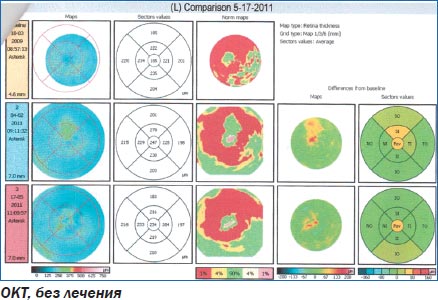
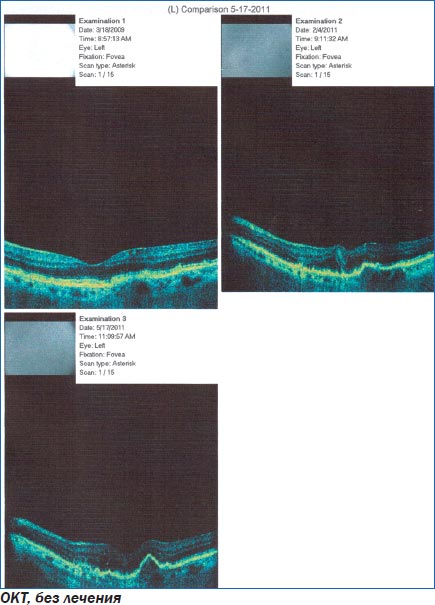
Клинический пример 1. Пациент с ВМД без лечения.
Больной Ч. наблюдался по поводу ВМД левого глаза. Зрение снижалось постепенно в течение 2 лет, не лечился. Курит на протяжении 20 лет.
При поступлении: острота зрения правого глаза — 1,0 н/к, левого глаза — 0,7 н/к. Оптические среды прозрачны. На глазном дне в левом глазу в макуле единичные сухие друзы.
При осмотре в динамике: острота зрения правого глаза — 1,0 н/к, левого глаза — 0,4 н/к. Оптические среды прозрачны. На глазном дне в левом глазу в макуле множественные сухие и сливные друзы, очаги деструкции ПЭС.
При проведении оптической когерентной томографии в динамике — слева увеличение количества мелких элеваций пигментного эпителия сетчатки в центре, скопление интраретинальной жидкости, увеличение толщины сетчатки.
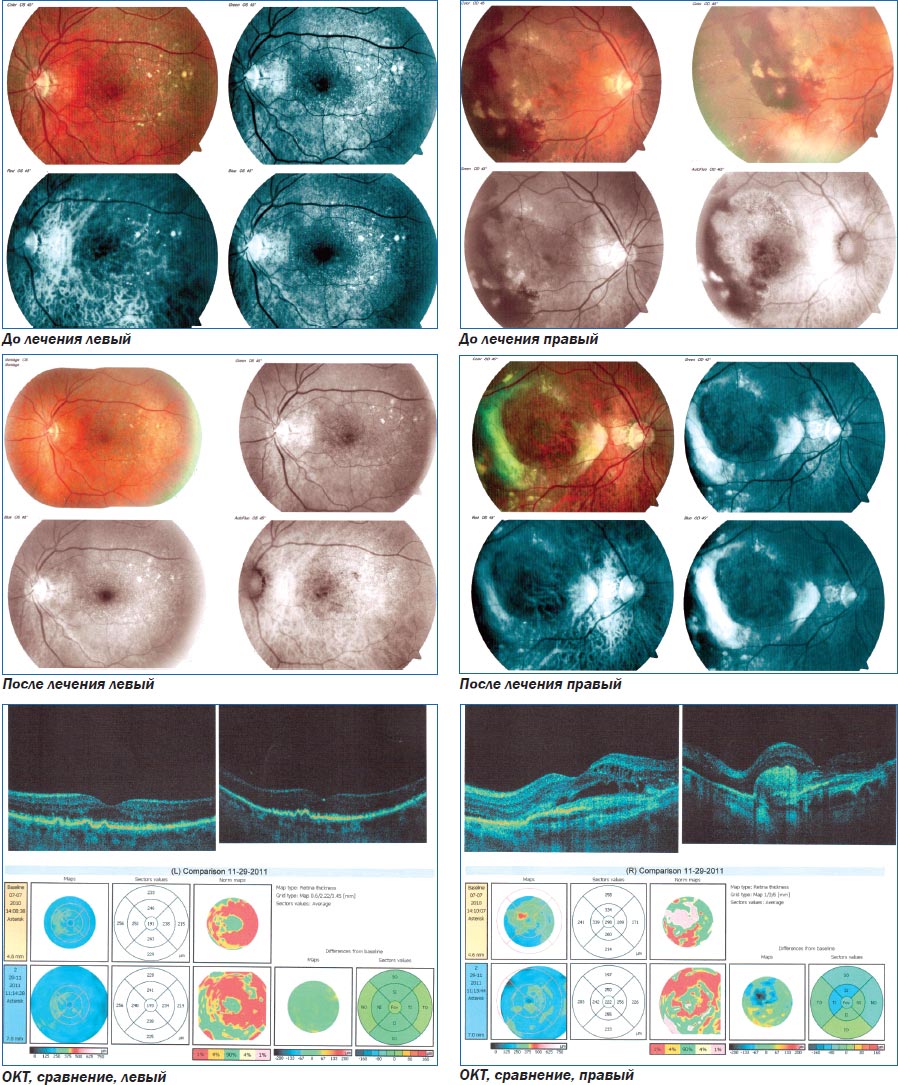
Клинический пример 2. Пациентка с начальной стадией ВМД на левом глазу и поздней стадией на правом. Проведена коллагенопластика с Ретиналамином на обоих глазах.
Больная Ч. 1943 г. р., поступила в клинику в связи с жалобами на постепенное ухудшение зрения в левом глазу в лечение 2 лет. К окулисту ранее не обращалась.
При поступлении: острота зрения правого глаза — 0,08 н/к, левого глаза — 1,0 н/к. Придаточный аппарат не изменен. Начальные помутнения в кортикальных слоях хрусталика. Изменения на глазном дне — слева в макуле сухие друзы. Справа сухие и сливные друзы, обширные геморрагии, при аутофлюоресценции видна скрытая хориоидальная неоваскуляризация. Проведение ФАГ не рекомендовано в связи с наличием лекарственной аллергии. На обоих глазах проведена коллагенопластика с Ретиналамином.
При осмотре в динамике: острота зрения правого глаза — 0,1 н/к, левого глаза — 1,0 н/к.
ОКТ: справа — в динамике уменьшение объема и количества кистозных интраретинальных полостей. Формируется гиперрефлективная зона (рубец) в области пигментного эпителия сетчатки. Уменьшение толщины сетчатки в центре и внутренних секторах. Слева — в динамике сохранены прежние структурные изменения.
Клинический пример 3. Пациентка с сухой формой ВМД на обоих глазах. Проведена коллагенопластика с Ретиналамином на обоих глазах.
Больная В. поступила в стационар с жалобами на снижение зрения в обоих глазах. Зрение снижалось постепенно, в последнее время заметила темное пятно в центре, невозможность читать при обычном освещении. Страдает ожирением, гипертонией.
При поступлении острота зрения правого глаза — 0,7 н/к, левого глаза — 0,5 н/к. Оптические среды прозрачны. На глазном дне в обоих глазах в макуле единичные сухие и сливные друзы. Проведена коллагенопластика с Ретиналамином на обоих глазах. При проведении оптической когерентной томографии в динамике — в обоих глазах уменьшение количества мелких элеваций пигментного эпителия сетчатки в центре, уменьшение высоты элеваций на остальном протяжении. Острота зрения правого глаза — 0,8 н/к, левого глаза — 0,6 н/к. Изменения на глазном дне прежние.
Выводы
1. Применение пептидного биорегулятора Ретиналамина при его введении в субтеноново пространство на коллагеновой губке у пациентов с макулодистрофией позволило повысить остроту зрения, контрастную чувствительность, стабилизировать течение заболевания.
2. Определен наиболее оптимальный способ лечения ВМД, заключающийся во введении Ретиналамина однократно в субтеноново пространство на коллагеновой губке в дозе 10 мг активной субстанции, при повторном проведении курса лечения через 6–12 месяцев.
3. При предлагаемом способе лечения пациентов с хориоретинальными дистрофиями улучшение зрительных функций наблюдалось более чем у 90 % пациентов. У пациентов, получивших ПБР парабульбарно, улучшение было достигнуто лишь в 45–50 % случаев. Применение пептидных биорегуляторов при введении их в субтеноново пространство на коллагеновой губке обеспечивает высокий терапевтический эффект и стабилизацию зрительных функций в течение 6 месяцев, а также в 2 раза сокращает сроки лечения пациентов в стационарных условиях.
4. Ретиналамин не вызывает побочных действий, хорошо переносится пациентами.