Газета «Новости медицины и фармации» Офтальмология (417) 2012 (тематический номер)
Вернуться к номеру
Изучение проницаемости барьерных структур головки зрительного нерва кролика после общего хронического рентгеновского облучения с помощью введения трассеров
Авторы: Н.Е. Думброва, проф., д.м.н., гл.н.с., Н.И. Молчанюк, к.б.н., ст.н.с., ГУ «Институт глазных болезней и тканевой терапии им. В.П. Филатова, НАМН Украины», г. Одесса
Версия для печати
В настоящее время в литературе имеются отдаленные (25 лет спустя после аварии на ЧАЭС) клинические результаты обследования населения, проживающего на загрязненных территориях, указывающие на то, что хроническое воздействие малых доз ионизирующего излучения вызывает в тканях головного мозга хроническую пострадиационную энцефалопатию [2, 7, 8]. Одной из причин возникновения данного заболевания является нарушение микроциркуляции. Другими авторами [3, 10, 13] у обследованного контингента населения выявлены патологические изменения микрососудов сетчатой оболочки. Приведенные клинические данные подтверждены экспериментальными исследованиями, включая и наши работы [3, 4, 6, 7]. Кроме того, известно также, что изменения, возникающие в структурах головного мозга, отражаются на функционировании зрительного нерва [9]. Однако в литературе мы не обнаружили сведений о влиянии хронического действия малых доз ионизирующего излучения на ткани зрительного нерва. Кроме того, в ряде работ [11, 12] показано, что ионизирующее излучение вызывает изменения в биомембранах. Известно, что между тканью зрительного нерва и кровью существует барьер для молекул большого размера и что ряд высокомолекулярных веществ распространяется из хориокапилляров сосудистой оболочки по ходу мембраны Бруха к глиальной ткани, окружающей аксоны зрительного нерва в преламинарной зоне [1, 15].
В связи с вышеизложенным целью настоящей работы является изучение изменения ультраструктуры и транспортных процессов в тканях головки зрительного нерва (ГЗН) кроликов после действия общего хронического рентгеновского облучения (ОХРО) в малых дозах с использованием трассеров: пероксидазы хрена (ПХ) и нитрата лантана (НЛ). Нами ранее опубликованы данные о транспортных процессах в структурах заднего отдела глаза кроликов с помощью упомянутых трассеров в норме [6], а также в структурах хориоретинального комплекса данных животных после действия ОХРО [5].
Материалы и методы исследования
Исследования проводились на 16 взрослых кроликах породы шиншилла массой 2,3–3,4 кг, подразделенных на 3 группы. I и II группы — опытные, в которых кролики подвергались ОХРО. III группа — интактные животные. Материал опытных групп забирался через 3, 15 суток и 2 месяца после окончания облучения. За 10 минут до забоя кроликам I группы вводили водный раствор ПХ, животным II группы — 5% р-р НЛ. В III, контрольной, группе половине животных вводили раствор ПХ, другой половине — 5% р-р НЛ. Исследовались ткани ГЗН. Эвтаназия животных осуществлялась методом воздушной эмболии под рауш-наркозом в соответствии с «Требованиями биоэтики Хельсинкской декларации об этическом регулировании медицинских исследований» [14]. Затем производились светооптические и электронно-микроскопические исследования. Условия облучения животных, дозы введения трассеров и обработка материала для электронно-микроскопического исследования описаны в предыдущих работах [5]. Ультратонкие срезы окрашивались растворами уранилацетата и цитрата свинца, просматривались и фотографировались в электронном микроскопе ПЭМ-100.
Результаты и их обсуждение
В тканях ГЗН на 3-и сутки после окончания ОХРО при светомикроскопическом исследовании (на полутонких препаратах) выражен отек между нервными волокнами (НВ), миелиновые оболочки НВ несколько деформированы, между пучками НВ располагаются хорошо окрашенные глиальные клетки и микрососуды. Позже, через 15 суток и 2 месяца после воздействия, в тканях ГЗН наблюдаются как вышеописанные изменения, так и разрушение миелиновых оболочек некоторых НВ, просветление аксоплазмы и цитоплазмы астроцитов.
При электронно-микроскопическом изучении структур ГЗН через 3 суток после окончания ОХРО выявлено, что между НВ наблюдается выраженный отек. В НВ большего диаметра миелиновые оболочки разволокнены и деформированы, аксоплазма выглядит электронно-прозрачной, лежащие в ней митохондрии набухшие, в них наблюдается фрагментация крист. В аксоплазме располагается небольшое число нейрофиламентов, которые выглядят нечетко (рис. 1). В НВ с меньшим диаметром структура миелиновых оболочек близка к норме. Лежащие между пучками НВ глиальные клетки — астроциты — имеют крупные размеры, ядро, в котором выражена маргинация хроматина. Кариолемма ядер извилистая. Выражен перинуклеарный отек. В цитоплазме астроцитов отмечается набухание митохондрий с деструкцией крист, расширение цистерн зернистой эндоплазматической сети (ЗЭС), выявлены единичные, небольших размеров, лизосомы. По всей цитоплазме рассредоточенно лежат полисомы, свободные рибосомы и единичные тонкие пучки разрыхленных фибрилл. В клетках определяются большие опустошенные участки. При изучении материала встречаются также двуядерные астроциты. В микрососудах, лежащих в этой области, эндотелиальные клетки (ЭК) крупные, ядра клеток с извилистой кариолеммой, по краю ядра выражена маргинация хроматина, однако структура хроматина разрушена. Цитоплазма ЭК умеренной электронной плотности, содержит набухшие мелкие митохондрии, расширенные цистерны ЗЭС, рибосомы, небольшое число пиноцитозных пузырьков. В электронно-прозрачном просвете определяется хлопьевидное содержимое и гранулы трассеров. У части микрососудов просвет сужен. Люминальная поверхность ЭК рыхлая, имеет нечеткие контуры, неровная, с многочисленными выростами. Выявляются участки на люминальной поверхности ЭК с признаками формирования пиноцитозных пузырьков с содержанием гранул трассера.
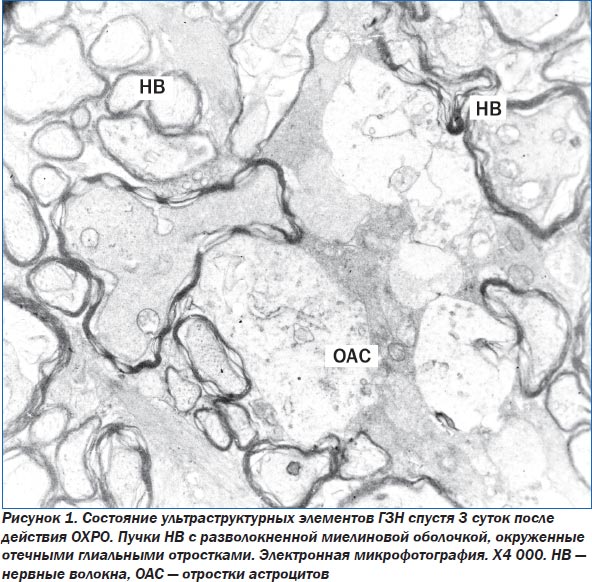
Спустя 15 суток после ОХРО в ГЗН в меньшей мере выражен отек между НВ. Однако деструктивные изменения в НВ более выражены по сравнению с описанными в предыдущем сроке. Помимо изменений в миелиновой оболочке НВ отмечается также сморщивание аксоплазмы. Аксоплазма умеренной электронной плотности. В ней лежат единичные нейрофибриллы.
Спустя 2 месяца после окончания ОХРО отмечены полиморфные изменения в ультраструктуре НВ — от незначительных реактивных изменений в миелиновых оболочках до волокон с очаговым их разрушением, со сжатием аксоплазмы и деструкцией ее элементов. В просвете аксоплазмы диффузно расположено мелкозернистое содержимое, среди которого выявлены единичные рибосомы, разрушенные митохондрии. Астроциты, лежащие рядом с пучками НВ, имеют овальное ядро, хроматин которого находится в диффузном состоянии, часть хроматина разрушена. В цитоплазме других астроцитов уменьшено количество органелл. Выявляются также крупные астроциты с большим ядром. В ядре определяется одно или два ядрышка. Цитоплазма клеток электронно-плотная. Митохондрии в них практически разрушены. На их месте видны вакуоли с нитевидным содержимым, между митохондриями лежат мелкие лизосомы, расширенные элементы ЗЭС, по всей цитоплазме рассеяны полисомы. Микрососуды, располагающиеся в этой области, выстланы крупными ЭК, их ядра неправильной формы, наблюдается маргинация хроматина, по центру кариоплазмы хроматин просветлен. Мембраны ЭК рыхлые, особенно по люминальной поверхности, с глубокими инвагинациями в сторону цитоплазмы, местами плазмолемма разрушена. Митохондрии в ЭК в состоянии деструкции, имеются единичные элементы ЗЭС. В клетке выявляются единичные окаймленные пиноцитозные пузырьки с зернистым содержимым, полисомы и свободные рибосомы. Межклеточные контакты в эндотелиальной выстилке рыхлые, в некоторых местах расширенные. Базальная мембрана ЭК утолщена. Лежащие перициты с элементами деструкции митохондрий. Ультраструктура отростков глиальных клеток, окружающих микрососуды, разрушена. В просвете сосуда определяется небольшое количество частиц трассеров. По-видимому, через рыхлые плазматические мембраны ЭК и по расширенным межклеточным контактам трассеры диффузно проникают в цитоплазму ЭК и базальную мембрану ЭК (рис. 2).
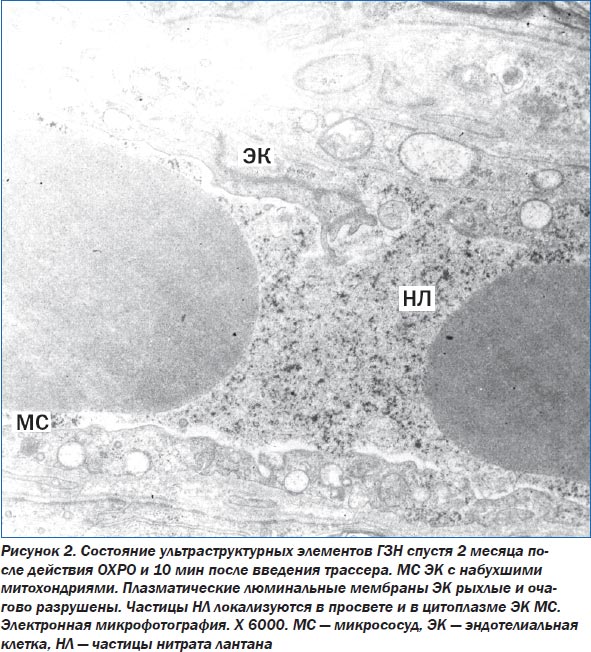
Полученные результаты исследования ультраструктурных элементов ГЗН в динамике от 3 суток до 2 месяцев после окончания действия ОХРО свидетельствует о том, что наиболее выраженные и первичные изменения наступают в структуре НВ. К концу срока наблюдения (2 месяца) патологические изменения в НВ нарастают. Выявляются разрушенные НВ. Нарастание деструктивных изменений отмечается также в ультраструктуре нейроглиальных элементов. В некоторых клетках отмечается разрушение плазмолеммы клеток и значительные опустошенные участки цитоплазмы. Отмечаются также глубокие деструктивные изменения в отростках астроцитов, особенно тех, которые контактируют с микрососудами. Нами также отмечено усиление альтернативных изменений в ЭК микрососудов, выражающееся в отеке и разрушении их органелл, расширении межклеточных контактов между ЭК. Однако структура микрососудов, по сравнению с другими образованиями ГЗН, более сохранна. Возможно, это связано, с одной стороны, с повреждением ультраструктуры глиальных клеток, а с другой стороны — с нарушением транспортных процессов между кровеносными сосудами и отростками как астроцитов, так и аксонов нервных клеток, вызванных действием радиации.
При изучении проницаемости барьерных структур ГЗН после введения животным трассеров выявлено, что в случае сохранения архитектоники эндотелиального пласта введенные микрочастицы ПХ и НЛ аккумулируются в просвете микрососудов и доходят до плотных межклеточных контактов, что было отмечено в сроке 3 суток после окончания действия ОХРО. При расширении межклеточных контактов и при повреждении плазматических мембран трассеры проникают в ЭК и в их базальную мембрану диффузно.
1. Вит В.В. Строение зрительной системы человека. — Одесса, 2003. — С. 285-286.
2. Возиянов О.Ф. // Журнал АМН Украины. — 2006. — Т. 12, № 1. — С. 5-15.
3. Воробьев Е.П., Степанов Р.П. Ионизирующее излучение и кровеносные сосуды. — М.: Энергоатомиздат, 1985.
4. Думброва Н.Е., Плевинскис В.П., Шамбра В.В., Молчанюк Н.И, Иванийчук Т.Ю. // Офтальм. журн. — 2001. — № 1. — С. 77-81.
5. Думброва Н.Е., Молчанюк Н.И. // Офтальм. журн. — 2007. — № 2. — С. 67-70.
6. Думброва Н.Е., Молчанюк Н.И. // Новости медицины и фармации. — 2011. — № 363. — С. 92-93.
7. Зозуля Ю.А., Винницкий А.Р. // Междунар. конф. «Актуальные и прогнозируемые нарушения психического здоровья после ядерной катастрофы в Чернобыле». — 24–28 мая. — Киев. — 1995. — С. 50-52.
8. Коваленко А.Н. // Журн. АМН Украины. — 2000. — Т. 6, № 4. — С. 686-702.
9. Коровенко Р.И. Циркуляция жидкости в зрительном нерве: Автореф. дис… канд. мед. наук — 1978. — 19 с.
10. Кринична І.П., Федірко П.А., Козлова Н.А. Збірка тез міжнар. конф. «Двадцять років Чорнобильської катастрофи. Погляд у майбутнє». — 24–26 квітня. — Київ, 2006. — С. 115.
11. Леус Н.Ф., Коломійчук С.Г., Ліщенко Б. // Матеріали 3-го симпозіуму «Діагностика та профілактика негативних наслідків радіації». — Київ, 1997. — С. 143-145.
12. Рыскулова С.Т. Радиационная биология плазматических мембран. — М.: Энергоатомиздат, 1986. — 125 с.
13. Федирко П.А. // Офтальм. журн. — 1995. — № 5–6. — С. 325-330.
14. Norman H.J. // Хроника ВОЗ. — 1985. — Т. 39, № 3. — С. 3-9.
15. Tso M.O., Shih C.Y., McLean I.W. // Arch. Ophthalmol. — 1975, Sep. — 93 (9). — Р. 815-825.
