Журнал «Боль. Суставы. Позвоночник» 1 (05) 2012
Вернуться к номеру
Мінеральна щільність та метаболізм кісткової тканини в пацієнтів зі спінальною травмою
Авторы: Поворознюк В.В., Бистрицька М.А. - Український науково-медичний центр проблем остеопорозу ДУ «Інститут геронтології НАМН України», м. Київ
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
Резюме. У дослідженні, наведеному в статті, доведено, що у пацієнтів із травматичною хворобою спинного мозку мінеральна щільність кісткової тканини (МЩКТ) вірогідно нижча, ніж у здорових осіб відповідного віку, при цьому МЩКТ вірогідно менша в пацієнтів із більшим строком травматичної хвороби. Це дало змогу зробити висновок, що тяжке пошкодження спинного мозку з глибоким руховим дефіцитом призводить до швидкої втрати кісткової маси вже в перші роки після травми з розвитком вторинного остеопорозу, який прогресує з тривалістю травматичної хвороби. Моніторинг МЩКТ у цієї категорії пацієнтів дозволить виділити хворих із високим ризиком розвитку переломів та своєчасно провести корекцію кісткової тканини й профілактику виникнення переломів.
Резюме. В исследовании, приведенном в статье, доказано, что у пациентов с травматической болезнью спинного мозга минеральная плотность костной ткани (МПКТ) достоверно ниже, чем у здоровых лиц соответствующего возраста, при этом МПКТ достоверно меньше у пациентов с большим сроком травматической болезни. Это дало возможность сделать вывод, что тяжелое повреждение спинного мозга с глубоким двигательным дефицитом приводит к быстрой потере костной массы уже в первые годы после травмы с развитием вторичного остеопороза, прогрессирующего с течением травматической болезни. Мониторинг МПКТ у этой категории пациентов позволит выделить больных с высоким риском развития переломов и своевременно провести коррекцию костной ткани и профилактику возникновения переломов.
Summary. In given article there had been proved that in patients with traumatic disease of spinal cord bone mineral density (BMD) is significantly lower than in healthy patients of appropriate age. At the same time BMD is significantly lower in patients with traumatic disease of long duration. Thus we made a conclusion that severe injury of spinal cord with profound motor deficit leads to fast bone loss already in first years after trauma with development of secondary osteoporosis, progressive with the course of traumatic disease. BMD monitoring in these patients enabled to select patients at high risk for fractures and to carry out bone-tissue remodeling and prevention of fractures.
Ключові слова: мінеральна щільність кісткової тканини, травма, ризик.
Ключевые слова: минеральная плотность костной ткани, травма, риск.
Key words: bone mineral density, trauma, risk.

Покращання спеціалізованої нейрохірургічної допомоги в гострому періоді травми призвело до збільшення відсотку виживання хворих із тяжкими ушкодженнями спинного мозку та значного збільшення тривалості життя цієї категорії хворих. Показники смертності при травмі хребта протягом перших трьох місяців знизились з 92 % на початку і в середині XX століття до 27,9 % на сьогодні, і близько 50 % постраждалих зі спінальною травмою живуть понад 25 років, але, на жаль, більшість із них інваліди [2]. Після пошкодження спинного мозку в пацієнтів розвивається комплекс симптомів, який отримав назву «травматична хвороба спинного мозку» (ТХСМ). До переліку ускладнень травм спинного мозку приєднались пізні ускладнення, які розвиваються зі збільшенням тривалості спінальної травми та проявляються в періоді стійких залишкових наслідків ТХСМ, саме тоді, коли пацієнт вже не чекає погіршення стану та не підлягає ретельному нагляду медиків. До таких ускладнень пізнього періоду належить вторинний остеопороз із низькоенергетичними переломами, які виникають спонтанно при побутовій активності, наприклад при пересіданні з ліжка у візок. За даними літератури, поширеність переломів у популяції осіб із ТХСМ може досягти 70 %. L.R. Morse, R.A. Battaglino et al. (2009) [2] повідомили, що хворі з повним поперечним пошкодженням спинного мозку мають ризик переломів у 3,7 раза більше, ніж хворі з неповним ураженням. Середня тривалість перебування в лікарні з метою лікування переломів для хворих з ТХСМ у 7 разів більша, ніж для пацієнтів без ТХСМ. Ускладнення, пов’язані з цими переломами, є загальними і включають уповільнену консолідацію, неправильне зрощення тканин після пошкодження, пролежні, гангрени та остеомієліт. Найбільш поширена локалізація переломів навколо колінного суглоба (тобто дистального відділу стегнової кістки та проксимального відділу гомілки). Дослідження 98 осіб із параплегією, проведені J. Krause еt al. у 2008 [6], показали, що частота переломів збільшується з тривалістю часу після травми, приблизно з 1 % протягом першого року після травми до 4,6 % у осіб із наслідками травматичної хвороби (від 20 до 29 років), при виникненні першого перелому в середньому через 8,5 року. Останні демографічні дослідження, проведені в Канаді R. Shields еt al. серед хворих із ТХСМ, показали, що поширеність переломів у цієї категорії осіб становила 7,3 %. За даними США, більше половини з щорічних 11 000 нових переломів у пацієнтів із ТХСМ виникає у осіб молодше 30 років. Навіть у пацієнтів без супутньої патології така травма вимагає тривалої іммобілізації чи оперативного втручання. В умовах порушення трофіки та вираженої спастичності м’язів лікуванні переломів значно ускладнюється, а отже, необхідні виявлення та корекція порушень кісткової тканини до виникнення переломів. У зв’язку з тим, що тривалість життя після ТХСМ різко збільшилась і складає більше ніж 30 років після травми, ускладнення з боку кісткової тканини значно погіршують якість життя цієї категорії пацієнтів. Незважаючи на клінічну значимість цих переломів, не існує стандарту діагностики, лікування остеопорозу та запобігання переломам у цієї категорії пацієнтів.
Метою нашого дослідження було визначити мінеральну щільність та особливості метаболізму кісткової тканини у хворих із травматичною хворобою спинного мозку.
Об’єкт та методи дослідження
У дослідження включений 31 пацієнт із наслідками спінальної травми, з них 10 пацієнтів (середній вік 26,0 ± 1,4 року) з тривалістю травматичної хвороби до 1 року, які склали групу І, та 21 пацієнт (середній вік 32,4 ± 1,6 року) з тривалістю хвороби понад 1 рік — група ІІ. 21 практично здорова особа відповідного віку (середній вік 30,60 ± 6,03 року), зросту та маси тіла склали групу ІІІ. Критерії включення: пацієнти чоловічої статі з пошкодженням спинного мозку на рівні шийного та середньогрудного відділів хребта з нижньою параплегією або глибоким нижнім парапарезом, що виключає можливість стояння та ходьби (ранг А та В за шкалою ASIA). Критерії виключення: супутня патологія, яка впливає на метаболізм кісткової тканини, наявність масивних осифікатів у ділянці кульшових суглобів, які не дозволяють адекватно оцінити стан кісткової тканини. Усі пацієнти перебували в вертикальному положенні 30–60 хв на добу 5–7 разів на тиждень у рамках занять лікувальною фізкультурою.
Методи дослідження:
1. Неврологічне обстеження.
2. Шкала ASIA — визначення ступеня пошкодження спинного мозку [1].
3. Двохфотонна рентгенівська абсорбціометрія (ДРА), яку виконували на апараті DXA Prodіgy (GE, 2005). У пацієнтів зі спінальною травмою мінеральну щільність кісткової тканини (МЩКТ) визначали на рівні всього скелету, поперекового відділу хребта та проксимального відділу стегнової кістки.
4. Визначення маркерів ремоделювання кісткової тканини в периферичній крові: остеокальцин, N-пропептид проколагену І типу, С-телопептид зшивок колагену І типу, методом електрохемолюмінісцентного аналізу на імуноферментному аналізаторі Elecsys.
5. Статистичні методи обробки отриманих результатів.
Результати досліджень
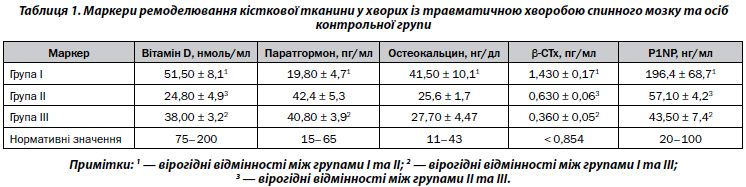
У пацієнтів зі спінальною травмою втрата кісткової маси розвивається швидко. Як видно з даних, наведених на рис. 1, вже через 1 рік після травми (група І) Z-критерій вірогідно відрізняться від такого в здорових осіб (група ІІІ) у всіх обстежених ділянках, хоча показники в середньому в групі залишаються в межах нормативних значень для відповідного віку.
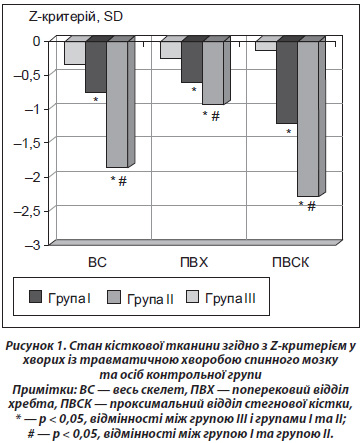
У пацієнтів ІІ групи, з тривалістю травматичної хвороби більше 1 року, Z-критерій був вірогідно нижчим, ніж у групі І, що свідчить про продовження прискореної втрати кісткової тканини. Оскільки найнижчі показники виявлені в ділянці проксимального відділу стегнової кістки, тому цю зону оцінювали більш детально (рис. 2).
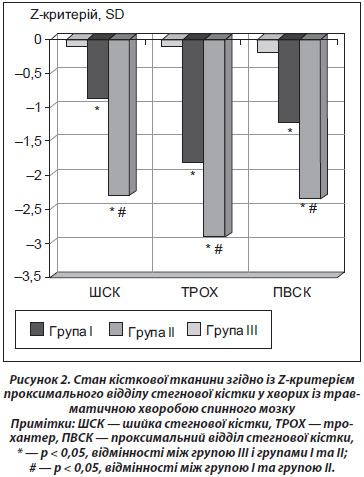
У даному дослідженні визначали також метаболізм кісткової тканини в пацієнтів зі спінальною травмою та в практично здорових осіб відповідного віку. У всіх хворих визначали маркери формування кісткової тканини: пропептиди колагену І типу (P1NP), остеокальцин та маркер резорбції кісткової тканини — С-телопептид зшивок колагену І типу (b-CTX).
У цілому результати дослідження показали, що в пацієнтів із травматичною хворобою спинного мозку рівень маркерів резорбції кісткової тканини в сироватці крові був вірогідно вищим порівняно з відповідними показниками в контрольній групі. При цьому підвищуються як маркери формування — остеокальцин та N-пропептид проколагену І типу, так і маркери резорбції кісткової тканини — С-телопептид зшивок колагену І типу. Сироваткові рівні маркерів P1NP та b-CTX перевищують нормативні значення, а рівень остеокальцину залишається в межах норми (рис. 3).
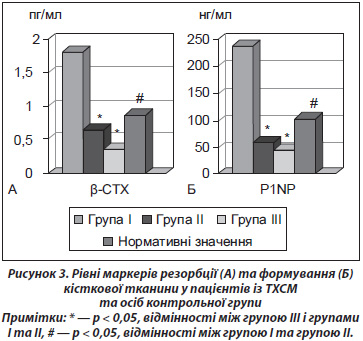
При порівнянні результатів пацієнтів першої та другої груп визначене вірогідне збільшення рівня маркерів ремоделювання кісткової тканини (P1NP та b-CTX) у хворих із меншою тривалістю травматичної хвороби. Тобто з часом активність процесу метаболізму кісткової тканини, підвищена після травми хребта та спинного мозку, зменшується й повертається до нормативних значень. При порівнянні параметрів пацієнтів ІІ групи та осіб контрольної групи отримана вірогідна відмінність лише за показником маркеру резорбції (b-CTX), який, проте, в середньому по підгрупі знаходиться в межах нормативних значень.
Отже, за результатами наших досліджень, у пацієнтів зі спінальною травмою виявлене зниження мінеральної щільності кісткової тканини, яке більш виражене в пацієнтів з більшим терміном травматичної хвороби спинного мозку. Максимальна втрата зареєстрована в ділянках нижче локалізації травми та таких, які залежать від навантаження, — проксимальний відділ стегнової кістки. При детальному вивченні виділена зона найнижчої щільності — трохантер. При вивченні показників метаболізму кісткової тканини зафіксоване збільшення маркерів ремоделювання — як формування, так і резорбції кісткової тканини в пацієнтів із травматичною хворобою спинного мозку, та вірогідно вищі показники в групі з меншим терміном травматичної хвороби.
Обговорення
Підвищення резорбції кісткової тканини у спінальних хворих виникає дуже швидко після травми і стосується перш за все кісток нижче рівня ураження спинного мозку. Під час дослідження 99 осіб з ознаками повного поперечного ушкодження спинного мозку, які мали низькоенергетичний перелом (J. Bryson et al., 2010), діагностовано втрату мінеральної щільності кісткової тканини на 54 % у дистальному відділі стегнової кістки та на 73 % у дистальних відділах гомілки, і ця втрата відбулася протягом перших 5–7 років після травми. У представленій роботі також отримані максимальні показники втрати кісткової тканини в ділянці стегнової кістки, але, на жаль, не було можливості оцінити показники дистальних відділів стегнової кістки. Тому, на нашу думку, сумарний показник МЩКТ проксимального відділу стегнової кістки є найбільш точним для діагностики в цієї категорії хворих, оскільки містить оцінку проксимального епіфізу стегнової кістки, який за структурою найближчий до дистального відділу стегнової кістки з усіх вимірюваних зон. Низька МЩКТ пов’язана зі збільшенням ризику переломів у осіб із ТХСМ.
Наразі активно дискутується питання створення діагностичних критеріїв щодо остеопорозу в пацієнтів з травматичною хворобою спинного мозку, оскільки сьогодні доступні лише критерії для жінок у постменопаузі та чоловіків віком понад 50 років. Основна маса пацієнтів (близько 75 %) з ТХСМ — це молоді чоловіки, близько половини з них молодші 30 років.
Підвищення резорбції кісткової тканини з наступним розвитком остеопорозу широко описане як ускладнення травми спинного мозку й більшою мірою пов’язане зі ступенем неврологічного дефіциту, ніж із рівнем травми. D. Garland et al. (2001) повідомили, що у хворих із ТХСМ демінералізація кісткової тканини відбувається нерівномірно, переважно в ділянках скелету, розташованих нижче рівня травми. Темпи резорбції кісткової тканини значно збільшуються після травми й повертаються до вихідного рівня через 16 міс. після травми при збереженні приблизно двох третин від первинної маси кісткової тканини. У нашій роботі також виявлена тенденція до нормалізації параметрів метаболізму кісткової тканини в другій групі пацієнтів із тривалістю травматичної хворобі спинного мозку від 1 до 4 років.
J. Rittweger et al. (2006) пов’язують гіперрезорбцію кісткової тканини з підвищеною активністю остеокластів і низькою активністю остеобластів. Це підтверджується змінами маркерів ремоделювання кісткової тканини, а саме підвищеною екскрецією з сечею N- і С-телопептиду та кальцію, зниженням рівня остеокальцину (маркер формування кістки) вже через 9–14 днів після ТХСМ. Згодом спостерігається помірне збільшення темпів формування кісткової тканини, але пік підвищення маркерів кісткової резорбції реєструється від 10 до 16 тижнів після травми. Ці зміни біохімічних маркерів корелюють із триваючою втратою кортикальної кістки та зберігаються протягом принаймні 10 років після травми. Таким чином, було висунуте припущення, що біохімічні маркери резорбції є чутливими індикаторами ризику переломів. У нашому дослідженні не вивчали маркери ремоделювання кісткової тканини в пацієнтів із раннім та проміжним періодами травматичної хвороби спинного мозку (до 3 міс.), але в обстежених хворих не зареєстроване зниження маркерів формування кісткової тканини (остеокальцину) ні в І групі, ні в ІІ, навпаки, у пацієнтів групи І зафіксоване підвищення маркерів як резорбції, так і формування. З іншого боку, в наведеному дослідженні використовувались маркери резорбції, визначені в сечі, на той час як у нашій роботі ці показники визначали в сироватці крові. На нашу думку, це особливо важливо для спінальних пацієнтів із порушенням контролю сечовипускання та наявністю сечового катетера, особливо в ранні періоди хвороби. Літературних даних щодо змін N-пропептиду проколагену І типу (P1NP) у пацієнтів зі спінальною травмою нами не знайдено, хоча в нашому дослідженні відмінності саме цього показника були найзначнішими порівняно з показником контрольної групи.
Висновки
У пацієнтів із травматичною хворобою спинного мозку мінеральна щільність кісткової тканини вірогідно нижча, ніж у здорових осіб відповідного віку, при цьому МЩКТ вірогідно менша в пацієнтів із більшим терміном травматичної хвороби.
Втрата кісткової маси спостерігається в відділах скелета нижче травми, й при проведенні ДРА найнижчі показники зафіксовані в ділянці проксимального відділу стегнової кістки, а саме в зоні трохантера.
У пацієнтів із травматичною хворобою спинного мозку зареєстроване значне підвищення рівня маркерів ремоделювання кісткової тканини — як маркерів резорбції, так і маркерів формування, вірогідно більшим це підвищення було у хворих із меншим строком травматичної хвороби спинного мозку.
Таким чином, тяжке пошкодження спинного мозку з глибоким руховим дефіцитом призводить до швидкої втрати кісткової маси вже в перші роки після травми з розвитком вторинного остеопорозу, що прогресує з тривалістю травматичної хвороби. Моніторинг МЩКТ у цієї категорії пацієнтів дозволить виділити хворих із високим ризиком розвитку переломів та своєчасно провести корекцію кісткової тканини й профілактику виникнення переломів.
1. Белова А.Н. Нейрореабилитация: Руководство для врачей. — М.: Антидот, 2000. — С. 172-180, 347-404.
2. Брюховецкий А.С. Травма спинного мозга: клеточные технологии в лечении и реабилитации. — М.: Практическая медицина, 2010. — 341 с.
3. Morse L., Battaglino R. et al. Osteoporotic fractures and hospitalization risk in chronic spinal cord injury // Osteoporos Int. — 2009. — № 20(3). — Р. 385-392.
4. Mechanick J., Liu K. et al. Effect of a Convenient Single 90-mg Pamidronate Dose on Biochemical Markers of Bone Metabolism in Patients With Acute Spinal Cord Injury // J. Spinal Cord Med. — 2006. — № 29(4). — Р. 406-412.
5. Modlesky C., Slade J. et al. Deteriorated geometric structure and strength of the midfemur in men with complete spinal cord injury // Bone. — 2005. — № 36. — Р. 331-339.
6. Krause J., Carter R. et al. A prospective study of health and risk of mortality after spinal cord injury // Arch. Phys. Med. Rehabil. — 2008. — № 89. — Р. 1482-1491.
7. Garland D., Adkins R. Bone loss at the knee in spinal cord injury // Top Spinal Cord. Inj. Rehabil. — 2001. — № 6. — Р. 37-46.
8. Rittweger J., Gerrits K. et al. Bone adaptation to altered loading after spinal cord injury: a study of bone and muscle strength // J. Musculoskelet Neuronal Interact. — 2006. — №. 6. — Р. 269-276.
9. Shields R., Dudley-Javoroski S. et al. Peripheral quantitative computed tomography: measurement sensitivity in persons with and without spinal cord injury // Arch. Phys. Med. Rehabil. — 2006. — № 87. — Р. 1376-1381.
10. Bryson J. Bisphosphonate Use in Acute and Chronic Spinal Cord Injury: A Systematic Review // Osteoporos Int. — 2010. — № 21(6). — Р. 985-995.