Журнал «Боль. Суставы. Позвоночник» 1 (05) 2012
Вернуться к номеру
Механизмы хондропротективного действия нимесулида
Авторы: Савустьяненко А.В. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
Резюме. Остеоартрит (остеоартроз) представляет собой дегенеративное заболевание суставного хряща, и для его терапии часто применяют нестероидные противовоспалительные средства. В рамках настоящего обзора было показано, что один из таких препаратов — нимесулид в дополнение к противовоспалительным свойствам, связанным с преимущественным ингибированием циклооксигеназы 2-го типа, проявляет также хондропротективное действие, которое реализуется за счет угнетения перекисного окисления липидов, снижения содержания и активности матриксных металлопротеиназ и торможения апоптоза хондроцитов в хрящевой ткани. Сочетание противовоспалительного и хондропротективного действия позволяет более эффективно бороться с дегенерацией хряща при остеоартрите.
Резюме. Остеоартрит (остеоартроз) являє собою дегенеративне захворювання суглобового хряща, і для його терапії часто використовують нестероїдні протизапальні засоби. У рамках даного обзору було показано, що один із таких препаратів — німесулід на додаток до протизапальних властивостей, що пов’язані з переважним інгібуванням циклооксигенази 2-го типу, справляє також хондропротективну дію, яка реалізується через пригнічення перекисного окислення ліпідів, зниження вмісту та активності матриксних металопротеїназ і гальмування апоптозу хондроцитів хрящової тканини. Поєднання протизапальної та хондропротективної дії дозволяє більш ефективно боротися з дегенерацією хряща при остеоартриті.
Summary. Osteoarthritis (osteoarthrosis) is a degenerative disease of articular cartilage, and for its therapy we should usually use non-steroidal anti-inflammatory drugs. In the present review it was shown that one of these drugs — nimesulide — additionally to anti-inflammatory activity as a result of preferential inhibition of cyclooxygenase-2 has also chondroprotective effect due to inhibition of lipid peroxydation, decreasing of the level and activity of matrix metalloproteinases and inhibition of chondrocyte apoptosis in the cartilage tissue. Combination of anti-inflammatory and chondroprotective activity produces more benefit effect on cartilage degeneration in a case of osteoarthritis.
Ключевые слова: остеоартрит, нестероидные противовоспалительные средства, хондропротекция, перекисное окисление липидов, матриксные металлопротеиназы, апоптоз.
Ключові слова: остеоартрит, нестероїдні протизапальні засоби, хондропротекція, перекисне окислення ліпідів, матриксні металопротеїнази, апоптоз.
Key words: osteoarthritis, non-steroidal anti-inflammatory drugs, chondroprotection, lipid peroxydation, matrix metalloproteinases, apoptosis.
Клинические аспекты остеоартрита

Остеоартрит (остеоартроз) представляет собой заболевание, которое характеризуется прогрессивной дегенерацией суставного хряща. В процесс вовлекаются также и остальные части сустава: субхондральные зоны кости, связки, капсула, синовиальная оболочка и периартикулярные мышцы. Считается, что остеоартрит является следствием механических и биологических воздействий, которые вызывают дисбаланс между деградацией и синтезом тканей внутри сустава. Частота развития остеоартрита в два раза выше у женщин, чем у мужчин, и увеличивается с возрастом, особенно после 60 лет. Клинические проявления остеоартрита включают боль в суставах, болезненность при пальпации, ограничение в движениях, крепитацию, наличие суставного выпота, воспаление различной степени выраженности. Все это в конечном счете приводит к развитию инвалидизации у многих пациентов [1].
Современная медицина предлагает много методов для поддерживающего лечения остеоартрита. Среди медикаментозных способов особое значение имеют нестероидные противовоспалительные средства, которые помимо противовоспалительного эффекта проявляют также дополнительное хондропротективное действие [2]. В рамках настоящего обзора мы сфокусировали свое внимание на хондропротективных свойствах одного из таких препаратов — нимесулида.
Краткая характеристика нимесулида
Нимесулид относится к нестероидным противовоспалительным средствам, которые угнетают работу преимущественно циклооксигеназы 2-го типа (ЦОГ-2). Препарат был создан доктором George Moore (которого по праву считают «отцом» нимесулида) и группой коллег из 3M Biochemical Research Laboratory [3].
Нимесулид характеризуется быстрой абсорбцией при приеме внутрь (максимальная концентрация в плазме крови достигается через 1–3 ч), что приводит к быстрому развитию обезболивающего эффекта при большом количестве болезненных состояний. Данный препарат подвергается окислительной биотрансформации в печени (главным образом на цитохромах CYP-2C9, CYP-2C19 и, возможно, CYP-1A2) в основном до 4-гидроксинимесулида (4-OH-NME), который обладает такими же фармакологическими свойствами, что и родительское соединение, но обладает меньшей силой. Время полувыведения из плазмы крови для родительского соединения составляет 2–5 ч, а для его основного метаболита — 3–9 ч. Как следствие, стандартную дозу нимесулида — 100 мг — достаточно назначать 2 раза в день, при этом риск кумуляции не возникает. Элиминация препарата не зависит от возраста, пола и не изменяется при наличии умеренных нарушений почечной функции (что может наблюдаться, например, в пожилом возрасте). Применение препарата противопоказано у пациентов с патологией печени [3].
Механизмы хондропротекции, присущие нимесулиду
Угнетает перекисное окисление липидов
Ряд исследователей полагает, что дегенерация суставного хряща и субхондральной кости начинается с перекисного окисления липидов (ПОЛ). И совсем не вызывает сомнения то обстоятельство, что ПОЛ способствует поддержанию хронического воспаления при остеоартрите. В связи с этим большое значение приобретает способность нимесулида проявлять антиоксидантные свойства.
В ряде исследований была изучена способность нимесулида и его основного метаболита 4-гидроксинимесулида захватывать активные формы кислорода (табл. 1). Было выяснено, что оба соединения являются хорошими акцепторами для гидроксильных радикалов (ОН•) и гипохлорит-анионов (ClO–), хотя родительский препарат чуть сильнее связывал гидроксильные радикалы, а метаболит — гипохлорит-анионы. Кроме того, было показано, что метаболит является хорошим акцептором для супероксид-аниона (О2–•) и пероксильных радикалов (ROO•) [4–6]. Помимо этих модельных (выполненных в искусственных системах) экспериментов была продемонстрирована способность нимесулида и его основного метаболита подавлять образование активных форм кислорода в хондроцитах из сустава человека и активированных нейтрофилах [6, 7].
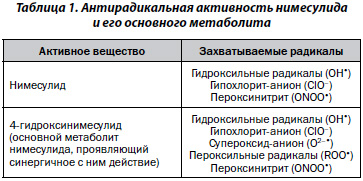
В ходе исследований было обнаружено, что при остеоартрите в хондроцитах увеличивается образование оксида азота (NO). С одной стороны, это тормозит синтез матрикса и усиливает его деградацию. С другой — взаимодействие NO с гидроксильными радикалами и супероксид-анионом приводит к образованию другого радикала кислорода — пероксинитрита (ONOO•), который усиливает повреждение клеток и повышает чувствительность хондроцитов к цитокин-индуцированному апоптозу [8].
Нимесулид предупреждает развитие NO-индуцированного повреждения тканей двумя способами. Во-первых, препарат ингибирует активность NO-синтазы, что приводит к уменьшению образования NO [3]. Во-вторых, нимесулид и его основной метаболит захватывают пероксинитрит, уменьшая его повреждающее воздействие на клетки [7].
Снижает содержание матриксных металлопротеиназ и их активность
Хорошо известно, что целостность хрящевой ткани поддерживается коллагеном II типа, протеогликанами и вспомогательными белками, такими как фибронектин. Все эти молекулы синтезируются хондроцитами и выделяются во внеклеточный матрикс. Коллаген II типа формирует обширную сеть, в ячейках которой находятся протеогликаны, и придает хрящевой ткани прочность на разрыв. В свою очередь, протеогликаны придают хрящу прочность на сжатие. Основным протеогликаном в хрящевой ткани является аггрекан. Его молекулы не находятся в отдельном состоянии — с помощью так называемых связывающих белков множество молекул аггрекана присоединяется к каждой из молекул гиалуронана (высокомолекулярный полисахарид, представляющий собой несульфатированный гликозаминогликан), что приводит к формированию сложных третичных комплексов. Упомянутый выше фибронектин связывается с интегральными белками клеточных мембран и коллагеном, осуществляя таким образом связь между хондроцитами и коллагеновыми волокнами. В контексте последующей информации необходимо обратить внимание и на такой компонент хрящевого матрикса, как хрящевой олигомерный матричный протеин (cartilage oligomeric matrix protein (COMP)). Его обнаруживают в большом количестве вокруг хондроцитов, с которыми он связывается за счет взаимодействия с интегральными белками их мембран. Однако функция COMP до сих пор остается невыясненной [1, 9, 10].
Во многих исследованиях было показано, что дегенерация хряща при остеоартрите связана с повышением содержания матриксных металлопротеиназ (MMP). В настоящее время установлено, что матриксные металлопротеиназы представляют собой целое семейство ферментов, в состав которого входит более 20 протеиназ. Из них наибольшее значение для развития остеоартрита имеют MMP-1,MMP-3, MMP-2, MMP-9, MMP-8 и MMP-13. Каждая из них ответственна за разрушение тех или иных компонентов внеклеточного матрикса: например, MMP-1 (коллагеназа-1) расщепляет коллаген II типа; MMP-3 (стромелизин-1) и MMP-2 (желатиназа А) расщепляют протеогликаны и фибронектин; MMP-9 (желатиназа В) расщепляет протеогликаны и т.д. Матриксные металлопротеиназы секретируются хондроцитами и синовиальными клетками в виде неактивных проферментов, которые впоследствии активируются. По состоянию на сегодняшний день в литературе описано несколько возможных путей активации ММР. Среди них важное значение отводят пути, реализуемому через активатор плазминогена/плазмин. Суть процесса сводится к тому, что урокиназный активатор плазминогена (uPA) переводит плазминоген (неактивное состояние) в плазмин (активное состояние). Плазмин некоторые матриксные металлопротеиназы может прямо переводить в активное состояние. В других случаях он сначала переводит про-ММР-3 (неактивное состояние) в ММР-3 (активное состояние), а уже затем ММР-3 переводит коллагеназы в активное состояние (например, неактивную форму про-ММР-9 в активную форму ММР-9). Важно отметить, что описанный путь активации матриксных металлопротеиназ через активатор плазминогена/плазмин может тормозиться с помощью ингибитора активатора плазминогена (PAI) [1, 11].
Деструкция хрящевой ткани при остеоартрите сопровождается выходом молекул — участников этого процесса в плазму крови. Поэтому о выраженности остеоартрита, помимо рентгенологической картины, судят по содержанию этих молекул в плазме крови. Чем более выражен процесс, тем больше содержание MMP, uPA, PAI (как отражение попытки организма, хотя и недостаточной, перевести активатор плазминогена в неактивное состояние и остановить процесс), гиалуронана, COMP и ряда других показателей в плазме крови [12, 13].
По состоянию на сегодняшний день выполнено несколько исследований, в которых продемонстрирована способность нимесулида влиять на биомаркеры деструкции хряща как отражение его хондропротективного действия. Ниже мы приведем результаты каждого из этих исследований, а затем обобщим полученные данные.
В исследовании, выполненном J.P. Pelletier и J. Martel-Pelletier (1993), была оценена способность нимесулида и напроксена тормозить разрушение протеогликанов и синтез металлопротеиназ в хрящевой ткани больных с остеоартритом. Исследование было выполнено in vitro. В результате обнаружено, что оба препарата уменьшали деградацию протеогликанов и синтез стромелизина. Однако нимесулид проявлял еще один дополнительный эффект — тормозил синтез коллагеназы [14].
В работе J.P. Pelletier и соавт. (1997) была изучена способность нимесулида и напроксена влиять на синтез uPA, PAI-1 (ингибитор активатора плазминогена-1) и IL-6 (интерлейкин-6) синовиальными фибробластами, изолированными от больных с остеоартритом. В результате было обнаружено, что оба препарата приводят к дозозависимому снижению синтеза uPA. Кроме того, оба препарата в терапевтических концентрациях оказывали стимулирующий эффект на синтез PAI-1 и снижали синтез IL-6 [15].
Годом позже одна из групп исследователей (A. Barracchini и соавт. (1998)) подняла вопрос о том, способны ли нестероидные противовоспалительные средства модулировать непосредственно активность металлопротеиназ (в отличие от других исследований, где изучали влияние нимесулида на содержание, или концентрацию, металлопротеиназ). Исследование было выполнено in vitro. В результате удалось обнаружить, что шесть из протестированных препаратов — нимесулид, пироксикам, толметин, мелоксикам, сулиндак и меклофенамат натрия — ингибируют активность коллагеназы со значениями IC50 (концентрация, обеспечивающая 50% ингибирование), варьирующими от 1,9 до 28,2 мкМ, и значениями Ki (кажущаяся константа ингибирования), варьирующими от 0,83 до 21,8 мкМ [16].
W.C. Kullich и соавт. (2002) выполнили пилотное клиническое исследование влияния нимесулида на содержание металлопротеиназ и деградацию матрикса при остеоартрите. Пациентам, у которых рентгенологически была подтверждена болевая форма остеоартрита коленного или тазобедренного сустава, назначали нимесулид в дозе 100 мг 2 раза в день в течение 3 недель. В результате было обнаружено, что, помимо клинического улучшения и снижения боли, нимесулид снижал содержание MMP-3, MMP-8 и COMP в плазме крови, что отражает положительное влияние препарата на сохранение целостности хряща [17].
В 2004 г. M. Bevilacqua и соавт. выполнили пилотное клиническое исследование по оценке влияния нимесулида на содержание в плазме крови гиалуронана и стромелизина-1 у пациентов с остеоартритом. Пациенты получали нимесулид в дозе 200 мг/день или ибупрофен в дозе 1200 мг/день. В результате было обнаружено, что лечение нимесулидом приводило к снижению содержания в плазме крови гиалуронана и ММР-3, в то время как ибупрофен умеренно повышал концентрацию ММР-3 и не оказывал влияния на уровень гиалуронана [18].
В 2008 г. S.F. Yang и соавт. выполнили исследование, цель которого сводилась к оценке влияния нестероидных противовоспалительных средств на экспрессию uPA, PAI-1, MMP-2 и MMP-9 у пациентов на ранних стадиях остеоартрита коленного сустава. У больных брали образцы суставного хряща, мениска и синовиальной оболочки и культивировали их in vitro в присутствии или в отсутствие диклофенака натрия, нимесулида, целекоксиба, вальдекоксиба, рофекоксиба и эторикоксиба. В результате было обнаружено, что все препараты снижали секрецию ММР-2 в хондральных, менисковых и синовиальных культурах клеток, а также ММР-9 в менисковых и синовиальных культурах. Кроме того, было обнаружено, что диклофенак натрия и рофекоксиб ингибировали секрецию uPA в хондральных культурах, а нимесулид, целекоксиб и эторикоксиб — в хондральных и синовиальных культурах. Рофекоксиб ингибировал секрецию PAI-1 в синовиальных культурах, а диклофенак натрия, нимесулид, целекоксиб и эторикоксиб — в хондральных и синовиальных культурах [19].
Таким образом, выполненные исследования свидетельствуют о том, что нимесулид снижает содержание MMP-2, MMP-3, MMP-8, MMP-9, uPA, PAI-1, гиалуронана, COMP в плазме крови или культурах суставных клеток, что указывает на его способность поддерживать целостность хряща у пациентов с остеоартритом.
Предотвращает апоптоз хондроцитов
В течение последних двух десятилетий было показано, что деградация хряща тесно связана с гибелью хондроцитов. При этом в различных исследованиях были продемонстрированы разные варианты клеточной гибели, которые могут иметь место в этом случае: классический апоптоз, хондроптоз и некроз. Какой из процессов доминирует при гибели хондроцитов — наука продолжает выяснять. Золотым стандартом для выявления гибели хондроцитов является электронная микроскопия, и ее результаты указывают на преобладание классического апоптоза/хондроптоза в хрящевой ткани при остеоартрите. В то же время авторы большей части работ все-таки сходятся во мнении, что более важное значение для гибели хондроцитов имеет классический апоптоз [20].
Интересно отметить, что термин «хондроптоз» был введен относительно недавно и представляет собой один из вариантов апоптотической (т.е. программируемой) гибели клеток. Между классическим апоптозом и хондроптозом имеются как общие черты, так и существенные отличия. Например, для обоих процессов характерна конденсация ядра; в то же время при классическом апоптозе наблюдается конденсация и фрагментация цитоплазмы и органелл, нет вакуолизации, при хондроптозе хорошо виден комплекс Гольджи и эндоплазматический ретикулум, формируются вакуоли и т.д. [21].
В более ранние годы, еще до разделения терминов «классический апоптоз» и «хондроптоз», были выполнены исследования, в которых было показано, что нимесулид обладает способностью угнетать апоптоз хондроцитов.
В одном из исследований апоптоз иммортализованной (лишенной способности к смерти) линии хондроцитов in vitro вызывали с помощью стауроспорина. Выраженность апоптоза зависела от концентрации стауроспорина и времени инкубации с ним; в клетках отмечалось увеличение экспрессии мРНК для bax и bcl-x, высвобождение в цитоплазму цитохрома С и повышение активности каспазы-3. Предварительная обработка клеточных культур хондроцитов с помощью нимесулида защищала их от стауроспорин-опосредованного апоптоза. Выраженность эффекта зависела от концентрации нимесулида; на фоне введения данного препарата наблюдалось угнетение активности каспазы-3. В результате был сделан вывод о том, что нимесулид, в дополнение к обезболивающей и противовоспалительной активности, обладает также протективным действием при остеоартрите за счет торможения апоптоза хондроцитов [22].
Спустя один год та же группа авторов показала, что стауроспорин вызывает апоптоз хондроцитов за счет изменения активности ряда генов, в то время как нимесулид обращает эти изменения, препятствуя развитию апоптоза [23].
Заключение
Обзор выполненных к сегодняшнему дню исследований свидетельствует о том, что нимесулид, преимущественный ингибитор ЦОГ-2, в дополнение к противовоспалительным свойствам проявляет также хондропротективное действие. Последнее реализуется путем угнетения перекисного окисления липидов, ингибирования активности матриксных металлопротеиназ и торможения апоптоза хондроцитов в хрящевой ткани. Сочетание обоих эффектов — противовоспалительного и хондропротективного является особенно важным для эффективной борьбы с дегенеративными изменениями при остеоартрите.
1. Ishiguro N., Kojima T., Poole A.R. Mechanism of cartilage destruction in osteoarthritis // Nagoya J. Med. Sci. — 2002. — V. 65, № 3–4. — P. 73-84.
2. Huskisson E.C. Symptomatic Treatment of Painful Osteoarthritis // 2007. www.touchbriefings.com
3. Nimesulide — a multifactorial approach to inflammation and pain: scientific and clinical consensus / Rainsford K.D.; Members of the Consensus Report Group on Nimesulide // Curr. Med. Res. Opin. — 2006. — V. 22, № 6. — P. 1161-1170.
4. Differential inhibition of superoxide, hydroxyl and peroxyl radicals by nimesulide and its main metabolite 4-hydroxynimesulide / Maffei Facino R., Carini M., Aldini G. et al. // Arzneimittelforschung. — 1995. — V. 45, № 10. — P. 1102-1109.
5. Antioxidant profile of nimesulide, indomethacin and diclofenac in phosphatidylcholine liposomes (PCL) as membrane model / Maffei Facino R., Carini M., Aldini G. et al. // Int. J. Tissue React. — 1993. — V. 15, № 6. — P. 225-234.
6. Invitro study of the antioxidant properties of nimesulide and 4-OH nimesulide: effects on HRP- and luminol-dependent chemiluminescence produced by human chondrocytes / Zheng S.X., Mouithys-Mickalad A., Deby-Dupont G.P. et al. // Osteoarthritis Cartilage. — 2000. — V. 8, № 6. — P. 419-425.
7. Invitro study of the antioxidant properties of non steroidal anti-inflammatory drugs by chemiluminescence and electron spin resonance (ESR) / Mouithys-Mickalad A.M., Zheng S.X., Deby-Dupont G.P. et al. // Free Radic. Res. — 2000. — V. 33, № 5. — P. 607-621.
8. Scher J.U., Pillinger M.H., Abramson S.B. Nitric oxide synthases and osteoarthritis // Curr. Rheumatol. Rep. — 2007. — V. 9, № 1. — P. 9-15.
9. http://ghr.nlm.nih.gov/gene/COMP
10. Chen F.H., Rousche K.T., Tuan R.S. Technology Insight: adult stem cells in cartilage regeneration and tissue engineering // Nat. Clin. Pract. Rheumatol. — 2006. — V. 2, № 7. — P. 373-382.
11. The roles of proteolytic enzymes in the development of tumour-induced bone disease in breast and prostate cancer / Woodward J.K., Holen I., Coleman R.E., Buttle D.J. // Bone. — 2007. — V. 41, № 6. — P. 912-927.
12. Molecular markers for osteoarthritis: the road ahead / DeGroot J., Bank R.A., Tchetverikov I. et al. // Curr. Opin. Rheumatol. — 2002. — V. 14, № 5. — P. 585-589.
13. Cartilage oligomeric matrix protein-inflammation biomarker in knee osteoarthritis / Zivanović S., Rackov L.P., Zivanović A. et al. // Bosn. J. Basic Med. Sci. — 2011. — V. 11, № 1. — P. 27-32.
14. Pelletier J.P., Martel-Pelletier J. Effects of nimesulide and naproxen on the degradation and metalloprotease synthesis of human osteoarthritic cartilage // Drugs. — 1993. — V. 46 (Suppl. 1). — P. 34-39.
15. Two NSAIDs, nimesulide and naproxen, can reduce the synthesis of urokinase and IL-6 while increasing PAI-1, in human OA synovial fibroblasts / Pelletier J.P., Mineau F., Fernandes J. et al. // Clin. Exp. Rheumatol. — 1997. — V. 15, № 4. —
P. 393-398.
16. Can non-steroidal anti-inflammatory drugs act as metalloproteinase modulators? An in-vitro study of inhibition of collagenase activity / Barracchini A., Franceschini N., Amicosante G. et al. // J. Pharm. Pharmacol. — 1998. — V. 50, № 12. — P. 1417-1423.
17. Kullich W.C., Niksic F., Klein G. Effect of nimesulide on metalloproteinases and matrix degradation in osteoarthritis: a pilot clinical study // Int. J. Clin. Pract. Suppl. — 2002. — V. 128. — P. 24-29.
18. Effect of nimesulide on the serum levels of hyaluronan and stromelysin-1 in patients with osteoarthritis: a pilot study / Bevilacqua M., Devogelaer J.P., Righini V. et al. // Int. J. Clin. Pract. Suppl. — 2004. — V. 144. — P. 13-19.
19. Effects of nonsteroidal anti-inflammatory drugs on the expression of urokinase plasminogen activator and inhibitor and gelatinases in the early osteoarthritic knee of humans / Yang S.F., Hsieh Y.S., Lue K.H. et al. // Clin. Biochem. — 2008. — V. 41, № 1–2. — P. 109-116.
20. Zamli Z, Sharif M. Chondrocyte apoptosis: a cause or consequence of osteoarthritis? / Int. J. Rheum. Dis. — 2011. — V. 14, № 2. — P. 159-166.
21. Kouri J.B. Chondroptosis: A variant of the Classical Apoptosis. A Confocal Microscopy Study // www.ciasem.com
22. Non-steroidal anti-inflammatory drugs protect against chondrocyte apoptotic death / Mukherjee P., Rachita C., Aisen P.S., Pasinetti G.M. // Clin. Exp. Rheumatol. — 2001. — V. 19, № 1 (Suppl. 22). — P. S7-S11.
23. Mukherjee P., Pasinetti G.M. Altered gene expression during nimesulide-mediated inhibition of apoptotic death in human chondrocytes // Int. J. Clin. Pract. Suppl. — 2002. — V. 128. — P. 20-23.
