Газета «Новости медицины и фармации» Неврология (413) 2012 (тематический номер)
Вернуться к номеру
Симпозиум 75 «Современные представления о тригеминальных вегетативных цефалгиях (trigeminal autonomic cephalgias)»
Авторы: О.Г. Морозова, д.м.н., профессор, А.А. Ярошевский, д.м.н. - Кафедра рефлексотерапии Харьковской медицинской академии последипломного образования
Версия для печати
Проводит: Донецкий национальный медицинский университет им. М. Горького.
Рекомендован: неврологам, терапевтам, врачам общей практики — семейной медицины, рефлексотерапевтам.
Пароксизмальные головные боли с выраженными вегетативными проявлениями на сегодняшний день объединяются в группу тригеминально-вегетативных головных болей. Тригеминальные вегетативные цефалгии (ТВЦ), а именно пучковая головная боль (ПГБ), встречаются в 10 раз реже, чем мигрень. Известны случаи ПГБ у лиц, страдавших в течение нескольких лет мигренью без ауры. ТВЦ сочетают в себе черты как мигренозной головной боли, так и краниальных парасимпатических невралгий. Экспериментальные и функциональные нейровизуализационные исследования показали, что ТВЦ сопровождаются активацией тригемино-парасимпатического рефлекса с клиническими признаками вторичной симпатической дисфункции.
Этиология и патогенез
Этиология ТВЦ остается неизвестной, и единая теория патогенеза, несмотря на значительный прогресс фундаментальних наук на современном этапе развития неврологии, еще не сформулирована. Обсуждаются тригемино-васкулярные, тригемино-вегетативные, биохимические, церебральные, наследственные аспекты патогенеза. Однако целый ряд исследований позволил предположить некоторые патогенетические звенья заболевания, и прежде всего это касается пучковой головной боли.
В настоящее время убедительно доказано, что вазодилатация офтальмической артерии и проксимальной части внутренней сонной артерии, возникающая в период боли, сочетается с повышением содержания болевых нейропептидов (кальцитонин-связанного и интестинального пептидов), что указывает на возможность нейрогенного происхождения вазодилатации в связи с активацией волокон тройничного нерва. В пользу правомочности вышеизложенной концепции патогенеза дополнительно свидетельствует оценка эффекта вазоактивных веществ при пучковой головной боли (вазодилататоры обусловливают возникновение боли, вазоконстрикторы — завершение приступа). В развитии болевых феноменов играет роль неполноценность региональной симпатической иннервации на стороне боли и изначальная дисфункция или воспаление сосудов в пределах кавернозного синуса, что инициирует гиперактивность ноцицептивных путей первой ветви тройничного нерва. То есть при всех ТВЦ имеет место вышеуказанная тригеминально-васкулярная активация, но является ли она непосредственной причиной головной боли — остается неясным.
Кроме того, в генезе ТВЦ принимают участие церебральные структуры (прежде всего гипоталамические), на что указывает наличие нарушения циклических гормональных сдвигов и ряда вегетативных параметров (в период боли нарушается секреция тестостерона, пролактина, мелатонина, кортизола, эндорфинов, а также изменяются температура тела, артериальное давление и др.), что также может быть связано с дисфункцией гипоталамо-гипофизарно-надпочечниковой системы и в определенной степени объясняет цикличность течения заболевания.
Поскольку все ТВЦ объединяются наличием вегетативной окраски в момент приступа, логично предположить активное участие в патогенезе надсегментарной вегетативной дисфункции. Подтверждение данной гипотезы об участии надсегментарных вегетативных структур в патогенезе ТВЦ, а именно пучковой головной боли, было получено с помощью нейровизуализации. Так, при проведении позитронно-эмиссионной томографии в период приступа ПГБ была выявлена активация заднего отдела гипоталамуса. Кроме того, у пациентов с ПГБ по сравнению с контрольной группой по данным объемной морфометрии было выявлено увеличение объема вещества в заднем гипоталамусе. Роль стволовых систем мозга в генезе заболевания подтверждают следующие факты: возникновение атак преимущественно в период сна, нарушение структуры сна в период болевого пучка (исчезновение фазы быстрого сна перед атакой) и нормализация сна в период ремиссии, а также изменение реактивности хеморецепторов, связанное с нарушением взаимоотношений сосудодвигательного и дыхательного центров на уровне ствола мозга, что подтверждается наличием сонных апноэ у лиц, страдающих кластерными головными болями.
Новым этапом развития знаний об этиологии и патогенезе ПГБ, которая изначально не считалась генетическим заболеванием, стали молекулярные исследования в области генома.
Так, опубликованы клинические случаи ПГБ у близнецов. При этом монозиготные близнецы демонстрируют большую конкордантность (2/12 пар), чем двузиготные (0/25 пар), что является непосредственным доказательством генетических факторов, участвующих в возникновении ПГБ. Семейный анамнез когорты пациентов оказался положительным у 7–20 %, относительный риск для родственников первой линии родства — 14–39 %. Патологический локус, ассоциированный с возникновением ПГБ, а также способ его передачи остаются неизвестными. Значительное количество работ посвящено полиморфизму гена HCRTR2, кодирующего рецептор 2-го типа к гипокретину. Нейроны, содержащие гипокретин, локализуются только в дорсальном и латеральном гипоталамусе и проецируются практически во все отделы мозга, в частности к образованиям, участвующим в регуляции цикла «сон — бодрствование». Они обладают модулирующим действием по отношению к норадренергическим нейронам locus coeruleus; активирующими эффектами; участвуют в контроле цикла «сон — бодрствование», пищевого поведения, эндокринных и кардиоваскулярных функций. Таким образом, различная экспрессия рецептора 2-го типа к гипокретину интегрируется с полученными ранее данными о гипоталамической дисфункции, является ведущей в понимании вариабельной восприимчивости к ПГБ и открывает широкое поле для дальнейших исследований в данной области. Предполагается как аутосомно-доминантный тип наследования патологического локуса с неполной пенетрантностью, так и аутосомно-рецессивное наследование. Серия генетических исследований не выявила причину преобладания мужчин среди больных с этим видом головной боли. Х-сцепленной передачи также пока не было зафиксировано. По некоторым данным, в 5 % случаев пучковая головная боль имеет наследственный (аутосомно-доминант-ный) характер.
Таким образом, основой патогенеза, объясняющей клинические проявления ТВЦ, является активация тригемино-парасимпатического рефлекса с клиническими признаками вторичной симпатической дисфункции.
Классификация и клинические проявления
Общими признаками тригеминальных вегетативных цефалгий являются: наличие четко очерченных более или менее кратковременных приступов строго односторонней интенсивной головной боли, локализующейся, как правило, в орбитальной, супраорбитальной и/или височной области; наличие односторонних вегетативных симптомов на стороне боли: инъекция конъюнктивы, слезотечение, заложенность носа, ринорея, выступание капель пота на половине лица, миоз, легкое опущение и отек века, которые как раз и связаны с рефлекторной активацией парасимпатических структур (за счет тригеминально-парасимпатического рефлекса) и вторичной симпатической дисфункцией.
Термин «гистаминная головная боль», применяемый ранее и указанный в МКБ-10, следует считать некоррект-ным, так как роль гистамина в патогенезе этих форм головной боли не доказана, а применение антигистаминных средств неэффективно.
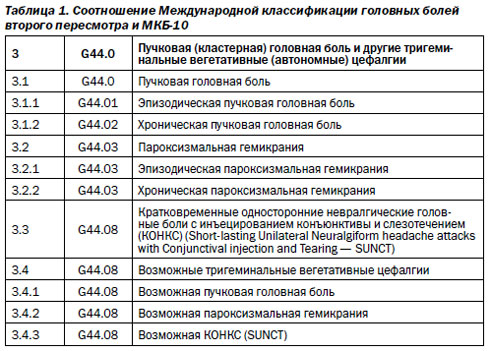
В Международной классификации головных болей второго пересмотра (International Classification Headaches second edition, ICHD II) тригеминальные вегетативные невралгии относятся к первичным головным болям и входят в третью рубрику, включающую кластерную головную боль, пароксизмальную гемикранию, кратковременную одностороннюю головную боль с инъецированием конъюнктивы и слезотечением (КОНКС, SUNCT-синдром), а также возможные тригеминальные вегетативные цефалгии.
3. Кластерная головная боль и другие тригеминальные вегетативные (автономные) цефалгии (Международная классификация головных болей, 2003) занимают третью рубрику.
3.1. Кластерная головная боль.
3.1.1. Эпизодическая кластерная головная боль.
3.1.2. Хроническая кластерная головная боль.
3.2. Пароксизмальная гемикрания.
3.2.1. Эпизодическая пароксизмальная гемикрания.
3.2.2. Хроническая пароксизмальная гемикрания (ХПГ).
3.3. Кратковременные односторонние невралгические головные боли с инъецированием конъюнктивы и слезотечением (КОНКС) (Short-lasting Unilateral Neuralgiform headache attacks with Conjunctival injection and Tearing — SUNCT).
3.4. Возможная тригеминальная вегетативная цефалгия.
3.4.1. Возможная кластерная головная боль.
3.4.2. Возможная пароксизмальная гемикрания.
3.4.3. Возможный SUNCT-синдром.
Первый вопрос, который необходимо разрешить неврологу при анализе жалоб и данных неврологического статуса пациента: является ли тригеминальная вегетативная цефалгия первичной, вторичной или имеет смешанный характер?
В том случае, если головная боль с симптомами ТВЦ впервые появляется в тесной связи с другим заболеванием, которое является причиной этих симптомов, эту цефалгию следует рассматривать как следствие данного заболевания, то есть как вторичную цефалгию. Следует подчеркнуть, что существует много причин, вызывающих головную боль, подобную первичной ТВЦ. Среди них сосудистые: расслоение или аневризма сонной артерии; расслоение или аневризма позвоночной артерии; аневризма передней соединительной артерии; артериовенозная мальформация затылочной доли; артериовенозная мальформация в бассейне средней мозговой артерии; артериовенозная мальформация в мягких тканях скальпа над ухом; артериовенозная мальформация передней доли; инфаркт в шейном отделе спинного мозга; инфаркт в латеральных отделах продолговатого мозга; лобно-височная субдуральная гематома, а также целый ряд инфекционных поражений. Поэтому при обнаружении клинических характеристик тригеминальных вегетативных невралгий (ТВН) необходима тщательная дифференциальная диагностика для исключения их вторичности.
Если течение ТВЦ, существовавшей до начала другого заболевания, утяжеляется с появлением заболевания, возможны две интерпретации: установление только диагноза ТВЦ или использование двух кодировок — ТВЦ и вторичная головная боль, вызванная другим заболеванием.
Установление двух диагнозов является более правильным, если имеется тесная временная связь между утяжелением течения ТВЦ и началом заболевания, а также доказано, что заболевание может провоцировать приступы ТВЦ и с уменьшением симптомов заболевания течение ТВЦ облегчается.
3.1. Пучковая (кластерная) головная боль
Пучковая головная боль (от англ. cluster — пучок) является наиболее частым вариантом первичных ТВЦ. Впервые симптомы ПГБ описаны Харрисом в 1926 г. Ранее для обозначения подобной головной боли использовались термины «пучковая мигрень», «гистаминная цефалгия», «мигренозная невралгия Харриса», «цилиарная невралгия», «эритромелалгия головы», «эритропрозопалгия Бинга», «невралгиеподобная гемикрания» и др.
Необходимо отметить, что синдромы, описанные ранее преимущественно в отечественной литературе как вегетативные прозопалгии (синдром Сладера, Чарлена, Оппенгейма, Хортона), соглас-но современной международной классификации также следует относить к кластерным головным болям.
Приступы на стороне боли сопровождаются одним или более из следующих симптомов вегетативной дисфункции, свидетельствующей о парасимпатической гиперактивации (инъецирование конъюнктивы, слезотечение, заложенность носа, ринорея, потливость лба и лица, отечность век) или симпатической гипоактивации (миоз, птоз).
У большинства пациентов во время приступа отмечается двигательное беспокойство и ажитация, что является патогномоничным симптомом. Физическая активность частично может облегчить боль при ПГБ. Во время приступа пациенты стремятся к деятельности, беспокойны, мечутся от невыносимой боли, интенсивность которой так велика, что кластерную головную боль называют суицидальной.
Диагностические критерии, позволяющие ставить диагноз первичной кластерной головной боли согласно классификации:
А. Как минимум 5 приступов, отвечающих критериям В–D.
В. Интенсивная или чрезвычайно интенсивная односторонняя боль орбитальной, супраорбитальной и/или височной локализации продолжительностью 15–180 минут без лечения.
С. Головная боль сопровождается как минимум одним из следующих симптомов:
1) ипсилатеральное инъецирование конъюнктивы и/или слезотечение;
2) ипсилатеральная заложенность носа и/или ринорея;
3) ипсилатеральная отечность век;
4) ипсилатеральная потливость лба и лица;
5) ипсилатеральный миоз и/или птоз;
6) чувство беспокойства (невозможность находиться в покое) или ажитация.
D. Частота приступов — от 1 раза в два дня до 8 раз в сутки.
Е. Головная боль не связана с другими причинами (нарушениями). Это положение означает, что анамнез, физикальный и неврологический осмотры не предполагают наличие расстройств, перечисленных в разделах 5–12, или анамнез, физикальный и/или неврологический осмотры предполагают наличие одного из таких расстройств, но оно исключено дополнительными методами исследования, или такое расстройство присутствует, однако приступы головной боли впервые возникли независимо от него.
Относительно интенсивности и продолжительности боли следует сказать, что иногда при пучковой головной боли (но менее чем в половине атак) приступы могут быть менее интенсивными и/или иметь меньшую или большую продолжительность.
Относительно частоты приступов в классификации подчеркивается, что иногда (но менее чем в половине атак) частота приступов пучковой головной боли может уменьшаться.
Приступы обычно возникают сериями (пучками) продолжительностью от нескольких недель до нескольких месяцев; болевые периоды сменяются ремиссиями, продолжительность которых может составлять от нескольких месяцев до нескольких лет. У 10–15 % пациентов отмечается хроническое течение без ремиссий.
В крупном исследовании с большой выборкой и длительным периодом наблюдения было показано, что у 27 % пациентов развивается лишь один эпизод кластерной головной боли. К этим пациентам также применима кодировка «3.1. Пучковая головная боль». Во время кластерного периода (болевого пучка), а также при хронической форме приступы возникают регулярно и могут провоцироваться приемом алкоголя, гистамина или нитроглицерина. Боль чаще локализуется вокруг глаза (наиболее интенсивная), в надбровной, височной области или в нескольких из этих областей, однако может распространяться в другие зоны головы. Во время болевого пучка боль всегда возникает с одной и той же стороны.
Во время некоторых приступов боль может становиться непереносимой, так что пациенты, не находя себе покоя, постоянно пребывают в состоянии двигательного возбуждения.
Пучковая головная обычно начинается между 20 и 40 годами. Почему пучковая головная боль в 34 раза чаще встречается у мужчин, остается неясным.
3.1.1. Эпизодическая пучковая головная боль
К пациентам с эпизодической пучковой головной болью могут быть отнесены больные с приступами пучковой головной боли, возникающими периодически в виде болевых пучков продолжительностью от 7 дней до 1 года и перемежающимися свободными от боли периодами (ремиссиями) продолжительностью 1 месяц и более.
Диагностические критерии:
А. Приступы, отвечающие критериям А–Е для «3.1. Пучковая головная боль».
В. По меньшей мере 2 кластерных (болевых) периода продолжительностью 7–365 дней, разделенных свободными от боли периодами (ремиссиями) продолжительностью не менее 1 месяца.
Кластерный период обычно продолжается от 2 недель до 3 месяцев. Продолжительность периода ремиссий была увеличена до 1 месяца по сравнению с предыдущими критериями.
3.1.2. Хроническая пучковая головная боль
Особенность цефалгии: приступы пучковой головной боли, возникающие на протяжении более 1 года без ремиссий или с ремиссиями, продолжительность которых менее 1 месяца.
Диагностические критерии:
А. Приступы, отвечающие критериям А–Е для «3.1. Пучковая головная боль».
В. Приступы повторяются в течение 1 года без ремиссий или с ремиссиями, продолжительность которых менее 1 месяца.
Хроническая пучковая головная боль может возникать de novo (ранее использовался термин «первичная хроническая пучковая головная боль») или происходить из эпизодической формы (ранее использовался термин «вторичная хроническая пучковая головная боль»). У некоторых пациентов может отмечаться переход хронической формы в эпизодическую.
Следует помнить, что кластерная головная боль может быть симптоматической на фоне асимметрично расположенной опухоли гипофиза, аневризмы передней соединительной артерии, диссекции внутренней сонной артерии, синдрома Толосы — Ханта, патологии лор-органов. В связи с этим нетипичная локализация, возраст дебюта старше 50 лет, появление неврологической симптоматики, персистенция синдрома Клода Бернара — Горнера между атаками при эпизодической ПГБ служат сигналами опасности и требуют тщательного обследования с использованием нейровизуализации (МРТ, КТ головы и шеи), ультразвуковой допплерографии магистральных сосудов головы и шеи для исключения органической патологии. Показанием к проведению МРТ является также любой рефрактерный к терапии случай ПГБ.
3.2. Пароксизмальная гемикрания
Клинические особенности: приступы с характеристиками боли и сопутствующими симптомами, аналогичными таковым при пучковой головной боли, но более кратковременные, возникающие с большей частотой, поражающие пре-имущественно женщин и отвечающие на терапию индометацином.
Диагностические критерии:
А. Как минимум 20 приступов, отвечающих критериям В–D.
В. Приступы интенсивной односторонней боли орбитальной, супраорбитальной или височной локализации продолжительностью 2–30 минут.
С. Головная боль сопровождается как минимум одним из следующих симптомов:
1) ипсилатеральное инъецирование конъюнктивы и/или слезотечение;
2) ипсилатеральная заложенность носа и/или ринорея;
3) ипсилатеральная отечность век;
4) ипсилатеральная потливость лба и лица;
5) ипсилатеральный миоз и/или птоз.
D. Преимущественная частота приступов более 5 раз в сутки, иногда несколько реже.
Е. Приступы полностью предотвращаются приемом индометацина в терапевтической дозе.
F. Боль не связана с другими причинами (нарушениями). Анамнез, физикальный и неврологический осмотры не предполагают наличие расстройств, перечисленных в разделах 5–12 международной классификации, или анамнез, физикальный и/или неврологический осмотры предполагают наличие одного из таких расстройств, но оно исключено дополнительными методами исследования, или такое расстройство присутствует, однако приступы головной боли впервые возникли независимо от него.
Рекомендации относительно дозы индометацина: для того чтобы исключить неполный ответ на лечение, индометацин следует применять внутрь или ректально в дозе не менее 150 мг/сутки или не менее 100 мг в виде инъекции; для поддерживающей терапии эффективными нередко являются и меньшие дозы.
Пароксизмальная гемикрания чаще встречается у женщин. Заболевание обычно начинается во взрослом возрасте, однако описаны и детские случаи. Следует подчеркнуть, что в 1-м издании все пароксизмальные гемикрании были отнесены в группу хронической пароксизмальной гемикрании. После того как клинические наблюдения подтвердили возможность эпизодического течения, было принято решение по аналогии с делением пучковой головной боли выделить эпизодическую форму пароксизмальной гемикрании отдельно.
Пароксизмальная гемикрания, сочетающаяся с тригеминальной невралгией(ПГ-тик-синдром). Если головные боли у пациента отвечают как критериям «3.2. Пароксизмальная гемикрания», так и критериям «13.1. Тригеминальная невралгия», следует использовать обе кодировки. В этом случае для того, чтобы избавить пациента от боли, важно проводить лечение обоих заболеваний. Патофизиологические механизмы, лежащие в основе такого клинического сочетания, пока не изучены.
3.2.1. Эпизодическая пароксизмальная гемикрания
К эпизодической ПГ относятся приступы ПГ, возникающие периодами продолжительностью от 7 дней до 1 года, которые перемежаются свободными от боли периодами (ремиссиями) продолжительностью 1 месяц и более.
Диагностические критерии:
А. Приступы, отвечающие критериям А–F для «3.2. Пароксизмальная гемикрания».
В. По меньшей мере два болевых периода продолжительностью 7–365 дней, разделенных свободными от боли периодами (ремиссиями) продолжительностью не менее 1 месяца.
3.2.2. Хроническая пароксизмальная гемикрания
Особенности клиники: приступы ПГ, возникающие в течение 1 года без ремиссий, которые перемежаются свободными от боли периодами (ремиссиями) продолжительностью 1 месяц и более.
Диагностические критерии:
А. Приступы, отвечающие критериям А–F для «3.2. Пароксизмальная гемикрания».
В. Приступы повторяются в течение более 1 года без ремиссий или с ремиссиями, продолжительность которых менее 1 месяца.
3.3. Кратковременные односторонние невралгические головные боли с инъецированием конъюнктивы и слезотечением (КОНКС, SUNCT-синдром)
SUNCT — аббревиатура международного англоязычного обозначения одной из кратковременных форм головной боли (Short-lasting, Unilateral, Neuralgiform headache with Conjunctival injection and Tearing — кратковременная односторонняя, невралгического типа головная боль с покраснением конъюнктивы глаза и слезотечением), которая была впервые описана норвежским исследователем О. Sjaastad в 1978 году уже после выпуска 1-го издания Международной классификации головных болей и более детально изучена в последнее десятилетие.
Клиническая характеристика синдрома: кратковременные приступы односторонней боли, продолжительность которых значительно меньше, чем при других формах ТВЦ; часто приступы сопровождаются выраженным слезотечением и покраснением глаза на стороне боли.
Диагностические критерии:
А. Как минимум 20 приступов, отвечающих критериям В–D.
В. Приступы односторонней пульсирующей боли орбитальной, супраорбитальной или височной локализации продолжительностью 5–240 секунд.
С. Боль сопровождается ипсилатеральным инъецированием конъюнктивы и слезотечением.
D. Приступы возникают с частотой от 3 до 200 раз в сутки.
Е. Не связаны с другими причинами (нарушениями), т.е. анамнез, физикальный и неврологический осмотры не предполагают наличие расстройств, перечисленных в разделах 5–12, или анамнез, физикальный и/или неврологический осмотры предполагают наличие одного из таких расстройств, но оно исключено дополнительными методами исследования, или такое расстройство присутствует, однако приступы головной боли впервые возникли независимо от него.
По данным литературы, симптомы «3.3. КОНКС» могут отмечаться при поражениях, локализующихся в задней черепной ямке или вовлекающих гипофиз.
Описаны случаи, когда у пациентов наблюдалось сочетание симптомов «3.3. КОНКС» и «13.1. Тригеминальная невралгия». В этом случае следует поставить оба диагноза. Дифференциальная диагностика для данных случаев нередко является трудной задачей.
SUNCT-синдром — один из наиболее редких вариантов кратковременных форм головной боли из группы тригеминально-вегетативных цефалгий. При выявлении симптомов, схожих с SUNCT-синдромом, перед врачом стоит важная задача определения его первичности или вторичности. Имеются описания вторичного синдрома SUNCT на фоне артериовенозной мальформации мостомозжечкового угла, гемангиомы ствола мозга, трансформации тригеминальной невралгии. Для синдрома SUNCT характерна резистентность к медикаментозной терапии и блокадам с местными анестетиками (над- и подглазничного нерва, слезного, большого затылочного, звездчатого ганглия, полости рта или носа), в отдельных случаях наблюдался некоторый положительный эффект карбамазепина, кортикостероидов, нестероидных противовоспалительных средств.
По нашему мнению, в патогенезе тригеминальных вегетативных цефалгий определенную роль играет цервикальный фактор (вертеброгенно-миофасциальный). В связи с этим хотелось бы представить клиническое наблюдение двух пациентов — с пучковой головной болью и КОНСТ-синдромом. В обоих случаях пациенты имели длительный анамнез (более 10 лет, резистентность к терапии) и при вертеброневрологическом обследовании — измененную биомеханику шейного отдела позвоночника с выраженной миофасциальной дисфункцией нижних косых мышц, верх-ней порции трапециевидной мышцы и обеих головок кивательной мышцы. Была разработана лечебная программа, направленная на коррекцию постурального мышечного дисбаланса на фоне патобиомеханических нарушений опорно-двигательного аппарата, а также ликвидацию миофасциальных триггерных точек, которая включала в себя: устранение функциональных блоков ПДС; устранение мышечно-дистоничeских, миодистрофичeских и миофасциальных нарушений техниками постизометрической релаксации, миофасциального расслабления и мышечно-энергетическими техниками (мягкие техники — soft tissue technique), ишемическую компрессию триггерных пунктов, акупрессуру, техники напряжения и противонапряжения (strain and counterstrain), релиз (release)-эффект; устранение дисфункций основания черепа техниками краниальной мануальной терапии. Следует отметить необходимость очень длительной и настойчивой работы с пациентами в течение 2–3 месяцев, после которых наблюдался стойкий клинический эффект. Вопрос в том, вляется ли миофасциальная дисфункция в данных наблюдениях первичной или вплетающейся в патогенез тригеминальной вегетативной цефалгии в результате вторичности миофасциальной дисфункции, требует дальнейшего изучения и доказательности. Но факт необходимости вертеброневрологического исследования и при выявлении миофасциальной дисфункции у больных с клиническими проявлениями цефалгий указанного типа ее ликвидации, по-видимому, является одно-значным.
Подобное наблюдение описывается В.В. Алексеевым, И.А. Строковым, А.Н. Бариновым, Е.В. Подчуфаровой (Неврологический журнал, 2001, № 6). Представлен клинический случай синдрома SUNCT, в патогенезе которого играет важную роль цервикогенный фактор в виде миофасциальной дисфункции мышц шеи. Авторами наблюдался пациент С., 65 лет, с типичными клиническими проявлениями SUNCT-синдрома, в неврологическом статусе у которого отмечались «гипестезия болевой и температурной чувствительности, тактильная, температурная и дистантная аллодиния в зоне иннервации тройничного нерва справа, более выраженные в зонах I и II ветвей; ограничение открывания рта, движений нижней челюсти, движений в шейном отделе позвоночника, особенно ротации, форсирование которых провоцировало приступ; а также мышечно-тонический синдром верхней порции трапециевидной, ременной, большой задней прямой и полуостистой мышц с двух сторон с выраженным миофасциальным синдромом правой нижней косой мышцы, пальпация которой вызывала типичный для пациента болевой синдром и конъюнктивальную инъекцию. Рентгенография шейного отдела позвоночника: выпрямление шейного лордоза, ротация позвонков по оси, остеохондроз СIII–CVII (сужения дисков CV–CVI и CVI–СVII, задние и передние остеофиты, субхондральный остеосклероз), оссифицирующий лигаментоз СIII–CVII. Нестабильность сегмента СII–СIII (смещение СII кпереди при сгибании)».
В процессе лечения после блокады правой нижней косой мышцы головы 2% раствором лидокаина с 30 ед. гидрокортизона, назначения карбамазепина — 800 мг/сут, амитриптилина — 75 мг/сут, в/в инфузий трентала и реланиума в течение 3 дней спонтанные пароксизмы полностью регрессировали.
После получения результатов, свидетельствующих об отсутствии органического поражения головного мозга и поражения тройничного нерва, была выполнена повторная блокада правой нижней косой мышцы 1,5 мл 2% раствора лидокаина с дексаметазоном 2 мл (8 мг), после которой приступы болей прекратились. Со следующего дня лечение было дополнено карбамазепином — 200 мг 3 раза в сутки и амитриптилином — 25 мг 3 раза в сутки. В последующем отмечался полный регресс спонтанного болевого синдрома и аллодинии в течение двухнедельного периода наблюдения.
На основании совокупности результатов обследования и лечения больному был установлен диагноз: хроническая правосторонняя прозопалгия (SUNCT-синдром); хроническая вертеброгенная цервикокраниалгия с мышечно-тоническим синдромом мышц шеи и миофасциальным синдромом правой нижней косой мышцы в стадии затянувшегося обострения.
Далее авторы обсуждают взаимоотношения тригеминально-вегетативных нарушений и цервикогенного фактора в форме афферентации с мышц шеи и, возможно, с суставов шейного отдела позвоночника, конвергирующей на тригеминальную систему ствола мозга, имеющую морфологическую общность с сенсорной системой задних рогов трех верхних сегментов шейного отдела спинного мозга, иногда обозначаемых как тригемино-цервикальная система. Авторы делают вывод, что «цервикогенный фактор, несомненно, присутствует в клинической картине описанного случая, но, вероятно, является вторичным или комплементарным. Первоначально возникая в качестве рефлекторного ответа на сенсорное воздействие в виде мышечного сокращения сегментарного комплекса (шейно-затылочная и жевательная мускулатура), при длительной экспозиции он становится вторичным источником боли вследствие активации мышечных ноцицепторов».
3.4. Возможная тригеминальная вегетативная цефалгия
Описание головной боли: приступы головной боли, напоминающие ТВЦ, но полностью не отвечающие диа-гностическим критериям ни одного из подтипов, описанных выше.
Диагностические критерии:
А. Приступы, отвечающие всем, кроме одного, критериям одного из подтипов тригеминальной вегетативной цефалгии.
В. Не связаны с другими причинами (нарушениями).
Кодировку «3.4. Возможная ТВЦ» следует использовать и в том случае, когда число типичных атак, отвечающих всем критериям, недостаточно (т.е. менее 20).
3.4.1. Возможная пучковая головная боль
А. Приступы, отвечающие всем, кроме одного, критериям A–D для «3.1. Пучковая головная боль».
В. Не связаны с другими причинами (нарушениями).
3.4.2. Возможная пароксизмальная гемикрания
А. Приступы, отвечающие всем, кроме одного, критериям A–Е для «3.2. Пароксизмальная гемикрания».
В. Не связаны с другими причинами (нарушениями).
3.4.3. Возможные кратковременные односторонние невралгические головные боли с инъецированием конъюнктивы и слезотечением (КОНКС, SUNCT-синдром)
А. Приступы, отвечающие всем, кроме одного, критериям A–D для «3.4.3. Возможные кратковременные односторонние невралгические головные боли с инъецированием конъюнктивы и слезотечением (КОНКС, SUNCT-синдром)».
В. Не связаны с другими причинами (нарушениями).
Дифференциальная диагностика тригеминальных вегетативных цефалгий
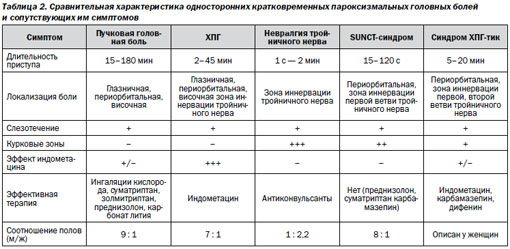
Как следует из клинической симптоматики, тригеминальные вегетативные цефалгии имеют много общих симптомов, прежде всего вегетативных, поэтому дифференциальная диа-гностика представляет определенные трудности.
В табл. 2 представлена сравнительная характеристика отдельных видов пароксизмальных головных болей и сопутствующих им симптомов, из которой следует, что, наиболее вероятно, представленный случай относится к варианту синдрома SUNCT .
Лечение и превентивная терапия
Рекомендации по ведению пациентов с ПГБ разработаны Европейской федерацией неврологических обществ (European Federation of Neurological Societies). Традиционно пароксизмальные боли имеют два направления в лечении: лечение приступа и профилактическая терапия.
Лечение приступа
Достоверно наиболее эффективными средствами для купирования атаки ПГБ являются специфические агонисты серотонина — триптаны. На сегодняшний день известно 7 таких препаратов: альмотриптан, элетриптан, фроватриптан, наратриптан, ризатриптан, суматриптан и золмитриптан, которые выпускаются в 5 лекарственных формах: таблетки для приема внутрь, таблетки для рассасывания, назальный спрей, раствор для подкожных инъекций и суппозитории. В Украине зарегистрированы суматриптан и золмитриптан. Наиболее эффективный для купирования пароксизма тригеминальной вегетативной цефалгии является парентеральный путь введения препарата, который обеспечивает максимальную биодоступность, а соответственно, и наиболее быстрое наступление клинического эффекта. Так, наиболее эффективным является подкожное введение 6 мг суматриптана (уровень доказательности А). Эффективным также является интраназальный путь введения 20 мг суматриптана или 5–10 мг золмитриптана (уровень рекомендаций А). Такой путь чаще используется у пациентов с абсолютными противопоказаниями к п/к введению суматриптана (период беременности и лактации, инсульта, окклюзионно-стенотических поражений периферических артерий). Относительными противопоказаниями являются: возраст до 18 и после 65 лет, феномен Рейно, аллергия на сульфаниламиды, параллельный прием ингибиторов обратного захвата серотонина. Пероральный прием золмитриптана в разовой дозе 5–10 мг менее эффективен (уровень рекомендаций В). Максимальная суточная доза суматриптана составляет 12 мг п/к или 40 мг интраназально, золмитриптана — 10 мг интраназально.
Эффективным и безопасным средством купирования атаки ПГБ является использование ингаляции нормобарического потока 100% кислорода в объеме 10–15 л/мин, подаваемого через маску (уровень рекомендаций А). Способ применяется при наличии противопоказаний к применению триптанов.
Используемые ранее препараты спорыньи (эрготамин и дигидроэрготамин) в лечении приступа ПГБ в настоящее время используются редко из-за недостаточно выраженного эффекта.
При рефрактерной пучковой головной боли может быть применена интраназальная аппликация 4% раствора лидокаина (уровень доказательности В). Анальгетики, включая опиоиды, для купирования атак ПГБ не должны использоваться.
Превентивная терапия
Целью профилактической терапии является уменьшение частоты приступов в период обострения. Пациентам с несколькими приступами в течение недели, реагирующим на препараты острого периода, профилактическое лечение обычно не назначается.
Основным препаратом для профилактики эпизодической и хронической ПГБ (уровень рекомендаций А) является блокатор кальциевых каналов верапамил. Суточные дозы варьируют в широком диапазоне — от 360 до 960 мг/сут. Побочные эффекты верапамила: слабость, усталость, отеки нижних конечностей, нарушения внутрисердечной проводимости, поэтому назначение верапамила и повышение дозы должно проводиться под контролем ЭКГ.
При тяжелых атаках, рефрактерности к верапамилу, длительном пучковом периоде рекомендуется преднизолон в дозе 1 мг/кг/сут в течение 7–14 дней, а затем поддерживающие дозы около 2 недель (уровень рекомендаций А).
С этой же целью используют и карбонат лития (уровень рекомендаций В), который может купировать атаку в дозе от 300 до 900 мг/сут (максимальная суточная доза 1200 мг) на протяжении нескольких недель, затем по окончании болевого пучка с профилактической целью принимают по 150–200 мг в течение 1–3 недель. При хронической форме рекомендуется не более 600 мг в день в течение 1–1,5 мес., но при условии контроля уровня лития в крови, а также функции щитовидной железы и почек. Побочные эффекты: тремор, инсомния, усталость, тошнота, расстройства зрения.
Применение топирамата показало достаточную эффективность при ПГБ (уровень рекомендаций В). Суточная дозировка колеблется от 25 до 200 мг и составляет в среднем 100 мг. Побочные эффекты включают онемение и парестезии конечностей, потерю массы тела, когнитивные нарушения, которые являются обратимыми и полностью исчезают при отмене препарата.
Возможно использование серотонинолитического препарата метисергид (уровень рекомендаций В) в дозе от 6 до 12 мг/сутки. Некоторые пациенты хорошо реагируют на данный препарат, однако основное ограничение при его использовании — невозможность параллельного назначения триптанов и эрготамина из-за опасности серотонинового синдрома. Его применение обосновано в случаях, если основным средством купирования приступов является кислород. Длительность применения составляет 6 месяцев с перерывом 1 месяц. Во избежание синдрома отмены препарат отменяют постепенно, в течение 2–3 нед.
Вальпроевая кислота, габапентин, баклофен, мелатонин могут быть использованы в качестве профилактической терапии третьей линии (уровень рекомендаций С) как показавшие некоторую эффективность при ТВЦ, а именно ПГБ.
В комплексной терапии хронических ТВЦ патогенетически обоснованным является также назначение антидепрессантов, бета-адреноблокаторов, анксиолитиков.
Наряду с медикаментозной терапией могут применяться немедикаментозные методы профилактики: иглорефлексотерапия, лазеротерапия, бальнеотерапия, психотерапия, аутогенная тренировка, способствующие нормализации функций вегетативной нервной системы. Важной составляющей лечения, с нашей точки зрения, является воздействие на миофасциальную дисфункцию соответствующими техниками мануальной терапии и биомеханической коррекции позвоночника.
Хирургическая коррекция
Хирургические методы применяются при резистентных к медикаментозной коррекции формах хронической ПГБ. В рандомизированном исследовании выявлена возможность прекращения приступа и снижения количества атак в сутки с помощью субокципитальной блокады большого затылочного нерва. Однако для широкого распространения этой процедуры необходима более широкая доказательная база.
Стимуляция гипоталамуса продемонстрировала определенную эффективность у пациентов, рефрактерных к консервативной терапии, однако вызывает серьезные осложнения. Механизм эффективности данной процедуры до конца не ясен. Кроме того, отсутствует доказательная база по этому виду лечения. Недавно описана стимуляция большого затылочного нерва, обладающая преимуществом в сравнении со стимуляцией гипоталамуса ввиду меньшей инвазивности. Хотя долгосрочная эффективность такой стимуляции также остается неизвестной.
В завершение хотелось бы сказать, что лечение тригеминальных вегетативных невралгий является достаточно трудной задачей, требующей терпения и настойчивости как от врача, так и от пациента.



