Газета «Новости медицины и фармации» 11 (421) 2012
Вернуться к номеру
Симпозиум 79 «Дисбиоз кишечника и принципы его коррекции»
Авторы: А.И. Дядык, С.С. Чубенко, В.О. Гайдуков, М.В. Хоменко, В.Б. Гнилицкая, Е.Ю. Череватская, А.Л. Христуленко
Донецкий национальный медицинский университет
им. М. Горького
Версия для печати
Проводит: Донецкий национальный медицинский университет им. М. Горького.
Рекомендован: гастроэнтерологам, терапевтам, семейным врачам.
Изучение роли кишечной микрофлоры в последние годы убедительно показало, что она является важнейшей составляющей защитного кишечного барьера, который осуществляет контроль над взаимодействием организма хозяина и внешней среды. Нарушение состава микрофлоры человека, а следовательно, и ее функции, сопровождается не только развитием кишечных расстройств (диарея, запор, синдромы мальдигестии и мальабсорбции), но и негативным влиянием на общесоматические регуляторные процессы. Так, дисбиозы кишечника различной локализации могут определять развитие или влиять на течение гиперхолестеринемии, коагулопатий, поражений суставов и системных заболеваний соединительной ткани, злокачественных новообразований желудка, толстой кишки, грудной железы, нарушений водно-солевого, углеводного и пуринового обмена, острой мезентериальной ишемии, спонтанного бактериального перитонита, печеночной энцефалопатии, синдрома «трансплантат против хозяина». Наличие дисбиотических нарушений может способствовать появлению нарушений менструального цикла и бесплодия, снижению эффективности гормональных противозачаточных средств, приводить к преждевременным родам, неонатальной анемии и кахексии, а также прогрессированию кариеса. Поэтому дисбиоз кишечника представляет собой не только общемедицинскую, но и социальную проблему [2, 6].
В экспериментальных работах установлена способность нормальной микрофлоры снижать активность тканевого ангиотензин-I-конвертирующего энзима и концентрацию холестерина в крови. Один из метаболитов Lactobacillus helveticus представляет собой пептид с мощным антигипертензивным действием, так что употребление ферментированного этими микроорганизмами молока позволяет снижать артериальное давление у лиц со стойкой артериальной гипертензией. Продемонстрирована высокая гипохолестеринемическая активность бифидобактерий, а бифидогенные свойства про- и пребиотиков рассматривают как важный фактор коррекции и профилактики атеросклероза. Известна способность лактобацилл продуцировать гистаминидазу, инактивирующую гистамин, что снижает риск развития и проявления аллергии. Под воздействием микрофлоры в кишечнике происходит образование гормоноподобных веществ (энтеродиол, энтеролактон), которым приписываются антиканцерогенные эффекты в отношении рака молочной железы. Важное значение имеет метаболическая активность нормальной микрофлоры, ассоциированная с образованием в толстой кишке короткоцепочечных (летучих) жирных кислот при гидролизе углеводов и растительной клетчатки (уксусная, пропионовая, масляная), а также белков (изомасляная, изовалериановая, капроновая). Указанные короткоцепочечные жирные кислоты, в свою очередь, обеспечивают: дополнительную регуляцию состава микрофлоры, поддержание водно-электролитного баланса в просвете кишки, питание и рост кишечного эпителия, повышение барьерно-механической функции колоноцитов, регулирование моторной активности кишечника, иммуносупрессивное действие, антиканцерогенное и противовирусное действие. Именно высокая метаболическая активность микрофлоры кишечника позволила ряду специалистов считать микробиоценоз кишечника целостным экстракорпоральным органом. Все вышеперечисленное позволяет считать мероприятия по восстановлению нормальной микрофлоры кишечника чрезвычайно важными [6, 8].
Характеристика нормальной микрофлоры желудочно-кишечного тракта
Многочисленные свойства нормальной микрофлоры желудочно-кишечного тракта (ЖКТ) обеспечивают широкий спектр ее системных регулирующих функций, что показано в табл. 1 [12].
Среди ведущих факторов, обеспечивающих стабильность микробиоценоза ЖКТ, традиционно рассматривают также естественные защитные системы, включающие продукцию слюны (протеолитические ферменты, лизоцим), желчи (желчные кислоты), панкреатических ферментов, муцина, секреторного IgA, перистальтическую активность (элиминация экзогенных агентов); лимфатический аппарат слизистой оболочки (солитарные фолликулы, пейеровы бляшки и др.), регенерацию эпителия.
Вышеперечисленные факторы во многом обеспечивают индивидуальность и стабильность микробиоценоза ЖКТ, который представляет собой чрезвычайно сложную экосистему, включающую несколько несопоставимых по своим биологическим характеристикам и составу микрофлоры биотопов — желудок, двенадцатиперстная, тощая, подвздошная и толстая кишки.
Микрофлора желудка здоровых людей весьма немногочисленна, количество микроорганизмов не превышает 103 колониеобразующих единиц (КОЕ) в 1 мл желудочного сока, что обусловлено прежде всего его кислотностью. Основная масса бактерий обитает в пилорической части желудка, зачастую они прочно связаны с его слизистой оболочкой (Helicobacter pylori, Streptococcus spp., Lactobacillus spp., Candida spp. и др.).
В верхних отделах тонкой кишки микроорганизмы определяются в небольшом количестве — не более 104 КОЕ на 1 мл содержимого, в подвздошной кишке совокупное количество микроорганизмов составляет 108 КОЕ в 1 мл химуса [3]. Избыточному росту бактерий в тонкой кишке препятствуют: 1) секреция соляной кислоты в желудке, предотвращающая размножение бактерий в верхних отделах желудочно-кишечного тракта; 2) илеоцекальный клапан, который препятствует поступлению содержимого из толстой кишки в тонкую; 3) высокая пропульсивная моторика тонкой кишки, исключающая застой кишечного содержимого.
Облигатная микрофлора толстой и прямой кишки представлена анаэробными бактериями (бифидо-, лактобактерии, бактероиды и др.), которые составляют 90–98 % от общего количества микроорганизмов. Облигатная микрофлора непосредственно участвует во многих жизненно важных процессах макроорганизма внутри самого пищеварительного тракта, а также обладает многочисленными и разнообразными системными регулирующими функциями [10, 16, 17]. Сопутствующую (факультативную) микрофлору толстого кишечника составляют аэробные и условно-анаэробные бактерии, представленные кишечными палочками, стрептококками, энтерококками (в сумме 5–10 %). К транзиторной (транзитной) микрофлоре (в сумме 0,01 %) относят стафилококки, клостридии, протей, грибы. Выделяют также условно-патогенные энтеробактерии — представители рода Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providencia, Citrobacter и др.
По характеру метаболизма микрофлору толстой кишки можно разделить на сахаролитическую и протеолитическую. Сахаролитическая микрофлора(Bifidobacterium, Lactobacillus, Enterococcus) использует в качестве питательного субстрата углеводы, поступающие извне, и полисахариды кишечной слизи. Протеолитическая микрофлора (Bacteroides, Proteus, Clostridium, некоторые штаммы E.coli, ристеллы) использует в качестве питательного субстрата продукты кишечного гидролиза белков. В результате их метаболизма образуются токсические вещества, в т.ч. сульфиды, эндогенные канцерогены, ароматические аминокислоты, способствующие развитию диареи, воспаления, новообразований [3, 8]. Метаболиты сахаролитической флоры полезны для организма хозяина, поддерживают гомеостаз и нейтрализуют негативные влияния протеолитической микрофлоры.
Нормальная микрофлора кишечника образует различные биоценотические и метаболические ниши на складках и в толще слизистой оболочки, а также на поверхности пищевых остатков, присутствующих в просвете толстой кишки, формируя соответственно мукозальную и просветную микрофлору.
Характеристика представителей облигатной микрофлоры кишечника
Бифидобактерии(Bifidobacterium bifidum, B.longum, B.infantis) — непатогенные грамположительные неспорообразующие анаэробы, являющиеся наиболее значимыми представителями облигатных бактерий в кишечнике детей и взрослых на протяжении всей жизни. У детей они составляют 90–98 % от всех микро-организмов кишечника. Большая часть бифидобактерий располагается в толстой кишке, являясь ее основной просветной и пристеночной микрофлорой. Эти анаэробы не образуют спор и морфологически представляют собой крупные грамположительные палочки ровной или слегка изогнутой формы. Доминирующее положение в микробном пейзаже кишечника у здоровых новорожденных детей, находящихся на естественном вскармливании, бифидофлора начинает занимать к 5–20-му дню после рождения. При этом преобладают B.bifidum.
Бифидобактерии выполняют следующие функции:
- осуществляют путем ассоциации со слизистой оболочкой кишечника физиологическую защиту кишечного барьера от проникновения микробов и токсинов во внутреннюю среду организма;
- обладают высокой антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам за счет выработки органических жирных кислот;
- участвуют в утилизации пищевых субстратов и активизации пристеночного пищеварения;
- синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В (В1 — тиамин, В2 — рибофлавин, В3 — никотиновая кислота, Вс — фолиевая кислота, В6 — пиридоксин), способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D.
Лактобактерии (Lactobacillus) — неспорообразующие грамположительные палочки с выраженным полиморфизмом, облигатные или факультативные анаэробы с высокой ферментативной активностью. Род лактобактерий включает 44 вида (в т.ч. Lactobacillus acidophilus, L.casei, L.bulgaricus, L.plantarum, L.salivarius, L.rhamnosus, L.reuteri). Лактофлора заселяет организм новорожденного ребенка в раннем постнатальном периоде. Средой обитания лактобацилл являются различные отделы желудочно-кишечного тракта, начиная с полости рта и кончая толстой кишкой, где они поддерживают рН на уровне 5,5–5,6. В процессе нормального метаболизма они способны образовывать молочную кислоту, перекись водорода, продуцировать лизоцим и другие вещества с бактерицидной активностью (реутерин, плантарицин, лактоцидин, лактолин). В желудке и тонкой кишке лактобациллы являются основным микробиологическим звеном формирования колонизационной резистентности: в процессе жизнедеятельности они вступают в сложное взаимодействие с другими микроорганизмами, в результате чего подавляются гнилостные и гноеродные условно-патогенные микроорганизмы, в первую очередь протей, а также возбудители острых кишечных инфекций. У женщин репродуктивного возраста они являются превалирующей флорой вульвы и вагины.
Наряду с бифидо- и лактобактериями группу нормальных кислотообразователей, т.е. бактерий, вырабатывающих органические кислоты, составляют анаэробные пропионобактерии. Снижая рН окружающей среды, пропионобактерии проявляют антагонистические свойства в отношении патогенных и условно-патогенных бактерий.
Бактероиды (Bacteroides) — это анаэробные неспорообразующие грамотрицательные микроорганизмы. Основными представителями рода Bacteroides являются B.thetaiotaomicron. Заселение кишечника бактероидами происходит постепенно: они обычно не регистрируются в бактерийных картах фекалий у детей первого полугодия жизни; у детей в возрасте от 7 мес. до 1–2 лет содержание бактероидов не превышает 108 КОЕ/г. Роль бактероидов не выяснена, но установлено, что они участвуют в процессах пищеварения, в обеспечении толерантности к пищевым антигенам, расщеплении желчных кислот, в процессах липидного обмена. Среди бактероидов встречаются бактерии типа B.fragilis, вызывающие различные гнойно-воспалительные заболевания.
Кишечные палочки (Escherichia coli) — аэробные или факультативно-анаэробные грамотрицательные палочки, участвующие в продукции витаминов, гидролизе лактозы, а также синтезе бактериоцинов и микроцинов. Микроцины оказывают подавляющее действие на рост сальмонелл, энтеропатогенных кишечных палочек и других видов патогенных и условно-патогенных энтеробактерий; оказывают иммуномодулирующее действие, стимулируя антителообразование. В кишечнике человека E.coli появляются в первые дни после рождения в количестве 107–108 КОЕ/г фекалий и сохраняются на протяжении жизни на этом уровне. Экологическая их ниша в здоровом организме — толстая кишка и дистальные отделы тонкой кишки. Выявлено, что эшерихии способствуют гидролизу лактозы, участвуют в продукции витаминов (в первую очередь витамина К и группы В), вырабатывают колицины — антибиотикоподобные вещества, тормозящие рост патогенных кишечных палочек.
Энтерококки (Enterococcus faecalis, E.faecium и E.flagellatus) — грамположительные кокки, аэробы и факультативные анаэробы, колонизирующие тонкий (в меньшей степени) и толстый отделы кишечника. Энтерококки подавляют рост и размножение других условно-патогенных и патогенных бактерий; обладают выраженной ферментативной активностью (в первую очередь лактазной). Энтерококки стимулируют локальный гуморальный и клеточный иммунитет, осуществляют метаболизм бродильного типа, ферментируют углеводы [4, 11, 14].
Дисбиоз кишечника: патофизиологические механизмы
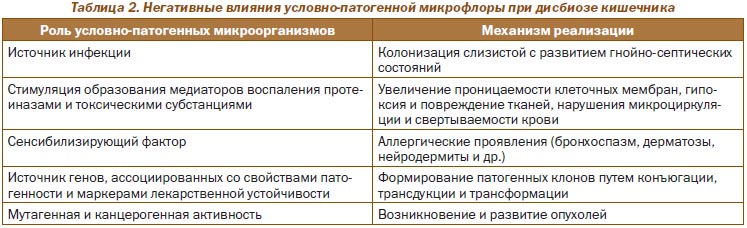
Нарушение вышепредставленных количественных и качественных соотношений микроорганизмов в указанных зонах тонкого и толстого кишечника (что обозначается термином «дисбиоз кишечника») сопровождается превалированием влияний условно-патогенных микроорганизмов как с развитием клинически значимых негативных последствий в процессах пищеварения, так и формированием условий для снижения детоксикационной функции печени, развития инфекционных (гнойно-септических) осложнений, сенсибилизации (аллергические реакции) и онкообразований [17].
Обобщенные данные о проявлениях отрицательного потенциала условно-патогенной микрофлоры при дисбиозе кишечника представлены в табл. 2.
Нарушение состава микрофлоры человека, а следовательно, и ее функций, сопровождается развитием ряда клинических синдромов, которые определяются локализацией дисбиотических изменений. В связи с этим следует различать синдромы тонкокишечного и толстокишечного дисбиоза [10, 13, 17].
Синдром тонкокишечного дисбиоза (или синдром избыточного бактериального роста в тонкой кишке) — это повышенное заселение тонкой кишки фекальной микрофлорой (кишечной палочкой, бактероидами и клостридиями, в норме присутствующими лишь в толстом кишечнике) в концентрации более 105 КОЕ/мл аспирата из тощей кишки, сопровождающееся появлением хронической диареи (полифекалия, метеоризм, абдоминальные боли) и признаков мальабсорбции (снижение массы тела, стеаторея, образование оксалатных камней в почках, макроцитарная анемия).
Избыточная микробная флора может приводить к повреждению эпителия тонкой кишки под влиянием метаболитов некоторых микроорганизмов, которые обладают цитотоксическим действием. Наблюдается уменьшение высоты ворсинок, углубление крипт, а при электронной микроскопии — дегенерация микроворсинок, митохондрий и эндоплазматической сети. При этом увеличивается секреция воды и электролитов в просвет кишки, что является причиной диареи. При уменьшении в просвете кишки конъюгированных желчных кислот, обеспечивающих эмульгирование жиров и активацию панкреатической липазы, появляется стеаторея и нарушается всасывание жирорастворимых витаминов А, D, Е, К и В12. Кроме того, на фоне тонкокишечного дисбиозаповышается концентрация гидрофобных желчных кислот, которые являются коканцерогенами (стимулируют активацию апоптоза, оказывают прямое цитотоксическое действие), что повышает риск развития карциномы и рака толстой кишки.
Частота выявления избыточного бактериального роста в тонкой кишке при разных заболеваниях ЖКТ колеблется от 70 до 97 % [17].
К наиболее важным этиологическим факторам тонкокишечного дисбиоза относят:
- длительный пищевой дисбаланс (несбалансированные диеты, вегетарианство, голодание);
- нарушения полостного пищеварения и всасывания (мальдигестия и мальабсорбция), обусловленные ахлоргидрией разного происхождения (оперированный желудок, хронический атрофический гастрит, длительный прием ингибиторов протонной помпы), внешнесекреторной недостаточностью поджелудочной железы (хронический панкреатит), энтеропатией (дисахаридазная недостаточность и другие пищевые интолерантности);
- заболевания ЖКТ, связанные с моторными расстройствами: гастростаз, дуоденостаз, стаз содержимого в тонкой и толстой кишке (хронические запоры, особенно у больных сахарным диабетом);
- поступление бактерий из внекишечного резервуара (патология желчевыводящих путей — желчнокаменная болезнь, хронический холецистит, холангит);
- хронические воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона);
- нарушение функции илеоцекального клапана (воспалительные, опухолевые процессы, реже — первичная функциональная недостаточность) и аномалии развития кишечника (дивертикулярная болезнь, синдром короткой кишки);
- последствия хирургических операций — врожденная (анатомическая) или сформированная слепая петля, тонкотолстокишечный анастомоз или свищ, ваготомия, холецистэктомия, резекция тонкой кишки;
- местные и системные иммунные нарушения (лучевое воздействие, химиотерапия (цитостатики), СПИД.
Синдром тонкокишечного дисбиоза развивается у большинства больных с циррозом печени, что связывают с прогрессирующим нарушением синтеза желчных кислот. Их дефицит способствует снижению бактерицидности желчи с последующими нарушениями гидролиза липидов и замедлением моторики кишечника, что создает условия для контаминации тонкого кишечника условно-патогенной и патогенной микрофлорой. Нарушение секреторной функции и повреждение слизистой оболочки тонкой кишки могут стать причинами развития спонтанного бактериального перитонита.
Верификацию тонкокишечного дисбиоза проводят с помощью прямых и непрямых методов диагностики. Прямой метод — бактериологическое исследование аспирата тонкой кишки. Непрямые методы основаны на определении наличия короткоцепочечных жирных кислот или неконъюгированных желчных кислот в аспирате из тощей кишки (14С- или 13C-гликохолатный тест; 14С- или 13С-D-ксилозный дыхательный тест). Дополнительные исследования позволяют оценить время тонкокишечного транзита (водородный дыхательный тест, 13С-лактозный тест, сцинтиграфия с 99Тс) и пищеварительную функцию тонкой кишки (тесты на определение экскреции жира с калом, тест Шиллинга для определения всасывания витамина В12 и др.).
Выделяют следующие степени тонкокишечного дисбиоза:
I степень.Увеличение общей обсемененности тонкого кишечника > 105–106 КОЕ/1 мл химуса (аспирата). При этом основными представителями микрофлоры тонкой кишки являются аэробы и факультативные анаэробы: стрептококки, стафилококки, лактобациллы, энтерококки, дрожжеподобные грибы.
II и III cтепень.Увеличение степени обсемененности тонкой кишки > 107 и > 109 КОЕ/мл в соответствии с преобладанием анаэробных условно-патогенных энтеробактерий (E.coli, бактероиды, клостридии, эубактерии, фузобактерии).
По мере нарастания вышеуказанных нарушений микрофлоры клиническая симптоматика обычно прогрессирует.
Синдром толстокишечного дисбиоза— это количественные и качественные нарушения состава микрофлоры толстой кишки с формированием дефицита бифидо- и лактофлоры при нарастании содержания различных условно-патогенных микроорганизмов, что сопровождается появлением разнообразных клинических проявлений (хронический запор, неустойчивость стула, метеоризм, спастические боли), а также метаболических, трофических, иммунологических нарушений. Длительное время синдром толстокишечного дисбиоза может протекать латентно [12, 16, 17].
Основными этиологическими факторами толстокишечного дисбиоза считают:
- социальные (несбалансированное питание, нарушение санитарно-гигиенических условий, стрессовые ситуации), климато-географические, профессионально-бытовые условия, сопровождающиеся избыточной потерей жидкости (жаркие страны, пустынные или высокогорные районы, Арктика, Антарктида);
- пребывание в районах экологических бедствий, зонах химического или радиационного загрязнения;
- перенесенные кишечные вирусные и бактериальные инфекции;
- последствия медикаментозной терапии соматических заболеваний (в т.ч. антибактериальными препаратами, иммуносупрессивными средствами);
- врожденные и приобретенные иммунодефицитные состояния;
- воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона).
Одной из распространенных причин толстокишечного дисбиоза (а возможно, и следствием последнего) как у пациентов в возрасте 20–30 лет, так и у пожилых лиц, собенно у женщин, считают синдром раздраженной кишки (СРК)[10]. Частота СРК в общей популяции составляет 10–20 %, его симптомы появляются у 7–33 % больных, перенесших острую кишечную инфекцию, чаще шигеллезную. Исследования микрофлоры при СРК с использованием высокоточного молекулярного метода показали разнообразные ее нарушения, определяемые вариантом СРК.
К методам верификации толстокишечного дисбиоза относят:
- бактериологическое исследование фекалий (прямой метод);
- идентификацию микроорганизмов молекулярно-генетическими методами;
- изучение метаболитов микрофлоры с помощью газожидкостной хроматографии фекалий (содержание короткоцепочечных жирных кислот);
- иммуноферментный анализ c целью выявления вирусов.
Толстокишечный дисбиоз классифицируют по виду преобладающих микроорганизмов(стафилококковый, протейный, дрожжевой, смешанный). Стафилококковый дисбиоз характеризуется изнуряющими поносами, интоксикацией, быстрым снижением массы тела. Грибковый (кандидозный) дисбиоз развивается у ослабленных больных, приводя к некрозам и перфорациям кишечника. Дисбиоз, вызванный синегнойной палочкой, отличается резистентностью к антибактериальной терапии и склонностью к генерализации. Наиболее неблагоприятными считают ассоциативные (смешанные) формы дисбиоза (например, стафилококковый с грибами рода Candida и синегнойной палочкой).
В зависимости от выраженности клинических проявлений и изменений микрофлоры фекалий выделяют следующие степени толстокишечного дисбиоза[17]:
I степень.Клинические проявления: сниженный аппетит, метеоризм, неустойчивость стула, неравномерная окраска каловых масс.
Характеристика микрофлоры фекалий:
- снижение общего количества основных представителей облигатной анаэробной микрофлоры (бифидо- и лактобациллы, бактероиды) до 108–107 КОЕ/г;
- уменьшение количества кишечной палочки с нормальной ферментативной активностью до 106 КОЕ/г;
- уровень условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida не более 103 КОЕ/г.
II степень.Клинические проявления: боли в животе, отрыжка, изжога, чувство распирания после приема пищи, метеоризм постоянно, умеренно выраженная диарея, симптомы гиповитаминоза, кожные аллергические реакции.
Характеристика микрофлоры фекалий:
- снижение общего количества облигатной микрофлоры до 105 КОЕ/г;
- увеличение количества лактозонегативной кишечной палочки до 104–105 КОЕ/г на фоне уменьшения их нормальных форм;
- повышение уровня условно-патогенных энтеробактерий (Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providencia, Citrobacter и др.), золотистых стафилококков, грибов рода Candida до 104 КОЕ/г.
III степень.Клинические проявления: выраженные симптомы желудочной и кишечной диспепсии, снижение массы тела.
Характеристика микрофлоры фекалий:
- снижение общего количества облигатной микрофлоры до 103–104 КОЕ/г;
- отсутствие эшерихий с нормальной ферментативной активностью на фоне повышения числа их неполноценных штаммов;
- повышение уровня условно-патогенных энтеробактерий (Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providencia, Citrobacter и др.), золотистых стафилококков, грибов рода Candida до 105–108 КОЕ/г.
IV степень.Клинические проявления: общеинтоксикационные симптомы, патологические примеси (гной, кровь) в кале, септикопиемия.
Характеристика микрофлоры фекалий:
- отсутствие представителей облигатной анаэробной микрофлоры (бифидо-, лактобациллы, бактероиды);
- отсутствие E.coli с нормальной ферментативной активностью;
- подавляющее превосходство условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida и их ассоциаций — более 108 КОЕ/г.
Лечение дисбиоза кишечника
К общим мероприятиям по устранению дисбиоза кишечника различного генеза и характера относят диетические рекомендации, особенности которых определяются ведущим клиническим синдромом (диарея/запор/метеоризм/абдоминальные боли/синдром мальабсорбции). Особую роль в коррекции дисбиотических нарушений I и II степени в последнее десятилетие отводят так называемому функциональному питанию.
Впервые термин «функциональное питание» получил официальное признание в 1989 году в Японии как обозначающий новое научно-прикладное направление, возникшее в результате достижений медицинских и пищевых биотехнологий. В европейской и североамериканской научной литературе в качестве синонимов используются термины Probiotik food, Functional food, Nutraceuticals, Pharmafoods, обозначающие разнообразные пищевые субстанции, рекомендуемые для употребления как в медицине, так и в повседневной жизни для профилактики и лечения многих заболеваний [7, 16].
Функциональное питание включает прежде всего натуральные продукты растительного, животного и микробного происхождения, содержащие бифидо- и лактобактерии, пищевые волокна, естественные антиоксиданты, пектины, протеины, витамины, минеральные вещества (хлеб ржаной и отрубной, овсяная крупа, ячневая крупа, гречневая ядрица, морковь, клюква, грибы, перловая крупа, картофель, соевое молоко, кисломолочные продукты и т.д.).
При дисбиозе толстого кишечника общепризнанной рекомендацией является использование продуктов, содержащих большое количество пищевых волокон (прежде всего капуста, свекла, морковь, яблоки, бананы, гречневая крупа), которые, являясь пищевым субстратом для сахаролитических (анаэробных) бактерий облигатной кишечной микрофлоры, способствуют росту последних, а следовательно, повышению их метаболической активности (т.е. проявляют бифидогенные свойства!). Кроме того, пищевые волокна оказывают абсорбирующий эффект по отношению к микробным и пищевым токсическим метаболитам и обеспечивают их элиминацию за счет усиления моторики толстой кишки под влиянием увеличенного объема фекальных масс. Их рекомендуют сочетать с молочнокислыми продуктами (кефир, простокваша, йогурты, творог, сметана, масло), содержащими живые бифидо- и лактобактерии. Увеличение количества жидкости с пищей является дополнительной универсальной рекомендацией, способствующей увеличению каловых масс и улучшению опорожнения толстого кишечника.
При тонкокишечном дисбиозе показана безлактазная (с исключением цельного коровьего/козьего молока) и низкожировая диета. К продуктам функционального питания, показанным при тонкокишечном дисбиозе, относят гречку, овсяную крупу, клюкву, картофель, бананы, соевое молоко, кисломолочные продукты.
Фармакологические подходы, направленные на устранение избыточного бактериального роста тонкой кишки и/или восстановление нормальной микрофлоры толстой кишки, включают:
1)дифференцированное применение фармабиотиков — препаратов, способных оказывать положительное влияние на состав кишечной микрофлоры, которые подразделяют на про-, пре- и синбиотики;
2)антибактериальную терапию.
Одним из наиболее распространенных направлений коррекции кишечных дисбиозов различной локализации является использование фармабиоти-ков, имеющих различный состав и механизмы действия. При этом выделяют фармпрепараты, содержащие [1, 9]:
- отдельных представителей кишечной микрофлоры в живом виде — пробиотики;
- бактериальные компоненты, такие как ДНК, биологически активные метаболиты бактериального происхождения, пищевые компоненты — пребиотики;
- комбинацию пре- и пробиотиков — синбиотики;
- трансгенные непатогенные бактерии (например, Lactococcus lactis).
Клинико-фармакологическая характеристика фармабиотиков представлена согласно Консенсусу экспертов Всемирной организации гастроэнтерологов, опубликованному в практическом руководстве для врачей-гастроэнтерологов Probiotics and prebiotics (2008) [16].
Пребиотики представляют собой пищевые субстанции, преимущественно содержащие поли- и олигосахариды некрахмального происхождения — лактулоза, инулин, олигофруктоза, олигосахариды грудного молока. Указанные вещества практически не перевариваются ферментами человеческого организма, однако являются пищевым субстратом для бактерий — представителей облигатной флоры толстого кишечника.
Пребиотики впервые были внедрены в Японии, где они широко используются для добавления в булочки, злаковые каши, шоколад, джем и имеют легальный статус продуктов питания, используемых для улучшения здоровья. К натуральным продуктам питания, содержащим указанные субстанции, относятся: хлеб (особенно ржаной), кукуруза, крупы, кисломолочные продукты, свежие фрукты, натуральные соки, орехи, артишок, аспарагус, горох, фасоль, кабачки, капуста, томаты, морковь, огурцы, лук репчатый, чеснок и т.д. Грудное молоко также содержит около 130 различных олигосахаридов, которые обладают рядом защитных функций, определяющих преимущества грудного вскармливания.
Пребиотики обладают выраженными бифидогенными свойствами (т.е. они существенно повышают количество бифидо- и лактобактерий в микробном пуле толстой кишки). Так, фруктоолигосахариды вызывают более чем 10-кратное повышение уровней бифидо- и лактобактерий в кале и значительное уменьшение количеств клостридий и энтеробактерий. В свою очередь, повышение уровней бифидо- и лактобактерий приводит к подавлению роста и размножения сальмонелл, листерий, кампилобактеров, шигелл и вибрионов.
Хорошо изучены метаболические эффекты пребиотиков, достигаемые благодаря увеличению продукции короткоцепочечных жирных кислот: добавление в рацион пребиотиков повышает всасывание ионов (кальций, железо, магний) в толстой кишке; положительно влияет на метаболизм липидов. Замена в рационе легкоусваиваемых сахаридов пребиотиками — субстанциями с низким гликемическим индексом — снижает риск развития сахарного диабета. Вышеперечисленные эффекты снижают риск атеросклеротических изменений в сердечно-сосудистой системе. Кроме того, пребиотики проявляют антиканцерогенное действие.
Классическим пребиотиком, широко используемым в клинической практике, является лактулоза,которая представляет собой дисахарид, синтезированный из лактозы (молочного сахара). Поскольку она в природе не встречается, в организме человека отсутствуют фермент-ные системы, способные расщеплять лактулозу, в связи с чем данный субстрат проходит неизмененным через верхние отделы ЖКТ, не всасываясь и не метаболизируясь в тонкой кишке. В толстой кишке под влиянием сахаролитических лакто- и бифидобактерий происходит распад лактулозы на короткоцепочечные жирные кислоты (молочную, уксусную, пропионовую и масляную). В результате возникает подкисление содержимого кишечника и повышается осмотическое давление в просвете толстой кишки, что стимулирует моторику кишечника и ускоряет транзит каловых масс. При этом уменьшается время контакта инфекционных агентов, если таковые имеются, и их метаболитов со слизистой оболочкой толстой кишки и ускоряется их элиминация из организма. Кроме того, короткоцепочечные жирные кислоты сами по себе обладают антимикробным действием. Таким образом, лактулоза, являясь для сахаролитических лакто- и бифидобактерий идеальным питательным субстратом, избирательно стимулирует их рост и функциональную активность, благоприятно влияет на бактериальный состав и микроэкологию толстой кишки, а также подавляет рост условно-патогенных бактерий и грибов рода Candida. При сравнении действия различных промышленных пребиотиков-олигосахаридов в контролируемых рандомизированных исследованиях было показано, что лактулоза и ксилоолигосахариды способствуют большему росту Bifidobacterium и увеличению продукции короткоцепочечных жирных кислот по сравнению с пребиотиком инулином [5, 9].
Пробиотики. Наиболее часто в качестве пробиотиков используют некоторые виды молочнокислых бактерий (Lactobacillus), бифидобактерий (Bifidobacterium), сахаромицетов (Saccharomycers cerevisiae), кишечной палочки (E.coli), а также отдельные разновидности бацилл (Bacillus) (табл. 3). Указанные микроорганизмы не только могут быть представлены в виде лекарственных бактерийных препаратов (истинные пробиотики), но и часто используются в виде биологически активных добавок. Предпочтение, отдаваемое пробиотикам, содержащим молочнокислые бактерии Lactobacillus spp. и Bifidobacterium spp., обусловлено их резистентностью к действию желудочного сока, желчи и ферментам поджелудочной железы, а также легкостью, с которой они колонизируют слизистую оболочку кишечника [10].
Положительные влияния пробиотиков на состояние микрофлоры кишечника заключаются в том, что они:
- изменяют уровень локального рН, создавая неблагоприятные условия для развития патогенных микроорганизмов;
- продуцируют бактериоцины, ингибирующие рост патогенной микрофлоры; удаляют свободные радикалы, оказывающие повреждающее действие на клеточные структуры;
- стимулируют продукцию муцина слизистой оболочкой кишечника;
- улучшают функционирование интестинального барьера;
- конкурируют с патогенами в отношении адгезии к эпителиоцитам кишечника;
- модифицируют патогенные бактериальные эндотоксины;
- обеспечивают ряд иммунообусловленных эффектов (активация локальных макрофагов, презентирующих антигены В-лимфоцитам, увеличение синтеза секреторного IgА; модуляция содержания цитокинов; индукция гипореактивности к пищевым аллергенам и др.) [5, 9, 16].
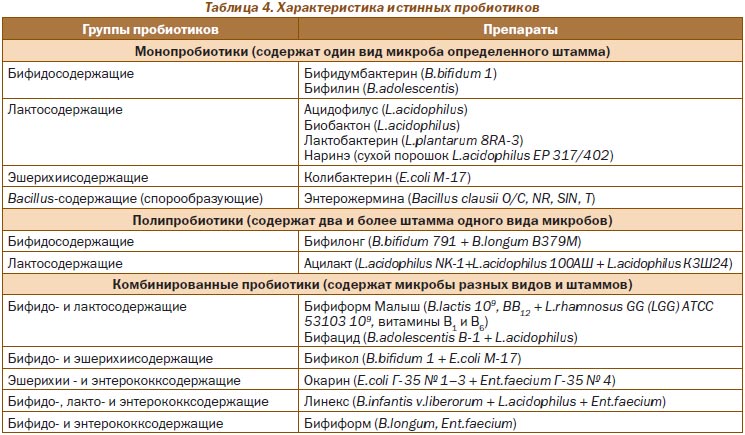
Пробиотики, характеризующиеся доказанной клинической безопасностью применения, представлены в табл. 3.
Характеристика наиболее часто используемых истинных пробиотиков (лекарственных бактерийных препаратов) с учетом их классификационных признаков представлена в табл. 4.
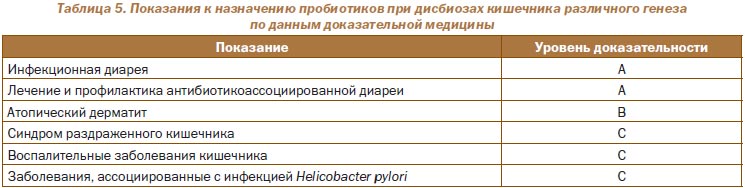
Современные показания к назначению пробиотиков разработаны международными экспертами с учетом уровня доказательств (табл. 5) [16].
Таким образом, назначение пробиотиков рекомендуется:
- при функциональных расстройствах пищеварения любого генеза (кишечная диспепсия), обусловленных нерациональным питанием (метеоризм, неустойчивый стул, тошнота), избыточной массой тела (хронический абдоминальный ишемический синдром), хронической усталостью (нарушение пассажа кишечного содержимого вследствие гипомоторики ЖКТ);
- при проявлениях пищевой и/или системной аллергии (атопический дерматит, аутоиммунное поражение слизистой кишечника);
- для профилактики антибиотикоассоциированной диареи во время восстановления микрофлоры кишечника после приема антибактериальных препаратов;
- для нормализации микрофлоры кишечника после кишечных инфекций (в т.ч. вирусных) и/или токсических, и/или радиационных поражений ЖКТ, после любых хирургических операций.
Кроме того, назначение пробиотиков оправдано как у взрослых, так и у детей при снижении секреторной функции желудка (в т.ч. ахлоргидрии), диффузных заболеваниях печени, дисфункции билиарного тракта, энтеропатиях (лактазная недостаточность, целиакия, спру), внешнесекреторной недостаточности поджелудочной железы, иммунодефицитных состояниях (СПИД, гемобластозы, онкозаболевания, состояние после химио- и лучевой терапии), системних заболеваниях соединительной ткани, сахарном диабете, аномалиях развития тонкого и толстого кишечника (в т.ч. дивертикулярная болезнь тонкого кишечника), синдроме раздраженного кишечника.
Результаты назначения пробиотиков, содержащих молочнокислые бактерии Lactobacillus spp. и Bifidobacterium spp., пациентам с синдромом раздраженной кишки в Римском консенсусе III оценены как обнадеживающие. Основные эффекты их связывают: 1) с нормализацией перистальтики, висцеральной чувствительности, газообразования в кишечнике; 2) нормализацией профиля провоспалительных цитокинов; 3) минимализацией мышечной дисфункции и нарушений нейрорегуляции кишечника [2, 10].
Спорообразующие бактерии Bacillus clausii относят к категории пробиотиков-биоэнтеросептиков, и они широко используются для восстановления качественного и количественного состава микрофлоры кишечника [14, 16]. Bacillus clausii относятся к роду строго аэробных или факультативно анаэробных грамположительных палочковидных бактерий (бацилл), образующих термоустойчивые эндоспоры. Типичными представителями этой группы также являются Bacillus subtilis, Bacillus pumilus, Bacillus coagulans, Bacillus cereus.
Представители Bacillus часто обнаруживаются в почве, выделяются из воды, воздуха, пыли, попадая в организм человека с продуктами питания, водой, во время дыхания. Они проявляют широкий спектр биологической активности: продуцируют ряд ферментов, лизирующих крахмал, пектины, целлюлозу, белки и жиры, производят различные аминокислоты и антибиотики, чем объясняют антагонизм по отношению ко многим патогенным микроорганизмам. В странах Востока бациллы используют при ферментации некоторых продуктов питания.
Споры Bacillus clausii способны выживать и сохранять свои свойства пробиотика в кислой среде желудка, под воздействием желчи в условиях двенадцатиперстной кишки и в неизмененном виде достигать кишечника и активизироваться с трансформацией в вегетативные формы уже через 2 часа после приема внутрь.
Как споры, так и вегетативные формы Bacillus clausii способны фиксироваться к специфическим локусам на кишечном эпителии и входить в состав мукозальной, а затем просветной микрофлоры.
Bacillus clausiiкак пробиотику присущи следующие характеристики:
- не являются патогенными микроорганизмами, распространены повсеместно;
- таксономически идентифицированы;
- геном Bacillus clausii полностью изучен и опубликован (март 2005 г.);
- в процессе трансформации спор в вегетативные формы происходит интенсивная продукция ряда физиологически активных веществ — лизоцима, аминокислот, витаминов, протеолитических ферментов, что обеспечивает оптимизацию пищеварения;
- дипиколиновая кислота, являющаяся продуцентом спор пробиотических штаммов Bacillus, ингибирует in vitro рост большинства лактобацилл, энтеробактерий и дрожжей, не влияя на энтерококки, а также обладает бактерицидной активностью относительно грамположительных бактерий, в частности Staph.aureus, Clostridium difficile;
- обладают иммуномодулирующими свойствами: стимулируют иммунокомпетентные клетки кишечника (в частности, Т-клетки и макрофаги), которые способствуют повышению продукции интерферонов и цитокинов, а также активности секреторного IgA;
- доказали свою эффективность в профилактике и лечении кишечного дисбиоза, диареи, в том числе антибиотикоассоциированной; продемонстрировали хороший профиль безопасности, подтвержденный многолетним клиническим опытом;
- обладают полиантибиотикорезистентностью, что позволяет применять их одновременно с антибиотиками, в частности при проведении эрадикационной терапии H.рylori [11]. Так, доказана резистентность Bacillus clausii к следующим антибиотикам: пенициллинам, тетрациклинам, макролидам, цефалоспоринам, аминогликозидам, линкомицину, изониазиду, рифампицину, хлорамфениколу, налидиксовой кислоте. Экспериментальные данные свидетельствуют об отсутствии передачи антибиотикорезистентности патогенным микроорганизмам и даже близким к Bacillus clausii видам. Поскольку данных о резистентности к карбапенемам, фторхинолонам, котримоксазолу, гликопептидам не получено, целесообразно использовать Bacillus clausii только после окончания курса их применения.
Bacillus clausii (в частности, препарат энтерожермина) назначается внутрь натощак в следующих дозировках: дети от 28 дней до 16 лет — по 1 флакону 1–2 раза в день; дети старше 16 лет и взрослые — по 1 флакону или 1 капсуле 2–3 раза в день. Продолжительность лечения осуществляется до наступления отчетливого клинического эффекта.
В качестве препарата первого ряда Bacillus clausii рекомендуется:
- для профилактики антибиотикоассоциированной диареи (одновременно с назначением антибактериальных препаратов) и коррекции нарушений микрофлоры кишечника после курса антибактериальной терапии;
- для профилактики постинфекционного СРК у взрослых (кишечные инфекции) и коррекции иммунологических нарушений микрофлоры кишечника на фоне острых респираторных вирусных инфекций у детей;
- для восстановления микрофлоры кишечника при токсических и/или радиационных поражениях ЖКТ, после хирургических операций; при системных заболеваниях соединительной ткани, сахарном диабете; аномалиях развития тонкого кишечника (дивертикулярная болезнь); иммунодефицитных состояниях (СПИД, гемобластозы, онкозаболевания, состояния после химио- и лучевой терапии);
- при функциональных расстройствах пищеварения любого генеза (кишечная диспепсия), в частности при нерациональном питании или проявлениях пищевой непереносимости;
- с целью профилактики спонтанного бактериального перитонита у больных с циррозом печени, а также энтеропатий, ассоциированных с применением нестероидных противовоспалительных препаратов;
- с целью избирательной деконтаминации кишечника при остром панкреатите.
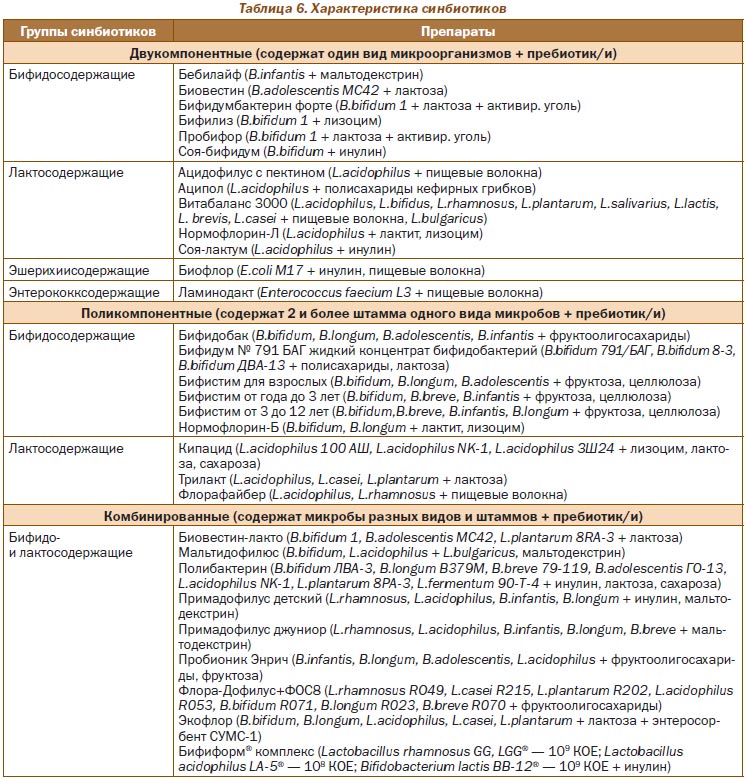
Синбиотики — комплексные фармабиотики, содержащие как пробиотики, так и пребиотики. В основу классификации синбиотиков положен принцип композиционного набора (табл. 6), согласно которому выделяют двукомпонентные (содержат один вид микроорганизмов + пребиотик/и), поликомпонентные (содержат 2 и более штамма одного вида микробов + пребиотик/и) и комбинированные (содержат микро-бы разных видов и штаммов + пребиотик/и) фармпрепараты.
Антибактериальная терапия дисбиоза кишечника
Антибактериальные препараты, занимающие первостепенное место в лечении дисбиоза кишечника, относятся к разряду кишечных антисептиков, отличающихся от системных антибиотиков отсутствием всасывания в пищеварительном канале. Это свойство составляет преимущество по сравнению с системно действующими антибактериальными препаратами благодаря: 1) возможности непосредственного воздействия на микрофлору тонкого кишечника как очаг инфекции; 2) низкой частоте системных побочных эффектов; 3) отсутствию лекарственного взаимодействия; 4) низкому риску формирования резистентных к ним штаммов патогенных микроорганизмов [1, 15].
К современным кишечным антисептикам относят рифаксимин, нифуроксазид и др. Считают также возможным при дисбиозе кишечника назначение системных антибактериальных препаратов широкого спектра (тетрациклин, доксициклин, амоксициллин, метронидазол, ципрофлоксацин, кларитромицин и др.). Все эти антибактериальные препараты назначаются перорально. Продолжительность приема препарата — 7 дней. Возможно проведение 2 или 3 курсов антибактериальной терапии.
Показаниями к назначению кишечных антисептиков являются синдромы тонкокишечного дисбиоза и дисбиоз толстой кишки III–IV степени.Предпочтительнее антибактериальные препараты, которые оказывают минимальное влияние на облигатную флору, но подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных микробов [15].
Одним из высокоэффективных и безопасных невсасывающихся антибиотиков, отвечающих вышеуказанным требованиям, нашедшим широкое применение при лечении инфекционных поражений тонкого кишечника, является рифаксимин, который оказывает бактерицидное действие, ингибируя синтез РНК бактерий в результате связывания 3-й единицы ДНК-зависимой РНК-полимеразы бактерий. Спектр антибактериальной активности препарата отличается значительной широтой и включает грамположительные аэробные бактерии: Streptococcus spp., Enterococcus spp. (включая Enterococcus fecalis), Staphylococcus spp.; грамотрицательные аэробные бактерии: энтеропатогенные штаммы Escherichia coli, Shigella spp., Salmonella spp., Yersinia spp., Proteus spp., Helicobacter pylori spp.; грамположительные анаэробные бактерии: Clostridium spp. (включая Clostridium difficile и Clostridium perfringens), Peptostreptococcus spp.; грамотрицательные анаэробные бактерии Bacteroides spp. (включая Bacteroides fragilis), Fusobacterium nucleatum [15].
Показаниями к применению рифаксимина служат:
- инфекционная диарея (включая диарею путешественника, при которой с 2004 г. рифаксимин зарегистрирован FDA США как препарат первой линии);
- синдром избыточного бактериального роста в кишечнике;
- дивертикулез толстого кишечника;
- воспалительные заболевания кишечника;
- печеночная энцефалопатия;
- профилактика инфекционных осложнений после колоректальных хирургических вмешательств.
Рифаксимин может быть эффективным (необходимы дополнительные исследования) также при инфекции Helicobacter pylori; колите, вызванном Clostridium difficile (псевдомембранозный колит); остром панкреатите, ряде экстрадигестивных заболеваний (инфекции кожи, бактериальный вагиноз, болезни периодонта); в качестве средства профилактики спонтанного бактериального перитонита у больных с асцитом на фоне цирроза печени; энтеропатиях, ассоциированных с применением нестероидных противовоспалительных препаратов.
Эффективность рифаксимина при синдроме избыточного бактериального роста в тонком кишечнике достигается в дозе 400 мг 3 раза в день в течение 7 дней.
Безопасность применения рифаксимина подтверждена для всех категорий пациентов, в том числе для детей. В связи с низкой биодоступностью препарата и отсутствием генотоксического воздействия в исследованиях как in vitro, так in vivo рифаксимин был разрешен FDA США к применению у беременных с негенерализованной инфекцией. Рифаксимин не абсорбируется и не метаболизируется в кишечном тракте, риск гепатотоксичности или системной кумуляции при его применении отсутствует, что позволяет назначать препарат пациентам с печеночной или почечной недостаточностью.
1. Агафонова Н.А. Невсасывающиеся (кишечные) антибактериальные препараты в гастроэнтерологии: спектр применения рифаксимина // Consilium medicum. Гастроэнтерология. — 2009. — № 1. — С. 61-66.
2. Барышников Н.В., Ткаченко Е.И., Успенский Ю.П. Cиндромы избыточного бактериального роста (дисбиоза) в тонкой кишке и дисбиоза толстой кишки // Вестник Клуба панкреатологов. — 2009. — № 1(2). — С. 86.-90.
3. Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы. — М.: ГЭОТАР-Медиа, 2007. — 304 с.
4. Гастроэнтерология и гепатология: диагностика и лечение: Руководство для врачей / Под ред. А.В. Калинина и А.И. Хазанова. — М.: Миклош, 2009. — 600 с.
5. Зрячкин Н.И. Новый подход к классификации пребиотиков, пробиотиков и синбиотиков // Фарматека. — 2007. — № 2(137). — С. 58-61.
6. Калинин А.В., Хазанов А.И. Гастроэнтерология и гепатология: диагностика и лечение: Руководство для врачей. — М.: Миклош, 2007. — С. 256-268.
7. Ливзан М.А., Костенко М.Б. Пробиотики в практике врача-терапевта // Consilium medicum. Гастроэнтерология. — 2008. — № 1. — С. 50-52.
8. Малов В.А., Гюлазян Н.М. Микробиоценоз желудочно-кишечного тракта: современное состоя-ние проблемы // Лечащий врач. — 2007. — № 6. — С. 10-13.
9. Можина Т.Л. Роль и место пробиотических препаратов в современной медицине (по материалам руководства Probiotics and prebiotics, 2008) // Сучасна гастроентерологія. — 2009. — № 1(45). — С. 1-13.
10. Передерий В.Г., Ткач С.М., Скопиченко С.В. Синдром раздраженной кишки как самостоятельный диагноз и одно из наиболее распространенных гастроэнтерологических заболеваний. — К., 2007. — С. 114-132.
11. Римарчук Г.В., Щеплягина Л.А., Круглова И.В., Тюрина Т.К. Нарушение микрофлоры кишечника у детей (клиническое значение, диагностика, факторы риска, новые технологии в лечении): Лекция для врачей. — М., 2009. — 32 с.
12. Скрипник И.Н. Функциональная роль микробиоты кишечника и дифференцированные подходы к коррекции нарушений микробиоценоза // Здоров’я України. — 2009. — № 6/1. — С. 51-53.
13. Харченко Н.В., Бабак О.Я. Гастроентерологія. — К., 2007. — С. 522-531.
14. Христич Т.Н. Значение микрофлоры кишечника и новые возможности коррекции микробиоце-ноза // Новости медицины и фармации. — 2009. — № 16(290). — С. 10-11.
15. Шептулин А.А., Торрес Э.А. Современные возможности применения рифаксимина в гастроэнтерологии // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2008. — № 5. — С. 17-22.
16. Guarner F., Khan A.G., Garisch J. et al. Probiotics and prebiotics // World Gastroenterol. Organisation Practice Guideline. — 2008. — http://www.world gastroenterology.org / assets / downloads / en / pdf / guidelines / 19_ probiotics _ prebiotics. pdf.
17. Shanahan F., M. O’Hara A. The bowel microflira: analysis of therapeutic potencial // Clinical Gastroenterology and Нepatology. — 2008. — Т. 1, № 1. — С. 6-17.