Журнал «Почки» 01(2012)
Вернуться к номеру
Кардиоренальный синдром: патофизиология, верификация, подходы к лечению
Авторы: Дзяк Г.В., академик НАМН Украины, д.м.н., профессор; Каплан П.А., к.м.н., доцент - Днепропетровская медицинская академия
Рубрики: Кардиология, Нефрология
Версия для печати
Введение
Связь кардиальной и почечной патологии давно привлекает внимание как кардиологов, так и нефрологов. Высокий риск кардиальной смерти при терминальной почечной недостаточности отмечен уже вскоре после внедрения в клиническую практику гемодиализа [1], но только за последнее десятилетие стало ясно, что любое повреждение почки, как острое, так и хроническое, также ассоциируется с высокой общей и сердечно-сосудистой летальностью. Эти данные, полученные в крупных рандомизированных исследованиях [2–8], стали основой концепции хронической болезни почек (ХБП), разработанной под эгидой NKF (National Kidney Foundation, США) [9] и явившейся началом последующих исследований кардиоренальных взаимодействий по всему миру [10–12].
За последнее время в связи с ростом распространенности сердечно-сосудистой патологии, увеличением продолжительности жизни кардиологических пациентов и применением интервенционных методов обследования и лечения растет и частота развития острой почечной недостаточности (ОПН) [13]. Группа экспертов Acute Dialysis Quality Initiative Group (ADQI) разработала понятие острого почечного повреждения (ОПП) и дала его определение. Для своевременного выявления, оценки тяжести и лечения почечной дисфункции была предложена многоуровневая классификационная система RIFLE (Risk, Injury, Failure, Loss of kidney function, End-stage kidney disease), в дальнейшем модифицированная экспертной группой Acute Kidney Injury Network (AKIN) [14, 15].
Необходимость раннего выявления поражения почек при сердечно-сосудистой патологии и сахарном диабете для оценки риска, выработки стратегии и тактики ведения пациентов способствовала появлению таких понятий, как «кардиоренальный синдром» (КРС) (P. Ledoux, 1951), «кардиоренальный анемический синдром» (D.S. Silverberg, 2003) и «кардиоренальный континуум» (V.J. Dzau et al., 2005) [16–19]. Об этом свидетельствует и изменение диагностических критериев и оценка значимости нарушения функции почек в рекомендациях ESC/ЕSH [20]. Однако отсутствие точного определения и единых представлений о патофизиологических механизмах кардиоренальных взаимодействий и клинических проявлениях создают сложности для своевременной диагностики и лечения.
Определение и классификация
На согласительной конференции ADQI в Венеции в 2008 г. C. Ronco с соавт. была представлена классификация, в которой выделялось пять типов кардиоренального синдрома [24].
Определение.Кардиоренальный синдром — это патофизиологическое расстройство сердца и почек, при котором острая или хроническая дисфункция одного из этих органов ведет к острой или хронической дисфункции другого. Таким образом, КРС включает острые и хронические расстройства, при которых первично пораженным органом может быть как сердце, так и почка. Особенностью явилась декларация о принципиальной неоднородности кардиоренального синдрома и выделение основных пяти его типов в зависимости от наличия острой/хронической сердечной недостаточности (СН), а также первичности/вторичности возникновения поражения сердца или почек по отношению друг к другу.
Острый КРС (1-го типа)характеризуется внезапным ухудшением сердечной деятельности, приводящим к острому повреждению почек (ОПП), встречается при остром коронарном синдроме (ОКС) в 9–19 % случаев [25, 26], а при кардиогенном шоке — в 70 % случаев [27]. Острая сердечная недостаточность (ОСН) и острая декомпенсация хронической сердечной недостаточности (ОДХСН) осложняются развитием ОПП у 24–45 % пациентов [28–31]. ОПП обычно развивается в первые дни госпитализации: 50 % — в первые 4 дня, 70–90 % — в первые 7 дней [32]. При ОДХСН и ОКС развитие ОПП ассоциируется с более высокой общей и кардиальной смертностью, более продолжительной госпитализацией, частотой регоспитализаций и прогрессированием ХБП при ее наличии. При СН летальность обратно пропорциональна скорости клубочковой фильтрации (СКФ), которая является не менее значимым прогностическим фактором, чем фракция выброса левого желудочка (ФВЛЖ), а ОПП протекает тяжелее у пациентов со сниженной ФВЛЖ по сравнению с пациентами, имеющими сохраненную ФВ [33–36]. Риск неблагоприятных исходов растет вне зависимости от устойчивости ОПП, даже незначительное повышение креатинина сыворотки (на 0,3 мг/дл — 26,6 мкмоль/л) ассоциируется с ростом смертности, при этом более тяжелое ОПП ассоциируется с более высоким риском смерти. Развитие ОПП при остром КРС 1-го типа обусловлено прежде всего нарушением перфузии почек вследствие снижения сердечного выброса и/или значительного повышения венозного давления. Часто развивается резистентность к диуретической терапии: при этом применение высоких доз или комбинаций диуретиков может быть дополнительным ятрогенным механизмом прогрессирования ОПП. При гиперволемии, резистентной к диуретикам, несмотря на оптимизацию сердечного выброса, возможно использование экстракорпоральной ультрафильтрации [37]. Наличие ОПП с гиперкалиемией или без нее ограничивает применение ингибиторов АПФ, антагонистов рецепторов ангиотензина II (АРА) и антагонистов альдостерона среди пациентов с СН и инфарктом миокарда, что может отрицательно влиять на исходы заболевания [38]. Однако при тщательном мониторинге функции почек и уровня калия потенциальная польза от назначения этих препаратов часто перевешивает риск.
Хронический КРС (2-го типа)характеризуется наличием хронической кардиальной патологии, приводящей к прогрессированию ХБП. Почечная дисфункция широко распространена среди пациентов с хронической сердечной недостаточностью (ХСН, 45–63,6 %) [39, 40] и является независимым негативным прогностическим фактором в отношении развития систолической и диастолической дисфункции ЛЖ, сердечно-сосудистой смерти, при этом выявлен биологический градиент между выраженностью почечной дисфункции и ухудшением клинических исходов [41, 42]. Одним из основных факторов повреждения при хроническом КРС, прежде всего при ХСН, считается длительная гипоперфузия почек, которой предшествуют микро- и макроангиопатии, хотя и не выявлена прямая связь между снижением ФВЛЖ и СКФ, показателями центральной гемодинамики и уровнем креатинина сыворотки [43, 44]. Также для КРС 2-го типа характерны выраженные нейрогормональные нарушения: повышение продукции вазоконстрикторов (адреналина, ангиотензина, эндотелина), изменение чувствительности и/или высвобождения эндогенных вазодилататоров (натрийуретических пептидов, оксида азота). Функциональное состояние почек также может ухудшаться вследствие терапии ХСН. Вероятность развития почечной дисфункции у больных с кардиальной патологией значительно выше, чем в популяции, а сочетание любых двух факторов сердечно-сосудистого риска повышает вероятность развития ХБП почти в 4 раза [8]. Артериальная гипертензия (АГ) — давно известная и частая причина развития ХБП, при этом развитие гипертензивного нефросклероза значительно ускоряется при наличии таких обменных нарушений, как гиперурикемия, гипергликемия и дислипидемия [45, 46]. Даже при неосложненном течении эссенциальной гипертензии (по данным исследования РIUMA) умеренное снижение СКФ ведет к удвоению риска кардиальной смерти, а АД в пределах 130–139/85–89 мм рт.ст. ассоциируется с ростом риска развития микроальбуминурии (МАУ) более чем в два раза по сравнению с пациентами с более низкими показателями.
Острый ренокардиальный синдром (КРС 3-го типа)характеризуется первичным, внезапным нарушением функции почек (например, при остром гломерулонефрите или пиелонефрите, остром канальцевом некрозе, острой обструкции мочевыводящих путей), которое приводит к острому нарушению функции сердца (СН, аритмиям, ишемии). ОПП часто наблюдается у госпитализированных пациентов и пациентов ОИТ, достигая 9 и 35 % соответственно. Распространенность ОПП при коронароангиографии и кардиохирургических вмешательствах составляет от 0,3 до 29,7 % [47, 48] и ассоциируется с высокой смертностью.
ОПП влияет на функциональное состояние сердца посредством нескольких механизмов [24]. Перегрузка жидкостью может привести к развитию ОСН, гиперкалиемия — к возникновению аритмий и остановке сердца, уремическая интоксикация снижает инотропную функцию миокарда и ведет к развитию перикардита. Развивающийся при почечной недостаточности ацидоз, способствуя возникновению легочной вазоконстрикции и правожелудочковой недостаточности, оказывает отрицательный инотропный эффект и, помимо электролитных расстройств, повышает риск развития аритмий. Кроме того, ишемия почек может сама по себе провоцировать воспаление и апоптоз кардиомиоцитов. Особой формой этого типа КРС является стеноз почечных артерий [49]. В патогенезе развития ОСН или ОДХСН в таких случаях играют роль диастолическая дисфункция ЛЖ, связанная с длительной АГ из-за гиперактивации ренин-ангиотензин-альдостероновой системы (РААС), задержка натрия и воды на фоне нарушения функции почек и острая ишемия миокарда, обусловленная повышенной потребностью его в кислороде на фоне периферической вазоконстрикции. Блокада РААС является необходимым компонентом терапии таких пациентов, однако при двустороннем стенозе почечных артерий или стенозе артерии единственной почки применение этих препаратов может привести к декомпенсации почечной недостаточности. При тяжелом ОПП, требующем заместительной почечной терапии, может развиться гемодинамическая нестабильность в виде гипотензии, нарушений ритма и проводимости, ишемия миокарда, обусловленная быстрым перемещением жидкости и электролитов при диализе.
Хронический ренокардиальный синдром (КРС 4-го типа)— это ситуация, когда первичное хроническое поражение почек приводит к нарушению функции сердца (гипертрофии желудочков, диастолической дисфункции и/или повышению риска развития неблагоприятных сердечно-сосудистых событий). В последние десятилетия растет распространенность хронических нефропатий во всем мире. По данным популяционных исследований, распространенность почечной патологии в США, Европе и Японии составляет 10–13 %, достигнув в группах высокого риска 20 % [50, 51]. Основной причиной поражения почек за последние годы являются сахарный диабет 2-го типа (СД) и АГ, заметную роль играют атеросклероз, ХСН и ожирение, то есть заболевания, распространенность которых в последние десятилетия резко возрастает. У больных с недиализной ХБП распространенность кардиальной патологии, общая и кардиальная летальность коррелируют с тяжестью почечной дисфункции [52]. Растет интерес к патогенетической роли относительного или абсолютного дефицита эритропоэтина при ХБП, который может стать причиной активации процессов апоптоза, фиброза и воспаления в миокарде [53]. Клинические исследования показали, что назначение эритропоэзстимулирующих препаратов пациентам с ХСН, ХБП и анемией приводит к улучшению функционального состояния сердца, уменьшению размеров ЛЖ и снижению уровня мозгового натрийуретического пептида [54]. В настоящее время доказано первостепенное значение достижения целевого АД для замедления прогрессирования почечной дисфункции у больных ХБП, а в качестве препаратов выбора в этих ситуациях рекомендуется применение блокаторов РААС в максимально переносимых дозах.
Вторичный КРС (5-го типа)характеризуется наличием сочетанной почечной и кардиальной патологии вследствие острых или хронических системных расстройств, при этом нарушение функции одного органа влияет на функциональное состояние другого, и наоборот. Примерами таких состояний являются сепсис, диабет, амилоидоз, системная красная волчанка, саркоидоз. Данные о распространенности 5-го типа КРС весьма скудны вследствие большого количества острых и хронических предрасполагающих состояний.
Сепсис — наиболее частое и тяжелое состояние, влияющее на функцию сердца и почек. Он может приводить к ОПП, одновременно вызывая глубокое угнетение миокарда, механизмы развития этих состояний до конца не изучены. Распространенность ОПП при сепсисе составляет 11–64 %, а частота повышения тропонина — 30–80 %, их сочетание ассоциируется с увеличением смертности по сравнению с наличием только одного из состояний [58–60].
Развитие функциональной депрессии миокарда и неадекватный сердечный выброс ведут к дальнейшему ухудшению функции почек, как при 1-м типе КРС, а ОПП влияет на функциональное состояние сердца, как при КРС 3-го типа, в результате чего возникает порочный круг, неблагоприятно влияющий на состояние обоих органов. При лечении этой патологии применяются те же принципы, что и при КРС 1-го и 3-го типов. Предварительные данные по применению интенсивной заместительной почечной терапии среди пациентов с сепсисом показали, что очищение крови может играть большую роль в улучшении функционального состояния миокарда при обеспечении оптимального клиренса, однако в настоящее время не разработаны оптимальные схемы профилактики и лечения ОПП у пациентов в критическом состоянии.
Патофизиологические механизмы
Нормальные кардиоренальные взаимоотношения представлены A. Guyton (1990) в виде гемодинамической модели, в которой почки осуществляют контроль объема внеклеточной жидкости путем регуляции процессов экскреции и реабсорбции натрия, а сердце контролирует системную гемодинамику [61]. Центральными звеньями этой модели являются РААС, эндотелийзависимые факторы и их антагонисты — натрийуретические пептиды (НУП) и калликреин-кининовая система. При поражении одного из органов происходит активация РААС и симпатической нервной системы, развиваются эндотелиальная дисфункция и хроническое системное воспаление, образуется порочный круг, при котором сочетание кардиальной и почечной дисфункции приводит к ускоренному снижению функциональной способности каждого из органов, ремоделированию миокарда, сосудистой стенки и почечной ткани, росту заболеваемости и смертности. Таким образом, прямые и косвенные влияния каждого из пораженных органов друг на друга могут приводить к появлению и сохранению сочетанных расстройств сердца и почек через сложные нейрогормональные механизмы обратной связи [62]. Более того, в этот порочный круг включается анемия, которая есть у многих пациентов с КРС, частота ее выявления повышается с увеличением функционального класса ХСН по NYHA, а уровень гемоглобина обратно пропорционален размерам левого желудочка сердца и выраженности ГЛЖ [63, 64].
Важно помнить и о возможных ятрогенных причинах развития КРС. Неконтролируемое увеличение диуреза на фоне диуретической терапии может привести к гиповолемии и уменьшению преднагрузки, а применение вазодилататоров может вызывать гипотензию. Кроме того, нестероидные противовоспалительные препараты, циклоспорин, иАПФ и АРА II также могут вызывать снижение перфузии почек.
Диагностика кардиоренального синдрома
Биомаркеры
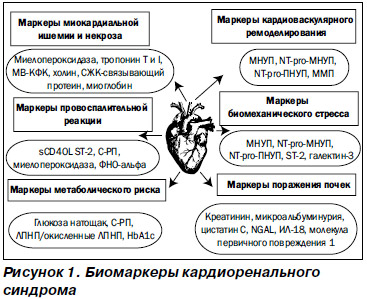
Ранняя диагностика КРС позволяет своевременно начать необходимое лечение, предупредить развитие осложнений и снизить летальность, а иногда и предотвратить развитие кардиоренальной патологии. Однако клинические симптомы появляются только на поздних стадиях дисфункции, а повреждение клеток, развивающееся вследствие молекулярных изменений, манифестирует прежде всего экспрессией биомаркеров (рис. 1) [65]. При КРС 1-го и 3-го типов выявление острого повреждения миокарда обычно не вызывает затруднений. В настоящее время НУП (BNP, NT-proBNP) являются признанными и используемыми маркерами ОСН и ОДХСН, а также независимыми предикторами сердечно-сосудистых событий и смертности от любой причины, в том числе и среди пациентов с почечной недостаточностью. Также отмечается высокая корреляция значений NT-proBNP с уровнем СКФ (r = –0,55), хотя при ОСН эта связь становится менее сильной (r = –0,33) [24, 32, 66]. Тропонины используются в качестве чувствительных маркеров повреждения миокарда. Однако повышение уровней тропонинов наблюдается и у пациентов с ХБП без клиники ОКС, обусловленное, по-видимому, как снижением их клиренса, так и возможным повреждением миокарда в условиях уремии [67, 68]. Тем не менее повышение уровней тропонинов ассоциируется с увеличением смертности при ХБП и играет прогностическую роль при КРС 4-го типа [69]. Также для раннего выявления повреждения миокарда можно использовать определение концентраций миелопероксидазы (маркера нарушения метаболизма кардиомиоцитов, окислительного стресса и воспаления) и провоспалительных цитокинов (фактор некроза опухоли a, интерлейкинов-1 и -6), способствующих повреждению и апоптозу кардиомиоцитов [70]. Непростой задачей является ранняя диагностика ОПП при КРС 1-го и 3-го типов, поскольку повышение креатинина сыворотки, которое в настоящее время является критерием диагноза ОПП, наблюдается на фоне уже развившегося повреждения почек. По современным представлениям, идеальный маркер КРС должен появляться на ранних стадиях заболевания, указывать на время повреждения и тяжесть процесса, обладать прогностической силой, высокой чувствительностью и специфичностью, а также желательна возможность его использования для стратификации риска, классификации КРС и мониторирования эффективности терапии, а возможно, и в качестве терапевтических целей. Кроме того, такой маркер должен быть экономически доступным для применения в клинической практике. Наиболее ранним маркером, выявляемым в крови и моче пациентов с ОПП, является ассоциированный с нейтрофильной желатиназой липокалин (neutrophil gelatinase-associated lipocalin — NGAL), появление которого опережает повышение уровня креатинина у пациентов на 48–72 часа [71, 72]. Цистатин С превосходит креатинин в диагностике почечной дисфункции, коррелирует с длительностью и тяжестью ОПП, потребностью в ЗПТ и госпитальной летальностью при операциях на сердце, при этом повышение уровня цистатина С в сыворотке крови является маркером снижения СКФ, а в моче указывает на канальцевую дисфункцию.
По данным сравнительного исследования чувствительности цистатина С и NGAL у пациентов с ОПП после кардиохирургических вмешательств, оба биомаркера позволяли спрогнозировать ОПП за 12 часов до повышения сывороточного креатинина, при этом предсказательная ценность NGAL превосходила цистатин С на более ранних сроках [73], а определение обоих маркеров позволяло оценивать как структурные, так и функциональные изменения почек. Молекула почечного повреждения (kidney injury molecule 1 — KIM-1) — белок, обнаруживаемый в моче после ишемического или токсического повреждения проксимальных канальцев, является высокоспецифичным маркером ишемического ОПП [74], а повышение уровня провоспалительного цитокина интерлейкина-18 (IL-18) в моче также специфично для острой ишемии почечной ткани и не характерно для нефротоксического повреждения, ХБП и инфекции мочевых путей [75]. Экскреция лизосомального фермента N-ацетил-b-d-глюкозаминидазы (NAG) с мочой является чувствительным и ранним качественным и количественным маркером канальцевого повреждения [76]. Одновременное исследование трех биомаркеров (матриксной металлопротеиназы-9, NAG и KIM-1) в моче у больных после кардиохирургических операций повышает чувствительность метода. Ранними маркерами почечного повреждения при 2-м типе КРС являются появление и нарастание МАУ и протеинурии, С-реактивного белка (СРБ), повышенные уровни НУП, ГЛЖ, снижение ФВЛЖ и СКФ — другими словами, появление и персистирование факторов риска развития и прогрессирования хронической сердечной и почечной дисфункции. Неблагоприятные сердечно-сосудистые исходы у пациентов с ХБП (КРС 4-го типа) ассоциируются с повышением плазменных уровней таких специфических биомаркеров, как тропонины, асимметричный диметиларгинин (ADMA), ингибитор активатора плазминогена 1-го типа (PAI 1), гомоцистеин, НУП, СРБ, сывороточный амилоидный белок А, альбумин, модифицированный ишемией, что свидетельствует о связи между хроническим субклиническим воспалением, прогрессированием атеросклероза и негативными сердечно-сосудистыми и почечными исходами.
Инструментальные методы диагностики КРС
Применение многих современных визуализирующих методов исследования ограничено высоким риском развития нефропатии при использовании рентген-контрастных препаратов у пациентов с почечной дисфункцией. В настоящее время наиболее перспективными неинвазивными методами являются мультифотонная микроскопия почек, позволяющая изучать патофизиологические процессы при ОПП на клеточном уровне и оценивать эффекты проводимой терапии, а также фазовоконтрастная магнитно-резонансная томография, дающая возможность оценивать кровоток в сосудах почек [24, 32]. Перспективным представляется использование метода биоимпедансного векторного анализа в сочетании с определением некоторых биомаркеров, прежде всего NGAL и НУП, что позволит более точно определять степень гидратации и контролировать ее при проведении диуретической терапии.
Подходы к лечению кардиоренального синдрома
Многие специалисты склоняются к поливалентному подходу к лечению пациентов с кардиоренальным синдромом. Нужно отметить, что в большинстве клинических исследований, посвященных различным стратегиям лечения острой и хронической СН, острая почечная недостаточность, тяжелая почечная дисфункция, а иногда и ранее документированный диагноз ХБП являлись критериями исключения. Все это обусловливает ограниченность данных по этой проблеме и требует продолжения исследований в этом направлении.
Диуретики
Диуретики широко применяются в лечении пациентов с острой и хронической СН. Однако эффективность их у пациентов с КРС ограничена развитием резиститентности и иногда нестабильной гемодинамикой [78]. В то же время применение петлевых диуретиков может повышать риск внезапной сердечной смерти и тромбоэмболических осложнений [79].
Антагонисты рецепторов вазопрессина
Антагонисты рецепторов вазопрессина в настоящее время считаются перспективными в лечении пациентов с КРС [77, 80]. Селективная блокада V2-рецепторов способствует увеличению диуреза (преимущественно за счет воды) [59] без сопутствующей активации РААС и симпатоадреналовой системы, гипотензии, гипокалиемии и стимуляции жажды [81, 82].
В настоящее время прошли первые этапы клинических испытаний два антагониста рецепторов к вазопрессину: кониваптан (conivaptan) — неспецифический антагонист V1a- и V2-рецепторов и толваптан (tolvaptan) — селективный непептидный антагонист V2-рецепторов [83, 84], причем кониваптан одобрен FDA для клинического применения [85].
Антагонисты аденозина
Антагонисты аденозина считаются перспективной группой препаратов, позволяющих повысить выживаемость почечной ткани, что теоретически может найти свое применение при кардиоренальном синдроме. Однако опыт клинического применения этих препаратов весьма ограничен. Так, антагонист A1-рецепторов KW-3902 продемонстрировал способность не только к сохранению почечной функции, но и к реверсии резистентности к диуретикам у пациентов с декомпенсированной СН и кардиоренальным синдромом [86].
Инотропные препараты
Несмотря на то что фармакологическая инотропная терапия при острой и декомпенсированной хронической СН существенно улучшает клинический статус пациентов, серьезными факторами, ограничивающими ее применение, остаются проаритмогенный и проишемический эффекты [77, 87, 88]. Но несмотря на все их преимущества, терапевтическое окно при их применении остается достаточно узким. Так, в исследовании OPTIME-CHF милринон повышал риск наступления смертельного исхода [89]. До сих пор нет четких рекомендаций по оптимальному дозированию милринона и других препаратов этого класса, длительности лечения и оценке риска наступления нежелательных клинических исходов при их применении [90, 91].
Левосимендан
Левосимендан относится к группе сенситизаторов кальция [92]. Препарат обладает позитивным инотропным эффектом, сравнимым с добутамином, а также ассоциированным с повышением величины СКФ [77, 93, 94]. Левосимендан зарегистрирован и применяется в Европе и в Украине, однако не все современные клинические рекомендации рассматривают его как лекарственное средство с доказанным позитивным влиянием в отношении ближайшей и отдаленной выживаемости [95]. Несмотря на благоприятный терапевтический профиль, остается неясной роль левосимендана при ОСН, вызванной острым инфарктом миокарда, и кардиоренальном синдроме, а доказательства его безопасности в отношении возможного проаритмогенного эффекта требуют более серьезного внимания [96, 97].
Антагонисты РААС
Сегодня окончательно не ясна роль ингибиторов АПФ, антагонистов альдостерона и антагонистов рецепторов к ангиотензину II в предотвращении возникновения кардиоренального синдрома. Представители этих классов препаратов рекомендованы на различных стадиях кардиоваскулярного и кардиоренального континуума, в том числе при ХСН, нефропатии различной этиологии, оказывают органопротекторный эффект и позитивно влияют на клинические исходы. Доказанным фактом является их позитивное влияние на выживаемость и риск повторных госпитализаций, связанных с ХДСН. Исследований же, посвященных их роли в лечении КРС, не проводилось.
Прямые ингибиторы ренинарекомендованы в настоящее время с антигипертензивной целью. Однако, учитывая их благоприятный терапевтический профиль и результаты клинических исследований, существует необходимость в исследованиях по оценке их влияния на твердые клинические конечные точки, такие как выживаемость и кардиоваскулярная/общая смертность у пациентов с ХСН. В исследовании ALOFT алискирен продемонстрировал способность к снижению уровня мозгового НУП плазмы у пациентов с ХСН, что ассоциировалось со значительным снижением выраженности митральной регургитации, улучшением трансмитрального кровотока и снижением конечно-диастолического объема левого желудочка [98]. В настоящее время проводятся клинические исследования ATMOSPHERE (у пациентов с ХСН) и ASTRONAUT (у пациентов с ОСН) по изучению влияния алискирена на твердые конечные точки. По завершении этих исследований можно будет оценить перспективы использования прямых ингибиторов ренина у больных с СН и возможной профилактики развития КРС при СН.
Несиритид
Несиритид — рекомбинантный мозговой НУП, в лечении ОСН обладающий благоприятным гемодинамическим эффектом и проявляющий натрийуретическую, ренопротективную активность, а также способствующий реверсии васкулярного и кардиального ремоделирования [99, 100]. Установлено, что длительная внутривенная инфузия несиритида способствует уменьшению выраженности нейрогуморальной активации, преимущественно за счет влияния на РААС, а также ассоциируется с дозозависимыми вазодилатацией, увеличением натрийуреза, диуреза и ингибированием секреции вазопрессина и эндотелина-1 [99]. Клинический эффект несеритида оказался сопоставимым с традиционно применяемой внутривенной инфузией негликозидного инотропного средства или нитроглицерина [101, 102]. Существуют предположения, что ренопротекторные эффекты несиритида, основанные на предотвращении снижения почечной функции за счет блокады локальной ренин-ангиотензиновой и симпатоадреналовой систем, могут благоприятно влиять как на ближайший, так и на отдаленный прогноз у пациентов с СН [102–104]. Необходимо отметить, что у пациентов с ОСН внутривенная инфузия несиритида не приводит к снижению СКФ и повышению плазменного пула креатинина [105]. Особое значение имеет потенцирование эффекта диуретиков, особенно у пациентов с развившейся острой почечной недостаточностью (ОПН) на фоне декомпенсации СН [105, 106]. В исследовании ASCEND-HF препарат не показал преимуществ по влиянию на конечные точки (смерть, госпитализация в связи с СН) через 30 дней и 6 месяцев после лечения пациентов с ОСН, хотя позитивно влиял на выраженность одышки и никак не влиял на функцию почек [107], что предопределило его место в последних Европейских рекомендациях по лечению ОСН [77]. Тем не менее вопрос о целесообразности применения несиритида и его эффективности в профилактике КРС остается открытым.
Ультрафильтрация
Процедура ультрафильтрации показана пациентам с документированной рефрактерностью к петлевым диуретикам. В то же время предполагается, что ультрафильтрация может предотвратить прогрессирование кардиоренального синдрома уже на ранних стадиях, что было изучено у пациентов с ХДСН в исследованиях RAPID-CHF и UNLOAD [108, 109]. В этих исследованиях ультрафильтрация способствовала быстрой реверсии симптомов СН, снижению массы тела, но не оказывала позитивного влияния на функцию почек. Ожидается, что исследование CARRESS-HF позволит установить преимущества ультрафильтрации в отношении функции почек у пациентов с ХДСН и КРС [110].
Заключение
Кардиоренальные синдромы — это проблема не только кардиологов и нефрологов, для ее решения необходимо объединение усилий специалистов различного профиля, а также проведение больших, хорошо спланированных исследований, которые позволят лучше понять механизмы, оценить чувствительность и специфичность существующих методов ранней диагностики, а также разработать принципы эффективной профилактики и лечения этих тяжелых состояний.
- Lindner A., Charra B., Sherrard D.J., Scribner B.H. Accelerated atherosclerosis in prolonged maintenance hemodialysis // N. Engl. J. Med. — 1974. — 290. — 697-701.
- Foley R.N., Parfrey P.S., Sarnak M.J. Clinical epidemiology of cardiovascular disease in chronic renal disease // Am. J. Kidney. Dis. — 1998. — 32: 112-119.
- Prevalence of low glomerular filtration rate in nondiabetic Americans: Third National Health and Nutrition Examination Survey (NHANES III) // J. Am. Soc. Nephrol. — 2002. — 13(5). — 1338-1349.
- Sarnak M.J., Levey A.S., Schoolwerth A.C. et al. Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention // Circulation. — 2003. — 108. — 2154-2169.
- Heywood J.T. The cardiorenal syndrome: lessons from the ADHERE database and treatment options // Heart Fail Rev. — 2004. — 9. — 195-201.
- Chadban S.J., Briganti E.M., Kerr P.G., Dunstan D.W., Welborn T.A., Zimmet P.Z., Atkins R.C.: Prevalence of kidney damage in Australian adults: The AusDiab kidney study // J. Am. Soc. Nephrol. — 2005. — 14[Suppl]. — 131-138.
- Foley R., Murray A., Li S. et al. Chronic Kidney Disease and the Risk for Cardiovascular Disease, Renal Replacement, and Death in the United States Medicare Population, 1998 to 1999 // J. Am. Soc. Nephrol. — 2005. — 16. — 489-495.
- McCullough P.A., Li S., Jurkovitz C.T. et al. CKD and cardiovascular disease in screened high-risk volunteer and general populations: the Kidney Early Evaluation Program (KEEP) and National Health and Nutrition Examination Survey (NHANES) 1999-2004 // Am. J. Kidney Dis. — 2008. — 51(4 Suppl 2). — 38-45.
- National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification // Am. J. Kidney Dis. — 2002. — 39(2 suppl 1). — S1-S266.
- Моисеев В.С., Кобалава Ж.Д. Кардиоренальные синдромы (патогенетические, клинико-диагностические и терапевтические аспекты) // Терапевтический архив. — 2011. — № 12. — С. 5-11.
- Мухин Н.А., Моисеев В.С. Кардиоренальные соотношения и риск сердечно-сосудистых заболеваний // Вестник РАМН. — 2003. — № 11. — С. 50-55.
- Мухин Н.А., Моисеев В.С., Кобалава Ж.Д. и др. Кардиоренальные взаимодействия: клиническое значение и роль в патогенезе заболеваний сердечно-сосудистой системы и почек // Терапевтический архив. — 2004. — № 6. — С. 39-46.
- Palevsky P.M. Epidemiology of acute renal failure: the tip of the iceberg // Clin. J. Am. Soc. Nephrol. — 2006. — 1. — 6-7.
- Mehta R.L., Kellum J.A., Shah S.V. et al. Acute Kidney Injury Network (AKIN): report of an initiative to improve outcomes in acute kidney injury // Crit. Care. — 2007. — 11. — R31.
- Bellomo R., Ronco C., Kellum J.A. et al. and the ADQI workgroup. Acute renal failure — definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group // Crit. Care. — 2004. — 8. — R204-R212.
- Ledoux P. Cardiorenal syndrome // Avenir. Med. — 1951. — 48(8) . — 149-153.
- Palaniappan L., Carnethon M., Formann S.P. Association between microalbuminuria and the metabolic syndrome: NHANES III // Am. J. Hypertens. — 2003. — 16(11) . — 952-958.
- Silverberg D.S. Outcomes of anaemia management in renal insufficiency and cardiac disease // Nephrol. Dial. Transplant. — 2003. — 18 (suppl 2) . — ii7-ii12.
- Dzau V. The cardiovascular continuum and renin-angiotensin-aldosterone system blockade // J. Hypertens. — 2005. — 23(suppl 1). — S9-S17.
- The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // EНJ. — 2007. — 28. — 1462-1536.
- Визир В.А., Березин А.Е. Кардиоренальный синдром // Артериальная гипертензия. — 2011. — № 2(16). — С. 100–109.
- Кобалава Ж.Д., Ефремовцева М.А., Виллевальде С.В. Кардиоренальные синдромы // Клиническая нефрология. — 2011. — № 6. — С. 9-15.
- Liang K.V., Williams A.W., Greene E.L., Redfield M.M. Acute decompensated heart failure and the cardiorenal syndrome // Crit. Care Med. — 2008. — 36. — S75-88.
- Ronco C., McCullough P., Anker S. et al.Cardio-renal syndromes: report from the consensus conference of the Acute Dialysis Quality Initiative // Eur. Heart. J. — 2010. — 31. — 703-711.
- Latchamsetty R., Fang J., Kline-Rogers E. et al. Prognostic Value of Transient and Sustained Increase in In-Hospital Creatinine on Outcomes of Patients Admitted With Acute Coronary Syndrome // Am. J. Cardiol. — 2007. — 99(7). — 939-942.
- Jose P., Skali H., Anavekar N. et al. Increase in Creatinine and Cardiovascular Risk in Patients with Systolic Dysfunction after Myocardial Infarction // J. Am. Soc. Nephrol. — 2006. — 17. — 2886-2891.
- Berl T., Henrich W. Kidney-heart interactions: epidemiology, pathogenesis, and treatment // Clin. J. Am. Soc. Nephrol. — 2006. — 1. — 8-18.
- Gottlieb S.S., Abraham W., Butler J. et al. The prognostic importance of different definitions of worsening renal function in congestive heart failure // J. Card. Fail. — 2002. — 8. — 136-141.
- Krumholz H.M., Chen Y.T., Vaccarin. V. et al. Correlates and impact on outcomes of worsening renal function in patients і65 years of age with heart failure // Am. J. Card. — 2000. — 85. — 1110-1113.
- Cowie M.R., Komajda M., Murray-Thomas T. et al. Prevalence and impact of worsening renal function in patients hospitalized with decompensated heart failure: results of the prospective outcomes study in heart failure (POSH) // EHJ. — 2006. — 27. — 1216-22.
- Smith G.L., Vaccarino V., Kosiborod M. et al. Worsening renal function: What is a clinically meaningful change in creatinine during hospitalization with heart failure? // J. Card. Fail. — 2003. — 9. — 13-25.
- Ronco C., Bellomo R., McCullough P.A. Cardiorenal Syndromes in Critical Care // Contrib. Nephrol. — Basel, Karge, 2010. — Vol. 165.
- Adams K.F., Fonarow G.C., Emerman C.L. et al. Characteristics and outcomes of patients hospitalized for heart failure in the United States: rationale, design, and preliminary observations from the first 100,000 cases in the acute decompensated heart failure national registry (ADHERE) // Am. Heart. J. — 2005. — 149. — 209-216.
- Fonarow G.C., Stough W.G., Abraham W.T. et al. Characteristics, treatments, and outcomes of patients with preserved systolic function hospitalized for heart failure: a report from the OPTIMIZE-HF registry // J. Am. Coll. Cardiol. — 2007. — 50. — 768-777.
- Jose P., Skali H., Anavekar N. et al. Increase in creatinine and cardiovascular risk in patients with systolic dysfunction after myocardial infarction // J. Am. Soc. Nephrol. — 2006. — 17. — 2886-2891.
- Goldberg A., Hammerman H., Petcherski S. et al. Inhospital and 1-year mortality of patients who develop worsening renal function following acute ST-elevation myocardial infarction // Am. Heart. J. — 2005. — 150. — 330-307.
- Costanzo M.R., Guglin M.E., Saltzberg M.T. et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure // J. Am. Coll. Cardiol. — 2007. — 13. — 49. — 675-683.
- Tessone A., Gottlieb S., Barbash I.M. et al. Underuse of standard care and outcome of patients with acute myocardial infarction and chronic renal insufficiency // Cardiology. — 2007. — 108. — 193-199.
- Ahmed A., Rich M.W., Sanders P.W. et al. Chronic Kidney Disease Associated Mortality in Diastolic Versus Systolic Heart Failure: A Propensity Matched Study // Am. J. Cardiol. — 2007. — 99. — 393-398.
- Campbell R.C., Sui S., Filippatos G. et al. Association of chronic kidney disease with outcomes in chronic heart failure: a propensity-matched study // Nephrol. Dial. Transplant. — 2009. — 24. — 186-193.
- Forman D.E., Butler J., Wang Y. et al. Incidence, predictors at admission, and impact of worsening renal function among patients hospitalized with heart failure // J. Am. Coll. Cardiol. — 2004. — 43. — 61-67.
- Hillege H.L., Nitsch D., Pfeffer M.A. et al. Renal function as a predictor of outcome in a broad spectrum of patients with heart failure // Circulation. — 2006. — 113. — 671-678.
- Dimopoulos K., Diller G.P., Koltsida E. et al. Prevalence, Predictors, and Prognostic Value of Renal Dysfunction in Adults With Congenital Heart Disease // Circulation. — 2008. — 117. — 2320-2328.
- Bhatia R.S., Tu J.V., Lee D.S. et al. Outcome of heart failure with preserved ejection fraction in a population-based study // N. Engl. J. Med. — 2006. — 355. — 260-269.
- Despres J.-P. Abdominal obesity: the most prevalent cause of the metabolic syndrome and related cardiometabolic risk // Eur. Heart. J. — 2006. — 8(suppl. B). — B4-B12.
- Lea J.P., Greene E.L., Nicholas S.B. et al. Cardiorenal metabolic syndrome in the african diaspora: rationale for including chronic kidney disease in the metabolic syndrome definition // Ethn Dis. — 2009. — 19(Suppl 2). — 11-14.
- Roghi A., Savonitto S., Cavallini C. et al. Impact of acute renal failure following percutaneous coronary intervention on long-term mortality // J. Cardiovasc. Med. — 2008. — 9. — 375-381.
- Lassnigg A., Schmid E.R., Hiesmayr M. et al. Impact of minimal increases in serum creatinine on outcome in patients after cardiothoracic surgery: do we have to revise current definitions of acute renal failure? // Crit. Care Med. — 2008. — 36. — 1129-1137.
- Hirsch A.T., Haskal Z.J., Hertzer N.R. et al. ACC/AHA guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society for Vascular Medicine and Biology, and the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease) // J. Am. Coll. Cardiol. — 2006. — 47. — e1-192.
- Coresh1 J., Stevens L., Levey A. Chronic kidney disease is common: What do we do next? // Nephrol. Dial. Transplant. — 2008. — 23(8). — 1122-1125.
- McClellan W. The epidemic of renal disease — what drives it and what can be done? // Nephrol. Dial. Transplant. — 2006. — 21(6) . — 1461-1464.
- Levin A., Foley R.N. Cardiovascular disease in chronic renal insufficiency // Am. J. Kidney Dis. — 2000. — 36. — S24-30.
- Jie K.E., Verhaar M.C., Cramer M.J. et al. Erythropoietin and the cardiorenal syndrome: Cellular mechanisms on the cardiorenal connectors // Am. J. Renal. Physiol. — 2006. — 291. — F932-44.
- Palazzuoli A., Silverberg D.S., Iovine F. et al. Effects of beta-erythropoietin treatment on left ventricular remodeling, systolic function, and B-type natriuretic peptide levels in patients with the cardiorenal anemia syndrome // Am. Heart. J. — 2007. — 154. — 645. — e9-15.
- House A.A., Haapio M., Lassus J. et al. Therapeutic strategies for heart failure in cardiorenal syndromes // Am. J. Kidney. Dis. — 2010. — 56. — 759-773.
- Roy P., Bouchard J., Amyot R., Madore F. Prescription patterns of pharmacological agents for left ventricular systolic dysfunction among hemodialysis patients // Am. J. Kidney. Dis. — 2006. — 48. — 645-51.
- Ko D.T., Juurlink D.N., Mamdani M.M. et al. Appropriateness of spironolactone prescribing in heart failure patients: a populationbased study // J. Card. Fail. — 2006. — 12. — 205-210.
- Bagshaw S.M., Lapinsky S., Dial S. et al. Acute kidney injury in septic shock: clinical outcomes and impact of duration of hypotension prior to initiation of antimicrobial therapy // Intensive. Care. Med. — 2009. — 35. — 871-881.
- Oppert M., Engel C., Brunkhorst F.M. et al. Acute renal failure in patients with severe sepsis and septic shock — a significant independent risk factor for mortality: results from the German Prevalence Study // Nephrol. Dial. Transplant. — 2008. — 23. — 904-909.
- Ammann P., Maggiorini M., Bertel O. et al. Troponin as a risk factor for mortality in critically ill patients without acute coronary syndromes // J. Am. Coll. Cardiol. — 2003. — 41. — 2004-2009.
- Bongartz L.G., Cramer M.J., Doevendans P.A. et al. The severe cardiorenal syndrome: Guyton revisited // Eur. Heart. J. — 2005. — 26. — 11-17.
- Brewster U.C., Setaro J.F., Perazella M.A. The renin-angiotensinaldosterone system: cardiorenal effects and implications for renal and cardiovascular disease states // Am. J. Med. Sci. — 2003. — 326. — 15-24.
- Silverberg D.S., Wexler D., Blum M. et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function and functional cardiac class, and markedly reduces hospitalizations // J. Am. Coll. Cardiol. — 2000. — 35. — 1737-1744.
- Levin A., Thompson C.R., Ethier J. et al. Left ventricular mass index increase in early renal disease: impact of decline in hemoglobin // Am. J. Kidney. Dis. — 1999. — 34. — 125-134.
- Ronco C., Cruz D.N. Biomarkers in cardio-renal syndromes (Rassegna) // Altri Contributi LigandAssay. — 14(4). — 2009. — 340-349.
- Austin W.J., Bhalla V., Hernandez-Arce I. et al. Correlation and prognostic utility of B-type natriuretic peptide and its aminoterminal fragment in patients with chronic kidney disease // Am. J. Clin. Pathol. — 2006. — 126. — 506-512.
- Needham D.M., Shufelt K.A., Tomlinson G. et al. Troponin I and T levels in renal failure patients without acute coronary syndrome: a systematic review of the literature // Can. J. Cardiol. — 2004. — 20. — 1212-1218.
- Abbas N.A., Jhon R.I., Webb M.C. et al. Cardiac troponins and renal function in nondialysis patients with chronic kidney disease // Clin. Chem. — 2005. — 51. — 2059-2066.
- Roberts M.A., MacMillan N., Hare D.L. et al. Cardiac troponin levels in asymptomatic patients on the renal transplant waiting list // Nephrology (Carlton). — 2006. — 11. — 471-476.
- Braunwald E. Biomarkers in heart failure // N. Engl. J. Med. — 2008. — 358. — 2148-59.
- Han W.K., Bonventre J.V. Biologic markers for the early detection of acute kidney injury // Curr. Opin. Crit. Care. — 2004. — 10. — 476-482.
- Ronco C. NGAL: an emerging biomarker of acute kidney injury // Int. J. Artif. Organs. — 2008. — 31. — 199-200.
- VandeVoorde R.G., Katlman T.I., Ma Q. et al. Serum NGAL and cystatin C as predictive biomarkers for acute kidney injury // J. Am. Soc. Nephrol. — 2006. — 17. — 404A.
- Han W.K., Bailly V., Abichandani R., Thadhani R., Bonventre J.V. Kidney injury molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury // Kidney Int. — 2002. — 62. — 237-244.
- Parikh C.R., Devarajan P. New biomarkers of acute kidney injury // Crit Care Med. — 2008. — 36(4 Suppl). — 159-165.
- Price R.G. The role of NAG (N-acetyl-beta-D-glucosaminidase) in the diagnosis of kidney disease including the monitoring of nephrotoxicity // Clin. Nephrol. — 1992. — 38(Suppl 1). — 14-19.
- ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC // European Heart Journal. — 2012. — 33. — 1787-1847.
- Leier C.V. Renal roadblock in managing low output heart failure // Critical Care Medicine. — 2004. — 32(5) . — 1228-1229.
- Cooper H.A., Dries D.L., Davis C.E. et al. Diuretics and risk of arrhythmic death in patients with left ventricular dysfunction // Circulation. — 1999. — 100. — 1311-1315.
- Ali F., Guglin M., Vaitkevicius P., Ghali J.K. Therapeutic potential of vasopressin receptor antagonists // Drugs. — 2007. — 67(6) . — 847-858.
- Greenberg A., Verbalis J.G. Vasopressin receptor antagonists // Kidney Int. — 2006. — 69. — 2124-2130.
- Veeraveedu P.T., Watanabe K., Ma M., Palaniyandi S.S., Yamaguchi K., Kodama M., Aizawa Y. Effects of V2-receptor antagonist tolvaptan and the loop diuretic furosemide in rats with heart failure // Biochem. Pharmacol. — 2008. — 75(6). — 1322-1330.
- Costello-Boerrigter L.C., Boerrigter G., Burnett J.C. Jr. V2-receptor antagonism with tolvaptan in heart failure // Expert Opin. Investig. Drugs. — 2007. — 16(10) . — 1639-1647.
- Goldsmith S.R. Vasopressin: a therapeutic target in congestive heart failure? // J. Cardiac. Failure. — 1999. — 5. — 347-356.
- Greenberg А. Tolvaptan, an Oral Vasopressin V2-Receptor Antagonist for Heart Failure? // Am. J. Kidney Diseases. — 2007. — 50(6). — 904-907.
- Givertz M.M., Massie B.M., Fields T.K., Pearson L.L., Dittrich H.C. The effects of KW-3902, an adenosine A1-receptor antagonist, on diuresis and renal function in patients with acute decompensated heart failure and renal impairment or diuretic resistance // J. Am. Coll. Cardiol. — 2007. — 50(16). — 1551-1560.
- Remme W.J. Positive inotropes: a new horizon or still a dead end? // Cardiovasc. Drugs Ther. — 2001. — 15. — 375-377.
- Thackray S., Easthaugh J., Freemantle N. et al. The effectiveness and relative effectiveness of intravenous inotropic drugs acting through the adrenergic pathway in patients with heart failure — a meta regression analysis // Eur. J. Heart Fail. — 2002. — 4. — 515-529.
- Felker G.M., Benza R.L., Chandler A.B. et al. Heart failure etiology and response to milrinone in decompensated heart failure: results from the OPTIME-CHF study // J. Am. Coll. Cardiol. — 2003. — 41(6). — 997-1003.
- Cleland J.G., Freemantle N., Coletta A.P., Clark A.L. Clinical trials update from the American Heart Association: REPAIR-AMI, ASTAMI, JELIS, MEGA, REVIVE-II, SURVIVE, and PROACTIVE // Eur. J. Heart Fail. — 2006. — 8. — 105-110.
- Stevenson L.W. Clinical use of inotropic therapy for heart failure // Circulation. — 2003. — 108. — 367-372.
- Yokoshiki H., Katsube Y., Sunagawa M. et al. Levosimendan, a novel Ca2+ sensitizer, activates the glibenclamide-sensitive K+ channel in rat arterial myocytes // Eur. J. Pharmacol. — 1997. — 333. — 249-259.
- Follath F., Cleland J.G., Just H. et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomised double blind trial // Lancet. — 2002. — 360. 196-202.
- Slawsky M.T., Colucci W.S., Gottlieb S.S. et al. Acute hemodynamic and clinical effects of levosimendan in patients with severe heart failure. Study Investigators // Circulation. — 2000. — 102. — 2222-2227.
- Mebazaa A., Nieminen M.S., Packer M. et al. Levosimendan vs dobutamine for patients with acute decompensated heart failure: the SURVIVE randomized trial // J. Am. Med. Association. — 2007. — 297(17). — 1883-1891.
- Lilleberg J., Ylonen V., Lehtonen L., Toivonen L. The calcium sensitizer levosimendan and cardiac arrhythmias: an analysis of the safety database of heart failure treatment studies // Scand. Cardiovasc. J. — 2004. — 38. — 80-84.
- Moiseyev V.S., Poder P., Andrejevs N. et al. Safety and efficacy of a novel calcium sensitizer, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. A randomized, placebo-controlled, double-blind study (RUSSLAN) // Eur. Heart J. — 2002. — 23. — 1422-1432.
- McMurray J., Pitt B., Latini R. et al. Effects of the oral direct inhibitor aliskiren in patients with symptomatic heart failure // Circ. Heart Fail. — 2008. — 11. — 17-24.
- ButlerJ., Emerman C., Peacock W.F. et al. The efficacy and safety of B-type natriuretic peptide (nesiritide) in patients with renal insufficiency and acutely decompensated congestive heart failure // Nephrol. Dial. Transplant. — 2004. — 19. — 391-399.
- Jensen K.T., Carstens J., Pedersen E.B. Effect of BNP on renal hemodynamics, tubular function and vasoactive hormones in humans // Am. J. Physiol. — 1998. — 274: F63-F72.
- Fonarow G.C. The treatment targets in acute decompensated heart failure // Rev. Cardiovasc. Med. — 2001. — 2(Suppl. 2). — S7-S12.
- Keating G.M., Goa K.L. Nesiritide: a review of its use in acute decompensated heart failure // Drugs. — 2003. — 63. — 47-70.
- Hillege H., Van Gilst W., de Zeeuw D. et al. Renal function as a predictor of prognosis in chronic heart failure // Heart Fail. Monit. — 2002. — 2. — 78-84.
- Jensen K.T., Eiskjaer H., Carstens J. et al. Renal effects of brain natriuretic peptide in patients with congestive heart failure // Clin Sci. — 1999. — 96. — 5-15.
- VMAC Investigators. Intravenous nesiritide vs. nitroglycerin for treatment of decompensated congestive heart failure: a randomized controlled trial // JAMA. — 2002. — 287. — 1531-1540.
- Cataliotti A., Boerrigter G., Costello-Boerrigter L.C. et al. Brain natriuretic peptide enhances renal actions of furosemide and suppresses furosemide-induced aldosterone activation in experimental heart failure // Circulation. — 2004. — 109. — 1680-1685.
- O'Connor C.M., Starling R.C., Hernandez A.F. et al. Effect of Nesiritide in Patients with Acute Decompensated Heart Failure // N. Engl. J. Med. — 2011. — 365. —32-43.
- Bart B.A., Boyle A., Bank A.J. et al. Ultrafiltration versus usual care for hospitalized patients with heart failure: the relief for acutely fluid-overloaded patients with decompensated congestive heart failure (RAPID-CHF) trial // J. Am. Coll. Cardiol. — 2005. — 46(11) . — 2043-2046.
- Costanzo M.R., Guglin M.E., Saltzberg M.T. et al. Ultrafiltration versus intravenous diuretics for patients hospita¬lized for acute decompensated heart failure // J. Am. Coll. Cardiol. — 2007. — 49(6). — 675-683.
- Bart B.A., Goldsmith S.R., Lee K.L. et al. Cardiorenal rescue study in acute decompensated heart failure: rationale and design of CARRESS-HF, for the Heart Failure Clinical Research Network // J. Card. Fail. — 2012 Mar. — 18(3). — 176-182.

