Журнал «Почки» 01(2012)
Вернуться к номеру
Практичні рекомендації KDIGO з гломерулонефриту
Авторы: Omar I. Abboud, MD, FRCP; Sharon Adler, MD, FASN; Rajiv Agarwal, MD; Sharon P. Andreoli, MD; Gavin J. Becker, MD, FRACP; Fred Brown, MBA, FACHE; Daniel C. Cattran, MD, FRCPC; Allan J. Collins, MD, FACP; Rosanna Coppo, MD; Josef Coresh, MD, PhD; Ricardo Correa-Rotter, MD; Adrian Covic, MD, PhD; Jonathan C. Craig, MBChB, MM (Clin Epi), DCH, FRACP, PhD; Angel de Francisco, MD; Paul de Jong, MD, PhD; Ana Figueiredo, RN, MSc, PhD; Mohammed Benghanem Gharbi, MD; Gordon Guyatt, MD, MSc, BSc, FRCPC; David Harris, MD; Lai Seong Hooi, MD; Enyu Imai, MD, PhD; Lesley A. Inker, MD, MS, FRCP; Michel Jadoul, MD; Simon Jenkins, MBE, FRCGP; Suhnggwon Kim, MD, PhD; Martin K. Kuhlmann, MD; Nathan W. Levin, MD, FACP; Philip K.-T. Li, MD, FRCP, FACP; Zhi-Hong Liu, MD; Pablo Massari, MD; Peter A. McCullough, MD, MPH, FACC, FACP; Rafique Moosa, MD; Miguel C. Riella, MD; Adibul Hasan Rizvi, MBBS, FRCP; Bernardo Rodriquez-Iturbe, MD; Robert Schrier, MD; Justin Silver, MD, PhD; Marcello Tonelli, MD, SM, FRCPC; Yusuke Tsukamoto, MD; Theodor Vogels, MSW; Angela Yee-Moon Wang, MD, PhD, FRCP; Christoph Wanner, MD; David C. Wheeler, MD, FRCP; Elena Zakharova, MD, PhD.
Рубрики: Кардиология, Нефрология
Версия для печати
Резюме. Хвороби нирок 2011: клінічні настанови KDIGO з гломерулонефриту мають на меті сприяти лікарям-практикам надавати допомогу дорослим і дітям, хворим на ГН. Розробка настанов базувалась на чіткому дотриманні процесу аналізу та оцінки доказових даних. Настанови містять розділи, присвячені різноманітним гломерулярним хворобам: стероїдочутливому нефротичному синдрому у дітей; стероїдорезистентному нефротичному синдрому у дітей; хворобі мінімальних змін; фокально-сегментарному гломерулосклерозу; ідіопатичній мембранозній нефропатії; мембранопроліферативному гломерулонефриту; гломерулонефриту, розвиток якого пов’язаний із інфекцією; IgA-нефропатії, нефриту на тлі пурпури Геноха — Шенляйна; люпус-нефриту; малоімунному фокальному і сегментарному некротизуючому гломерулонефриту; гломерулонефриту, зумовленому наявністю антитіл до гломерулярної базальної мембрани. Лікувальні підходи подані в кожному розділі, рекомендації настанови базуються на систематичних оглядах результатів відповідних досліджень. Оцінка якості доказів та доведеності рекомендацій базувалась на шкалі GRADE. Обмеження доказовості обговорювались окремо, також запропоновані певні пропозиції щодо проведення подальших досліджень.
Ключові слова: клінічні настанови, KDIGO; гломерулонефрит, нефротичний синдром, рекомендації, що базуються на доказових даних, систематичний огляд.
Kidney International, June 2012, vol. 2, issue 2, p. 259-274.
http://www.kidney-international.org
Члени робочої групи KDIGO
Співголови робочої групи:
Garabed Eknoyan, MD
Norbert Lameire, MD, PhD
Kai-Uwe Eckardt, MD; Bertram L. Kasiske, MD
Співробітники з підготовки NKF-KDIGO Guideline:
Kerry Willis, PhD, Senior Vice-President for Scientific Activities
Michael Cheung, MA, Guideline Development Director
Sean Slifer, BA, Guideline Development Manager
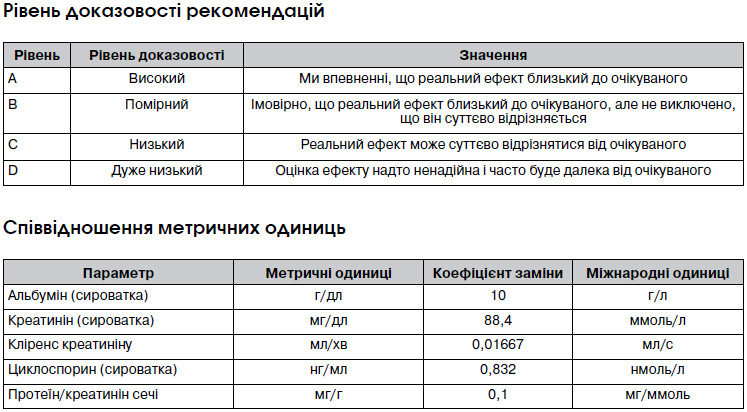
Термінологія та опис градацій рекомендацій настанов
Кожна глава містить рекомендації, що класифікуються як рівень 1 або 2, і якість підтвердження доказів A, B, C або D, як наведено нижче.
Класифікація рівня рекомендацій
Абревіатури і акроніми
Анти-ГБН ГН — гломерулонефрит, зумовлений наявністю антитіл до гломерулярної базальної мембрани
AНЦА — антинейтрофільні цитоплазматичні антитіла
АФС — антифосфоліпідний синдром
БРА — блокатор рецепторів до ангіотензину
в/в — внутрішньовенно
ГБМ — гломерулярна базальна мембрана
ГН — гломерулонефрит
ГУН — гостре ураження нирок
ГШП — Геноха — Шенляйна пурпура
ІАПФ — інгібітор АПФ
ІКН — інгібітор кальциневрину
ІМН — ідіопатична мембранозна нефропатія
ЛН — люпус-нефрит
ММФ — мікофенолату мофетил
МН — мембранозна нефропатія
МНС — міжнародне нормалізоване співвідношення
МПГН — мембранопроліферативний гломерулонефрит
рШКФ — розрахована швидкість клубочкової фільтрації
СЗ — стероїдозалежний
СРНС — стероїдорезистентний нефротичний синдром
СЧНС — стероїдочутливий нефротичний синдром
ТТП — тромботична тромбоцитопенічна пурпура
ФСГЗ — фокально-сегментарний гломерулосклероз
ЦФ — циклофосфамід
ЧР — часто рецидивуючий
ХМЗ — хвороба мінімальних змін
ХХН — хронічна хвороба нирок
ШКФ — швидкість клубочкової фільтрації
IgAН — імуноглобулін-А-нефропатія
GRADE — Grading of Recommendations Assessment, Development and Evaluation
HBV— вірус гепатиту В
HCV— вірус гепатиту С
HSV — вірус Herpes simplex
KDIGO — Kidney Disease: Improving Global Outcomes
р.о. — перорально
Примітка
Частина 1. Використання клінічних настанов
Клінічні настанови базуються на результатах систематичних оглядів літератури (січень 2011), окремі доказові дані отримані на листопад 2011. Настанови розроблені для надання інформації та допомоги в прийнятті ґрунтовного рішення. Вони не визначають стандартів лікування, а також не можуть бути інтерпретовані як ексклюзивний курс ведення. Варіації в практиці неминуче виникають, коли клініцисти беруть до уваги індивідуальність пацієнта, наявні можливості та обмеження відповідно до типу лікувального закладу. Кожний фахівець використовує ці рекомендації залежно від умов та дотримується їх згідно з конкретною клінічною ситуацією. Рекомендації для досліджень, що містяться в цьому документі, є загальними і не є офіційним протоколом.
Частина 2. Інформаційне підґрунтя
Kidney Disease: Improving Global Outcomes (KDIGO) докладає усіх можливих зусиль для уникання будь-яких фактичних або виправданих відчутних конфліктів інтересів, що можуть виникати як наслідок сторонніх втручань або персональних, професійних чи ділових інтересів членів робочої групи. Від усіх учасників робочої групи вимагались повні підписані представлення інформації та атестаційні форми, що відображали всі взаємовідносини, які могли сприйматися або бути фактичними ознаками конфлікту інтересів. Цей документ щорічно оновлювався, а інформація відповідно коректувалась. Вся подана інформація буде надрукована в остаточній редакції та в документах National Kidney Foundation (NKF) — керівного агента KDIGO.
Склад робочої групи
Співголови робочої групи:
Daniel C. Cattran, MD, FRCPC, Toronto General Hospital, Toronto, Canada
John Feehally, DM, FRCP, University Hospitals of Leicester, Leicester, United Kingdom
Група формування доказової бази:
Tufts Center for Kidney Disease Guideline Development and Implementation, Tufts Medical Center, Boston, MA, USA:
Ethan M. Balk, MD, MPH, Project Director; Program Director, Evidence Based Medicine
Gowri Raman, MD, MS, Scientific Staff
Dana C. Miskulin, MD, MS, Staff Nephrologist
Aneet Deo, MD, MS, Nephrology Fellow
Amy Earley, BS, Project Coordinator
Shana Haynes, MS, DHSc, ResearchAssistant
За підтримки
Katrin Uhlig, MD, MS, Director, Guideline Development
Робоча група:
H. Terence Cook, MBBS, MRCP, MRCPath, FRCPath, FMedSci, Imperial College London, London, United Kingdom
Fernando C. Fervenza, MD, PhD, Mayo Clinic, Rochester, MN, USA
Jьrgen Floege, MD, University Hospital, RWTH Aachen, Aachen, Germany
Debbie S. Gipson, MD, MS, University of Michigan, Ann Arbor, MI, USA
Richard J. Glassock, MD, MACP, The Geffen School of Medicine at UCLA, Laguna Niguel, CA, USA
Elisabeth M. Hodson, MBBS, FRACP, The Children’s Hospital at Westmead, Sydney, Australia
Vivekanand Jha, MD, DM, FRCP, FAMS, Postgraduate Institute of Medical Education, Chandigarh, India
Philip Kam-Tao Li, MD, FRCP, FACP, Chinese University of Hong Kong, Hong Kong, China
Zhi-Hong Liu, MD, Nanjing University School of Medicine, Nanjing, China
Sergio A. Mezzano, MD, FASN, FACP, Universidad Austral, Valdivia, Chile
Patrick H. Nachman, MD, University of North Carolina, Chapel Hill, NC, USA
Manuel Praga, MD, PhD, Hospital 12 de Octubre, Madrid, Spain
Jai Radhakrishnan, MD, MS, MRCP, FACC, FASN, New York Presbyterian-Columbia, New York, NY, USA
Brad H. Rovin, MD, FACP, FASN, The Ohio State University College of Medicine, Columbus, OH, USA
Stйphan Troyanov, MD, University of Montreal, Montreal, Canada
Jack F.M. Wetzels, MD, PhD, Radboud University Nijmegen Medical Center, Nijmegen, The Netherlands
Цитування
При цитуванні цього документу посилатись як:
Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for Glomerulonephritis // Kidneyinter., Suppl. 2012; 2, 139-274.
Скорочений виклад рекомендацій
Розділ 3. Стероїдочутливий нефротичний синдром (СЧНС) у дітей
3.1. Лікування дебютного епізоду СЧНС.
3.1.1. Ми рекомендуємо призначати кортикостероїдну терапію (преднізон чи преднізолон)* щонайменше на 12 тижнів (1B).
3.1.1.1. Ми рекомендуємо призначення перорального преднізолону у вигляді одноразової добової дози (1B), починаючи з 60 мг/м2/день або 2 мг/кг/день до максимальної 60 мг/день (1D).
3.1.1.2. Ми рекомендуємо призначення одноразової добової дози преднізолону перорально протягом 4–6 тижнів (1C) із наступним прийомом через день у формі єдиної добової дози, починаючи з 40 мг/м2 або 1,5 мг/кг (максимум 40 мг в альтернативні дні) (1D) та продовжувати протягом 2–5 місяців, поступово знижуючи дозу (1B).
3.2. Лікування повторного епізоду (рецидиву) СЧНС кортикостероїдами.
3.2.1. Кортикостероїдна терапія для дітей з нечастими рецидивами СЧНС:
3.2.1.1. Ми пропонуємо в разі нечастих епізодів СЧНС у дітей призначення перорального преднізолону у вигляді одноразової добової дози 60 мг/м2 або 2 мг/кг (максимальна доза 60 мг/день) до досягнення повної ремісії протягом щонайменше трьох днів (2D).
3.2.1.2. Ми пропонуємо після досягнення повної ремісії призначати дітям одноразову дозу преднізолону через день (40 мг/м2 одноразова доза або 1,5 мг/кг на дозу: максимально 40 мг через день) щонайменше протягом 4 тижнів (2C).
3.2.2. Кортикостероїдна терапія для часто рецидивуючого (ЧР) і стероїдзалежного (СЗ) СЧНС.
3.2.2.1. Ми пропонуємо рецидиви у дітей із ЧР або СЗ СЧНС лікувати щоденними прийомами преднізону до досягнення дитиною ремісії щонайменше протягом 3 днів, із наступним прийомом преднізону через день щонайменше три місяці (2C).
3.2.2.2. Ми пропонуємо призначення преднізону через день у найменшій дозі для підтримання ремісії, щоб запобігти значним небажаним явищам у дітей з ЧР та СЗ СЧНС (2D).
3.2.2.3. Ми пропонуємо призначення добової дози преднізону щоденно у мінімальній дозі для запобігання значним небажаним ефектам підтримання ремісії у дітей із СЗ СЧНС у тих випадках, коли терапія преднізоном через день неефективна (2D).
3.2.2.4. Ми пропонуємо щоденний прийом преднізону для тих пацієнтів, які приймають його через день, у випадках епізодів захворювань верхніх дихальних шляхів та інших інфекційних захворювань для зниження ризику рецидивів у дітей із ЧР та СЗ СЧНС (2C).
3.3. Лікування ЧР та СЗ СЧНС агентами, що позбавляють від потреби в кортикостероїдах.
3.3.1. Ми рекомендуємо призначення кортикостероїд-замісних медикаментів дітям із ЧР СЧНС і СЗ СЧНС, у яких розвиваються небажані ефекти, пов’язані зі стероїдами (1B).
3.3.2. Ми рекомендуємо призначення алкілуючих препаратів, циклофосфаміду та хлорамбуцилу як кортикостероїд-позбавляючих засобів для ЧР СЧНС (1B). Ми пропонуємо призначення алкілуючих препаратів, циклофосфаміду та хлорамбуцилу як кортикостероїд-замісних засобів для СЗ СЧНС (2C).
3.3.2.1. Ми пропонуємо призначення циклофосфаміду (2 мг/кг/д) протягом 8–12 тижнів (максимальна кумулятивна доза 168 мг/кг) (2C).
3.3.2.2. Ми пропонуємо не призначати циклофосфамфід, поки дитина не ввійшла в ремісію при лікуванні кортикостероїдами (2D).
3.3.2.3. Ми пропонуємо призначення хлорамбуцилу (0,1–0,2 мг/кг/д) протягом 8 тижнів (максимальна кумулятивна доза 11,2 мг/кг) як альтернативу циклофосфаміду (2C).
3.3.2.4. Ми пропонуємо не призначати повторний курс алкілуючих препаратів (2D).
3.3.3. Ми рекомендуємо призначати левамізол як кортикостероїд-замісний агент (1B).
3.3.3.1. Ми пропонуємо призначення левамізолу у дозі 2,5 мг/кг через день (2B) протягом щонайменше 12 місяців (2C), оскільки більшість дітей мають рецидив після припинення прийому левамізолу.
3.3.4. Ми рекомендуємо призначати інгібітор кальциневрину (ІКН) циклоспорин або такролімус як кортикостероїд-замісний медикамент (1C).
3.3.4.1. Ми пропонуємо призначення циклоспорину в дозі 4–5 мг/кг/день (стартова доза) у два прийоми (2C).
3.3.4.2. Ми пропонуємо призначення такролімусу в дозі 0,1 мг/кг/день (стартова доза) у два прийоми замість циклоспорину, коли косметичні побічні ефекти циклоспорину неприйнятні (2D).
3.3.4.3. Моніторуйте рівні інгібітору кальциневрину протягом терапії для обмеження токсичності (не оцінюється).
3.3.4.4. Ми пропонуємо прийом ІКН щонайменше протягом 12 місяців, тому що в більшості дітей виникає рецидив після припинення його прийому (2C).
3.3.5. Ми пропонуємо приймати ММФ як кортикостероїд-замісний медикамент (2C).
3.3.5.1. Ми пропонуємо застосовувати ММФ (початкова доза 1200 мг/м2/день) у два прийоми, щонайменше протягом 12 місяців, оскільки в більшості дітей виникає рецидив після припинення його прийому (2C).
3.3.6. Ми пропонуємо прийом ритуксимабу лише у дітей зі СЗ СЧНС, у яких мають місце тривалі повторні рецидиви, незважаючи на оптимальну комбінацію преднізолону та кортикостероїд-замісного медикаменту, та/або у яких є серйозні побічні ефекти від лікування (2C).
3.3.7. Ми пропонуємо не призначати мізорибін як кортикостероїд-замісний агент у дітей із ЧР та СЗ СЧНС (2C).
3.3.8. Ми рекомендуємо не використовувати азатіоприн як кортикостероїд-замісний агент у дітей із ЧР та СЗ СЧНС (1B).
3.4. Показання до біопсії нирки.
3.4.1. Показання до біопсії нирки у дітей із СЧНС (не градуйовано):
— відсутність ефективності терапії кортикостероїдами (формування резистентності) після наявного початкового позитивного ефекту;
— сильна підозра на іншу першопричину захворювання;
— зниження функції нирок у дітей, що приймають ІКН.
3.5. Імунізація у дітей з СЕНС.
3.5.1. Для зниження ризику серйозних інфекцій у дітей з СЧНС (не градуйовано):
— Вакцинуйте дітей проти пневмокока.
— Щорічно вакцинуйте дітей та осіб, які їх оточують, проти грипу.
— Відкладіть вакцинацію живими вакцинами до зниження добової дози преднізолону до 1 мг/кг щодня (< 20 мг/день) або до 2 мг/кг дерез день (< 40 мг через день).
— Живі вакцини протипоказані дітям, які приймають кортикостероїд-замісні імуносупресивні препарати.
— Вакцинуйте здорових осіб з оточення дітей живими вакцинами для мінімізації ризику передачі інфекції імуносупресованій дитині, але обмежте можливий контакт дитини з гастроінтестинальними, сечовими або респіраторними виділеннями вакцинованої людини протягом наступних 3–6 тижнів.
— За наявності близького контакту з інфекцією вітряної віспи призначте неімунізованим дітям, що приймають імуносупресивні препарати, імуноглобулін проти вітряної віспи.
Розділ 4. Стероїдорезистентний нефротичний синдром у дітей
4.1. Аналіз дітей зі СРНС.
4.1.1. Ми пропонуємо мінімум 8 тижнів лікування кортикостероїдами для визначення резистентності до стероїдів (2D).
4.1.2. Наступне потрібно для оцінки дітей з СРНС (не оцінюється):
— діагностична біопсія нирки;
— оцінка функції нирок за допомогою визначення ШКФ або рШКФ;
— визначення рівня екскреції білка з сечею.
4.2. Рекомендації щодо лікування СРНС.
4.2.1. Ми рекомендуємо використання інгібітору кальциневрину як початкову терапію у дітей з СЧНС (1B).
4.2.1.1. Ми пропонуємо продовжувати терапію ІКН не менше 6 місяців, а потім припинити, якщо часткова або повна ремісія протеїнурії не досягається (2C).
4.2.1.2. Ми пропонуємо продовжувати терапію ІКН мінімум протягом 12 місяців, коли принаймні часткова ремісія була досягнута за 6 місяців (2C).
4.2.1.3. Ми пропонуємо комбінацію терапії низькими дозами кортикостероїдів з ІКН (2D).
4.2.2. Ми рекомендуємо терапію ІАПФ або БРА для дітей зі СРНС (1B).
4.2.3. Для дітей, у яких не вдається досягнути ремісії за допомогою терапії ІКН:
4.2.3.1. Ми пропонуємо комбінацію мікофенолату мофетилу (2D), високої дози кортикостероїдів (2D) або комбінацію цих препаратів (2D) розглянути як варіант терапії у дітей, у яких не вдалось досягнути повної або часткової ремісії за допомогою ІКН та кортикостероїдів.
4.2.3.2. Ми пропонуємо не призначати циклофосфамід дітям із СРНС (2B).
4.2.4. У пацієнтів із рецидивом нефротичного синдрому після повної ремісії ми пропонуємо відновити лікування одним із варіантів на вибір (2C):
— пероральні кортикостероїди (2D);
— повернутись до попереднього успішно вживаного імуносупресивного агента (2D);
— альтернативний імуносупресивний агент для мінімізації подальшої кумулятивної токсичності (2D).
Розділ 5. Хвороба мінімальних змін (ХМЗ) у дорослих
5.1. Лікування початкового епізоду ХМЗ у дорослих.
5.1.1. Ми рекомендуємо призначати кортикостероїди для початкового лікування нефротичного синдрому (1C).
5.1.2. Ми пропонуємо преднізон або преднізолон призначати у разовій добовій дозі 1 мг/кг (максимум 80 мг) або в разовій дозі 2 мг/кг через день (максимум 120 мг) (2C).
5.1.3. Ми пропонуємо початкову високу дозу кортикостероїдів за умови доброї переносимості підтримувати мінімум 4 тижні, якщо повна ремісія досягнута, та максимум 16 тижнів, якщо повна ремісія не досягнута (2C).
5.1.4. Для пацієнтів із ремісією ми пропонуємо повільне зниження дози кортикостероїдів протягом загального періоду до 6 місяців після досягнення ремісії (2D).
5.1.5. Для пацієнтів із відносними протипоказаннями або нетолерантністю до високих доз кортикостероїдів (наприклад, неконтрольований діабет, психічні розлади, тяжкий остеопороз) ми пропонуємо пероральний прийом циклофосфаміду або ІКН, як було вказано при часто рецидивуючій ХМЗ (2D).
5.1.6. Ми пропонуємо використання однакової початкової дози та тривалість прийому кортикостероїдів для нечастих рецидивів як у рекомендаціях 5.1.2, 5.1.3 та 5.1.4 (2D).
5.2. Часто рецидивуюча (ЧР)/СЗ ХМЗ.
5.2.1. Ми пропонуємо прийом циклофосфаміду у дозі 2–2,5 мг/кг/день протягом 8 тижнів (2C).
5.2.2. Ми пропонуємо прийом ІКН (циклоспорин 3–5 мг/кг/день або такролімус 0,05–0,1 мг/кг/день у розподілених дозах) протягом 1–2 років для пацієнтів з ЧР/СЗ ХМЗ, у яких був рецидив на фоні лікування циклофосфамідом, або для людей, що бажають зберегти свою фертильність (2C).
5.2.3. Ми пропонуємо ММФ 500–1000 мг двічі на день протягом 1–2 років для пацієнтів, які не переносять кортикостероїди, циклофосфамід та ІКН (2D).
5.3. Кортикоїдорезистентна ХМЗ.
5.3.1. Повторіть обстеження кортикостероїд-резистентних пацієнтів для виявлення інших причин нефротичного синдрому (не оцінюється).
5.4. Підтримуюча терапія.
5.4.1. Ми пропонуємо пацієнтам із ХМЗ та гострим ураженням нирок лікування нирковозамісною терапією за призначенням, але разом із кортикостероїдами, як для першого епізоду ХМЗ (2D).
5.4.2. Ми пропонуємо для початкового епізоду нефротичного синдрому, асоційованого з ХМЗ, не використовувати статини для лікування гіперліпідемії, ІАПФ і БРА не використовувати у нормотензивних пацієнтів для зниження протеїнурії (2D).
Розділ 6. Ідіопатичний фокально-сегментарний гломерулосклеоз у дорослих
6.1. Початкова оцінка ФСГЗ.
6.1.1. Починайте оцінку з аналізу виключення вторинних форм ФСГЗ (не оцінюється).
6.1.2. Не виконуйте без необхідності генетичне дослідження (не оцінюється).
6.2. Початкове лікування ФСГЗ.
6.2.1. Ми рекомендуємо розглядати кориткостероїдну та імуносупресивну терапію тільки при ідіопатичному ФСГЗ за наявності клінічних ознак нефротичного синдрому (1C).
6.2.2. Ми пропонуємо призначати преднізон в одній добовій дозі 1 мг/кг (максимум 80 мг) або альтернуючій (через добу) дозі 2 мг/кг (максимум 120 мг) (2C).
6.2.3. Ми пропонуємо початкове лікування кортикостероїдами у високій дозі протягом мінімум 4 тижнів; продовжувати лікування у високій дозі максимально до 16 тижнів при добрій переносимості або до досягнення повної ремісії, навіть якщо вона виникла раніше (2D).
6.2.4. Ми пропонуємо повільне зниження дози кортикостероїдів протягом 6 місяців після досягнення повної ремісії (2D).
6.2.5. Ми пропонуємо розглядати ІКН як першу лінію терапії для пацієнтів із відносними протипоказаннями або непереносимістю високих доз кортикостероїдів (наприклад, неконтрольований діабет, психічні розлади, тяжкий остеопороз) (2D).
6.3. Лікування рецидиву.
6.3.1. Ми пропонуємо лікування нефротичного синдрому згідно з рекомендаціями щодо ХМЗ у дорослих (див. розділ 5.1 і 5.2) (2D).
6.4. Лікування стероїд-резистентного ФСГЗ.
6.4.1. Для стероїд-резистентного ФСГЗ ми пропонуємо призначення циклоспорину в дозі 3–5 мг/кг/день у два прийоми протягом щонайменше 4–6 місяців (2B).
6.4.2. При досягненні часткової або повної ремісії ми пропонуємо продовжити лікування циклоспорином щонайменше 12 місяців із наступним повільним зниженням (2D).
6.4.3. Ми пропонуємо пацієнтам зі стероїдорезистентним ФСГЗ, які не переносять циклоспорин, лікування поєднанням ММФ і дексаметазону у високих дозах (2C).
Розділ 7. Ідіопатична мембранозна нефропатія
7.1. Оцінка МН.
7.1.1. Виконуйте відповідні дослідження для виключення вторинних причин у всіх випадках біопсійно підтвердженої МН (не оцінюється).
7.2. Відбір дорослих пацієнтів з ІМН для лікування імуносупресивними препаратами (див. рек. 7.8 для дітей).
7.2.1. Ми рекомендуємо розпочинати стартову терапію тільки пацієнтам із нефротичним синдромом та за наявності щонайменше однієї з ознак:
— протеїнурія перевищує 4 г/день та залишається понад 50 % від початкового рівня і суттєво не знижується при проведенні антигіпертензивної і антипротеїнуричної терапії (див. розд. 1) протягом щонайменше 6-місячного періоду спостереження (1B);
— прояви тяжкі, інвалідизуючі або життєво небезпечні і пов’язані з наявним нефротичним синдромом (1C);
— концентрація креатиніну в сироватці підвищилася на 30 % або більше протягом 6–12 місяців із моменту встановлення діагнозу, але рШКФ не менша за 25–30 мл/хв/1,73 м2 та ці зміни не можна пояснити розвитком ускладнень (2C).
7.2.2. Не використовуйте імуносупресивну терапію у пацієнтів із рівнем креатиніну сироватки, що перевищує 309 мкмоль/л (або рШКФ < 30 мл/хв/1,73 м2) та зменшенням довжини нирки за даними УЗД < 8 см або тим, хто має супутні важкі чи потенціально небезпечні для життя інфекції (не оцінюється).
7.3. Початкова терапія ІМН.
7.3.1. Ми рекомендуємо для початкової терапії 6-місячний курс альтернуючих місячних циклів кортикостероїдів (р.о. і в/в) та алкілуючих препаратів per os (див. табл. 15) (1В).

7.3.2. Ми пропонуємо для початкової терапії використовувати циклофосфамід замість хлорамбуцилу (2B).
7.3.3. Ми рекомендуємо пацієнтам залишатися на консервативному веденні принаймні протягом 6 місяців після завершення цього режиму, перш ніж робити висновок про недосягнення ремісії, якщо немає зниження функції нирок або не виникають тяжкі інвалідизуючі або потенціально життєво небезпечні симптоми, зумовлені нефротичним синдромом (див. також рекомендацію 7.2.1) (1С).
7.3.4. Виконуйте повторну біопсію нирки тільки у випадку швидкої втрати функції нирок у пацієнта (подвоєння концентрації креатиніну сироватки протягом 1–2 місяців спостереження) за відсутності масивної протеїнурії (> 15 г/день) (не оцінюється).
7.3.5. Корегуйте дозу циклофосфаміду або хлорамбуцилу згідно з віком хворого і рШКФ (не оцінюється).
7.3.6. Ми вважаємо, що щоденний прийом (нециклічний) алкілуючих медикаментів також може бути ефективним, але асоціюється з більшим ризиком токсичності, особливо при застосуванні понад 6 місяців (2С).
7.4. Альтернативні режими початкової терапії: терапія ІКН.
7.4.1. Ми рекомендуємо застосування циклоспорину або такролімусу протягом щонайменше 6 місяців у пацієнтів, що відповідають критеріям призначення терапії (як представлено в рекомендації 7.2.1), але які вирішили не приймати кортикостероїди/алкілуючі медикаменти або мають протипоказання для такого режиму лікування (1С).
7.4.2. Ми пропонуємо відміняти ІКН у пацієнтів при недосягненні повної або часткової ремісії після 6 місяців такого лікування (2С).
7.4.3. Ми пропонуємо знизити дозу ІКН в інтервалі 4–8 тижнів на 50 % від стартової, передбачаючи, що ремісія збережеться та не виникатимуть нефротоксичні обмежуючі лікування ефекти ІКН, та продовжувати лікування щонайменше до 12 місяців (2С).
7.4.4. Ми пропонуємо регулярний моніторинг рівня ІКН крові протягом початкового лікування та у випадках немотивованого підвищення креатинінемії (понад 20 %) під час терапії (не оцінюється)
7.5. Не рекомендується або підлягає обговоренню при виборі початкової терапії ІМН.
7.5.1. Ми рекомендуємо не використовувати монотерапію кортикостероїдами для початкової терапії ІМН (1B).
7.5.2. Ми пропонуємо не використовувати монотерапію ММФ для початкової терапії ІМН (2C).
7.6. Лікування ІМН, резистентної до рекомендованої початкової терапії.
7.6.1. Ми пропонуємо пацієнтам с ІМН, резистентною до початкової терапії кортикостероїдами/алкілуючими препаратами, лікуватись ІКН (2С).
7.6.2. Ми пропонуємо пацієнтам з ІМН, резистентною до початкової терапії ІКН, лікуватись кортикостероїдами/алкілуючими препаратами (2С).
7.7. Лікування рецидивів нефротичного синдрому у дорослих з ІМН.
7.7.1. Ми пропонуємо лікування рецидивів нефротичного синдрому при ІМН у тому ж режимі, що сприяв початковому досягненню ремісії (2D).
7.7.2. Ми пропонуємо в разі використання 6-місячного циклічного курсу кортикостероїду/алкілуючого медикаменту як початкову терапію (див. рекомендацію 7.3.1) його повторне застосування тільки одноразово для лікування рецидиву (2В).
7.8. Лікування ІМН у дітей.
7.8.1. Ми пропонуємо керуватися в лікуванні дітей з ІМН рекомендаціями терапії ІМН у дорослих (2C) (див. рекомендації 7.2.1 і 7.3.1).
7.8.2. Ми пропонуємо не використовувати більше одного курсу циклічного режиму призначення кортикостероїду/алкілуючого агента дітям (2D).
7.9. Профілактика антикоагулянтами при ІМН.
7.9.1. Ми пропонуємо пацієнтам з нефротичним синдромом та ІМН, значним зниженням альбумінемії (< 25 г/л) та додатковим ризиком тромбозу розглянути доцільність профілактичної антикоагулянтної терапії з призначенням варфарину per os (2C).
Розділ 8. Ідіопатичний мембранопроліферативний гломерулонефрит
8.1. Аналіз МПГН.
8.1.1. Аналізуйте пацієнтів із гістологічним (світломікроскопічним) субстратом МПГН на предмет уточнення основи захворювання до призначення специфічного лікування (табл. 20) (не оцінюється).

8.2. Лікування ідіопатичного МПГН.
8.2.1. Ми пропонуємо дорослим і дітям з ідіопатичним МПГН і нефротичним синдромом та прогресуючим зниженням функції нирок оральний прийом циклофосфаміду або ММФ у поєднанні з низькою альтернуючою або щоденною дозою кортикостероїдів (початково — до 6 місяців) (2D).
Розділ 9. Інфекційнозалежний гломерулонефрит
9.1. Для наступних інфекційнозалежних типів ГН ми пропонуємо відповідне лікування інфекцій і стандартні підходи до лікування ураження нирок (2D):
— постстрептококовий ГН;
— ГН, пов’язаний з інфекційним ендокардитом;
— шунт-нефрит.
9.2. ГН, пов’язаний із вірусом гепатиту С (HCV).
(Будь ласка, зверніться до чинних рекомендацій KDIGO з профілактики, діагностики, ведення та лікування гепатиту С при хронічній хворобі нирок.)
9.2.1. Для HCV-інфікованих пацієнтів з ХХН 1–2-ї стадій і ГН ми пропонуємо комбіновану антивірусну терапію пегільованим інтерфероном і рибавірином як прийнято загалом (2C) [на підставі KDIGO HCV рекомендації 2.2.1].
9.2.1.1. Титруйте дозу рибавірину, орієнтуючись на його переносимість пацієнтом та функціональний стан нирок (не оцінюється).
9.2.2. Для HCV-інфікованих пацієнтів із ХХН 3–5-ї стадій і ГН, які не отримують діаліз, ми пропонуємо монотерапію пегільованим інтерфероном з індивідуальним підбором дози відповідно до рівня функції нирок (2D) [спираючись на KDIGO HCV рекомендацію 2.2.2].
9.2.3. Для пацієнтів з HCV і змішаною кріоглобулінемією (IgG/IgM) з нефротичною протеїнурією або наявним прогресуванням хвороби нирок або гострим епізодом кріоглобулінемії ми пропонуємо плазмаферез, ритуксимаб чи циклофосфамід у поєднанні з в/в введенням метилпреднізолону та супутньою антивірусною терапією (2D).
9.3. ГН, пов’язаний із вірусом гепатиту В (HBV).
9.3.1. Ми рекомендуємо пацієнтам із HBV-інфекцією і ГН лікування інтерфероном a в поєднанні з нуклеозидними аналогами, як для загальної популяції, згідно зі стандартом клінічної практики для HBV-інфекції (1C).
9.3.2. Ми рекомендуємо дозування антивірусних агентів відповідно до функціонального стану нирок (1C).
9.4. Гломерулярні порушення, пов’язані з вірусом імунодефіциту людини (ВІЛ).
9.4.1. Ми рекомендуємо розпочинати антиретровірусну терапію всім пацієнтам із підтвердженою методом біопсії ВІЛ-асоційованою нефропатією незалежно від кількості CD4 (1B).
9.5. Нефропатії на тлі шистосомозу, філяріатозу і малярії.
9.5.1. Ми пропонуємо пацієнтам з ГН і супутньою малярією, шистосомозом і філяріатозом лікування відповідними антипаразитарними засобами в достатній дозі і необхідної тривалості лікування для ерадикації паразитів з організму (не оцінюється).
9.5.2. Ми пропонуємо не використовувати кортикостероїди й імуносупресанти для лікування шистосомоз-асоційованого ГН, оскільки встановлено, що ГН є безпосереднім результатом інфікування та віддзеркалює імунну відповідь організму (2D).
9.5.3. Ми пропонуємо дослідження культури крові на сальмонелу у всіх пацієнтів з підозрою на гепатолієнальний шистосомоз, у яких виявлено аномалії сечової системи і/або зниження ШКФ (2C).
9.5.3.1. Ми пропонуємо всім пацієнтам із позитивним результатом культури крові на Salmonella отримувати антисальмонельозну терапію (2C).
Розділ 10. Імуноглобулін-А-нефропатія (IgAH)
10.1. Початковий аналіз включає встановлення ризику прогресування хвороби нирок.
10.1.1. Оцініть всіх пацієнтів із підтвердженою біопсією IgAH на наявність вторинних причин IgAH (не оцінюється).
10.1.2. У всіх випадках IgAH оцінюйте ризик прогресування шляхом оцінки ступеня протеїнурії, артеріального тиску і рШКФ на момент встановлення діагнозу та при подальшому спостереженні (не оцінюється).
10.1.3. Патоморфологічні характеристики можуть бути використані для оцінки прогнозу (не оцінюється).
10.2. Антипротеїнурична та антигіпертензивна терапія.
10.2.1. Ми рекомендуємо тривале призначення ІАПФ або БРА за наявності протеїнурії > 1 г/день з титруванням відповідно до рівня артеріального тиску (1B).
10.2.2. Ми пропонуємо призначення ІАПФ або БРА за наявності протеїнурії в межах 0,5–1 г/день (у дітей 0,5–1 г/день/1,73 м2) (2D).
10.2.3. Ми пропонуємо титрувати ІАПФ або БРА з підвищенням їх дози до досягнення рівня протеїнурії < 1 г/день (2C).
10.2.4. При IgAH використовуйте значення цільового артеріального тиску < 130/80 мм рт.ст. у пацієнтів із протеїнурією < 1 г/день і < 125/75 мм рт.ст. при початковій протеїнурії > 1 г/день (не оцінюється).
10.3. Кортикостероїди.
10.3.1. Ми пропонуємо пацієнтам із персистуючою протеїнурією і 1 г/день, незважаючи на 3–6-місячний курс оптимізованої підтримуючої терапії (що включає ІАПФ або БРА і контроль артеріального тиску) і ШКФ > 50 мл/хв/1,73 м2 пройти 6-місячний курс кортикостероїдної терапії (2С).
10.4. Імуносупресивні медикаменти (циклофосфамід, азатіоприн, ММФ, циклоспорин).
10.4.1. Ми пропонуємо не лікувати з поєднанням кортикостероїдів і циклофосфаміду або азатіоприну пацієнтів із IgAH (якщо не наявні півмісяці IgAH зі швидкою втратою функції нирок, див. рекомендацію 10.6.3) (2D).
10.4.2. Ми пропонуємо не використовувати імуносупресивну терапію у пацієнтів із ШКФ < 30 мл/хв/1,73 м2 у разі відсутності півмісяців IgAH зі швидкою втратою функції нирок (див. підрозділ 10.6) (2С).
10.4.3. Ми пропонуємо не використовувати ММФ при IgAH (2C).
10.5. Інші методи лікування.
10.5.1. Лікування риб’ячим жиром.
10.5.1.1. Ми пропонуємо використовувати риб’ячий жир у лікуванні IgAH у пацієнтів з персистуючою протеїнурією > 1 г/день, незважаючи на 3–6-місячну оптимізовану підтримуючу терапію (що включає ІАПФ або БРА та контроль артеріального тиску) (2D).
10.5.2. Антитромбоцитарні препарати.
10.5.2.1. Ми пропонуємо не використовувати антитромбоцитарні препарати для лікування IgAH (2C).
10.5.3. Тонзилектомія.
10.5.3.1. Ми пропонуємо не проводити тонзилектомію при IgAH (2C).
10.6. Атипові форми IgAH.
10.6.1. ХМЗ із мезангіальними IgA-депозитами.
10.6.1.1. Ми рекомендуємо лікування, аналогічне ХМЗ (розд. 5), пацієнтам із нефротичним синдромом, у яких встановлені патоморфологічні ознаки ХМЗ із мезангіальними IgA-депозитами за результатами біопсії нирки (2B).
10.6.2. ГУН асоційоване з макроскопічною гематурією.
10.6.2.1. Проведіть повторну біопсію нирки пацієнтам з IgAH і ГУН, що супроводжується макрогематурією у випадку, якщо через 5 днів після початку розвитку зниження функції нирок не спостерігається жодного покращення (не оцінюється).
10.6.2.2. Ми пропонуємо загальний об’єм допомоги для ГУН при IgAH у разі наявності тільки гострого тубулярного некрозу і внутрішньоканальцевих еритроцитарних циліндрів за результатами біопсії нирки, проведеної під час епізоду макрогематурії (2C).
10.6.3. IgAH із півмісяцями.
10.6.3.1. Визначайте IgAH з півмісяцями за наявності понад 50 % півмісяців гломерул за результатами біопсії нирки і у разі швидкопрогресуючої втрати функції нирок (не оцінюється).
10.6.3.2. Ми пропонуємо застосування кортикостероїдів і циклофосфаміду у пацієнтів з IgAH і швидкопрогресуючою IgAH із півмісяцями аналогічно лікуванню ANCA васкулітів (розд. 13) (2D).
Розділ 11. Нефрит на тлі пурпури Геноха — Шенляйна
11.1. Лікування ГШП-нефриту у дітей.
11.1.1. Ми пропонуємо дітям із ГШП-нефритом і персистуючою протеїнурією > 0,5–1,0 г/л/м2 лікування ІАПФ або БРА (2D).
11.1.2. Ми пропонуємо дітям із персистуючою протеїнурією понад 1 г/л/1,73 м2 після спроби лікування ІАПФ або БРА за умов ШКФ > 50 мл/хв/1,73 м2 6-місячне лікування кортикостероїдами, аналогічне IgA-нефропатії (див. розділ 10) (2D).
11.2. Лікування ГШП-нефриту з півмісяцями у дітей.
11.2.1. Ми пропонуємо дітям із ГШП-нефритом з півмісяцями і нефротичним синдромом і/або погіршенням функції нирок лікування, як при IgA нефропатії з півмісяцями (див. рекомендацію 10.6.3) (2D).
11.3. Профілактика ГШП-нефриту у дітей.
11.3.1. Ми рекомендуємо не використовувати кортикостероїди для профілактики ГШП-нефриту (1B).
11.4. ГШП-нефрит у дорослих.
11.4.1. Ми пропонуємо лікування ГШП нефриту у дорослих таким самим чином, як і у дітей (2D).
Розділ 12. Люпус-нефрит
12.1. Клас I ЛН (мінімальні зміни — мезангіальний ЛН).
12.1.1. Ми пропонуємо пацієнтам із класом 1 ЛН терапію згідно з лікуванням екстраренальних клінічних форм вовчака (2D).
12.2. Клас II ЛН (мезангіально-проліферативний ЛН).
12.2.1. Лікуйте пацієнтів з класом II ЛН і протеїнурією < 1 г/день відповідно до екстраренальних клінічних проявів вовчака (2D).
12.2.2. Ми пропонуємо при класі II ЛН із протеїнурією > 3 г/день лікування кортикостероїдами або ІКН, як описано для ХМЗ (див. розділ 5) (2D).
12.3. Клас III ЛН (фокальний ЛН) і клас IV ЛН (дифузний ЛН)— початкова терапія.
12.3.1. Ми рекомендуємо початкову терапію кортикостероїдами (1А) у поєднанні з циклофосфамідом (1В) або ММФ (1В).
12.3.2. Ми пропонуємо у разі прогресування ЛН (підвищення вмісту креатиніну плазми, зростання протеїнурії) протягом перших 3 місяців лікування робити зміни в бік альтернативної рекомендованої початкової терапії або повторити біопсію нирки для визначення подальшого лікування (2D).
12.4. Клас III ЛН (фокальний ЛН) і клас IV ЛН (дифузний ЛН) — підтримуюча терапія.
12.4.1. Ми рекомендуємо після завершення початкової терапії пацієнтам із III і IV ЛН отримувати підтримуючу терапію азатіоприном (1,5–2,5 мг/кг/день) або ММФ (1–2 г/день у розділених дозах) та низьку дозу кортикостероїдів (Ј 10 мг еквівалентну преднізолону) (1B).
12.4.2. Ми пропонуємо ІКН разом із низькими дозами кортикостероїдів для призначення підтримуючої терапії пацієнтам із непереносимістю ММФ і азатіоприну (2C).
12.4.3. Ми пропонуємо після досягнення повної ремісії продовження підтримуючої терапії щонайменше протягом 1 року до прийняття рішення щодо обмеження імуносупресії (2D).
12.4.4. У разі недосягнення повної ремісії після 12-місячної підтримуючої терапії обміркуйте потребу повторної біопсії нирки для визначення корекції терапії (не оцінюється).
12.4.5. У разі зниження функції нирок і/або збільшення протеїнурії під час обмеження підтримуючої терапії ми пропонуємо відновлення лікування на попередньому рівні ефективних доз імунодепресантів, що контролювали перебіг ЛН (2D).
12.5. Клас V ЛН (мембранозний ЛН).
12.5.1. Ми рекомендуємо пацієнтам із класом V ЛН, нормальною функцією нирок і ненефротичною протеїнурією лікування антипротеїнуричними і антигіпертензивними препаратами, прийом кортикостероїдів та імуносупресантів залежно від екстраренальних проявів системного вовчака (2D).
12.5.2. Ми пропонуємо пацієнтам із чистим класом V ЛН і персистуючою протеїнурією нефротичного рівня лікування кортикостероїдами в поєднанні з імуносупресивним агентом: циклофосфамідом (2С), або ІКН (2С), або ММФ (2D), або азатіоприном (2D).
12.6. Загальні принципи лікування ЛН.
12.6.1. Ми пропонуємо всім пацієнтам із ЛН незалежно від морфологічного класу лікування гідроксихлороквіном (максимальна добова доза 6–6,5 мг/кг ідеальної маси тіла) у разі відсутності специфічних протипоказань до цього препарату (2C).
12.7. Клас VI ЛН (прогресуючий склерозуючий ЛН).
12.7.1. Ми рекомендуємо пацієнтам із класом VI ЛН лікування кортикостероїдами та імуносупресантами відповідно до показань у разі екстраренальних проявів системного вовчака (2D).
12.8. Рецидив ЛН.
12.8.1. Ми пропонуємо при рецидиві ЛН після повної або часткової ремісії лікування за початковою методикою з наступним підтримуючим лікуванням, що вже було ефективним в досягненні отриманої ремісії (2B).
12.8.1.1. Якщо попередня терапія призвела до ризиків, пов’язаних із надмірною дією циклофосфаміду, ми пропонуємо початкове повторне лікування без циклофосфаміду (режим D, табл. 28) (2B).
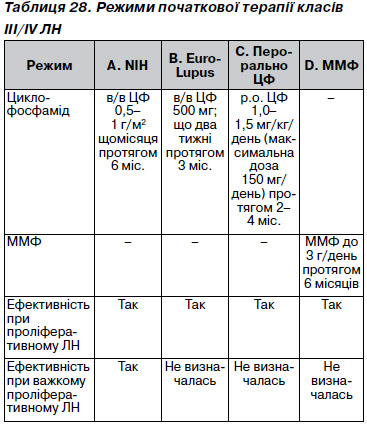
12.8.2. Розгляньте необхідність повторної біопсії нирки у разі рецидиву, якщо передбачаєте зміну гістологічного класу ЛН або в разі немотивованого зростання вмісту креатиніну в сироватці і/або збільшенні протеїнурії, які свідчать про активність чи хронізацію хвороби (не оцінюється).
12.9. Лікування резистентної хвороби.
12.9.1. У пацієнтів із збільшенням концентрації креатиніну в сироватці і/або протеїнурією після застосування одного з початкових лікувальних режимів поміркуйте про проведення повторної біопсії нирки для диференціації активності перебігу ЛН від склерозування (не оцінюється).
12.9.2. Лікуйте пацієнтів зі зростанням умісту креатиніну плазми і/або протеїнурією, із стабілізацію активності ЛН за даними біопсії згідно з одним із початкових режимів терапії (див. розділ 12.3) (не оцінюється).
12.9.3. Ми пропонуємо для пацієнтів, що не відповідають на більше ніж один з рекомендованих початкових режимів лікування (розд. 12.3) розглянути доцільність лікування ритуксимабом, в/в імуноглобуліном або ІКН (2D).
12.10. Системний вовчак і тромботична мікроангіопатія.
12.10.1. Ми пропонуємо при антифосфоліпідному антитільному синдромі, який уражає нирки у пацієнтів з системним вовчаком, з ЛН або без нього, лікування антикоагулянтами (цільове міжнародне нормалізоване співвідношення (МНС) 2–3 (2D).
12.10.2. Ми пропонуємо пацієнтам із системним вовчаком і тромоботичною тромобоцитопенічною пурпурою (ТТП) проводити плазмозаміщення, як і пацієнтам з ТТП без системного вовчака (2D).
12.11. Системний вовчак і вагітність.
12.11.1. Ми пропонуємо жінкам рекомендувати перенести вагітність до досягнення повної ремісії ЛН (2D).
12.11.2. Ми рекомендуємо не використовувати циклофосфамід, ММФ, ІАПФ і БРА під час вагітності (1A).
12.11.3. Ми пропонуємо продовжувати лікування гідроксихлороквіном під час вагітності (2B).
12.11.4. Ми рекомендуємо пацієнткам з ЛН, які завагітніли під час лікування ММФ, перейти на азатіоприн (1B).
12.11.5. Ми рекомендуємо пацієнткам з ЛН у разі розвитку рецидиву під час вагітності застосовувати лікування кортикостероїдами і, залежно від тяжкості рецидиву, азатіоприном (1B).
12.11.6. Якщо вагітні пацієнтки отримують кортикостероїди або азатіоприн, ми пропонуємо не зменшувати дози препаратів під час вагітності і щонайменше 3 місяці після пологів (2D).
12.11.7. Ми пропонуємо призначення низької дози аспірину під час вагітності для зменшення ризику втрати плода (2C).
12.12. ЛН у дітей.
12.12.1. Ми пропонуємо дітям із ЛН отримувати таку ж терапію, як і дорослим пацієнтам із ЛН, використовуючи дози відповідно віку та ШКФ (2D).
Розділ 13. Малоімунний фокальний і сегментарний некротизуючий гломерулонефрит (при гранулематозі Вегенера, мікроскопічному поліангіїті та синдромі Черга — Страусса)
13.1. Початкове лікування малоімунного фокального та сегментарного некротизуючого гломерулонефриту.
13.1.1. Ми рекомендуємо циклофосфамід і кортикостероїди для початкового лікування (1A).
13.1.2. Ми рекомендуємо ритуксимаб і кортикостероїди як альтернативне початкове лікування пацієнтам без тяжких проявів хвороби або за наявності протипоказань до циклофосфаміду (1B).
13.2. Окремі групи пацієнтів.
13.2.1. Ми рекомендуємо доповнення лікування плазмаферезом пацієнтів, які потребують діалізу або зі швидким приростом вмісту креатиніну в сироватці крові (1C).
13.2.2. Ми пропонуємо доповнення лікування плазмаферезом у пацієнтів із масивною легеневою кровотечею (2C).
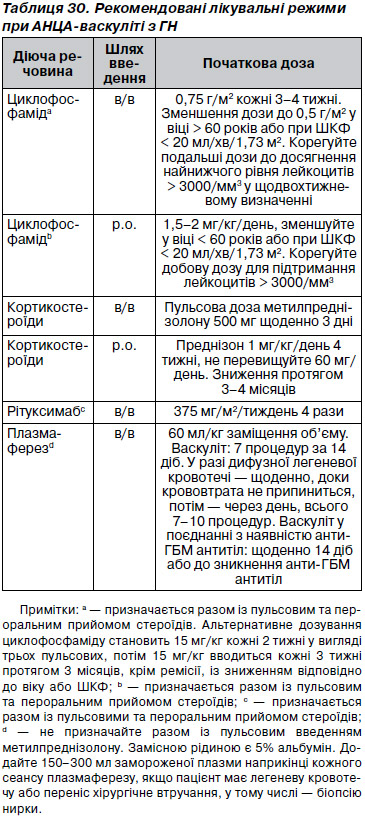
13.2.3. Ми пропонуємо доповнення лікування плазмаферезом пацієнтів із синдромом переповнення при АНЦА-васкуліті і анти-ГБМ ГН, згідно із запропонованими критеріями та режимами при анти-ГБМ ГН (див. розділ 14) (2D).
13.2.4. Ми пропонуємо відміняти циклофосфамід після трьох місяців у пацієнтів, які є стабільно діаліз-залежними, та тих, хто вже не має ніяких екстраренальних проявів хвороби (2C).
13.3. Підтримуюча терапія.
13.3.1. Ми рекомендуємо підтримуючу терапію пацієнтам, які досягли ремісії (1B).
13.3.2. Ми пропонуємо продовжувати підтримуючу терапію щонайменше 18 місяців для пацієнтів, які досягли повної ремісії (2D).
13.3.3. Ми рекомендуємо не проводити підтримуючу терапію пацієнтам, які є діаліз-залежними та не мають екстраренальних проявів хвороби (1C).
13.4. Вибір агенту для підтримуючої терапії.
13.4.1. Ми рекомендуємо азатіоприн 1–2 мг/кг/день перорально як підтримуючу терапію (1B).
13.4.2. Ми пропонуємо ММФ до 1 г двічі на день як підтримуючу терапію в пацієнтів з алергією або непереносимістю азатіоприну (2C).
13.4.3. Ми пропонуємо триметоприм-сульфаметаксозол як доповнення до підтримуючої терапії у пацієнтів із захворюваннями верхніх дихальних шляхів (2B).
13.4.4. Ми пропонуємо метотрексат (початково 0,3 мг/кг/тиждень, максимум 25 мг/тиждень) для підтримуючої терапії в пацієнтів із непереносимістю азатіоприну і ММФ, але якщо ШКФ не менша за 60 мл/хв/м2 (1C).
13.4.5. Ми рекомендуємо не використовувати етанерсепт як додаткову терапію (1A).
13.5. Лікування рецидиву.
13.5.1. Ми рекомендуємо лікування пацієнтів із тяжким рецидивом АНЦА-васкуліту (життє- або органорятівне) згідно з настановами проведення початкової терапії (див. розділ 13.1) (1C).
13.5.2. Ми пропонуємо лікування інших рецидивів АНЦА-васкуліту імуносупресивною терапією шляхом підвищення інтенсивності лікування медикаментами, відмінними від циклофосфаміду, включаючи застосування більших доз кортикостероїдів з азатіоприном, або без нього, або ММФ (2C).
13.6. Лікування резистентної хвороби.
13.6.1. При АНЦА-ГН, резистентному до індукційної терапії циклофосфамідом і кортикостероїдами, ми рекомендуємо доповнення лікування ритуксимабом (1C), з можливістю в/в введення імуноглобуліну (2С) або плазмаферез (2D) як альтернативи.
13.7. Моніторування.
13.7.1. Ми пропонуємо не змінювати імуносупресію, базуючись тільки на змінах титру АНЦА (2D).
13.8. Трансплантація.
13.8.1. Ми рекомендуємо відстрочення трансплантації, доки пацієнти не будуть мати позаниркову ремісію протягом 12 місяців (1C).
13.8.2. Ми рекомендуємо не відстрочувати трансплантацію для пацієнтів із повною ремісією, але все ще АНЦА-позитивних (1C).
Розділ 14. Лікування ГН, обумовленого наявністю антитіл до гломерулярної базальної мембрани (анти-ГБМ ГН).
14.1. Лікування анти-ГБМ ГН.
14.1.1. Ми рекомендуємо проведення початкової імуносупресії циклофасфамідом і кортикостероїдами в поєднанні з плазмаферезом (табл. 31) всім пацієнтам з анти-ГБМ ГН за винятком тих, які є діаліз-залежними на момент розвитку анти-ГБМ ГН, мають 100 % півмісяців за даними адекватно проведеної біопсії та без легеневої кровотечі (1B).
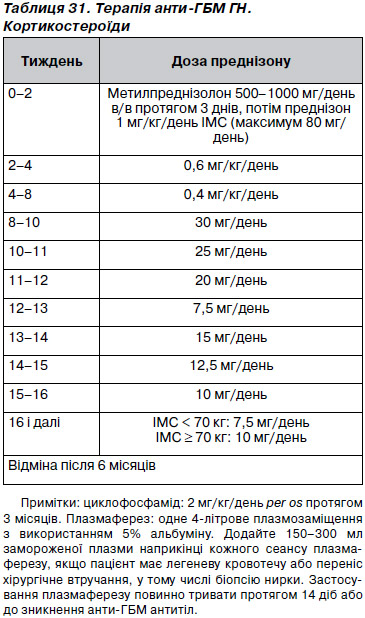
14.1.2. Невідкладно починайте терапію анти-ГБМ ГН, як тільки діагноз встановлено. У випадку високої ймовірності передбаченого діагнозу доречним є починати з високих доз кортикостероїдів і плазмаферезу, поки очікуєте на його підтвердження (не градуйовано).
14.1.3. Ми рекомендуємо не проводити підтримуючу імуносупресивну терапію для анти-ГБМ ГН (1D).
14.1.4. Відстрочуйте трансплантацію нирки після анти-ГБМ ГН, доки анти-ГБМ антитіла не виявлятимуться мінімум протягом 6 місяців (не оцінюється).
Переклад настанови здійснено
групою фахівців у складі:
Д.Д. Іванов, Л.А. Пиріг, М.Д. Іванова