Журнал «Медико-социальные проблемы семьи» 3-4 (том 17) 2012
Вернуться к номеру
Прогнозування та профілактика прееклампсії у вагітних з генетично обумовленими формами тромбофілії
Авторы: Чайка В.К., Носенко О.М., Бешир М. - Донецький національний медичний університет ім. М. Горького
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
У статті представлено результати науково-дослідної роботи щодо зниження частоти і тяжкості прееклампсії і кількості перинатальних ускладнень у вагітних клінічної групи ризику за прееклампсією. На підставі вивчення частот генотипів і алелей генів тромбофілії F5, F2, PAI1, FGB, GP3a і MTHFR у породіль з прееклампсією середнього та тяжкого ступеня з використанням технології гелевих біочипів розроблена бальна оцінка ризику її розвитку і заснована на цьому диференційована схема ранньої профілактики, впровадження якої призвело до зниження частоти і тяжкості прееклампсії і кількості перинатальних ускладнень у вагітних клінічної групи ризику з розвитку прееклампсії середнього та тяжкого ступеня.
В статье представлены результаты научно-исследовательской работы по снижению частоты и тяжести преэклампсии и количества перинатальных осложнений у беременных клинической группы риска по преэклампсии. На основании изучения частот генотипов и аллелей генов тромбофилии F5, F2, PAI1, FGB, GP3a и MTHFR у рожениц с преэклампсией средней и тяжелой степени с использованием технологии гелевых биочипов разработана балльная оценка риска ее развития и основанная на этом дифференцированная схема ранней профилактики, внедрение которой привело к снижению частоты и тяжести преэклампсии и количества перинатальных осложнений у беременных клинической группы риска по развитию преэклампсии средней и тяжелой степени.
The paper presents the results of research work on reducing the preeclampsia frequency and severity and number of perinatal complications in pregnant women with clinical risk for preeclampsia. On the basis of studying the frequency of genotypes and alleles of thrombophilia genes F5, F2, PAI1, FGB, GP3a, MTHFR study in parturient women with moderatte and severe preeclampsia using gel biochips there has been developed score of preeclampsia risk and differentiated scheme of early prevention based on it. Introduction of this scheme led to a decrease in frequency and severity of preeclampsia and in unmber of perinatal complications of pregnant women with clinical risk for moderatte and severe preeclampsia.
Прееклампсія, тромбофілія, генетичне тестування, гелеві біочипи, прогнозування, профілактика.
Преэклампсия, тромбофилия, генетическое тестирование, гелевые биочипы, прогнозирование, профилактика.
Preeclampsia, thrombophilia, genetic testing, gel biochips, prediction, prevention.
Прееклампсія (ПЕ) належить до найважливіших проблем сучасного акушерства й на сьогодні є однією з основних причин материнської та перинатальної захворюваності та смертності [7, 9].
Існує понад 30 аргументованих етіопатогенетичних суджень про виникнення ПЕ, проте, на жаль, жодне з них не пояснює однозначно і повною мірою різноманіття морфофункціональних змін та клінічних маніфестацій, які відбуваються при даному ускладненні вагітності [4, 12]. Серед етіопатогенетичних аспектів ПЕ є різні порушення в системі гемостазу крові з розвитком тромбофілічних станів. Наявність спадкових та/або набутих форм тромбофілії може бути також пов’язана з високим ризиком звичного невиношування, затримки росту плода (ЗРП), антенатальної загибелі плода, передчасного відшарування плаценти та іншими ускладненнями.
Незважаючи на те, що етіологія і патогенез тромбофілії вивчені досить докладно, питання прогнозування та профілактики можливих тромбофілічних ускладнень, у тому числі й ПЕ, залишається відкритим [5]. Це пов’язано з браком знань про роль певних форм тромбофілії, значення генетичних дефектів системи гемо-стазу у формуванні тих чи інших ускладнень. Крім того, проведення адекватної профілактики ускладнень спадкової тромбофілії дуже утруднено через великі відмінності у частоті окремих її форм у популяції, участь тих чи інших генетичних форм тромбофілії у формуванні певних акушерських ускладнень, вплив різних додаткових факторів на маніфестацію генетичних дефектів системи гемостазу, що призводять до тромбофілії.
Дані про роль генетичних змін, що призводять до підвищеного тромбоутворення і розвитку ПЕ, багато в чому визначаються приналежністю індивіда до тієї чи іншої популяції. Тому на даний момент особливо важливим при розробці методів прогнозування та профілактики тромбофілічних ускладнень уявляється проведення популяційних досліджень спадкової тромбофілії, пошук найбільш значущих генетичних маркерів патології системи гемостазу в кожній окремій популяції. Слід також ураховувати, що розвиток, характер перебігу та ускладнень тромбофілії можуть залежати від дефектів різних компонентів системи гемостазу, зовнішніх факторів, варіювати за ступенем вираженості у гетеро- або гомозиготних носіїв мутації, залежати від взаємодії та особливостей поєднання (комбінування) цих порушень [1–3, 5, 8, 11].
Наявність двох і більше мутацій збільшує ризик тромбофілічних ускладнень вагітності в кілька разів порівняно з носіями ізольованих мутацій. Сьогодні найбільш перспективним методом вивчення полігенних захворювань є підхід, заснований на технології біочипів, що обумовлено такими їх перевагами, як мультиплексність, швидкість, ефективність, мініатюрність, висока специфічність, простота виконання і можливість застосування для широкомасштабних популяційних досліджень. У зв’язку з цим використання «Фібр-біочипа» для виявлення генетично обумовлених форм тромбофілії у жінок із ризиком розвитку ПЕ може виявитися перспективним [10].
Своєчасне виявлення генетичних факторів ризику розвитку ПЕ з подальшою диференційованою патогенетично обґрунтованою ранньою профілактикою може дозволити знизити ризик виникнення та тяжкості ПЕ і супутніх їй перинатальних ускладнень.
Мета дослідження: знизити частоту виникнення й тяжкість прееклампсії та кількість перинатальних ускладнень у вагітних клінічної групи ризику з розвитку прееклампсії середнього та тяжкого ступеня шляхом розробки та впровадження тестування на генетично обумовлені тромбофілії і заснованої на ньому диференційованої схеми ранньої профілактики.
Матеріал та методи
Під спостереженням перебувало 426 жінок. Групу П становили 38 породіль ПЕ середнього та тяжкого ступеня. Групу К1 становили 46 породіль без проявів ПЕ та артеріальної гіпертензії.
До групи Р увійшли 312 вагітних клінічної групи ризику з розвитку ПЕ середнього та тяжкого ступеня. Критерієм виключення став цукровий діабет. Вагітні групи Р були стратифіковані в 2 групи: основна група О — 157 вагітних, які отримували диференційований комплекс профілактики залежно від наявності генетично обумовлених тромбофілій: група порівняння С — 155 вагітних, які отримували традиційний комплекс терапії. У групах О і С були виділені групи: О1 (n = 33) і С1 (n = 33) з наявністю помірного і високого ризику з розвитку ПЕ середнього та тяжкого ступеня, асоційованої з генетично успадкованими тромбофіліями; О2 (n = 124) і С2 (n = 122) з наявністю низького ризику розвитку ПЕ середнього та тяжкого ступеня. Контрольну групу К2 становили 30 умовно здорових вагітних з майбутніми повторними пологами без наявності вищезазначених факторів ризику розвитку ПЕ.
У всіх обстежених хворих вивчали соціальний статус, дані гінекологічного, акушерського, соматичного анамнезу, результати клініко-лабораторного обстеження. З метою виявлення екстрагенітальної патології всі жінки були консультовані терапевтом, ендокринологом, невропатологом.
Для оцінки антропометричних даних обстежених хворих визначали індекс маси тіла (ІМТ). Рівень артеріального тиску оцінювали за стандартною методикою, середній артеріальний тиск — за формулою I.S. Ekaidem (2011): середній артеріальний тиск = діастолічний тиск + 1/3 х (систолічний тиск — діастолічний тиск).
Для оцінки стану системи гемостазу застосовували методи і тести, що характеризують основні ланки системи гемостазу:
— судинно-тромбоцитарну: згортання крові за Сухаревим; загальна кількість тромбоцитів на автоматичному аналізаторі, спонтанна агрегація тромбоцитів та індекс адгезивності тромбоцитів за допомогою набору «Агрескрін-тест»;
— коагуляційну: міжнародне нормалізоване відношення (МНВ); протромбіновий час; фібриноген за Рутбергом; активований частковий тромбопластиновий час (АЧТЧ) шляхом реєстрації часу згортання плазми за наявності цефаліну та поверхневого активатора; вміст тромбомодуліну і фактора Віллебранда імуноферментним методом Elisa фірми Asserachrom® vWF: Ag, STAGO (Франція); рівень фібронектину методом нефелометрії з реактивами Daele Behring (Німеччина); концентрацію розчинних фібрин-мономірних комплексів (РФМК) і D-димера — імуноферментним методом Elisa з реактивами фірми Technozym (Австрія);
— антикоагуляційну і фібринолітичну: активність антитромбіну III, рівень протеїну С, протеїну S — на автоматичному коагулометрі ACL-200 (США) з використанням реагентів фірми Instrumentation Laboratory (ACL-200 Operator’s Manual); рівень продуктів деградації фібриногену/фібрину (ПДФ) імуноферментним методом Elisa за допомогою реактивів фірми Technozym (Австрія); час Хагеман-залежного фібринолізу за А.Г. Архиповим і Г.Ф. Єрьоміним, 1985); вміст гомоцистеїну в плазмі (з ЕДТА) методом рідинної хроматографії з флюорометричним детектуванням (Shimadzu RF-535) при 385 нм (збудження) і 515 нм (випускання); концентрації кальцію, магнію і калію в сироватці крові комплексометричним методом на біохімічному аналізаторі електролітів фірми Screen Master Plus (Швейцарія) з використанням стандартного набору реактивів Вio-la-test фірми Lachema (Чеська Республіка).
Генетичне дослідження проводили молекулярно-генетичними методами, у тому числі зразків ДНК за допомогою «Фібр-біочипа», що включало такі етапи: виділення ДНК із лімфоцитів периферичної крові фенольним методом, проведення двох раундів мультиплексної ПЛР, гібридизацію міченого продукту на мікрочипі та інтерпретація результатів гібридизації. Флуоресцентний сигнал від осередків мікрочіпа реєстрували за допомогою широкопольного люмінесцентного мікроскопа, з камерою ПЗЗ і програмним забезпеченням Imageware («Биочип-ИМБ», Росія).
Для морфологічного вивчення посліди від обстежених породіль зважували, вимірювали товщину плаценти. Зразки послідів поміщали в нейтральний забуферений 10% розчин формаліну (pH 7,4) і фіксували протягом 24 годин. Після дегідратації шматочки заливали в парафін за стандартною методикою. На ротаційному мікротомі Microm HM325 з системою переносу зрізів STS (Carl Zeiss, Німеччина) виготовляли серійні гістологічні зрізи товщиною 4 мкм, що потім забарвлювали гематоксиліном та еозином за стандартною методикою. Мікроскопію препаратів проводили на мікроскопі Olympus AX70 Provis (Olympus, Японія) за допомогою програми аналізу зображення Analysis 3.2 Pro (Soft Imaging, Німеччина).
Отримані дані були оброблені за допомогою IBM PC із використанням електронної таблиці Excel і методів аналітичної та варіаційної статистики.
Результати дослідження та їх обговорення
На першому етапі обстежено 38 породіль основної групи П з ПЕ середнього та тяжкого ступеня, які надійшли на розродження в Донецький регіональний центр з охорони материнства і дитинства та ЦМЛ № 6 м. Донецька, і 46 породіль контрольної групи К1 без проявів ПЕ та артеріальної гіпертензії. Їм усім проведено клініко-лабораторне дослідження, включаючи поглиблене вивчення стану показників системи гемо-стазу. Визначено основні клініко-анамнестичні фактори ризику розвитку ПЕ середнього та тяжкого ступеня. У всіх породіль проведений забір периферичної крові для генетичного дослідження. Виконано гістологічне дослідження послідів.
Вік породіль групи П у середньому становив 25,16 ± ± 0,86 року, а в групі К1 — 26,83 ± 0,56 року (p > 0,05). Середня маса тіла породіль групи П до настання вагітності перевищувала таку в групі К1 в 1,12 раза (р < 0,01), а ІМТ — в 1,14 раза (р < 0,01). Породіллі групи П до настання вагітності мали надмірну масу тіла в 2,12 раза частіше (55,26 %), ніж у групі К1 (26,09 %, р < 0,01; ВШ 3,50; ДІ 95 % —1,40–8,76); ожиріння — у 6,06 раза (13,16 % проти 2,17 %, р < 0,03; ВШ 8,44; ДІ 95% — 0,97–73,53).
Середній вік менархе у породіль групи П становив 12,00 ± 0,16 року, у контрольній групі — 12,67 ± 0,21 року (р < 0,02); при цьому кількість жінок із віком менархе до 12 років — відповідно 28,95 і 8,70 % (р < 0,02; ВШ 4,28; ДІ 95% — 1,24–14,82).
Кількість першопороділь у групі П перевищувала таку в групі К1 в 1,29 раза (p < 0,05) (84,21 % проти 65,22 %, ВШ 2,84; ДІ 95% — 0,98–8,23).
ПЕ середнього та тяжкого ступеня при попередній вагітності мали 10,53 % жінок групи П, тоді як у групі К1 таких випадків не спостерігалося (р < 0,03). У породіль із ПЕ середнього та тяжкого ступеня попередні вагітності частіше, ніж у контрольній групі, закінчувалися мимовільним перериванням вагітності в 7,86 раза (34,21 проти 4,35 %, p < 0,01; ВШ 11,44; ДІ 95% — 2,39–54,85) і середня кількість мимовільних абортів перевищувала таку в групі П в 10,50 раза (p < 0,01). У 5,56 % породіль групи ПЕ в анамнезі були вагітності з антенатальною загибеллю плода, у 2,56 % — з інтранатальною.
Виявлено, що у жінок із ПЕ середнього та тяжкого ступеня в анамнезі в 4,23 раза частіше зустрічалися гінекологічні захворювання (50,00 проти 32,61 %, p < 0,04; ВШ 2,07; ДІ 95% — 0,95–5,01); у 4,23 раза — полікістозні яєчники (18,42 проти 4,35 %, p < 0,04; ВШ 4,97; ДІ 95% — 0,97–25,54) і в 5,44 раза — лейоміома матки (23,68 проти 4,35 %, p < 0,01; ВШ 6,83; ДІ 95% — 1,38–33,90).
При аналізі екстрагенітальної захворюваності встановлено, що у жінок групи П в 8,49 раза частіше реєструвалася гіпертонічна хвороба (18,42 проти 2,17 %, p < 0,02; ВШ 10,16; ДІ 95% — 1,19–86,77); в 3,03 — нейроциркуляторна дистонія (26,32 проти 8,70 %, p < 0,04; ВШ 3,75; ДІ 95% — 1,07–13,14); в 3,23 — хронічний холецистопанкреатит (21,05 проти 6,52 %, p < 0,05; ВШ 3,82; ДІ 95% — 0,94–15,60); в 4,84 — хронічний пієлонефрит (31,58 проти 6,52 %, p < 0,01; ВШ 6,62; ДІ 95 % — 1,71–25,66); в 3,23 — сечокам’яна хвороба (21,05 проти 6,52 %, p < 0,05; ВШ 3,82; ДІ 95% — 0,94–15,60); в 4,97 — гіпотиреоз (18,42 проти 4,35 %, p < 0,04; ВШ 4,97; ДІ 95% — 0,97–25,54); в 3,64 раза— цукровий діабет (7,89 проти 2,17 %, p < 0,04; ВШ 3,86; ДІ 95% — 0,97–25,54). Тромбозів в анамнезі породіль обох груп не було.
Середній гестаційний вік на момент пологів у групі П був меншим порівняно з контрольною групою (32,81 ± 0,51 проти 38,98 ± 0,16 тижня) на 6,17 тижня (p < 0,01). Під час вагітності у породіль з ПЕ в 2,16 раза (p < 0,01) частіше реєструвалася респіраторно-вірусна інфекція, в 8,94 — пієлонефрит (p < 0,01), в 1,88 раза — анемія (p < 0,01).
У групі П 58,33 % породіль були з ПЕ середнього, 41,67 % — тяжкого ступеня. Тривалість ПЕ становила в середньому 3,44 ± 0,17 тижня. У групі П на головний біль скаржилися 13,89 % жінок, на порушення зору — 11,11 %, на відчуття важкості або болі в епігастрії — 33,33 %. Набряки різного ступеня вираженості мали 94,44 % породіль із ПЕ і 17,39 % породіль контрольної групи. 36,11 % породіль з ПЕ мали генералізовані набряки (p < 0,01). Набряки гомілок у групі П зустрічалися в 8,30 раза частіше (p < 0,01), кистей рук — у 7,41 (p < 0, 01). Кожна третя жінка з ПЕ мала набряки нижніх кінцівок на всьому протязі (p < 0,01), кожна третя — лиця (p < 0,01), кожна друга — передньої черевної стінки (p < 0,01), у контрольній групі такі набряки не зустрічалися.
Максимальний систолічний артеріальний тиск на момент пологів у групі П варіював від 150 до 190 мм рт.ст., у середньому становив 165,28 ± 1,91 мм рт.ст. і перевищував такий у контрольній групі (107,22 ± ± 1,29,87 мм рт.ст.) в 1,54 раза (p < 0,01), діастолічний — в 1,54 раза (112,93 ± 1,15 мм рт.ст. проти 73,48 ± ± 0,89 мм рт.ст., p < 0,01).
Білок у сечі був зареєстрований у всіх породіль із ПЕ і у 6,52 % жінок контрольної групи. Рівень протеїнурії у породіль групи П коливався від 0,04 до 11,00 г/л і в середньому становив 3,00 ± 0,54 г/л, у жінок конт-рольної групи — від 0,03 до 0,52 г/л і в середньому 0,02 ± 0,01 г/л (p < 0,01).
Кількість тромбоцитів у периферичній крові у жінок з ПЕ середнього та тяжкого ступеня в середньому становила 189,89 ± 5,83 г/л, у контрольній групі була більше в 1,39 раза (p < 0,01). У 36,11 % (p < 0,01) породіль із ПЕ рівень тромбоцитів був менше 180 г/л і у 16,67 % (p < 0,01) менше 150 г/л, у контрольній групі таких випадків не реєструвалося (p < 0,01). Уміст у крові сечової кислоти у породіль групи П був вірогідно більший у 2,00 раза, сечовини — в 1,74, креатиніну — в 1,13, загального білка — в 1,14, аланінамінотрансферази — в 1,48, аспартатамінотрансферази — в 2,27, гомоцистеїну — в 1,67 раза. Електролітний склад крові породіль із ПЕ середнього та тяжкого ступеня відрізнявся зниженням рівнів калію в 1,13 раза (p < 0,01), кальцію — в 1,16 (p < 0,01), магнію — в 1,26 (p < 0,01) і підвищенням вмісту натрію в 1,07 раза (p < 0,01).
Дослідження судинно-тромбоцитарної ланки гемостазу виявило скорочення початку і кінця часу згортання крові (відповідно в 1,67 і в 1,09 раза; p < 0,01), підвищення спонтанної агрегації тромбоцитів — в 1,24 (p < 0,01) та індексу їх адгезивності — в 1,24 (p < 0,01).
При вивченні коагуляційної ланки гемостазу у групі П виявлено вірогідне зниження МНВ в 1,20 раза і збільшення протромбінового індексу в 1,10 раза; фібриногену А — в 1,25; рівня РФМК — в 1,30; АЧТЧ — в 1,71; фактора Віллебранда — в 1,84; фібронектину — в 1,77 раза. Про активацію згортання крові свідчило збільшення концентрації РФМК в 1,30 раза (p < 0,01) і D-димера — в 1,20 раза (p < 0,01).
Виявлено зниження первинних фізіологічних антикоагулянтів: активності антитромбіну II в 1,24 раза (p < 0,01), протеїну С — в 1,32 (p < 0,01), протеїну S — в 1,69 (p < 0,01) і збільшення концентрації тромбомодуліну в 1,16 раза (p < 0,01), а також вторинних фізіологічних антикоагулянтів, таких як ПДФ — в 1,44 раза (p < 0,01).
При оцінці фібринолітичної ланки гемостазу крові виявлено подовження часу лізису еуглобулінових згустків/Хагеман-залежного фібринолізу у породіль із ПЕ в 1,14 раза (15,73 ± 0,19 хв проти 13,80 ± 0,18 хв, p < 0,01).
Термін вагітності під час пологів у жінок групи П був менший за такий у групі К1 в 1,18 раза — 33,00 ± ± 0,55 тижня проти 38,98 ± 0,20 тижня (р < 0,01), відповідно кількість передчасних пологів у групі П перевищувала таку в групі К1 в 42,24 раза (91,67 проти 2,17 %, р < 0, 01), а термінових була в 5,87 раза менше (16,67 проти 97,83 %, р < 0,01). У породіль групи П усі пологи були ускладненими, тоді як у контрольній групі ускладнені пологи відмічалися в 3,54 раза рідше і відбулися у 28,26 % жінок (р < 0,01). Нормальні пологи в контрольній групі зареєстровані в 71,74 % випадків (р < 0,01). Пологи через природні пологові шляхи у породіль групи П були в 4,25 раза рідше, ніж у групі К1 (19,44 проти 82,61 %, р < 0,01), а шляхом операції кесаревого розтину — у 4,63 раза частіше (80,56 проти 17,39 %, р < 0,01).
Середня маса новонароджених у групі П була в 1,95 раза менша, ніж у групі К1 (1744,17 ± 113,72 г проти 3405,43 ± 97,24 г, р < 0,01), зріст — у 1,22 (42,89 ± ± 0,84 см проти 52,43 ± 0,43 см, р < 0,01), оцінка за шкалою Апгар на 1-й хвилині — в 1,20 раза (5,89 ± 0,09 бала проти 7,07 ± 0,08 бала, р < 0,01), на 5-й хвилині — в 1,03 (7,75 ± 1,18 бала проти 7,98 ± 0,10 бала, р > 0,05). Основними перинатальними наслідками розродження жінок із ПЕ середнього та тяжкого ступеня були: перинатальне гіпоксичне ураження центральної нервової системи — у 84,21 % новонароджених (р < 0,01); вроджені розсіяні ателектази легенів — у 73,68 % (р < 0,01); дихальна недостатність — у 71,05 % (р < 0,01); ЗРП — у 26,32 % (р < 0,01); кон’югаційна жовтяниця — у 23,68 % (р < 0,01). 91,67 % дітей народилися недоношеними, найбільш часто серед них реєструвалися недоношеність II (39,47 %, р < 0,01) і III (31,58 %, р < 0,01) ступеня.
Гістологічно досліджено 38 послідів від породіль груп П і К1. Середня маса послідів становила при ПЕ 400,97 ± 6,87 г і була менше за таку в контрольній групі (485,87 ± 9,90 г) в 1,21 раза (р < 0,01). Число породіль із масою посліду менше 400 г у групі П перевищувало таке в контрольній групі в 2,04 раза (р < 0,03), а з масою понад 450 г було менше в 12,52 раза (р < 0, 01). До 1/10 площі плацент у групі П було представлено інфарктами, гематомами, кавернами, а в контрольній групі не перевищувала 1/100 частини.
Інфаркти материнської поверхні плаценти зустрічалися в групі П у 61,11 % жінок і перевищували число таких у контрольній групі в 5,62 раза (р < 0,01). Інфаркти плодової поверхні плаценти зустрічалися у кожної восьмої породіллі груп П і К1 (р > 0,05). Червоні інфаркти реєструвалися тільки в групі П у 61,11 % жінок і не спостерігалися в контрольній групі (р < 0,01), аналогічно — мембранні інфаркти (11,11 %, р < 0,02). Білі інфаркти у групі П (41,67 %) реєструвалися частіше порівняно з контрольною групою (13,04 %) в 3,19 раза (р < 0,01). Нерідко траплялися хронічні інфаркти і старі тромби в міжворсинчастому просторі. У жінок із ПЕ середнього та тяжкого ступеня в 2,11 раза частіше в плацентах зустрічалися некрози (91,67 %, р < 0,01) і 1,79 раза— кальцинати (58,33 %, р < 0,02).
Характерним було викривлення і вкорочення ворсинчастого дерева, 2/3 ворсин були повнокровними. У групі П в 44,44 % випадків відзначали відкладення периворсинчастого фібриноїду, тоді як у контрольній групі — у 2,92 раза рідше (15,22 %, р < 0,01). При ПЕ була різко збільшена кількість ворсин, позбавлених епітелію і замурованих у фібриноїд. Дистальна гіпоплазія ворсин спостерігалася в 47,22 % плацентах (р < 0,01) від жінок із ПЕ, тоді як у групі П — в 7,24 раза рідше (6,52 %). За рахунок значного зменшення термінальних ворсин у групі П значно зростала частка проміжних. Кількість синтиціальних вузлів збільшувалася в порівнянні з контрольною групою в 2,02 раза (52,78 %, р < 0,02). Відзначалася зміна рельєфу ворсинчастого дерева з нерівномірністю розподілу і викривленням ворсин і зміною топографії поверхні, в окремих ділянках — з набряком і деструкцією. У стовбурових і середніх за діаметром ворсинах фіброз строми був виражений більш різко, ніж у групі К1. Спостерігалося потовщення стінок артеріальних стовбурів із гіпертрофією і звуженням просвіту. У плацентах на тлі ПЕ тяжкого ступеня число фібриноїдно-змінених ворсин сягало 3/4. Зростала кількість склерозованих і набряклих ворсин, збільшувалася кількість фібриноїду в міжворсинчастому просторі.
В амніоні відзначався нерівномірний набряк і склероз строми. Ядра епітелію амніону були пікнотизовані і зруйновані, виявлялися великі ділянки без’ядерного епітелію з зернистою або пінистою цитоплазмою. Виявлено суттєві зміни у позаплацентарних плодових оболонках залежно від тяжкості ПЕ — збільшення гідрофільності, набухання волокон, розпушення сполучної тканини, помітне зменшення кількості фібробластів. У судинах хоріальної пластини і ворсин спостерігався нерівномірний склероз, набряк, проліферація ендотелію, особливо в артеріолах. Зазначалося плазматичне просочування стінок дрібних судин децидуальної оболонки і гіллястого хоріону.
На другому етапі в Інституті генетики та репродукції людини (м. Київ) фенольним методом проведено виділення геномної ДНК з лімфоцитів периферичної крові у породіль з ПЕ середнього та тяжкого ступеня. У РАМН НДІ акушерства і гінекології ім. Д.О. Отта Північно-Західного відділення РАМН (м. Санкт-Петербург) проведено дослідження зразків ДНК за допомогою «Фібр-біочипа». На підставі отриманих даних виявлено розподіл частот генотипів і алелей генів F5, F2, PAI1, FGB, GP3a і MTHFR у породіль із ПЕ середнього та тяжкого ступеня та без ПЕ і артеріальної гіпертензії з Південно-Східного регіону України; виявлено найбільш значущі генетичні маркери тромбофілії у вагітних із ПЕ, розроблена система бальної оцінки ризику розвитку ПЕ середнього та тяжкого ступеня у вагітних Південно-Східного регіону України на підставі генетичного тестування з використанням технології гелевих біочипів.
При генетичному тестуванні встановлено, що наявність змін генів тромбофілії у пацієнток із ПЕ середнього та тяжкого ступеня зустрічалася в 1,18 раза частіше, ніж у групі вагітних без ПЕ (97,22 ± 1,66 % проти 82,61 ± 1,54 %, p < 0,04; ВШ 7,37; ДІ 95 % — 0,88–61,94). У жінок групи П вірогідно рідше реєструвалися нормальні гомозиготні алелі гена — ендотеліального інгібітору активатора плазміногену-1 PAI1 в 2,74 раза (р < 0,01); гена глікопротеїну тромбоцитарних рецепторів ITGB3 — в 1,49 (р < 0,01); гена метилентетрагідрофолатредуктази MTHFR — в 1,57 (р < 0,04), але частіше гетерозиготні алелі гена ITGB3 — в 2,34 раза (р < 0,05). Мутації генів спадкових тромбофілій відмічалися у жінок із ПЕ в 44,44 % випадків (р < 0,03), причому зустрічалися мутації майже всіх досліджуваних генів за винятком мутацій гена коагуляційного фактора 2 або протромбіну (F2), а саме фактора 5 (F5) Лейдена — у 2,78 % породіль (р > 0,05); гена FGB, що кодує -субодиницю коагуляційного фактора-1 фібриногену, — у 11,11 % (р > 0,05); PAI1 — у 36,11 % (р < 0,02), ITGB3 — у 11,11 % (р < 0,03), MTHFR — у 13,89 % (р < 0,01). Мутації генів спадкових тромбофілій реєструвалися у жінок контрольної групи в 21,74 % випадків (р < 0,03): FGB — у 10,87 % (р > 0,05) і PAI1 — у 13,04 % (р < 0,02). Гетерозиготні алелі досліджуваних генів спадкової тромбофілії зустрічалися як у групі П, так і у групі К1. Вірогідні відмінності спостерігалися за кількістю гетерозиготних алелей гена ITGB3 — у жінок групи П кількість випадків його гетерозигот зустрічалася частіше в 2,34 раза.
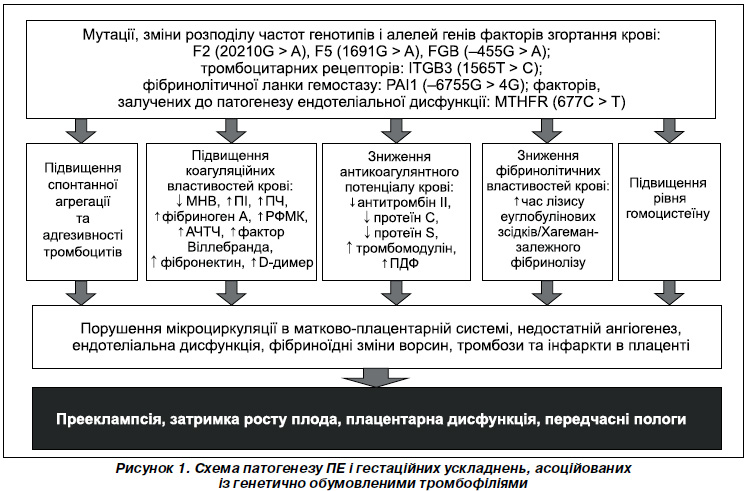
Таким чином, на підставі проведених досліджень можна зробити висновок про те, що в розвитку ПЕ середнього та тяжкого ступеня важливу роль відіграють генетично обумовлені форми тромбофілії (рис. 1).
Порушення в системі різних ланок гемостазу, такі як підвищення агрегації та адгезії тромбоцитів, збільшення згортання, зниження антикоагулянтної і фібринолітичної здатності крові призводять до порушень мікроциркуляції в матково-плацентарній системі, недостатнього ангіогенезу, фібриноїдних змін ворсин, тромбозів та інфарктів у плаценті. Недостатній ангіогенез веде до гіпоксії, неповної реконструкції материнських спіральних артерій, порушень і затримки росту плаценти та плода, артеріальної гіпертензії та протеїнурії. Поліморфізм гена MTHER супроводжується гіпергомоцистеїнемією, порушеннями фолатного обміну та ендотеліальною дисфункцією, що також може призводити до розвитку ПЕ, і це збігається з думкою Є.Е. Гродницької (2010) [3]. Гіпергомоцистеїнемія справляє негативний вплив на механізми, що беруть участь у регуляції судинного тонусу, обміну ліпідів та коагуляційного каскаду. Несприятливий вплив гіпергомоцистеїнемії на ендотелій та еластичні властивості судин, а також стимуляція тромбоутворення можуть викликати вже в ранні терміни вагітності порушення плацентації та розлади фетоплацентарного кровообігу, результатом яких може стати розвиток ускладнень вагітності, в тому числі ПЕ і передчасних пологів. Зв’язок поліморфізму гена MTHER і ризику передчасних пологів підтверджують також дослідження W.G. Johnson et al. (2005) [10].
Розроблена система бальної оцінки ризику ПЕ середнього та тяжкого ступеня для мешканок Південно-Східного регіону України. Для цього кожному стану з тестованих генів привласнювали певний бал залежно від внеску цього гена в ризик розвитку захворювання з урахуванням особливостей популяції. Далі проводили підрахунок абсолютних балів. Підрахунок відносних балів ризику розвитку ПЕ середнього та тяжкого ступеня проводили за формулою:
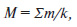
де М — відносна сума балів, m — сума балів усіх індивідуальних генотипів, k — число вивчених генів.
Високому ризику ПЕ середнього та тяжкого ступеня відповідав інтервал М від 1,1 бала і вище, помірному — від 0,9 до 1,1, низькому — від 0 до 0,9 бала.
На третьому етапі з 6200 вагітних відібрано 312 вагітних групи клінічного ризику розвитку ПЕ середнього та тяжкого ступеня (група Р) на підставі раніше виявлених клініко-анамнестичних факторів ризику і 30 умовно здорових вагітних групи К2 без вище зазначених факторів ризику розвитку ПЕ. Їм усім було проведено комплексне клініко-лабораторне обстеження з поглибленим вивченням показників системи гемостазу та генетичне тестування.
Вивчення розподілу клінічних факторів ризику ПЕ середнього та тяжкого ступеня в обстежених вагітних групи Р показало, що в цій когорті жінок найбільш часто зустрічалися такі фактори ризику, як гіпотиреоз (30,13 %), надмірна маса тіла (28,85 %), мимовільне переривання вагітності (28,85 %), гіпертонічна хвороба (27,88 %).
Вивчення розподілу алелей генів тромбофілії в обстежених вагітних виявило, що у вагітних групи Р рідше зустрічалися нормальні гомозиготні алелі гена PAI1 в 2,29 раза (р < 0,01), ITGB3 — в 1,28 (р < 0,04), MTHFR — в 2,57 (р < 0,02), але частіше гетерозиготні алелі гена MTHFR в 2,27 раза (р < 0,02). У пацієнток групи Р реєструвалися випадки мутацій усіх досліджуваних генів при відсутності таких у контрольній групі К2, проте вірогідно частіше зустрічалися мутації генів PAI1 (28,62 %, р < 0,01) і MTHFR (17,31 %, р < 0,02).
Проведення бальної оцінки ступеня ризику розвитку ПЕ середнього та тяжкого ступеня, асоційованої з генетично зумовленими формами тромбофілії, в обстежених вагітних виявило вірогідне збільшення середнього абсолютного бала за геном FGB на 0,11 бала, PAI1 — у 2,47 раза, ITGB3 — у 2,92, MTHFR — у 3,34 раза. Загальна середня абсолютна сума бала ризику розвитку ПЕ в групі Р вірогідно перевищувала таку в групі К2 в 2,97 раза, а загальна середня відносна сума балів ризику розвитку ПЕ — у 3,00 раза.
Аналіз розподілу генетичного ризику розвитку ПЕ середнього та тяжкого ступеня в досліджуваних клінічних групах ризику на основі проведеної бальної оцінки показав, що в групі Р 43 (13,78 %) вагітних мали помірний ризик і 23 (7,37 %) — високий ризик ПЕ середнього та тяжкого ступеня, асоційованої з тромбофіліями.
На четвертому етапі була розроблена, впроваджена та оцінена ефективність диференційованої схеми ранньої профілактики ПЕ з урахуванням тестування на генетично обумовлені форми тромбофілії.
Усім вагітним групи ризику були запропоновані руховий режим з обов’язковими пішими прогулянками з ходьбою 2 раза на день не менше 30 хв; раціональне харчування, що включає фізіологічно нормальний уміст білка, жирів і вуглеводів; при супутньому ожирінні або надмірному набиранні жирової маси тіла — зниження енергоцінності раціону за рахунок легкоза-своюваних вуглеводів і тваринних жирів, але не білків; уміст у раціоні калію, кальцію і магнію на верхній межі фізіологічних потреб вагітної як за рахунок харчових продуктів, так і вітамінно-мінеральних речовин у фізіологічних дозах; включення в раціон харчування морських продуктів з високим умістом поліненасичених жирних кислот.
Вагітні з групи С відповідно до наказу № 676 МОЗ України від 31.12.2004 р. з метою профілактики ПЕ отримували ацетилсаліцилову кислоту 60–100 мг/добу, починаючи з 20-го тижня вагітності; препарати кальцію 2 г/добу (у перерахунку на елементарний кальцій), починаючи з 16-го тижня вагітності.
Вагітним з групи О2 з низьким ризиком розвитку ПЕ середнього та тяжкого ступеня, асоційованої з генетично обумовленими формами тромбофілії, рекомендували: препарат, що містить магнію лактат 500 мг і піридоксин 125 мг (магне В6), по 1 табл. два рази на день 4 двотижневих курси по 15 днів із перервою між курсами 2 тижні; фолієву кислоту 1 мг по 1 табл. 1 раз на день до пологів; карбонат кальцію 2500 мг з 400 MЕ холекальциферолу на добу (кальцій-D3 Нікомед) до пологів і ацетилсаліцилову кислоту по 100 мг 1 раз на день у формі таблетки, вкритої кишковорозчинною оболонкою (аспірин® кардіо), з 14 (!) до 32 тижнів). Якщо при обстеженні в 20 тижнів у групах О2 і С2 виявлялися зрушення в гемостазіограмі з наростанням гіперкоагуляції, то призначалася відповідна терапія дезагрегантами, антикоагулянтами, сеанси плазмаферезу або озонотерапії.
Вагітним із помірним і високим ризиком розвитку ПЕ середнього та тяжкого ступеня, асоційованої з генетично обумовленими формами тромбофілії, рекомендували всі вищеперераховані препарату + НМГ десятиденний курс у 12, 20 і 28 тижнів під контролем гемостазіограми. Якщо при обстеженні в 20 тижнів у групах О1 і С1 виявлялися зрушення в гемостазіограмі з наростанням гіперкоагуляції, то призначалися сеанси плазмаферезу або озонотерапії.
Вагітні з груп О і С, О1 і С1, О2 і С2 були однорідні за віком, масо-ростовими показниками, тютюнопалінням, віком менархе, тривалістю менструальної кровотечі, віком початку статевого життя, паритетом даної вагітності та майбутніх пологів, спектром гінекологічних та екстрагенітальних захворювань, розподілом алелей генів тромбофілії, генетичним ризиком розвитку ПЕ середнього та тяжкого ступеня на основі бальної оцінки, середнім терміном взяття під спостереження, середнім систолічним і діастолічним артеріальним тиском при взятті під спостереження, показниками гемостазу, що дозволило надалі порівнювати результати профілактики.
Вагітні з групи Р порівняно з контрольною групою мали більший ІМТ в 1,15 раза (р < 0,01); частіше палили в 2,02 раза (р < 0,01); мали меншу середню кількість вагітностей та пологів в анамнезі на одну жінку в 1,53 (р < 0,0) і 3,90 раза (р < 0,01); 28,85 % (р < 0,0) жінок мали мимомовільне переривання вагітності; реєструвалася більша кількість гінекологічних захворювань в 2,47 раза (р < 0,01): хронічний аднексит — у 22,76 % випадків (р < 0,01), полікістозні яєчники — у 18,33 % (р < 0,01), лейоміома матки — у 19,94 % (р < 0,01), урогенітальні інфекції та/або бактеріальний вагіноз — у 39,74 % (р < 0,01), у тому числі уреаплазмоз — у 24,68 % (р < 0,01), бактеріальний вагіноз — у 21,15 % (р < 0,05); гіпертонічна хвороба була у 87,78 % жінок (р < 0,01); нейроциркуляторна дистонія — у 15,38 % (р < 0,03), хронічний гастрит — у 26,28 % (р < 0,01); коліт — у 38,14 % (р < 0,01), хронічний холецистопанкреатит — у 16,35 % (р < 0,02); хронічний пієлонефрит — у 16,99 % (р < 0,02); гіпотиреоз — у 30,13 % (р < 0,01).
Вірогідними генетичними відмінностями групи Р були: менша кількість випадків нормальної гомозиготної алелі гена PAI1 в 2,29 раза і наявність його мутацій у 28,62 % жінок; менша кількість випадків нормальної гомозиготної алелі гена ITGB3 в 1,28 раза і гена MTHFR в 2,57 раза; більша кількість випадків гетерозиготної алелі MTHFR в 2,27 раза і поява його мутацій у 17,31 % жінок. Реєструвалося вірогідне збільшення середнього абсолютного бала ризику розвитку ПЕ середнього та тяжкого ступеня, асоційованої з генетично обумовленими формами тромбофілії: за геном FGB — на 0,11 бала, PAI1 — на 0,63, ITGB3 — на 0,25, MTHFR — на 0,40 бала; загальної середньої абсолютної і відносної суми балів ризику розвитку ПЕ — відповідно на 2,42 і 0,40 бала.
При аналізі розподілу алелей генів тромбофілії залежно від ступеня ризику розвитку ПЕ виявлено, що вірогідними відмінностями в групах помірного і високого ризику порівняно з низьким ризиком було зменшення нормальних гомозиготних алелей гена F5 в 1,89 раза, F2 — в 1, 25, ITGB3 — в 3,03, MTHFR — в 2,57 раза; збільшення гетерозиготних алелей гена F5 на 40,50 %, гена F2 — на 16,61 %, ITGB3 — на 36,76 %; поява мутацій F5 у 7,58 % жінок і збільшення мутацій ITGB3 в 3,32 раза. Відмінними рисами груп помірного і високого ризику ПЕ залежно від спадкових тромбофілій порівняно з групами низького ризику було збільшення середнього абсолютного бала ризику за геном F5 в 113,37 раза (р < 0,01), за геном F2 — у 26,16 (р < 0,01), FGB — в 1,62 (р < 0,01), ITGB3 — у 3,66 (р < 0,0001), MTHFR — в 1,47 раза (р < 0,01); загальної середньої абсолютної і відносної суми балів — у 2,27 (р < 0,01) і 2,26 раза (р < 0,01).
Вивчення показників судинно-тромбоцитарної ланки гемостазу в обстежених вагітних групи ризику ПЕ у термін 11–12 тижнів показало, що, незважаючи на відсутність вірогідних відмінностей у кількості тромбоцитів, з’являються зміни їх функціональних властивостей: спонтанна агрегація тромбоцитів збільшується в 1,06 раза (р < 0,01), а індекс адгезивності — в 1,07 (р < 0,01). При цьому кількість тромбоцитів у групі помірного і високого ризику розвитку ПЕ, асоційованої з тромбофіліями, перевищує показники в групі низького ризику в 1,03 раза (р < 0,0); спонтанна агрегація та індекс адгезивності тромбоцитів — в 1,02 (р < 0,01); МНВ менше в 1,05 раза (р < 0,0001), рівень фібриногену більше в 1,04 (р < 0,01) і фібронектину — в 1,21 раза (р < 0,01), рівень протеїну С нижче в 1,05 раза (р < 0,01), концентрація ПДФ вище в 1,18 (р < 0,01) і гомоцистеїну — в 1,34 раза (р < 0,01), рівень магнію нижче в 1,07 раза (р < 0,01).
У вагітних із груп О1, О2, С1 і С2 було проведено клініко-лабораторне обстеження в 21–22 тижня. В нормі артеріальний тиск у другому триместрі вагітності знижується, що ми й отримали в групі К2: середній артеріальний тиск знизився в 1,02 раза і становив 80,16 ± 1,38 мм рт.ст. У групі О1 зареєстровано зниження середнього артеріального тиску в 1,03 раза (86,63 ± 0,82 мм рт.ст., рО1–К2 < 0,01) раза, О2 — в 1,02 (84,83 ± 0,87 мм рт.ст., рО2–К2 < 0,01, рО1–О2 > ,05); у групі С1 — в 1,01 (88,50 ± 0,92 мм рт.ст., рС1–К2 < 0,01, рО1–С1 > 0,05), С2 — в 1,01 (85,36 ± 0,62 мм рт.ст., рС2–К2 < 0,01, рС1–С2 < 0,01; рО2–С2 > 0,05).
У 21–22 тижні реєструвалося вірогідне зниження кількості тромбоцитів у групі високого і помірного ризику ПЕ середнього та тяжкого ступеня, асоційованої з генетично успадкованими тромбофіліями в 1,17 раза, а в групі низького ризику ПЕ — в 1,07; збільшення спонтанної агрегації тромбоцитів — відповідно в 1,07 і 1,07; зниження МНВ — в 1,06 і 1,05; скорочення протромбінового часу — в 1,14 і 1,05; збільшення рівня фібриногену — в 1,15 і 1,23; посилення експресії фактора Віл-лебранда — в 1,40 і 1,17, фібронектину — в 1,24 і 1,43; збільшення РФМК — в 1,42 і 1,16; D-димерa — в 2,51 і 2,18; зниження активності антитромбіну III — в 1,21 і 1,12; зменшення концентрації протеїну С — в 1,11 і 1,06, протеїну S — в 1,10 і 1,07; збільшення ПДФ — в 1,22 і 1,14; подовження часу Хагеман-залежного фібринолізу — в 1,06 і 1,04; підвищення рівня гомоцистеїну — в 1,20 і 1,07; зниження концентрації кальцію в 1,03 і 1,01, магнію — в 1,14 і 1,04 раза.
Етичні аспекти не дозволяють не проводити лікування вагітних із виявленою патологією. Тому після обстеження в 21–22 тижня не тільки 9,09 % вагітним групи О1 були додатково проведені сеанси плазмаферезу, 12,90 % пацієнток групи О2 — терапія НМГ і 8,06 % — сеанси плазмаферезу або озонотерапії; але й у групі С1 78,79 % вагітних були призначені курси НМГ, 36,36 % — сеанси плазмаферезу або озонотерапії; у групі С2 — відповідно 44,27 і 24,59 %.
Застосування запропонованої схеми ранньої профілактики в групі високого і помірного ризику О1 з розвитку ПЕ середнього та тяжкого ступеня, асоційованої зі спадковими тромбофіліями, привело в 20–21 тижні вагітності до вірогідно меншої зміни ряду показників гемостазу і мінерального обміну, ніж у групі С1, у тому числі меншого: зниження кількості тромбоцитів в 1,06 і 1,03 раза; збільшення спонтанної агрегації тромбоцитів — в 1,03 і 1,03; зниження МНВ — в 1,02 і 1,04; скорочення протромбінового часу — в 1,03 і 1,01; збільшення концентрації фібриногену — в 1,08 і 1,09; скорочення АЧТЧ — в 1,06 і 1,02; посилення експресії фактора Віллебранда — в 1,17 і 1,05; збільшення рівня фібронектину — в 1,03 і 1,10; збільшення рівня РФМК — в 1,12 і 1,05; підвищення вмісту D-димерa — в 1,37 і 1,10; зниження активності антитромбіну III — в 1,04 і 1,05; зменшення концентрації протеїну С — в 1,07 і 1,04; зниження вмісту протеїну S — в 1,06 і 1,04; збільшення рівня продуктів деградації фібриногену/фібрину — в 1,20 і 1,06; подовження часу Хагеман-залежного фібринолізу — в 1,05 і 1,03; підвищення продукції гомоцистеїну — в 1,13 і 1,03; зниження концентрації магнію — в 1,08 і 1,01 раза.
Упровадження запропонованої схеми профілактики в групі помірного і високого ризику ПЕ середнього та тяжкого ступеня за генетично успадкованими тромбофіліями привело до зниження загального числа випадків ПЕ в 2,08 раза (р < 0,002) і кількості випадків ПЕ середнього та тяжкого ступеня — в 2,29 (р < 0,02); збільшення кількості термінових пологів в 1,15 (р < 0,03) та зниження передчасних — у 3,00 (р < 0,03); збільшення середньої маси новонароджених — в 1,10 (р < 0, 04), середньої оцінки за шкалою Апгар на 1-й хвилині — в 1,08 (р < 0,02); зниження числа дітей з перинатальним гіпоксичним ураженням центральної нервової системи — у 5,00 (р < 0,02), із дихальною недостатністю — у 2,40 (р < 0,05), із вродженими розсіяними ателектазами легенів — у 2,75 раза (р < 0,04).
Впровадження запропонованої схеми профілактики в групі низького ризику ПЕ середнього та тяжкого ступеня, асоційованої з генетично успадкованими тромбофіліями призвело до зниження загального числа випадків ПЕ в 2,43 раза (р < 0,01); зменшення кількості випадків ПЕ середнього та тяжкого ступеня — у 7,09 (р < 0,03); збільшення середньої маси новонароджених — в 1,09 (р < 0,01) і середньої оцінки за шкалою Апгар на 1-й хвилині — в 1,09 (р < 0,01); зниження числа недоношених дітей — в 1,96 раза (р < 0,02).
Проведені дослідження дозволяють рекомендувати розроблену диференційовану схему ранньої профілактики ПЕ у вагітних клінічної групи ризику з ПЕ в широку клінічну практику.
Висновки
1. Клініко-анамнестичними факторами ризику ПЕ середнього та тяжкого ступеня є самовільне переривання вагітності в анамнезі (ВШ 11,44; ДІ 95 % — 2,39–54,85); гіпертонічна хвороба (ВШ 10,16; ДІ 95 % — 1,19–86,77); ожиріння (ВШ 8,44; ДІ 95% — 0,97–73,53); лейоміома матки (ВШ 6,83; ДІ 95% — 1,38–33,90); хронічний пієлонефрит (ВШ 6,62; ДІ 95% — 1,71–25,66); полікістозні яєчники (ВШ 4,97; ДІ 95 % — 0,97–25,54); гіпотиреоз (ВШ 4,97; ДІ 95 % — 0,97–25,54); вік менархе до 12 років (ВШ 4,28; ДІ 95 % —1,24–14, 82); цукровий діабет (ВШ 3,86; ДІ 95 % — 0,97–25,54); сечокам’яна хвороба (ВШ 3,82; ДІ 95 % — 0,94–15,60), хронічний холецистопанкреатит (ВШ 3,82; ДІ 95 % — 0,94–15,60); нейроциркуляторна дистонія (ВШ 3,75; ДІ 95% — 1,07–13,14); надмірна маса тіла (ВШ 3,50; ДІ 95% — 1,40–8,76); перші пологи (ВШ 2,84; ДІ 95% — 0,98–8,23).
2. Гемостаз у породіль із ПЕ середнього та тяжкого ступеня вірогідно характеризується порушеннями судинно-тромбоцитарної, активацією коагуляційної, виснаженням резервів антикоагуляційної та фібринолітичної ланки гемостазу. У жінок із ПЕ середнього та тяжкого ступеня спостерігається більша кількість передчасних пологів у 38,33 раза (р < 0,01), менше термінових — в 5,87 (р < 0,01); рідше пологи через природні пологові шляхи — в 4,25 (р < 0,01), частіше — шляхом операції кесаревого розтину — в 4,63 (р < 0,01); середня маса новонароджених — менше в 1,95 раза (р < 0,01), зріст — у 1,22 (р < 0,01), оцінка за шкалою Апгар нижча на 1-й хвилині в 1,20 раза (р < 0,01); у 84,21 % (р < 0,01) новонароджених зустрічається перинатальне гіпоксичне ураження центральної нервової системи, у 73,68 % (р < 0,01) — вроджені розсіяні ателектази легенів, у 71,05 % (р < 001) — дихальна недостатність, у 26,32 % (р < 0,02) — затримка росту плода, у 23,68 % (р < 0,01) — кон’югаційна жовтяниця. У послідах від породіль із ПЕ середнього та тяжкого ступеня переважають виражені інволютивно-дистрофічні та циркуляторні порушення, множинні інфаркти та тромбози, що ускладнюють плацентарно-плодовий обмін і призводять до порушень та затримки росту плода, іноді — до загибелі.
3. Генетично успадковані форми тромбофілії є факторами ризику розвитку ПЕ середнього та тяжкого ступеня (ВШ 7,37; ДІ 95 % — 0,88–61,94). У породіль із середньою та тяжкою ПЕ порівняно з породіллями без ПЕ частіше в 2,77 раза (р < 0,02) зустрічаються мутації гена — інгібітора активатора плазміногену-1 PAI1, а також реєструються мутації гена глікопротеїну тромбоцитарних рецепторів ITGB3 (11,11 %, р < 0,03) і метилентетрагідрофолатредуктази MTHFR (13,89 %, р < 0,01); кількість випадків гетерозигот гена ITGB3 зустрічається частіше в 2,34 раза (р < 0,05). Запропонована система оцінки ризику розвитку ПЕ у вагітних Південно-Східного регіону України на підставі тестування на генетично обумовлені тромбофілії з використанням технології гелевих біочипів і методу бальної оцінки в плані прогнозу ПЕ у конкретної вагітної досить умовна, проте вже зараз вона дозволяє в першому наближенні оцінити рівень генетично обумовленої схильності.
4. У вагітних клінічної групи ризику з ПЕ середнього та тяжкого ступеня вірогідно рідше зустрічаються нормальні гомозиготні алелі гена PAI1 в 2,29 раза (р < 0,01), ITGB3 — в 1,28 (р < 0,04), MTHFR — у 2,57 (р < 0,02), але частіше — гетерозиготні алелі гена MTHFR — у 2,27 раза (р < 0,02); реєструються випадки мутацій всіх досліджуваних генів, проте вірогідно частіше — мутації гена PAI1 (28,62 %) і гена MTHFR (17,31 %). Згідно з бальною оцінкою тестування на генетично обумовлені тромбофілії вагітні клінічної групи ризику мають помірний ризик розвитку ПЕ середнього та тяжкого ступеня в 13,78 % випадків і високий — в 7,37 %. Відмінними рисами груп помірного і високого ризику ПЕ, асоційованої зі спадковими тромбофіліями, в порівнянні з групами низького ризику є збільшення середнього абсолютного бала ризику за геном F5 в 113,37 раза (р < 0,01), F2 — в 26,16 (р < 0,01), FGB — в 1,62 (р < 0,01), ITGB3 — в 3,66 (р < 0,01), MTHFR — в 1,47 (р < 0,01); загальної середньої абсолютної і відносної суми балів — в 2,27 (р < 0,01) і 2,26 раза (р < 0,01).
5. У вагітних групи ризику з розвитку ПЕ в терміні 11–12 тижнів, незважаючи на відсутність вірогідних відмінностей у кількості тромбоцитів, з’являються зміни їх функціональних властивостей: спонтанна агрегація збільшується в 1,06 (р < 0,01) раза, індекс адгезивності — в 1,07 (р < 0,01). При цьому кількість тромбоцитів у групі помірного і високого ризику розвитку ПЕ, асоційованої з тромбофіліями, перевищує показники в групі низького ризику в 1,03 раза (р < 0,01); спонтанна агрегація й індекс адгезивності тромбоцитів — в 1,02 (р < 0,01); МНВ — менше в 1,05 (р < 0, 01); рівень фібриногену — більше в 1,04 (р < 0,01) і фібронектину — в 1,21 (р < 0,01), рівень протеїну С — нижче в 1,05 (р < 0,01), концентрація продуктів деградації фібриногену/фібрину — вище в 1,18 (р < 0,01) і гомоцистеїну — в 1,34 (р < 0,01), рівень магнію — нижче в 1,07 раза (р < 0,01).
6. Застосування запропонованої схеми ранньої профілактики в групі високого і помірного ризику і групі низького ризику з розвитку ПЕ середнього та тяжкого ступеня, асоційованої зі спадковими тромбофіліями, приводить у 20–21 тижні вагітності до вірогідно меншої зміни ряду показників гемостазу і мінерального обміну, в тому числі: зниження кількості тромбоцитів — відповідно в 1,06 і 1,03 раза; збільшення спонтанної агрегації тромбоцитів — в 1,03 і 1,03; зниження МНВ — в 1,02 і 1,04; скорочення протромбінового часу — в 1,03 і 1,01; збільшення концентрації фібриногену — в 1,08 і 1,09; скорочення активованого часткового тромбопластинового часу — в 1,06 і 1,02; посилення експресії фактора Віллебранда — в 1,17 і 1,05; збільшення рівня фібронектину — в 1,03 і 1,10; збільшення рівня розчинних фібринмономірних комплексів — в 1,12 і 1,05; підвищення вмісту D-димерa — в 1,37 і 1,10; зниження активності антитромбіну III — в 1,04 і 1,05; зменшення концентрації протеїну С — в 1,07 і 1,04; зниження вмісту протеїну S — в 1,06 і 1,04; збільшення рівня продуктів деградації фібриногену/фібрину — в 1,20 і 1,06; подовження часу Хагеман-залежного фібринолізу — в 1,05 і 1,03; підвищення продукції гомоцистеїну — в 1,13 і 1,03; зниження концентрації магнію — в 1,08 і 1,01 раза.
7. Впровадження запропонованої схеми ранньої профілактики в групі помірного і високого ризику з розвитку ПЕ середнього та тяжкого ступеня, асоційованої зі спадковими тромбофіліями, призводить до зниження загального числа випадків ПЕ в 2,08 раза (р < 0,01), кількості випадків ПЕ середнього та тяжкого ступеня — в 2,29 (р < 0,02); зниження кількості передчасних пологів — в 3,00 (р < 0,03); збільшення середньої маси новонароджених — в 1,10 раза (р < 0,04), середньої оцінки за шкалою Апгар на 1-й хвилині — в 1,08 (р < 0,02); зменшення числа дітей з перинатальним гіпоксичним ураженням центральної нервової системи — у 5,00 раза (р < 0,02), з дихальною недостатністю — у 2,40 (р < 0,05), з вродженими розсіяними ателектазами легенів — у 2,75 раза (р < 0,04). Застосування запропонованої схеми профілактики в групі низького ризику розвитку ПЕ середнього та тяжкого ступеня призводить до зниження загального числа випадків ПЕ в 2,43 раза (р < 0,002); зменшення кількості випадків ПЕ середнього та тяжкого ступеня — у 7,09 (р < 0,03); збільшення середньої маси новонароджених — в 1,09 (р < 0,01) і середньої оцінки за шкалою Апгар на 1-й хвилині — в 1,09 (р < 0,01); зниження числа недоношених — в 1,96 раза (р < 0,02).
1. Баймурадова С.М. Патогенез, принципы диагностики, профилактики и терапии синдрома потери плода, обусловленного приобретенными и генетическими дефектами гемостаза: Автореф. дис... д-ра мед. наук: спец. 14.01.01 // Седа Майрабековна Баймурадова. — М., 2007. — 48 с.
2. Беспалова О.Н. Генетика невынашивания беременности / О.Н. Беспалова // Журнал акушерства и женских болезней. — 2007. — Т. LVI, вып. 1. — С. 81-96.
3. Гродницкая Е.Э. Роль нарушений обмена фолатов и гомоцистеина в развитии осложнений беременности / Е.Э. Гродницкая // Российский вестник акушера-гинеколога. — 2010. — № 4. — С. 20-24.
4. Запорожан В.Н. Приобретенные и генетические формы тромбофилий в патогенезе акушерской патологии / В.Н. Запорожан, В.И. Линников // Интегративная антропология. — 2006. — Т. 8, № 2. — С. 3-7.
5. Лоскутова Т.О. Генний поліморфізм залежно від ступеня тяжкості прееклампсії / Т.О. Лоскутова, К.В. Воронін // Медичні перспективи. — 2011. — Т. XVI, № 4. — С.1-5.
6. Пикаускайте Д.О. Популяционный и клинико-генетический анализ преэклампсии / Пикаускайте Д.О., Прытков А.Н., Козлова С.И. // Медицинская генетика. — 2006. — № 11. — С. 28-31.
7. Преэклампсия беременных: особенности патогенеза, тактики ведения / И.И. Иванов, М.В. Черипко, Н.В. Косолапова, Е.Н. Прочан // Таврический медико-биологический вестник. — 2012. — Т. 15, № 2. — Ч. 2(58). — С. 273-286.
8. Репина М.А. Преэклампсия и материнская смертность / М.А. Репина. — СПб.: Издательский дом СПбМАПО, 2005. — 208 с.
9. Сімрок В.В. L-аргінін в комплексній терапії плацентарної дисфункції у вагітних з преєклампсією на тлі гепатобіліарної патології / В.В. Сімрок, Т.Ф. Коряєва // Таврический медико-биологический вестник. — 2012. — Т. 15, № 2. — Ч. 2(58). — С. 276-279.
10. Common dihydrofolate reductase 19-base pair deletion allele: a novel risk factor for preterm delivery / [Johnson W.G., Scholl T.O., Spychala J.R. et al. // Am. J. Clin. Nutr. — 2005. — Vol. 81, № 3. — P. 664-668.
11. Khan S. Hereditary thrombophilia / S. Khan, J.D. Dickerman [Электронный ресурс] // Thrombosis Journal. — 2006. — Vol. 4, № 15. — Режим доступа: http://www.thrombosisjournal. com/content/4/1/15.
12. The role of angiogenic, anti-angiogenic and vasoactive factors in pre-eclamptic African women: early-versus late-onset pre-eclampsia / Govender L., Mackraj I., Gathiram P., Moodley J. // Cardiovasc J. Afr. — 2012. — Vol. 23, № 3. — P. 153-159.