Журнал «Медико-социальные проблемы семьи» 3-4 (том 17) 2012
Вернуться к номеру
Тактика ведення та ендохірургічне лікування доброякісних кістозних утворень яєчників у вагітних
Авторы: Носенко О.М., Васильєва Л.Л. - Донецький національний медичний університет ім. М. Горького
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Стаття присвячена підвищенню безпечності та ефективності тактики ведення вагітних із доброякісними кістозними утвореннями яєчників. На підставі вивчення особливостей перебігу гестаційного періоду та пологів, стану немовлят та частки утворень яєчників у вагітних при спостережній та хірургічній тактиці ведення, особливостей їх гормонального, оксидативного, нітрозативного гомеостазу і вираженості ендогенної інтоксикації розроблений патогенез негативного впливу утворень яєчників на перебіг гестаційного періоду, а також спостережна та ендохірургічна тактика ведення, що привело до зменшення ускладнень і випадків припинення вагітності в жінок із доброякісними кістозними утвореннями яєчників.
Статья посвящена повышению безопасности и эффективности тактики ведения беременных с доброкачественными кистозными образованиями яичников. На основании изучения особенностей течения гестационного периода и родов, состояния новорожденных и части образований яичников у беременных при наблюдательной и хирургической тактике ведения, особенностей их гормонального, оксидативного, нитрозативного гомеостаза и выраженности эндогенной интоксикации разработан патогенез негативного влияния образований яичников на течение гестационного периода, а также наблюдательная и эндохирургическая тактика ведения, что привело к уменьшению осложнений и случаев прерывания беременности у женщин с доброкачественными кистозными образованиями яичников.
The article deals with the increasing safety and effectiveness of management of pregnant women with benign ovarian cystic formations. On the basis of the studying of the peculiarities of gestational period and deliveries, state of newborns and cystic formations in pregnant women in supervisory and surgical management, the peculiarities of their hormonal, oxidative, nitrosattive homeostasis and the severity of endogenous intoxication there has been developed pathogenesis of negative impact of cystic formations on the course of gestational period, and supervisory and endosurgical management that led to the reduction of complications and cases of abortions in women with benign ovarian cystic formations.
Вагітність, доброякісні кістозні утворення яєчників, спостережна тактика ведення, ендохірургічне лікування, гормони жовтого тіла та плаценти, вільнорадикальне окислення, антиоксидант-ний захист, нітрозативний гомеостаз.
Беременность, доброкачественные кистозные образования яичников, наблюдательная тактика ведения, эндохирургическое лечение, гормоны желтого тела и плаценты, свободнорадикальное окисление, антиоксидантная защита, нитрозативный гомеостаз.
Pregnancy, benign ovarian cystic formations, supervisory management, endosurgical treatment, progesterones and placental hormones, free radical oxidation, antioxidant protection, nitrosative homeostasis.
Утворення яєчників реєструються під час вагітності, за даними різних авторів, в 1–4 % випадків [6, 7, 17, 18, 22]. Більшість цих утворень представлено кістами жовтих тіл вагітності, які зазвичай регресують до 16 тижнів вагітності [4, 10]. Серед найбільш часто персистуючих під час вагітності кістозних утворень яєчників (КУЯ) у 45–47,8 % випадків зустрічаються зрілі тератоми, у 7,6–28,6 % — муцинозні цистаденоми, у 4,3–22 % — серозні цистаденоми, у 9,1–21,4 % — функціональні кісти, у 7,1–18,2 % — ендометріоїдні і в 2,1–7,6 % — пара-оваріальні кісти. Від 2,1 до 23 % персистуючих під час вагітності кістозних утворень яєчників представлено злоякісними пухлинами [11].
До 50–70 % персистуючих під час вагітності утворень яєчників не супроводжуються маніфестацією будь-яких клінічних симптомів [11, 13]. Ведення таких безсимптомних утворень яєчників залишається суперечливим [8, 12, 13]. Традиційно ці хворі піддавалися лапаротомії та видаленню пухлин у термін 16–20 тижнів вагітності. Хірургія запобігає таким ускладненням, як перекрут і розрив утворень, а також видаляє перешкоду у вигляді оваріального утворення для розродження через природні пологові шляхи [12, 16, 18]. У той же час хірургія оваріальних утворень під час вагітності може призводити до мимовільного переривання вагітності в ранньому терміні, передчасного розриву навколоплідних оболонок, передчасних пологів і перинатальної смертності [4, 19].
До теперішнього часу питання оперативного лікування вагітних із персистуючими утвореннями яєчників залишаються спірними, недостатньо чітко визначені доцільність проведення оперативного втручання, операційний доступ, термін вагітності, при якому оптимально проводити операцію [9]. Традиційним хірургічним доступом для лікування пухлин яєчників є лапаротомічний. Однак у зв’язку з розвитком нових технологій, широким впровадженням ендоскопічної техніки з’явилися повідомлення про використання лапароскопічного доступу при лікуванні вищевказаної патології під час вагітності [14, 21, 22]. Основними маловивченими проблемними питаннями лапароскопічних втручань є термін вагітності, під час якого доцільно проведення оперативного втручання, точки накладання троакарних портів, перебіг вагітності в післяопераційному періоді та стан новонароджених [9, 14, 16, 19, 21].
За результатами вивчення стану оксидативного гомеостазу при доброякісних кістозних утвореннях яєчників здійснюється накопичення продуктів вільнорадикального окислення (ВРО) на тлі зниження загальної антиокислювальної активності плазми (ЗАОА) і деяких компонентів антиоксидантної системи [3]. Надлишок вільних радикалів призводить до порушення синтезу ендотеліальною системою оксиду азоту та ендогенної інтоксикації [1], що під час вагітності може спричинити порушення гестації. Роботи, присвячені вивченню порушень оксидативного та нітрозативного гомеостазу і вираженості ендогенної інтоксикації при доброякісних кістозних утвореннях яєчників під час вагітності, у доступній нам літературі ми не знайшли, як і роботи, присвячені особливостям гормональної функції жовтого тіла та плаценти при даній патології.
Таким чином, дослідження, присвячене розробці тактики ведення, вивченню можливостей та ефективності надання їм малоінвазивної ендохірургічної допомоги, а також розробці післяопераційних реабілітаційних заходів, є актуальним.
Мета дослідження: підвищити безпечність та ефективність тактики ведення вагітних із добро-якісними кістозними утвореннями яєчників шляхом розробки та впровадження спостережної тактики, малоінвазивного ендохірургічного лікування та післяопераційної реабілітації.
Матеріал та методи
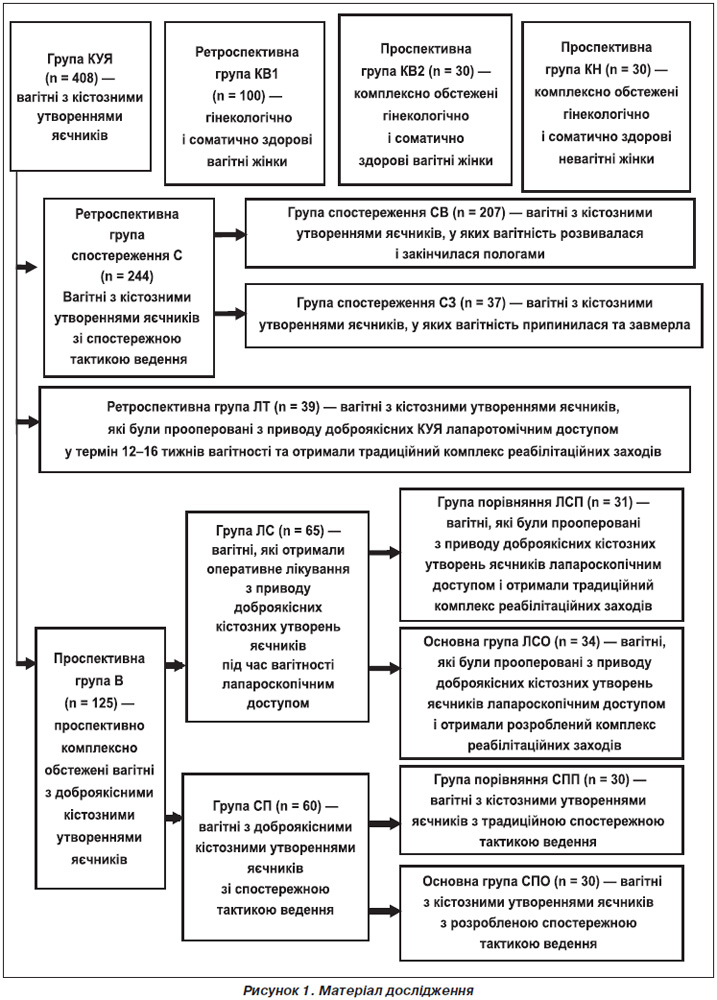
Було обстежено 568 пацієнток репродуктивного віку, з яких 408 вагітних із кістозними утвореннями яєчників і 160 жінок без таких (рис. 1).
Вивчено скарги, гінекологічний, акушерський, соматичний, алергологічний та інфекційний анамнез усіх жінок. Наявність больового синдрому оцінювали за візуально-аналоговою шкалою. Для виявлення екстрагенітальної патології жінки були консультовані суміжними спеціалістами.
Стан систем ВРО та антиоксидантного захисту (АОЗ) вивчали за допомогою фотометричних методів. Вміст у плазмі крові дієнових кон’югат (ДК) ненасичених жирних кислот досліджували методом Z. Placer (1966) у модифікації В.Б. Гаврилова (1983), рівень малонового діальдегіду (МДА) — за J.A. Knight (1988), перекисний гемоліз еритроцитів (ПГЕ) — за F.C. Tiager (1968). Резерви АОЗ крові оцінювали за показником загальної антиокислювальної активності (ЗАОА) плазми методом Г.І. Клебанова (1988). Визначення активності супероксиддисмутази (СОД) проводили за Fridovich у модифікації О.П. Макаревича (1983), активності каталази (Ка) у сироватці крові — методом М.А. Королюк (1988). Вміст сироваткового -токоферолу — методом J. Biery у модифікації Р.Ш. Кисилевич (1973). Концентрацію сумарних нітрит-аніонів (NO2–) визначали з використанням реакції з реактивом Гриста — Ілосвая. Вміст вільного L-аргініну в сироватці крові визначали класичним методом Сакагучі. Для оцінки вираженості ендогенної інтоксикації досліджували концентрацію молекул середньої маси (МСМ) скринінговим методом Н.І. Габріелян (1983) у модифікації А.Н. Ковалевського.
При інструментальному обстеженні жінок застосовували ультразвукове дослідження (УЗД) з допплерографією, лапароскопію.
Оперативне втручання проводили лапаротомічним і лапароскопічним доступом. При лапароскопії використовували техніку накладання чотирьох портів, біполярної різки та коагуляції тканин.
Операційний матеріал фіксували в 10% розчині нейтрального формаліну (рН 7,4). Парафінові зрізи забарвлювали гематоксиліном та еозином, вивчали за допомогою світлового мікроскопу Olympus BX-40.
Отримані дані були оброблені за допомогою IBM PC з використанням електронної таблиці Excel і методів аналітичної та варіаційної статистики.
Результати власних досліджень та їх обговорення
На першому етапі дослідження була проведена ретроспективна оцінка спостережної тактики ведення вагітних із кістозними утвореннями яєчників, для чого були проаналізовані амбулаторні карти, карти вагітних, історії пологів 244 вагітних групи С з кістозними утвореннями яєчників та 100 умовно гінекологічно та соматично здорових вагітних групи КВ1.
Термін звернення до лікаря з приводу даної вагітності вірогідно між групами С і КВ1 не відрізнявся і становив 5,78 ± 0,13 і 6,08 ± 00,23 тижня.
Кістозні утворення яєчників під час вагітності вірогідно частіше зустрічалися у жінок, які палять (56,15 %), мають несприятливий соматичний фон (20,08 %), нерегулярний менструальний цикл (17,21 %), пізній початок статевого життя (p < 0,003), оперативні втручання на придатках матки (9,43 %), урогенітальні інфекції або бактеріальний вагіноз в анамнезі (38,68 %), хронічний аднексит (28,28 %), полікістозні яєчники (14,81 %), кістозні утворення яєчників (12,70 %), зовнішньо-внутрішній ендометріоз (11,48 %), лейоміому матки (9,02 %).
Доброякісні кістозні утворення яєчників під час вагітності у 73,36 % випадків мали безсимптомний перебіг і виявлялися тільки при УЗД.
При спостереженні за 244 вагітними групи С встановлено, що у 15,16 % жінок плід завмер на різних строках вагітності (підгрупа СЗ) (p < 0,01), у 84,84 % вагітність продовжувала розвиватися (підгрупа СВ). При зіставленні клініко-анамнестичних даних груп СЗ і СВ не виявлено вірогідної різниці за середнім віком, характером репродуктивного анамнезу за розподілом і середньою кількістю пологів, мимовільних абортів, паритетом даної вагітності. Але в підгрупі СЗ в 3,50 раза частіше зустрічалися захворювання шлунково-кишкового тракту (p < 0,02) і в 1,53 — штучні аборти в анамнезі (56,76 проти 37,20 %, p < 0,03).
Кожна друга вагітна як у підгрупі СЗ, так і в підгрупі СВ мала кістозне утворення яєчника ≥ 6 см. Кількість вагітних з рівнем прогестерону нижче за норму відповідно до терміну вагітності в групі СЗ була більше за таку в СВ в 2,15 раза (p < 0,01). Сироватковий рівень СА 125 після виявлення кістозного утворення також не мав вірогідної різниці — 26,78 ± 2,56 Од/мл проти 24,34 ± 1,49 Од/мл.
Термін припинення вагітності у підгрупі СЗ варіював від 5 до 28 і в середньому становив 9,30 ± 0,93 тижня. Більша частина вагітностей (86,49 %) завмерла в термін до 12 тижнів. Після встановлення припинення вагітності у 94,59 % був проведений штучний аборт, у 5,41 % — штучні пологи за медичними показниками, в одному випадку — шляхом кесаревого розтину. Протягом 2 місяців після завершення вагітності у пацієнток підгрупи СЗ у 35,14 % випадків настав регрес кістозних утворень яєчників. За даними попередніх проведених УЗД і враховуючи повний регрес після припинення вагітності, ці утворення були розцінені як кісти жовтого тіла. 64,86 % пацієнток підгрупи СЗ після завершення вагітності були прооперовані з приводу кістозних утворень яєчників, з яких у 29,73 % жінок гістологічно були підтверджені ендометріоми, у 5,41 % — кісти без епітеліального вистилання, у 16,22 % — зрілі кістозні тератоми, у 5,41 % — муцинозні цистаденоми, у 8,11 % — серозні цистаденоми.
Таке ускладнення, як загроза переривання вагітності, зустрічалося в жінок групи С в 17,22 раза (р < 0,01) і підгрупи СВ в 11,36 (р < 0,01) частіше, ніж у групі КВ1, плацентарна дисфункція — відповідно в 9,56 (р < 0,01) і в 5,31 (р < 0,01).
Термін вагітності під час пологів становив у групі С 38,52 ± 0,12 тижня, СВ — 38,63 ± 0,11 тижня, КВ1 — 38,77 ± 0,13 тижня і вірогідно між групами не відрізнявся. Не існувало вірогідних розбіжностей за частотою термінових, передчасних, запізнілих, нормальних та ускладнених пологів, за оцінкою новонароджених за шкалою Апгар та її розподілом, кількістю випадків перинатальних втрат та вроджених вад розвитку, але новонароджені від матерів із кістозними утвореннями яєчників мали вірогідно меншу масу тіла при народженні в 1,04 раза (p < 0,02); 5,26 % (p < 0,02) немовлят — масу нижче за 2500 г; кількість новонароджених масою понад 4000 г реєструвалася рідше в 3,83 (p < 0,01) раза.
У групі СВ у 49,59 % вагітних під час гестаційного періоду спостерігався регрес кісти яєчника, у 9,02 % випадках було виконано хірургічне видалення кістозного утворення яєчника під час вагітності, у 10,25 % — хірургічне видалення під час кесаревого розтину, а у 16,39 % жінок спостерігалася персистенція утворення після пологів. Серед 49,59 % вагітних, у яких під час гестаційного періоду спостерігався регрес кісти яєчника, у 84,30 % випадках він відбувся в термін до 12 тижнів вагітності, у 15,70 % — після 12 тижнів; враховуючі дані УЗД, ці кістозні утворення були розцінені як кісти жовтого тіла.
Серед 9,02 % вагітних групи С, яким було виконано видалення утворення яєчника під час вагітності, показниками для операції були: розрив утворення у 1,23 % випадків; перекрут — у 4,92 %; ріст та великі розміри — у 0,82 % (серозна цистаденома діаметром 16 см і муцинозна цистаденома діаметром 20 см); підозра на малігнізацію внаслідок комплексної, багатокамерної структури з потовщеними перетинками за даними УЗД і рівня онкомаркерів, вищих за референсні показники, — у 2,05 % (в 1 випадку — ендометріома яєчника, в 1 — зріла кістозна тератома, в 1 — муцинозна цистаденома, у 2 — аденокарцинома яєчника).
Взагалі в групі вагітних групи С, яким була обрана спостережна тактика ведення, але виконано хірургічне видалення кістозного утворення яєчника під час вагітності, переважну більшість утворень становили зрілі кістозні тератоми (27,27 %) та муцинозні цистаденоми (18,18 %).
Серед 10,25 % вагітних групи С, яким було виконано хірургічне видалення кістозного утворення яєчника під час кесаревого розтину, показниками для оперативного розродження були акушерські фактори: слабкість пологової діяльності — у 44,00 % випадках; аномалії передлежання плода — у 28,00 %; дистрес плода — у 28,00 %. У цій групі переважну більшість утворень становили кісти без епітеліального вистилання (32,00 %), зрілі кістозні тератоми (24,00 %) та ендометріоїдні кісти (8,00 %).
Серед 16,39 % вагітних групи С, яким було виконано хірургічне видалення кістозного утворення яєчника після пологів, за даними гістологічного дослідження, переважали серозні цистаденоми (20,51 %) та зрілі кістозні тератоми (20,51 %). З серозних цистаденом у 7,50 % утворення були з наявністю папілярних розростань, у 5,00 % були представлені проліферувальними цистаденомами.
Вірогідно найменший середній діаметр кістозного утворення яєчників спостерігався в підгрупі з персистенцією утворення протягом вагітності і хірургією після пологів (4,86 ± 0,13 см), найбільший — у підгрупі вагітних із хірургією кістозних утворень яєчників під час вагітності (8,86 ± 0,75 см). 95,45 % вагітних у підгрупі з хірургією кістозних утворень яєчників під час вагітності мали діаметр кістозного утворення ≥ 6 см, тоді як у підгрупі з хірургією після пологів — 12,82 %.
Кількість вагітних із рівнем сироваткового прогестерону нижче за норму відповідно до терміну вагітності була більша в підгрупі із завмерлою вагітністю (89,19 %) і перевищувала таку в підгрупі з хірургією під час вагітності — в 1,78 раза (p < 0,01), у підгрупі з хірургією кістозних утворень яєчників під час кесаревого розтину — у 2,03 (p < 0,01), у підгрупі з хірургією після пологів — в 1,83 (p < 0,01), у підгрупі з регресом кістозних утворень яєчників під час вагітності — у 2,40 (p < 0,01).
На другому етапі дослідження було проведене порівняння результатів оперативного лікування кістозних утворень яєчників під час вагітності лапароскопічним і лапаротомічним доступом.
Вік вагітних із доброякісними кістозними утвореннями яєчників групи ЛТ у середньому становив 26,03 ± 0,39 року, групи ЛСП — 25,68 ± 0,64 року, у контролі — 25,77 ± 0,69 року (p > 0,05). Больовий синдром відмічався у 62,16 % вагітних групи ЛТ і у 51,61 % групи ЛСП, відповідно у 37,84 і 48,39 % доброякісні кістозні утворення яєчників мали безсимптомний перебіг.
Термін виявлення кістозного утворення під час вагітності становив у групі ЛТ 7,49 ± 0,33 тижня, ЛСП — 7,29 ± 0,33 тижня (p > 0,05). Термін оперативного втручання варіював від 12 до 16 тижнів вагітності, також між досліджуваними групами не відрізнявся і становив у групі ЛТ 13,14 ± 0,17 тижня, ЛСП — 13,52 ± ± 0,21 тижня. Хірургічне лікування в плановому порядку в групі ЛТ було виконано у 81,08 % вагітних, в ургентному — у 18,92 %, у групі ЛСП — відповідно у 74,19 % (p > 0,05) і 25,81 % (p > 0,05). Основними показаннями в обох групах були: підозра на малігнізацію внаслідок комплексної або багатокамерної структури з потовщеними перегородками за даними УЗД або підвищений рівень СА 125, а також перекрут утворення. Середній максимальний діаметр прооперованих кістозних утворень у групі ЛТ становив 9,19 ± 0,94 см, ЛСП — 8,84 ± 0,91 см (p > 0,05). Найбільшу кількість прооперованих утворень в обох групах становили кістоми.
Середня тривалість операції при лапаротомічному доступі перевищувала таку при лапароскопічному в 1,57 раза (p < 0,01), середній об’єм крововтрати — у 3,94 раза (p < 0,01). У групі ЛТ порівняно з ЛСП в першу добу післяопераційного періоду вагітні відмічали біль у ділянці післяопераційних швів сильніший у 2,76 раза (p < 0,01), на третю — у 4,06 (p < 0,01), на сьому — у 6,29 (p < 0,01).
Після видалення кістозних утворень яєчників вагітність продовжувала розвиватися до терміну пологів у 86,49 % випадках у групі ЛТ і у 87,10 % — у групі ЛСП (p > 0,05), припинилася відповідно у 13,51 і у 12,90 % жінок (p > 0,05).
Після видалення доброякісних кістозних утворень яєчників під час вагітності лапаротомічним і лапаро-скопічним доступом не існувало вірогідної різниці за частотою таких ускладнень гестаційного періоду, як загроза переривання вагітності, кольпіт, анемія, багатоводдя, плацентарна дисфункція, затримка росту плода, набряки, артеріальна гіпертензія та прееклампсія; за паритетом і характером пологів; за масою та оцінкою новонароджених за шкалою Апгар на 5-й хвилині. Але перебіг гестаційного періоду у прооперованих вагітних із приводу кістозних утворень яєчників та умовно здорових вагітних відрізнявся більшою частотою загрози переривання вагітності в жінок, прооперованих як лапаротомічним доступом у 9,74 раза (р < 0,01), так і лапароскопічним — у 10,65 (р < 0,01), частотою плацентарної дисфункції — відповідно в 8,93 (р < 0,01) і 8,65 (р < 0,01) раза.
На третьому етапі дослідження було проспективно обстежено 125 вагітних із доброякісними кістозними утвореннями яєчників групи В, з яких 65 вагітних групи ЛС були прооперовані лапароскопічним доступом і 60 вагітним групи СП проводилася спостережна тактика ведення. Контролем були 30 умовно гінекологічно і соматично здорових вагітних групи КВ2 і 30 умовно гінекологічно і соматично здорових невагітних жінок репродуктивного віку КН. Усім жінкам проведено дослідження рівнів деяких гормонів жовтого тіла та плаценти, оксидативного і нітрозативного гомеостазу в термін 7–8 тижнів вагітності. Розроблений патогенез акушерських ускладнень при вагітності на тлі доброякісних кістозних утворень яєчників і тактика спостереження вагітних із кістами жовтого тіла та комплекс післяопераційної реабілітації вагітних, прооперованих лапароскопічним доступом із приводу кістозних утворень яєчників.
Середній рівень сироваткового прогестерону у вагітних із доброякісними кістозними утвореннями яєчників був нижчий порівняно з групою КВ2 в 1,17 раза (р < 0,01), вільного естріолу — в 1,18 (р < 0,01), хоріонічного гонадотропіну — в 1,20 (р < 0,01), плацентарного лактогену — в 1,18 (р < 0,01). 41,60 % вагітних із доброякісними кістозними утвореннями яєчників у термін 7–8 тижнів вагітності мали рівень сироваткового прогестерону нижчий за референсну межу відповідного терміну вагітності (р < 0,01), 45,60 % — у межах референсного інтервалу (р < 0,01), 12,80 % — вищий за референсну межу (р < 0,04).
Як відомо, фізіологічна вагітність супроводжується помірною інтенсифікацією ВРО (В.К. Чайка, Е.В. Литвинова, 2006), що підтвердили отримані нами дані: на 7–8-му тижні вагітності середній рівень ДК ненасичених жирних кислот у групі КВ2 перевищував такий у групі КН в 1,07 раза (p < 0,01), МДА в еритроцитах крові — в 1,23 (p < 0,01), ПГЕ — в 1,06 (p > 0,05).
У вагітних групи В з доброякісними кістозними утвореннями яєчників у термін 7–8 тижнів вагітності виявлено накопичення продуктів ВРО порівняно з вагітними групи КВ2: збільшення середнього рівня ДК в 1,19 раза (p < 0,01), МДА — в 1,33 (p < 0,01), що приводило до посилення ПГЕ в 1,23 раза (p < 0,01), у тому числі: у групі ЛС — ДК в 1,20 раза (p < 0,01), МДА — в 1,37 (p < 0,01), ПГЕ — у 1,26 (p < 0,01); у групі СП — ДК в 1,17 раза (p < 0,01), МДА — в 1,29 (p < 0,01), ПГЕ — у 1,20 (p < 0,02).
При фізіологічній вагітності здійснюється активація ферментних та неферментних компонентів антиоксидантної системи, про що свідчило підвищення активності Ка плазми крові в групі КВ2 порівняно з групою КН в 1,07 раза (p < 0,04), активності СОД плазми крові — в 1,10 (p < 0,04), ЗАОА плазми крові — в 1,02 (p < 0,05), -токоферолу в сироватці крові — в 1,08 (p < 0,0003).
У вагітних із доброякісними кістозними утвореннями яєчників групи В у в термін 7–8 тижнів спостерігалося зниження активності досліджуваних показників АОС порівняно з вагітними групи КВ2: активності Ка — в 1,22 раза (p < 0,01), активності СОД — в 1,36 (p < 0,01), ЗАОА — в 1,17 (p < 0,01), вмісту a-токоферолу — в 1,17 (p < 0,01); у тому числі в групі ЛС — відповідно в 1,21 (p < 0,01), в 1,32 (p < 0,01), в 1,16 (p < 0,01) і в 1,18 раза (p < 0,01); у групі СП — в 1,23 (p < 0,01), в 1,39 (p < 0,01), в 1,18 (p < 0,01) і в 1,16 раза (p < 0,01).
При фізіологічній вагітності в термін 7–8 тижнів відмічали підвищення продукції L-аргініну в 1,56 раза (p < 0,01) та нітрит-аніонів (NO2–) в 1,25 (p < 0,01). Дослідження показників нітрозативного гомеостазу вагітних із кістозними утвореннями яєчників групи В у 7–8 тижнів вагітності порівняно з вагітними групи контролю КВ2 виявило зниження продукції L-аргініну в 1,21 раза (p < 0,01) і нітрит-аніонів — в 1,36 (p < 0,01); у тому числі в групі ЛС — відповідно в 1,22 (p < 0,01) і 1,34 раза (p < 0,01); у групі СП — в 1,21 (p < 0,01) і 1,09 (p < 0,01).
При фізіологічній вагітності спостерігалося вірогідне збільшення всіх досліджуваних фракцій МСМ порівняно з невагітними жінками: МСМ 238 нм — в 1,05; МСМ 254 нм — в 1,05; МСМ 260 нм — в 1,07; МСМ 280 нм — в 1,09 раза. У вагітних групи В з доброякісними кістозними утвореннями яєчників у термін 7–8 тижнів вагітності порівняно з групою КВ2 виявлено вірогідне підвищення продукції МСМ 238 нм — в 1,17 раза, МСМ 254 нм — в 1,20, МСМ 260 нм — в 1,12, МСМ 280 нм — в 1,24; у тому числі в групі ЛС: МСМ 238 нм — в 1,20 раза, МСМ 254 нм — в 1,22, МСМ 260 нм — в 1,15, МСМ 280 нм — в 1,27; у групі СП : МСМ 238 нм — в 1,14 раза, МСМ 254 нм — в 1,19, МСМ 260 нм — в 1,08, МСМ 280 нм — в 1,21.
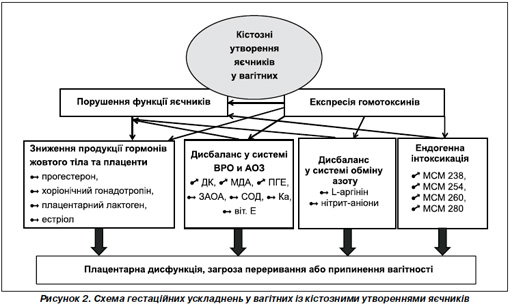
Таким чином, у вагітних із кістозними утвореннями яєчників гестаційний період перебігає на тлі зниження продукції гормонів жовтого тіла та плаценти, накопичення продуктів ВРО, зниження продукції ферментних і неферментних антиоксидантів, зменшення ЗАОА плазми крові, зниження продукції L-аргініну і нітрит-аніону, що супроводжуються розвитком ендогенного токсикозу. Ендогенний токсикоз у вагітної може призводити до плацентарної дисфункції, загрози переривання або припинення вагітності (рис. 2).
Для профілактики гестаційних ускладнень у вагітних із доброякісними кістозними утвореннями яєчників нами був розроблений спосіб спостережної тактики ведення та післяопераційної реабілітації вагітних із доброякісними кістозними утвореннями яєчників, що включав мембранний плазмаферез, препарати L-аргініну, вітамін Е, препарати мікронізованого прогестерону.
Лікувальний ефект плазмаферезу обумовлений: видаленням із кровоносного русла токсичних речовин, автоантитіл, імунних комплексів, продуктів метаболізму; підвищенням функціональної активності і зміною життєдіяльності кровотворних, стромальних, імунокомпетентних клітин; деблокуванням фагоцитарної системи; поліпшенням мікроциркуляції.
Стан внутрішньоутробного плода та новонародженого знаходяться в лінійній залежності від умісту аргініну в сироватці крові [2], а дефіцит оксиду азоту призводить до вазоконстрикції, порушень плацентарно-плодового кровотоку та зниження функціональних можливостей плаценти. Збереження оптимального рівня синтезу NO може при вагітності нівелювати клінічні прояви плацентарної дисфункції та перешкоджати розвитку затримки росту плода. Тому для корекції дефіциту азоту у своїй роботі ми використовували L-аргінін, який забезпечує організм «будівельним матеріалом» (субстратом) для синтезу оксиду азоту. Крім того, за даними А. Takasaki et al. (2009) [15], L-аргінін і вітамін Е поліпшують функцію жовтого тіла, зменшуючи опір припливу крові в жовте тіло. Кровотік у жовтому тілі є найважливішим фактором для лютеїнової функції і збереження вагітності. Вітамін Е поліпшує капілярний кровотік шляхом інгібування розпаду ліпідів мембран еритроцитів та внаслідок захисту ендотелію від окислювального стресу (Н. Tamura et al., 2011 [5]).
Препарати мікронізованого прогестерону зменшують збудливість та скоротливість мускулатури матки (V. Tomic, et al., 2011 [20]), а також мають імуномодулюючі, андроген- та естрогенконтролюючі, анксіолітичні, антиальдостеронові ефекти, що сприяє розвитку вагітності.
На четвертому етапі дослідження були проаналізовані результати впровадження розробленої спостережної та ендохірургічної тактики ведення вагітних із доброякісними кістозними утвореннями яєчників.
Було оцінено рівень сироваткового прогестерону, вільного естріолу, хоріонічного гонадотропіну і плацентарного лактогену в динаміці гестаційного періоду у жінок із доброякісними кістозними утвореннями яєчників залежно від тактики ведення в термін 7–8, 11–12 і 15–16 тижнів вагітності.
При вивченні рівнів сироваткового прогестерону встановлено, що у групах ЛСО і ЛСП, де вагітні не отримували препарати мікронізованого прогестерону до проведення оперативного втручання, його середній рівень був нижчий за такий у групі КВ2 у 7–8 тижнів вагітності відповідно у 1,19 (рлсо-кв2 < 0,01) і 1,22 раза (рлсп-кв2 < 0,01) і в 11–12 тижнів — у 1,11 (рлсо-кв2 < 0,01) і 1,11 раза (рлсп-кв2 < 0,01). У групі ЛСО вагітні за наявності зниженого рівня сироваткового прогестерону після оперативного втручання приймали препарати мікронізованого прогестерону, внаслідок чого середній рівень сироваткового прогестерону у 15–16 тижнів вагітності в цій групі вірогідно не відрізнявся від такого в групі контролю КВ2. У групі ЛСП вагітні не отримували препарати мікронізованого прогестерону після проведення оперативного втручання, тому в 15–16 тижнів вагітності середній рівень сироваткового прогестерону в цій групі був нижчий порівняно з групою КВ2 в 1,05 (рлсп-кв2 < 0,01) і ЛСО — в 1,05 (рлсп-лсо < 0,02) раза.
Кількість жінок із рівнем сироваткового прогестерону нижче за референсну межу відповідного терміну вагітності у групі ЛСО і ЛСП у термін 7–8 і 11–12 тижнів вірогідно не змінилася; у термін 15–16 тижнів у групі ЛСО знизилася у 8,00 раза (рд < 0,01), у групі ЛСП — в 1,17 (рд > 0,05) і була в групі ЛСО нижчою за таку в групі ЛСП в 6,58 (рлсп-лсо < 0,01) раза. Кількість жінок із рівнем сироваткового прогестерону в межах референсної норми відповідного терміну вагітності в групі ЛСО і ЛСП у термін 7–8 і 11–12 тижнів вірогідно не змінилася; у термін 15–16 тижнів у групі ЛСО підвищилася в 2,04 раза (рд < 0,01), у групі ЛСП — в 1,25 (рд < 0,05) і була в групі ЛСО вищою за таку в групі ЛСП в 1,70 раза (рлсп-лсо < 0,01).
У групі СПО жінки при встановленні зниженого рівня сироваткового прогестерону приймали препарати мікронізованого прогестерону, у групі СПП вагітні не отримували такі препарати, що привело до того, що середній рівень сироваткового прогестерону в 11–12 тижнів у групі СПО вірогідно не відрізнявся від конт-рольних значень, а у групі СПП був нижчий у 1,08 (рспп-кв2 < 0,01) раза: у 15–16 тижнів — у групі СПО вірогідно не відрізнявся від контрольних значень, а у групі СПП був нижчий в 1,04 раза (рспп-кв2 < 0,01). На 11–12-му тижні вагітності середній рівень сироваткового прогестерону в групі СПО був вищий порівняно з групою СПП в 1,10 раза (рспп-спо < 0,02), на 15–16-му тижні — в 1,05 (рспп-спо < 0,01).
Кількість жінок із рівнем сироваткового прогестерону нижче за референсну межу відповідного терміну вагітності в 11–12 тижнів в групі СПО знизилася в 3,00 раза (рд < 0,02), у групі СПП — в 1,11 (рд > 0,05) і була в групі СПО нижчою за таку в групі СПП в 2,25 раза (рспп-спо < 0,01); у 15–16 тижнів у групі СПО зменшилася в 12,01 раза (рд < 0,01), у групі СПП — в 1,25 (рд > 0,05) і була у групі СПО нижчою за таку в групі СПП в 8,01 раза (рспп-спо < 0,02).
Кількість жінок із рівнем сироваткового прогестерону в межах референсної норми відповідного терміну вагітності в 11–12 тижнів у групі СПО підвищилася в 1,67 раза (рд < 0,04), у групі СПП — в 1,07 (рд > 0,05) і була в групі СПО більша за таку в групі СПП в 1,25 (рспп-спо < 0,01) раза; у 15–16 тижнів у групі СПО стала більшою в 1,92 раза (рд < 0,01), у групі СПП — в 1,13 (рд > 0,05) і була у групі СПО більшою за таку в групі СПП в 1,35 раза (рспп-спо > 0,05).
При аналізі продукції хоріонічного гонадотропіну було встановлено, що у групах ЛСО і ЛСП у 7–8 тижнів вагітності його середній рівень був нижчий порівняно з групою КВ2 відповідно в 1,22 (рлсо-кв2 < 0,02) і 1,25 (рлсп-кв2 < 0,01) раза й в 11–12 тижнів — у 1,42 (рлсо-кв2 < 0,01) і 1,46 (рлсп-кв2 < 0,01). У 15–16 тижнів вагітності у групі ЛСО рівень хоріонічного гонадотропіну вірогідно не відрізнявся від такого в групі контролю КВ2; у групі ЛСП був нижчий порівняно з групою КВ2 в 1,35 (рлсп-кв2 < 0,01) і ЛСО — в 1,26 (рлсп-лсо < 0,01) раза.
Середній рівень хоріонічного гонадотропіну в 7–8 тижнів вагітності у групах СПО і СПП був нижчим, ніж у групі КВ2, відповідно у 1,17 (рлсо-кв2 < 0,05) і 1,16 раза (рлсп-кв2 < 0,05), в 11–12 тижнів у групі СПО вірогідно не відрізнявся від контрольних значень, а у групі СПП був нижчий у 1,08 раза (рспп-кв2 < 0,01): у 15–16 тижнів — у групі СПО вірогідно не відрізнявся від конт-рольних значень, а у групі СПП був нижчий у 1,25 раза (рспп-кв2 < 0,01). У 11–12 тижнів вагітності середній рівень хоріонічного гонадотропіну у групі СПО був вищий порівняно з групою СПП в 1,18 раза (рспп-спо < 0,04), у 15–16 тижнів — в 1,21 (рспп-спо < 0,02).
Дослідження вмісту в сироватці крові вільного естріолу показало, що у групах ЛСО і ЛСП середній його рівень був нижчий від групи КВ2 у 7–8 тижнів вагітності відповідно у 1,18 (рлсо-кв2 < 0,02) і 1,23 раза (рлсп-кв2 < 0,01) і в 11–12 тижнів — у 1,20 (рлсо-кв2 < 0,01) і 1,22 (рлсп-кв2 < 0,01). У 15–16 тижнів вагітності у групі ЛСО рівень сироваткового вільного естріолу вірогідно не відрізнявся від такого в групі КВ2; а у групі ЛСП був нижчим порівняно з групою КВ2 в 1,42 раза (рлсп-кв2 < 0,01) і з групою ЛСО — в 1,32 (рлсп-лсо < 0,01).
Середній рівень вільного естріолу в 7–8 тижнів вагітності у групах СПО і СПП був нижчий від групи КВ2 відповідно в 1,17 (рлсо-кв2 < 0,04) і 1,16 раза (рлсп-кв2 < 0,04), в 11–12 — у групі СПО вірогідно не відрізнявся від контрольних значень, а у групі СПП був нижчий у 1,18 раза (рспп-кв2 < 0,03): у 15–16 тижнів — у групі СПО не відрізнявся від контролю, а у групі СПП був нижчий у 1,38 раза (рспп-кв2 < 0,01). У 11–12 тижнів середній рівень вільного естріолу у групі СПО був вищим, ніж у групі СПП, в 1,15 (рспп-спо < 0,03), у 15–16 — в 1,24 раза (рспп-спо < 0,01).
При аналізі вмісту сироваткового плацентарного лактогену виявлено, що у групах ЛСО і ЛСП його середній рівень був нижчий порівняно з групою КВ2 у 7–8 тижнів відповідно у 1,18 (рлсо-кв2 < 0,02) і 1,15 раза (рлсп-кв2 < 0,01) і в 11–12 тижнів — у 1,28 (рлсо-кв2 < 0,01) і 1,26 (рлсп-кв2 < 0,01). У 15–16 тижнів вагітності в групі ЛСО рівень плацентарного лактогену вірогідно не відрізнявся від такого в групі КВ2; у групі ЛСП був нижчий порівняно з групою КВ2 в 1,42 (рлсп-кв2 < 0,01) і з групою ЛСО — в 1,20 раза (рлсп-лсо < 0,01).
Середній рівень сироваткового плацентарного лактогену в 7–8 тижнів вагітності у групах СПО і СПП був нижчим, ніж у групі КВ2, відповідно у 1,17 (рлсо-кв2 < 0,03) і 1,16 раза (рлсп-кв2 < 0,04), в 11–12 — у групі СПО вірогідно не відрізнявся від контрольних значень, а у групі СПП був нижчий у 1,21 раза (рспп-кв2 < 0,01): у 15–16 тижнів — у групі СПО вірогідно не відрізнявся від контрольних значень, а у групі СПП був нижчий у 1,38 (рспп-кв2 < 0,01) раза. У 11–12 тижнів вагітності середній рівень плацентарного лактогену в групі СПО був вищий порівняно з групою СПП в 1,15 раза (рспп-спо < 0,03), у 15–16 тижнів — в 1,24 (рспп-спо < 0,01).
Встановлено, що проведення розробленого комплексу післяопераційної реабілітації у вагітних після видалення кістозного утворення зменшило порівняно з традиційним середній рівень ДК в 1,05 раза (р < 0,05), МДА — в 1,21 (р < 0,01), ПГЕ — в 1,09 (р < 0,04); підвищило активність Ка в 1,17 раза (р < 0,01), активність СОД — в 1,16 (р < 0,02), ЗАОА плазми крові — в 1,05 (р < 0,04), вміст a-токоферолу — в 1,13 раза (р < 0,01), продукцію L-аргініну — в 1,17 (р < 0,01), нітрит-аніону (NO2–) — в 1,30 (р < 0,01); знизило вміст МСМ 238 нм в 1,10 раза (р < 0,01), МСМ 254 нм — в 1,12 (р < 0,02), МСМ 260 нм — в 1,11 (р < 0,02), МСМ 280 нм — в 1,08 (р < 0,03).
Проведення розробленої спостережної тактики ведення у вагітних з кістами жовтого тіла зменшило, порівняно з традиційною, середній рівень ДК в 1,05 раза (р < 0,02), МДА — в 1,28 (р < 0,01), ПГЕ — у 1,15 (р < 0,05); підвищило середній рівень активності Ка в 1,16 раза (р < 0,01), активність СОД — в 1,21 (р < 0,06), ЗАОА плазми крові — в 1,07 (р < 0,03), вміст a-токоферолу — у 1,13 (р < 0,01), продукцію L-аргініну — в 1,16 (р < 0,01), нітрит-аніону (NO2–) — у 1,41 (р < 0,01); знизило вміст МСМ 238 нм в 1,12 раза (р < 0,01), МСМ 254 нм — в 1,11 (р < 0,01), МСМ 260 нм — в 1,12 (р < 0,01), МСМ 280 нм — у 1,22 (р < 0,01).
Аналіз перебігу гестаційного періоду у прооперованих вагітних показав, що в 100,00 % випадків у групі ЛСО і у 87,10 % у групі ЛСП вагітність продовжувала після операції розвиватися до терміну пологів (p < 0,04), а у 12,90 % жінок у групі ЛСП вагітність завмерла в термін від 17 до 22 тижнів (p < 0,04). Середній термін припинення вагітності у групі ЛСП становив 18,75 ± 0,40 тижня, середній термін між проведенням оперативного втручання та припиненням вагітності — 5,50 ± 0,56 тижнів.
Серед вагітних із кістами жовтого тіла у 100,00 % випадків у групі СПО і у 86,87 % у групі СПП вагітність продовжувала розвиватися до терміну пологів (p < 0,04), а у 13,33 % жінок у групі СПП вагітність завмерла в термін від 8 до 14 тижнів (p < 0,04). Середній термін припинення вагітності в групі СПП становив 11,50 ± 0,35 тижня.
За частотою гестаційних ускладнень, таких як кольпіт, анемія, багатоводдя, затримка росту плода, набряки, артеріальна гіпертензія та прееклампсія групи ЛСО і ЛСП, СПО і СПП були однорідні. Загроза переривання вагітності в групі ЛСО зустрічалася рідше, ніж у групі ЛСП, у 3,57 раза (pлсо-лсп < 0,01), у групі СПО — ніж СПП, у 2,40 (pспо-спп < 0,05), плацентарна дисфункція — відповідно у 3,29 (pлсо-лсп < 0,04) і 3,33 раза (pспо-спп < 0,03).
Термін вагітності під час пологів становив: у групі ЛСО — 38,71 ± 0,31 тижня, ЛСП — 38,89 ± 0,18, СПО — 38,63 ± 0,34, СПП — 38,81 ± 0,17, КВ2 — 38,73 ± 0,17 і вірогідно між групами не відрізнявся. Не зареєстровано вірогідних розбіжностей між досліджуваними групами за частотою термінових, передчасних, запізнілих, нормальних та ускладнених пологів. Розподіл факторів, які ускладнювали пологи в обстежених жінок, також був гомогенним.
Новонароджені групи ЛСО мали більшу масу тіла порівняно з групою ЛСП в 1,10 раза (p < 0,03), у групі СПО — порівняно з групою СПП — в 1,13 (p < 0,01). У групі СПП у 19,23 % породіль немовлята мали масу тіла менше за 2500 кг, тоді як у групі СПО таких дітей не було (p < 0,02). Новонароджені від матерів груп ЛСО, ЛСП, СПО, СПП і КВ2 за оцінкою шкали Апгар на 5-й хвилині та її розподілом, кількістю випадків перинатальних втрат та вроджених вад розвитку вірогідно не відрізнялися.
Висновки
1. Спостереження є життєздатним варіантом тактики ведення безсимптомних, доброякісних кістозних утворень яєчників у вагітних без ознак злоякісності, відзначених при ультразвуковому дослідженні та вимірюванні сироваткових онкомаркерів. Для вагітних із комплексними утвореннями яєчників із ризиком злоякісності, розмірами до 6 см і нормальними рівнями онкомаркерів у динаміці також може бути запропонована спостережна тактика ведення як прийнятний варіант до проведення хірургічного видалення утворення під час кесаревого розтину або після пологів.
2. Рішення про те, щоб відкласти хірургічне лікування комплексного утворення яєчників до моменту пологів або після пологів, повинно базуватися на балансі ризиків і вигод, оцінці ризику озлоякіснення проти непотрібного хірургічного ризику для матері та плода. Вагітні, відібрані для спостереження повинні бути проконсультовані про можливість розвитку перекруту, розриву утворень яєчників, потенційну потребу в хірургії наприкінці вагітності, а також про потенційну затримку в діагностиці злоякісних новоутворень, а також про те, що передпологові операції можуть виявитися необхідними у випадку появи симптоматики або особливих змін утворень із часом.
3. Для вагітних, у яких хірургічне лікування є виправданим, враховуючи переваги, які має лапаро-скопія порівняно з лапаротомією щодо інвазивності, післяопераційного болю, перебування в стаціонарі, ризику інфікування й часу на відновлення, лапаро-скопічний доступ слід вважати переважним і доцільним при наявності відповідних кваліфікаційних навичок та підготовки операційної бригади.
4. Час проведення планового оперативного втручання з приводу кістозних утворень яєчників при вагітності визначається терміном формування основ-них систем і органів плода; терміном формування плаценти, яка бере на себе основне ендокринно-метаболічне навантаження по збереженню вагітності замість жовтого тіла яєчника; розмірами вагітної матки і можливістю здійснення лапароскопічного доступу; наявністю даних обстеження, які свідчать про високий ризик озлоякіснення. Оптимальний термін для проведення планового оперативного втручання з приводу кістозних утворень яєчників під час вагітності лапароскопічним доступом — 12–14 тижнів вагітності.
5. Після виявлення у вагітних кіст жовтого тіла й безпосередньо після видалення кістозних утворень яєчників під час вагітності доцільно призначати для корекції оксидативного та нітрозативного гомеостазу, зниження ендогенної інтоксикації та поліпшення функції плаценти курсу з 3–5 сеансів безперервного фільтраційного плазмаферезу з перервами між сеансами в 2 дні; введення імуноглобуліну людини нормального один раз на 3 дні на курс 3 внутрішньом’язові ін’єкції; прийом per os 4,2% розчину L-аргініну по 25 мл 3 раза на день 20 днів; a-токоферолу ацетату в капсулах по 0,2 г 1 раз на добу 20 днів; при зниженому рівні сироваткового прогестерону — препарати натурального мікронізованого прогестерону по 100 мг вагінально тричі на добу до нормалізації рівня прогестерону і/або зникнення симптомів загрози переривання вагітності.
1. Головченко Ю.И. Обзор современных представлений об эндотелиальной дисфункции / Ю.И. Головченко, М.А. Трещинская [Электронный ресурс] // Режим доступа: http://www.tivortin.com/publications.php?view=10.
2. Дубоссарская З.М. Тивортин: на страже здоровья матери и ребенка / З.М. Дубоссарская, Н.С. Луценко, О.В. Грищенко // Здоров’я України. Тематичний випуск. Акушерство. Гинекология. Репродуктология. — 2011. — № 3. — С. 55.
3. Носенко О.М. Стан вільнорадикального та антиоксидантного захисту і виразність ендогенної інтоксикації у пацієнток кістозними доброякісними пухлинами і пухлиноподібними утвореннями яєчників / О.М. Носенко // Медико-соціальні проблеми сім’ї. — 2005. — Т. 10, № 2. — С. 52-64.
4. Adnexal Masses in Pregnancy / R.H.M. Hermans, D.-C. Fi-scher, H.W.H.M. van der Putten et al. // Oncologie. — 2003. — Vol. 26. — P. 167-172.
5. Changes in blood-flow impedance of the human corpus luteum throughout the luteal phase and during early pregnancy / Tamura H., Takasaki A., Taniguchi K. et al. // Fertil Steril. — 2008. — Vol. 90, № 6. — Р. 2334-2339.
6. Chiang G. Imaging of adnexal masses in Pregnancy / Chiang G., Levine D. // J. Ultrasound Med. — 2004. — Vol. 23. — P. 805-819.
7. Chittacharoen A. Adnexal masses in pregnancy / A. Chittacharoen, A.Wangpusayavisut, P. O-Prasertsawat // J. Med. Assoc. Thai. — 2005. — Vol. 88, Suppl. 2. — P. 37-40.
8. Glanc P. Adnexal masses in pregnant patient: a diagnostic and management challenge / P. Glanc, S. Salem, D. Farine // Ultrasound Q. — 2008. — Vol. 24. — P. 225-240.
9. Kilpatrick C.C. Approach to the acute abdomen in pregnancy / C.C. Kilpatrick, M. Monga // Obstet. Gynecol. Clin. North. Am. — 2007. — Vol. 34, № 3. — P. 389-402.
10. Ko Ma-Lee. Laparoscopic management of complicated adnexal masses in the first trimester of pregnancy / Ma-Lee Ko, T. Lai, S. Chen // Fertil. Steril. — 2009. — Vol. 92. — P. 283-287.
11. Laparoscopic management of ovarian cysts in pregnancy / Y. Lenglet, H. Roman, B. Robishong et al. // Gynecol. Obstet. Fertil. — 2006. — Vol. 34. — P. 101-106.
12. Laparoscopic management of pelvic mass in pregnancy / [Purnichescu V., Cheret-Benoist A., Von Theobald P. et al.] // J. Gynecol. Obstet. Biol. Reprod. (Paris). — 2006. — Vol. 35, № 4. — P. 388-395.
13. Laparoscopy during pregnancy: experience of the French university hospital of Clermont-Ferrand / Azuar A.S., Bouillet-Dejou L., Jardon K. et al. // Gynecol. Obstet. Fertil. — 2009. — Vol. 37, № 7–8. — P. 598-603.
14. Laparotomy versus laparoscopy for the treatment of adnexal masses during pregnancy / Koo Y.J., Kim H.J., Lim K.T. et al. // Aust. N. Z. J. Obstet. Gynaecol. — 2011. — Nov 17. doi: 10.1111/j.1479-828X.2011.01380.x.
15. Luteal blood flow and luteal function / Takasaki A., Tamura H., Taniguchi K. et al. // Ovarian Res. — 2009. — Vol. 4, 2, 1. Published online 2009 January 14. doi: 10.1186/1757-2215-2-1.
16. Risk analysis of torsion and malignancy for adnexal masses during pregnancy / C.F. Yen, S.L. Lin, W. Murk et al. // Fertil. Steril. — 2009. — Vol. 91, № 5. — P. 1895-1902.
17. Rosales Aujang E. Giant ovarian cyst and pregnancy. Case report and literature review / E. Rosales Aujang // Ginecol. Obstet. Mex. — 2011. — Vol. 79, № 4. — P. 235-238.
18. Sayin N.C. Pregnancies complicated by adnexal masses: a case series / N.C. Sayin, H.A. Inal, F.G. Varol // Arch. Gynecol. Obstet. — 2008. — Vol. 278, № 6. — P. 573-577.
19. Surgical treatment of adnexal masses in pregnancy: indications, surgical approach and pregnancy outcome / Ribic-Pucelj M., Kobal B., Peternelj-Marinsek S. // J. Reprod. Med. — 2007. — Vol. 52, № 4. — P. 273-279.
20. Tomic V. Oral micronized progesterone combined with vaginal progesterone gel for luteal support / Tomic V., Tomic J., Klaic D.Z. // Gynecol Endocrinol. — 2011. — Vol. 27, № 12. — Р. 1010-1013.
21. Value of preoperative ultrasound examination in the selection of women with adnexal masses for laparoscopic surgery / Yazbek J., Helmy S., Ben-Nagi J. et al. // Ultrasound Obstet Gynecol. — 2007. — Vol. 30, № 6. — P. 883-888.