Газета «Новости медицины и фармации» 19 (436) 2012
Вернуться к номеру
Инфекции мочевой системы (Часть 1)
Авторы: А.И. ДЯДЫК, А.Э. БАГРИЙ, Н.Ф. ЯРОВАЯ, М.В. ХОМЕНКО, Донецкий национальный медицинский университет им. М. Горького
Рубрики: Неврология
Разделы: Медицинское образование
Версия для печати
Сообщение 1
Проблема инфекций мочевой системы (ИМС) крайне важна и многообразна; больные с ИМС широко представлены в повседневной работе врачей общей практики, интернистов, нефрологов, урологов, гинекологов. Ввиду объемности материала, посвященного ИМС, мы сочли возможным разделить его на два сообщения. В первом обсуждаются вопросы терминологии и номенклатуры, этиологии и патогенеза. Представлены современные взгляды на бессимптомную бактериурию, острый цистит, острый и хронический пиелонефрит. Во втором сообщении рассматриваются вопросы лечения неосложненных форм ИМС, а также лечебной тактики при ИМС у отдельных групп больных (беременных, с сахарным диабетом и пожилых).
Терминология и номенклатура
Внедрение микроорганизмов (преимущественно бактерий) в различные отделы мочевой системы и в предстательную железу с последующей их колонизацией и развитием воспаления обозначается термином «инфекция мочевой системы». В структуре ИМС выделяют инфекции верхних (т.е. почек) и нижних (т.е. мочевого пузыря и уретры) отделов. Кроме того, принципиально важным с клинических позиций является разделение ИМС на осложненную и неосложненную.
Критерии, характеризующие осложненные варианты ИМС:
— наличие врожденных и приобретенных анатомических аномалий (аномалий развития, расположения и структуры почек, мочеточников и уретры, ретроперитонеальный фиброз);
— функциональные нарушения мочевой системы (рефлюксы);
— сахарный диабет, мочекаменная болезнь, синдром приобретенного иммунодефицита, хроническая сердечная недостаточность, снижение функции почек, беременность;
— ИМС, возникшие после выполнения инструментальных методов исследования и лечения (катетеризация мочевого пузыря и мочеточников, бужирование уретры, цистоскопия, стентирование мочеточника, трансуретральные оперативные вмешательства);
— мужской пол;
— пожилой и старческий возраст независимо от пола.
Общепризнанная клиническая классификация ИМС отсутствует, что создает определенные трудности как в их диагностике, так и в лечении и оценке результатов научных исследований.
Ниже приводим традиционную терминологию, широко используемую в клинической практике. Дизурия — болезненность, жжение, дискомфорт или затруднение при мочеиспускании. Поллакиурия — частое мочеиспускание малыми порциями мочи. Лейкоцитурия — наличие более 5–10 лейкоцитов в поле зрения или более 4000 лейкоцитов в 1 мл мочи (проба Нечипоренко). Императивное мочеиспускание — ощущение необходимости немедленного мочеиспускания. Бессимптомная бактериурия — бессимптомное наличие более 100 тысяч бактериальных колониеобразующих единиц (КОЕ) в 1 мл мочи. Уретральный синдром — персистирующая или рецидивирующая дизурия у больных с истинной бактериурией в бакпосеве мочи, поллакиурия, пиурия. Уретрит — воспаление слизистой мочеиспускательного канала без глубокой инвазии микроорганизмов в подслизистый слой. Уретропростатит — воспаление слизистой уретры и предстательной железы, сопровождающееся дизурическими явлениями, болями внизу живота, в заднем проходе, нарушениями половой функции и выделениями из мочеиспускательного канала. Реинфекция — возобновление бактериурии с идентификацией того же или другого патогена как этиологического фактора через 10 дней после лечения с подтвержденной эрадикацией уропатогена (тот же микроорганизм обычно высевается, если он персистирует в периуретральной области). Рецидив — возобновление бактериурии (с тем же микроорганизмом) до 10-го дня после антибактериального лечения, приведшего к стерилизации мочи. Острый пиелонефрит — первый эпизод бактериально обусловленного заболевания, характеризующегося воспалением преимущественно почечного интерстиция и проявляющегося наличием лихорадки, озноба, лейкоцитурии, бактериурии, боли и/или напряжения в поясничной области. Хронический пиелонефрит — инфекционно-индуцированное очаговое воспаление почечного интерстиция, приводящее к формированию рубцов с возможным последующим вовлечением всех структур нефрона.
Эпидемиология
ИМС является самой распространенной бактериальной инфекцией у человека, наблюдаемой во всех возрастных группах как с наличием анатомо-функциональных изменений, так и без таковых (от новорожденных до лиц гериатрического возраста). Она является одной из самых частых причин обращения больных к врачу как за плановой, так и за ургентной помощью. ИМС наблюдается у 15 % мужчин в возрасте до 35 лет, а после 50 лет частота ИМС существенно возрастает в связи с патологическими процессами в предстательной железе (аденома, простатит и др.). В возрасте до 10 лет ИМС наблюдаются у 2 % мальчиков и 8 % девочек. Около 50 % женщин в течение жизни переносят как минимум один эпизод ИМС.
Риск развития ИМС повышен у лиц с наличием функциональных или анатомических изменений в почках и мочевыводящих путях, у больных, получающих иммуносупрессивную терапию (в том числе с трансплантатами внутренних органов, в частности, почек), а также при сахарном диабете (СД). Кроме того, целый ряд факторов способствует развитию осложнений при инфицировании мочевой системы (МС). К ним относят: возраст моложе 15 и старше 55 лет, мужской пол, катетеризацию мочевого пузыря (в том числе постоянный катетер), нейрогенный мочевой пузырь, поликистоз почек, беременность, сердечную недостаточность, нарушение функции почек, инфицирование необычными микроорганизмами или инфекциями, резистентными к стандартной противовоспалительной терапии.
ИМС часто развивается у здоровых, сексуально активных женщин, характеризуясь при этом в подавляющем большинстве случаев хорошим прогнозом. В то же время течение и — нередко — прогноз ИМС у младенцев и детей, а также у лиц гериартрического возраста менее благоприятны, нередко проявляются тяжелой клинической картиной, сопряжены с риском серьезных непосредственных осложнений и неблагоприятных отдаленных последствий. Наличие ИМС у детей обычно требует проведения тщательных исследований для исключения анатомических и функциональных нарушений со стороны МС. У лиц пожилого возраста ИМС часто сочетается с различными сопутствующими заболеваниями, что нередко затрудняет ее своевременную диагностику, усугубляет течение, ухудшает эффективность терапии и прогноз.
Довольно интересными представляются данные о длительном (около 18 лет) наблюдении за школьницами с бактериурией и без таковой. У многих из них эпизоды бактериурии сменяются длительными промежутками со стерильной мочой. В то же время бактериурия часто вновь возникает после замужества или в течение первой беременности. ИМС при беременности развивается значительно чаще среди женщин, у которых в девичьем возрасте имели место эпизоды ИМС: 63,8 % против 26,7 %, у которых подобных эпизодов не было.
Этиология
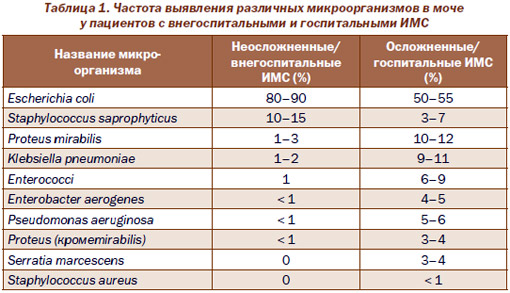
В табл. 1 представлена частота выявления различных бактериальных уропатогенов в пробах мочи у пациентов с неосложненными внегоспитальными и осложненными госпитальными ИМС.
Патогенез
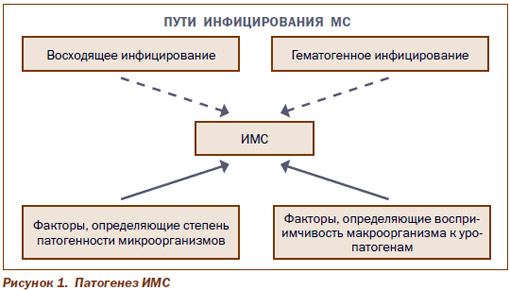
Выделяют два основных пути инфицирования МС (рис. 1): гематогенный — с поступлением инфекционных агентов в почки в ходе бактериемии и восходящий — с ретроградным распространением уропатогенов из нижних отделов МС в их верхние отделы и далее в почки.
Гематогенное инфицирование МС
Развитие бактериемии сопровождается поступлением в почки значительного количества микроорганизмов, что связано с доставкой к ним от 20 до 25 % минутного объема крови. В то же время лишь некоторые из микроорганизмов при таких условиях инфицирования являются уропатогенами, способными обеспечить устойчивую колонизацию почек и развитие ИМС. С этим связывают относительно невысокую долю гематогенного пути инфицирования в структуре ИМС: он определяет развитие менее 3 % случаев ИМС у человека. Избирательная резистентность почек при бактериемии определяет спектр микроорганизмов, способных вызывать развитие ИМС при гематогенном инфицировании. Так, если среди причин ИМС с восходящим распространением доминируют Escherichia coli, Enterobacter spp., Staphylococcus saprophyticus и Enterococcus faecalis, то ведущими патогенами при гематогенном инфицировании являются Staphylococcus aureus, Salmonella spp., Pseudomonas aeruginosa, Candida spp.
Восходящее инфицирование МС
Развитие подавляющего большинства случаев ИМС связано с восходящим распространением уропатогенов из уретры и периуретральных тканей в мочевой пузырь, далее — в мочеточник, почечную лоханку и мозговой слой почки. В связи с доминированием восходящего пути в развитии ИМС мы сочли возможным обсудить его более детально.
Колонизация уретры. Начальным этапом восходящего инфицирования МС является колонизация потенциальными уропатогенами дистальной части уретры, периуретральных тканей и vestibulum vaginae (у женщин). Исходным резервуаром уропатогенов при этом является желудочно-кишечный тракт. Степень риска восходящего инфицирования определяется анатомическими различиями между полами: у женщин близость ануса и выхода из уретры благоприятствует колонизации МС фекальной флорой. Исследования особенностей начальных этапов восходящего инфицирования МС у человека ограничены преимущественно женщинами. Мнения о значимости для колонизации уретры у женщин таких факторов, как особенности индивидуальных гигиенических привычек, методов менструальной протекции, вариантов нижнего белья пациенток, гормональных изменений в ходе менструального цикла (а также связанные с ними изменения вагинальной рН), остаются неоднозначными.
Вероятность возникновения ИМС у здоровых мужчин существенно ниже по сравнению с женщинами из-за анатомической удаленности выхода из уретры от ануса, большей длины мужской уретры и бактерицидной активности секрета предстательной железы.
Поступление уропатогенов в мочевой пузырь. Механизм поступления микроорганизмов из уретры в мочевой пузырь остается недостаточно изученным. Если важная роль инструментальных манипуляций на уретре и мочевом пузыре (цистоскопия, установка катетера типа Foley и др.) в развитии восходящего инфицирования является доказанной, то патофизиология проникновения уропатогенов в мочевой пузырь при отсутствии таких манипуляций продолжает оставаться предметом обсуждения. Предполагается, что уропатогены могут проникать в мочевой пузырь во время мочеиспускания, что связывают с развитием турбулентного потока мочи и/или уретро-везикального рефлюкса после завершения опорожнения мочевого пузыря; устойчивость последующей колонизации зависит от особенностей микроорганизмов и восприимчивости к ним клеток уроэпителия.
Пузырные защитные механизмы и колонизация мочевого пузыря. В норме мочевой пузырь обладает способностью к эрадикации поступивших в него микроорганизмов в течение 2–3 дней. Выделяют следующие факторы, определяющие защиту мочевого пузыря от инфекции:
— выведение микроорганизмов из мочевого пузыря в ходе его периодического опорожнения и разводящий эффект мочи, поступающей из почек (гидрокинетический механизм);
— бактериостатические свойства нормальной мочи;
— антибактериальные свойства слизистой мочевого пузыря.
Нарушения процессов разведения и опорожнения мочевого пузыря, снижение антибактериальных свойств его слизистой и бактериостатических свойств мочи (при неадекватном мочеиспускании, наличии значительного количества резидуальной мочи, инородных тел и конкрементов в мочевом пузыре, повышении внутрипузырного давления, изменениях состава мочи, предсуществующих воспалительных процессов в слизистой мочевого пузыря) существенно увеличивают риск развития устойчивой ИМС.
Рефлюксы и их роль в восходящем распространении инфекции и повреждении почечной ткани. Восходящему распространению инфекции из мочевого пузыря в мочеточник препятствует наличие особой анатомической структуры, обозначаемой как везико-уретральный клапан. Он сформирован расположенным в толще стенки мочевого пузыря интрамуральным сегментом мочеточника, достигающим у взрослых около 2 см в длину. При мочеиспускании активное сокращение мышц мочевого пузыря приводит к повышению интрамурального давления и компрессии интрамурального сегмента мочеточника, препятствуя ретроградному току мочи. Возникновение несостоятельности везико-уретрального клапана с формированием везико-уретральных рефлюксов (ВУР) является структурно-функциональной основой развития так называемой рефлюкс-нефропатии (reflux-nephropathy), являющейся ведущей причиной рубцовой трансформации почек при ИМС. Рефлюксные механизмы создают условия для развития тубулоинтерстициальных нарушений, которым, наряду с процессами рубцевания, отводится важное место в прогрессировании почечного поражения и развития почечной недостаточности при ИМС.
Неосложненные ИМС у взрослых
Бессимптомная бактериурия (ББ)
Персистирующее бессимптомное наличие более 100 тыс. (105) бактериальных колониеобразующих единиц (КОЕ) в 1 мл мочи (при двух исследованиях) (при отсутствии пиурии) обозначается термином «бессимптомная бактериурия». Частота ББ в общей популяции составляет около 3,5 % и нарастает с возрастом. ББ (равно как и симптомная ИМС) наблюдается преимущественно у женщин и нехарактерна для мужчин, не достигших шестого десятилетия жизни, при отсутствии у них в более ранние сроки жизни урологических заболеваний.
Начиная с пятого десятилетия жизни, по мере развития патологических процессов в предстательной железе, существенно нарастает частота ББ у мужчин, достигая к 70 годам 3,5 % у лиц, у которых ранее не было инфицирования МС, а у лиц с тяжелыми заболеваниями, обусловливающими снижение защитных механизмов организма и требующими частых и длительных госпитализаций, частота ББ достигает 25–50 %, т.е. приближается к таковой у женщин аналогичных возрастных групп.
Частота ББ у женщин неизменно нарастает с возрастом и существенно выше у сексуально активных. В ряде исследований отмечена зависимость бактериурии от метода контрацепции. Кроме того, частота ББ увеличивается при использовании спермицида, а также у женщин с СД II типа и у беременных.
По мере нарушения ментальных функций и в связи с частыми госпитализациями частота ББ у лиц гериатрического возраста обоих полов становится почти одинаковой, достигая 25–50 %.
При отсутствии представленных выше факторов риска и беременности, по мнению многих специалистов, проведение антибактериальной терапии при ББ нецелесообразно, так как отсутствуют данные о ее неблагоприятном влиянии на отдаленный прогноз. Кроме того, антибактериальные препараты могут вызывать дисбактериоз, элиминируя защитную флору мочевыводящих путей. В ряде исследований было показано, что применение антибактериальных препаратов у женщин с ББ (без факторов риска) увеличивает частоту реинфицирования и морбидность. Женщинам с ББ рекомендуют применение Lactobacillus casci, обладающих способностью выделять ингибиторные субстанции к уропатогенам. При интравагинальном введении лактобациллы колонизируются на уроэпителии, уменьшая риск его поражения.
Острый цистит
Острый неосложненный цистит представляет серьезную клиническую и социальную проблему, что связано с высокой заболеваемостью и высокой частотой рецидивов. У четырех из пяти женщин, перенесших цистит, заболевание рецидивирует в ближайшие 12–18 мес. Высокую частоту циститов у женщин связывают с рядом предрасполагающих факторов, включающих анатомические особенности мочеполовой системы, сексуальную активность, использование противозачаточных диафрагм (спиралей) и спермицидов, способствующих колонизации колиформ бактерий в периуретральной зоне. В подавляющем большинстве случаев циститы у женщин носят неосложненный характер и редко ассоциируются с анатомическими и функциональными нарушениями. По данным экскреторной уронефрографии (ЭУ), УЗИ почек и мочевыводящих путей, анатомические нарушения МС наблюдаются менее чем у 1 % женщин, обращающихся к врачам по поводу дизурии и учащенного мочеиспускания. В связи с этим, по мнению многих специалистов, представляется необоснованным проведение специальных инструментальных и бактериологических исследований (без строгих показаний) женщинам с острым неосложненным циститом. Более того, сегодня критически пересмотрены традиционные рекомендации по тактике ведения женщин с неосложненным острым циститом или редкими (не более 1–2 эпизодов) рецидивами цистита о необходимости проведения до и после лечения исследований, включающих бактериологическое исследование мочи с определением чувствительности уропатогенов к антибиотикам.
В клинической практике в нашей стране широко используется классификация циститов, представленная ниже:
1) по этиологии: инфекционный (специфический и неспецифический); химический, термический, медикаментозный, неврогенный, радиационный, инволютивный, послеоперационный;
2) по течению: острый и хронический;
3) по распространенности воспалительного процесса: диффузный и очаговый (шеечный);
4) по характеру морфологических изменений:
— острый (катаральный, гангренозный, геморрагический, грануляционный, фибринозный, флегмонозный, язвенный);
— хронический (катаральный, язвенный, полипозный, кистозный, инкрустирующий, интерстициальный (болезнь Гуннера)).
Острый цистит часто развивается после переохлаждения или на фоне менструации, или после полового акта, или после дефлорации (дефлорационный цистит). Наиболее весомыми факторами риска развития цистита у женщин в пременопаузе являются анамнестические указания на перенесенный цистит и сексуальную активность. У женщин, не имеющих половых связей, циститы развиваются редко. Часто развитие цистита наблюдается через 36–48 часов после полового акта. Риск развития цистита существенно возрастает при использовании спермицида и противозачаточных диафрагм (спиралей). Рецидивирующие циститы чаще наблюдаются у женщин, в анамнезе которых имеются эпизоды цистита в детстве или указания на циститы у матери.
Ведущие клинические проявления цистита включают частые (иногда каждые полчаса) императивные болезненные (с ощущением рези и жжения) мочеиспускания малыми порциями, а также с ощущением неполного опорожнения мочевого пузыря. При тяжелом течении цистита наблюдаются резкие боли при мочеиспускании и выделение капелек крови в конце мочеиспускания. Обычно больные циститом отмечают дискомфорт или болезненность внизу живота и иногда — в промежности. У части больных повышается температура до субфебрильных цифр (фебрильная температура не характерна для цистита). Моча больных циститом имеет мутный вид (при макрогематурии — бурый или розовый цвет) и приобретает неприятный запах. Развитие тяжелой интоксикации не присуще циститу. Однако в части случаев развиваются общая слабость, утомляемость и снижение трудоспособности. При пальпации у больных циститом часто выявляется боль в надлобковой области.
После достижения ремиссии у большинства женщин в последующем наблюдаются спорадические рецидивы цистита (в течение первого года — в 25–50 % случаев). Острый цистит и его рецидивы ассоциируются с существенным снижением качества жизни.
Пиурия обычно представлена при цистите и уретрите, но отсутствует при вагините; гематурия (превалируют неизмененные эритроциты) наблюдается приблизительно в 20–40 % случаев при цистите и редко — при уретрите и вагините. Культура мочи положительная при цистите и отрицательная при уретрите и вагините. Наличие таких факторов риска, как перенесенный ранее цистит, недавняя сексуальная связь, недавнее использование диафрагмы (спирали) и/или спермицида, отсутствие мочеиспускания после половой связи, свидетельствуют в пользу цистита.
Прогноз при неосложненных циститах (даже часто рецидивирующих) у небеременных женщин рассматривается как довольно благоприятный. Вероятность снижения функции почек даже при частых обострениях цистита ставится под сомнение. В нескольких исследованиях показана высокая возможность спонтанного выздоровления (до 50–70 %) при острых циститах. Однако, по данным других авторов, без проведения адекватной антибактериальной терапии нередко наблюдается пролонгация клинических проявлений цистита. Кроме того, по мнению ряда специалистов, при часто повторяющихся длительных эпизодах цистита увеличивается риск инфицирования почек, т.е. развития пиелонефрита.
Пиелонефрит
Пиелонефрит — неспецифическое инфекционно-воспалительное заболевание почек (одно- или двустороннее), при котором в патологический процесс вовлекаются почечная лоханка, чашечки и паренхима почки (в первую очередь и в основном интерстиций и канальцевый аппарат), а также клубочки и почечные сосуды.
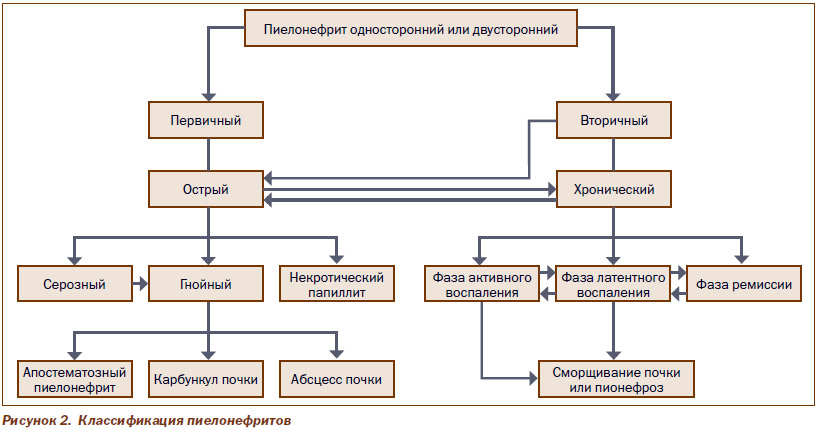
Довольно распространена в клинической практике приводимая ниже классификация пиелонефритов (рис. 2).
Острый пиелонефрит. Сегодня мы не располагаем данными о частоте острого пиелонефрита в общей популяции, которые базировались бы на убедительных диагностических критериях в репрезентативных группах обследуемых. Результаты ряда исследований позволяют говорить, что женщины с ББ и рецидивирующими циститами составляют группу повышенного риска развития острого пиелонефрита. За исключением S.saprophyticus, редко вызывающего развитие острого пиелонефрита, спектр уропатогенов при остром пиелонефрите довольно близок к таковому при остром цистите и характеризуется существенным превалированием E.сoli, превышающим 80 %.
Одни авторы рассматривают острый пиелонефрит, развивающийся у здоровых женщин, как неосложненную инфекцию мочевой системы. В то же время, по мнению других специалистов, любое инфицирование почек следует рассматривать как осложненную инфекцию, что, по нашему мнению, не имеет достаточных оснований.
Острому пиелонефриту присущи как местные, так и общие проявления, наличие и выраженность которых широко варьируют. Местные симптомы острого пиелонефрита включают: болезненность и/или напряжение в реберно-вертебральном треугольнике, боль в поясничной области (одно- или двустороннюю), и/или боль в надлобковой области. Кроме того, у части пациентов (чаще у женщин) могут быть представлены дизурия, поллакиурия, императивные позывы к мочеиспусканию и ощущение неполного опорожнения мочевого пузыря. В ряде случаев отмечается никтурия. Общими проявлениями острого пиелонефрита могут быть общая слабость, повышение температуры до субфебрильных или фебрильных цифр, ознобы, потливость. У части больных лихорадка носит гектический характер, сопровождается потрясающими ознобами, заканчивающимися проливными потами; ознобы могут повторяться на протяжении суток несколько раз. Нередко в тяжелых случаях наблюдаются головная боль, анорексия, тошнота, рвота, сухость во рту, жажда, миалгии, артралгии, а у части пациентов (чаще в пожилом возрасте) — заторможенность, галлюцинации, бред. Кроме того, у части больных с тяжелым пиелонефритом имеет место развитие бактериемии. В большинстве случаев при своевременном проведении адекватной антибактериальной терапии наблюдается успешное излечение без каких-либо последствий. В то же время у части больных (особенно с грамотрицательными уропатогенами) существует риск развития развернутой картины сепсиса. При этом активация комплементарной, свертывающей и кининовой систем может привести к развитию септического шока и/или диссеминированной интраваскулярной коагуляции.
В анализах мочи при остром пиелонефрите выявляются лейкоцитурия (пиурия) и бактериурия. Протеинурия может отсутствовать или представлена минимальными уровнями.
В общеклинических анализах крови у больных с развернутой картиной острого пиелонефрита наблюдается лейкоцитоз со сдвигом лейкоцитарной формулы влево (в тяжелых случаях — вплоть до миелоцитов) и ускорение СОЭ.
Развитие острого повреждения почек, а также гнойных осложнений не присуще острому неосложненному пиелонефриту. Однако запоздалая диагностика пиелонефрита, обусловливающая несвоевременное проведение антибактериальной терапии, или неадекватная антибактериальная терапия повышают риск развития таких гнойных осложнений, как апостематозный нефрит, абсцессы и карбункулы почек.
У больных острым пиелонефритом при ультразвуковом исследовании выявляются: увеличение размеров почки (почек) в трех плоскостях, увеличение ее (их) объема; возрастание толщины паренхимы; нарушение кортико-медуллярной дифференцировки; увеличение кортико-медуллярного индекса (отношение произведения ширины и высоты пирамиды к высоте коркового слоя над ней); понижение эхогенности паренхимы за счет ее отека и гиперемии; увеличение размера пирамид; расширение чашечно-лоханочной системы; усиление контурированности фиброзной капсулы почек и возникновение ореола разрежения около нее и ограничение подвижности почки при дыхании за счет отека паранефрия. В части случаев для уточнения диагноза необходимо проведение экскреторной уронефрографии и/или компьютерной томографии, и/или сцинтиграфии.
Хронический пиелонефрит. Истинная частота хронического пиелонефрита (ХП) остается неизвестной, что обусловлено трудностями диагностики, широкой вариабельностью его клинических проявлений, а также данных лабораторных и инструментальных исследований.
Удельный вес ХП в структуре терминальной стадии хронического поражения почек довольно широко варьирует в различных сообщениях, что объясняется приведенными выше причинами. По данным регистров различных ассоциаций диализа и трансплантации почек, частота ХП среди больных с терминальной стадией почечной недостаточности составляет 13–22 %.
В активной фазе воспалительного процесса ХП (т.е. при обострении заболевания) клиническая картина напоминает таковую при остром пиелонефрите. В фазе ремиссии при нормальном АД и сохранной функции почек отсутствуют какие-либо специфические симптомы. В то же время у больных ХП в фазе ремиссии наличие артериальной гипертензии (АГ) и/или снижения функции почек определяет клиническую картину. При латентном течении ХП (при отсутствии АГ и снижения функции почек) возможны такие проявления заболевания, как боль в пояснице, субфебрильная температура, познабливание, недомогание, общая слабость. Если в активной фазе ХП имеют место увеличение СОЭ, лейкоцитоз, сдвиг лейкоцитарной формулы влево, то при ремиссии эти изменения отсутствуют. По мнению многих специалистов, эпизоды обострения ХП с развернутой картиной симптомов инфекционного процесса наблюдаются редко. Чаще ХП протекает латентно. При этом у части больных отсутствуют какие-либо клинические симптомы при нормальном АД и сохранной функции почек. У других имеют место неприятные ощущения в поясничной области, слабость, недомогание, субфебрильное повышение температуры, познабливание, а также дизурия. Характеризуя клиническую картину ХП, важно подчеркнуть развитие симптоматики, обусловленной преимущественными тубулоинтерстициальными поражениями, присущими данному заболеванию, обусловливающими увеличение натрийуреза, полиурию, никтурию, снижение концентрационной способности почек, а также тенденцию к развитию гиперкалиемии, ацидоза и АГ. Эти нарушения нередко развиваются на ранних стадиях ХП и обычно (в отличие от гломерулонефритов и гломерулярных поражений, обусловленных АГ) представлены даже при умеренном снижении клубочковой фильтрации и небольшом повышении уровней креатинина плазмы. Развитие описанной выше симптоматики обусловливает высокий риск развития дегидратации, гиперкалиемии и ацидоза.
В течение длительного времени доминировала точка зрения, что ХП присуща минимальная протеинурия (т.е. суточные потери белка менее 1 г). В то же время в ряде сообщений показано наличие умеренной (суточные потери белка 1,0–3,0 г) и даже большой протеинурии (суточные потери белка более 3,0 г) у части больных с ХП, что связывают, прежде всего, с развитием патологических изменений в клубочковом аппарате. Гломерулярные изменения, развивающиеся у больных ХП, характеризуются разнообразием. Наиболее часто развивается вторичный фокальный сегментарный гломерулосклероз, распространенность которого коррелирует с выраженностью нарушения функции почек.
В многочисленных исследованиях установлена высокая частота развития АГ при ХП, составляющая в различных сообщениях 49–75 %. Развитие АГ у больных ХП наблюдается как при одностороннем, так и при двустороннем поражении почек.
При ультразвуковом исследовании у больных ХП могут отмечаться уменьшение почки (почек) в размерах, уменьшение ее объема, нечеткость и неровность контура; уменьшение толщины паренхимы (причем эти изменения могут носить как очаговый, так и тотальный характер); повышение эхогенности паренхимы; неоднородность эхогенности ее различных участков; расширение или деформация чашечно-лоханочной системы в целом либо расширение отдельных чашечек; уплотнение и неоднородность стенок; нечеткость дифференцировки синуса от паренхимы. Таким образом, очаговость изменений паренхимы, несимметричность процессов в обеих почках являются характерными особенностями ХП.
При экскреторной уронефрографии на пиелограммах определяются стойко расширенные лоханки, чашечки и мочеточники, наблюдается чередование ригидных сегментов с гипотоничными участками чашечек и лоханок. Начальные чашечки округленные, гладкостенные, форниксы деформированы. Хроническое рецидивирующее воспаление чашечек сопровождается их булавовидной или грибовидной деформацией, соответственно чашечкам определяются зоны форникальных рубцов в паренхиме, обычно полярно расположенных, т.к. чашечки в области полюсов почек предрасположены к развитию интраренального рефлюкса. Паренхиматозные рубцы расположены над зонами измененных чашечек и могут обусловливать неровные контуры профиля почек. Приведенные выше данные уронефрограмм имеют несимметричный характер.
На компьютерных томограммах при ХП определяются кортикальные рубцы над деформированными подлежащими чашечками.
Характер течения ХП и его прогноз определяются целым рядом факторов, включающих следующие:
— у взрослых (старше 18 лет) больных с неосложненным ХП отдаленный прогноз относительно благоприятный; в подавляющем большинстве случаев длительно сохраняется нормальная функция почек. У многих больных АГ не развивается, а в случаях ее развития обычно эффективна антигипертензивная терапия;
— риск развития ХП повышен у лиц с наличием функциональных или анатомических изменений в почках и мочевыводящих путях (например, ВУР), у больных с сахарным диабетом, у получающих иммуносупрессивную терапию (в том числе и с трансплантатами внутренних органов, в частности, почек). К факторам, которые могут увеличивать риск развития обострений ХП, относят: возраст моложе 15 и старше 55 лет, мужской пол, катетеризацию мочевого пузыря (в том числе постоянный катетер), нейрогенный мочевой пузырь, поликистоз почек, беременность, сердечную недостаточность, нарушение функции почек.