Газета «Новости медицины и фармации» Неврология (428) 2012 (тематический номер)
Вернуться к номеру
Рекомендації щодо ведення хворих з ішемічним інсультом та транзиторною ішемічною атакою
Рубрики: Неврология
Разделы: Руководства
Версия для печати
рекомендации, инсульт, профилактика, образование, отделение острых нарушений мозгового кровообращения (инсульта), визуализация, лечение, реабилитация.
Адаптована клінічна настанова,
заснована на доказах
Робоча група з адаптації клінічної настанови:
Гуляєва М.В. - Виконавчий директор Всеукраїнського громадського об’єднання «Українська асоціація боротьби з інсультом», лікар
Костюк М.Р. - Cт.н.с. відділення судинної нейрохірургії ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова АМН України», к.мед.н.
Матюха Л.Ф. - Головний позаштатний спеціаліст МОЗ України — координатор груп зі спеціальності «Загальна практика — сімейна медицина», доцент кафедри загальної практики — сімейної медицини Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.мед.н.
Міщенко Т.С. - Головний позаштатний спеціаліст МОЗ України зі спеціальності «Неврологія», головний спеціаліст-координатор Національної академії медичних наук України за напрямом «Неврологія і психіатрія», завідувач відділення судинної патології головного мозку ДУ «Інститут клінічної та експериментальної неврології і психіатрії Національної академії медичних наук України», д.мед.н., професор
Парій В.Д. - Професор кафедри соціальної гігієни та організації охорони здоров’я з підвищення кваліфікації керівних кадрів Національного медичного університету імені О.О. Богомольця, д.мед.н., професор
Титова Т.А. - Доцент кафедри загальної практики — сімейної медицини Харківської медичної академії післядипломної освіти МОЗ України, к.мед.н.
Швець О.В. - Головний позаштатний спеціаліст МОЗ України зі спеціальності «Дієтологія», директор державного підприємства «Державний науково-дослідний центр із проблем гігієни харчування МОЗ України», доцент кафедри внутрішньої медицини № 1 Національного медичного університету ім. О.О. Богомольця, к.мед.н.
Шуляк В.І. - Заступник головного лікаря Житомирської центральної районної лікарні
За методичної підтримки та експертизи:
Степаненко А.В. - Радник Міністра охорони здоров’я, консультант державного підприємства «Державний експертний центр МОЗ України», д.мед.н., професор
Ліщишина О.М. - Директор Департаменту стандартизації медичних послуг державного підприємства «Державний експертний центр МОЗ України»
Кравець О.М. - Начальник Відділу доказової медицини державного підприємства «Державний експертний центр МОЗ України»
Шилкіна О.О. - Начальник Відділу методичного забезпечення нових технологій в охороні здоров’я державного підприємства «Державний експертний центр МОЗ України»
Горох Є.Л. - Начальник Відділу якості медичної допомоги та інформаційних технологій державного підприємства «Державний експертний центр МОЗ України»
Державний експертний центр МОЗ України є членом Guidelines International Network (Міжнародна мережа настанов) Міжнародного проекту ADAPTE (Франція).
Рецензенти:
Дубенко О.Є. - Професор кафедри невропатології та нейрохірургії Харківської медичної академії післядипломної освіти МОЗ України, д.мед.н.
Перегляд адаптованої клінічної настанови до 2015 року.
Список условных сокращений
ADL Активность в повседневной жизни
CAVATAS Carotid and Vertebral Artery Transluminal Angioplasty Study
DECIMAL Decompressive craniectomy in malignant middle cerebral artery infarcts
DESTINY Decompressive surgery for the treatment of malignant infarction on the middle cerebral artery
DIAS Desmoteplasein Acute Ischemic Stroke
ECST European Carotid Surgery Trialists
EFNS Европейская федерация неврологических сообществ
ESO Европейская организация инсульта
EUSI Европейская инициативная группа по инсульту
EVA3S Endarterectomy versus Stenting in Patients with Symptomatic Severe Carotid Stenosis
FAST Тест «лицо — рука — речь»
GCP Good Clinical Practice
HAMLET Hemicraniectomy after middle cerebral artery infarction with life-treatening edema trial
MERCI Mechanical Embolus Removal in Cerebral Embolism
MUST The Malnutrition Universal Screening Tool
NIHSS Национальный институт здоровья (США)
NINDS National Institute of Neurological Disorders and Stroke
NNH Число лиц, которые должны заболеть, чтобы развилось одно серьезное осложнение в течение года
NNT Число лиц, нуждающихся в лечении, чтобы избежать одного серьезного сосудистого события в течение года
PROACT Pro-urokinase for Acute Ischemic Stroke
SAPPHIRE Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy
SPACE Stent-protected Angioplasty versus Carotid Endarterectomy in symptomatic patients
Перелік скорочень, які використовувалися робочою групою
ЦВЗ Цереброваскулярні захворювання
ЛПМД Локальний протокол медичної допомоги
УКПМД Уніфікований клінічний протокол медичної допомоги
ТІА Транзиторна ішемічна атака
ЗОЗ Заклад охорони здоров’я
МОЗ Міністерство охорони здоров’я
КЕА Каротидна ендартеректомія
1. Резюме
2. Введение
3. Осведомленность населения и образование
4. Направление и транспортировка пациента
5. Экстренная помощь
6. Инсультная служба и отделение острых нарушений мозгового кровообращения (инсульта)
6.1. Обеспечение инсультной службы
6.2. Отделения острых нарушений мозгового кровообращения (инсульта)
7. Диагностика
7.1. Диагностическая визуализация
7.1.1. Общие положения
7.1.2. Визуализация у больных с острым ин-сультом
7.1.3. Методы визуализации у больных с ТИА, малым инсультом и инсультом со спонтанным регрессом симптомов
7.2. Другие диагностические тесты
7.2.1. Исследование сердца
7.2.2. Лабораторная диагностика
8. Первичная профилактика
8.1. Контроль сосудистых факторов риска
8.1.1. Высокое артериальное давление
8.1.2. Сахарный диабет
8.1.3. Гиперлипидемия
8.1.4. Курение
8.1.5. Употребление алкоголя
8.1.6. Физическая активность
8.1.7. Диета
8.1.7.1. Употребление фруктов, овощей и рыбы
8.1.7.2. Витамины
8.1.8. Постменопаузальная эстроген-заместительная терапия
8.2. Антитромботическая терапия
8.2.1. У лиц с низким риском
8.2.2. У лиц, имеющих сосудистые факторы
риска
8.2.3. У лиц с атероматозом крупных артерий
8.2.4. У лиц с мерцательной аритмией
8.3. У лиц после оперативного вмешательства на сонных артериях и ангиопластики
9. Вторичная профилактика
9.1. Повышенное артериальное давление
9.1.1. Сахарный диабет
9.1.2. Гиперлипидемия
9.1.3. Курение
9.1.4. Диета
9.1.4.1. Избыточная масса тела
9.1.4.2. Витамины
9.1.5. Расстройства дыхания во сне
9.1.6. Открытое овальное окно
9.1.7. Постменопаузальная эстроген-заместительная терапия
9.2. Антитромботическая терапия
9.2.1. Антитромбоцитарная терапия
9.2.1.1. Аспирин
9.2.1.2. Клопидогрель
9.2.1.3. Дипиридамол
9.2.1.4. Трифлузал
9.2.1.5. Комбинация дипиридамола и аспирина
9.2.1.6. Комбинация клопидогреля и аспирина
9.2.2. Пероральные антикоагулянты
9.2.3. Повторные сосудистые события на фоне антитромбоцитарной терапии
9.3. Хирургические методы и ангиопластика
9.3.1. Каротидная эндартерэктомия
9.3.2. Ангиопластика и стентирование сонных артерий
9.3.3. Стено-окклюзирующие процессы интракраниальных и позвоночных артерий
9.3.3.1. Экстра-интракраниальный анастомоз
9.3.3.2. Стентирование при стенозах интракраниальных или позвоночных артерий
10. Базисная терапия инсульта
10.1. Легочная функция и защита дыхательных путей
10.2. Поддержание сердечной деятельности
10.3. Инфузионная терапия
10.4. Коррекция артериального давления
10.5. Коррекция уровня глюкозы
10.6. Коррекция температуры тела
11. Специфическая терапия
11.1. Тромболитическая терапия
11.1.1. Внутривенное введение тканевого активатора плазминогена (тромболизис)
11.1.2. Другие тромболитические препараты для внутривенного введения
11.1.3. Внутриартериальный и комбинированный (ВВ + ВА) тромболизис
11.1.4. Устройства для внутриартериальной реканализации
11.2. Антитромбоцитарная терапия
11.3. Ранняя антикоагулянтная терапия
11.4. Нейропротекция
11.5. Отек мозга и повышенное внутричерепное давление
11.5.1. Медикаментозное лечение
11.5.2. Гипотермия
11.5.3. Хирургическая декомпрессия
12. Предупреждение и лечение осложнений
12.1. Аспирация и пневмония
12.2. Тромбозы глубоких вен и ТЭЛА
12.3. Пролежни
12.4. Эпилептические припадки
12.5. Психомоторное возбуждение
12.6. Падения
12.7. Инфекции мочеполовой системы
12.8. Дисфагия (нарушение глотания) и кормление
13. Реабилитация
13.1. Требования к реабилитации
13.2. Основные принципы реабилитации
13.3. Элементы реабилитации
13.3.1. Лечебная физкультура (кинезитерапия)
13.3.2. Эрготерапия
13.3.3. Логопедическая коррекция
13.3.4. Информационное обеспечение
13.3.5. Другие специалисты
13.4. Когнитивные расстройства
13.5. Сексуальная функция
13.6. Осложнения, возникающие при реабилитации
13.7. Постинсультная депрессия
13.8. Боль и спастичность
13.9. Психологическая и социальная реабилитация
13.10. Приемлемость реабилитации
14. Приложение
15. Таблицы
16. Литература
16.1. Список литературы, представленный в прототипе клинической рекомендации
16.2. Список литературы, использованной при адаптации клинических рекомендаций
17. Дополнения
Рекомендации
по ведению больных с ишемическим инсультом
и транзиторными ишемическими атаками 2008
Исполнительный комитет Европейской инсультной организации (ESO) и Авторский комитет ESO:
Peter A. Ringleb, Heidelberg, Germany; Marie-Germaine Bousser, Paris, France; Gary Ford, Newcastle, UK; Philip Bath, Nottingham, UK; Michael Brainin, Krems, Austria; Valeria Caso, Perugia, Italy; Álvaro Cervera, Barcelona, Spain; Angel Chamorro, Barcelona, Spain; Charlotte Cordonnier, Lille, France; László Csiba, Debrecen, Hungary; Antoni Davalos, Barcelona, Spain; Hans-Christoph Diener, Essen, Germany; José Ferro, Lisbon, Portugal; Werner Hacke, Heidelberg, Germany; Michael Hennerici, Mannheim, Germany; Markku Kaste, Helsinki, Finland; Peter Langhorne, Glasgow, UK; Kennedy Lees, Glasgow, UK; Didier Leys, Lille, France; Jan Lodder, Mastricht, The Netherlands; Hugh S. Markus, London, UK; Jean-Louis Mas, Paris, France; Heinrich P. Mattle, Bern, Switzerland; Keith Muir, Glasgow, UK; Bo Norrving, Lund, Sweden; Victor Obach, Barcelona, Spain; Stefano Paolucci, Rome, Italy; E. Bernd Ringelstein, Münster, Germany; Peter D. Schellinger, Erlangen, Germany; Juhani Sivenius, Kuopio, Finland; Veronika Skvortsova, Moscow, Russia; Katharina Stibrant Sunnerhagen, Göteborg, Sweden; Lars Thomassen, Bergen, Norway; Danilo Toni, Rome, Italy; Rüdiger von Kummer, Dresden, Germany; Nils Gunnar Wahlgren, Stockholm, Sweden; Marion F. Walker, Nottingham, UK; Joanna Wardlaw, Edinburgh, UK.
Адрес для корреспонденции:
Werner Hacke MD PhD Department of Neurology Im Neuenheimer Feld 400 69120 Heidelberg Germany
Вступ та коментар робочої групи
Ця клінічна настанова була обрана робочою групою з адаптації як один із ключових прототипів найкращої медичної практики надання медичної допомоги пацієнтам з ішемічним інсультом, що ґрунтуються на даних доказової медицини стосовно ефективності та безпеки медичних втручань, фармакотерапії та організаційних принципів її надання. Клінічна настанова була обрана на основі об’єктивних критеріїв їх оцінки, а саме за допомогою опитувальника AGREE.
Відповідно до міжнародної практики та уніфікованої методики МОЗ України зі створення клінічних настанов, медичних стандартів та клінічних протоколів, адаптована клінічна настанова має слугувати джерелом доказових (наукових) даних при виборі медичних технологій, ліків та організаційних принципів надання медичної допомоги.
Отже, ця клінічна настанова, а за необхідності й інші клінічні настанови будуть покладені в основу розробки уніфікованого клінічного протоколу медичної допомоги (УКПМД) хворим на ішемічний інсульт, що затверджується МОЗ України. Уніфікований протокол є основою для розробки в подальшому локальних протоколів медичної допомоги (ЛПМД) у кожному конкретному закладі охорони здоров’я.
Адаптовану клінічну настанову пропонується використовувати як інформаційне джерело найкращої практики для вибору методу діагностичної та лікувальної тактики при веденні пацієнтів з ішемічним інсультом і ТІА.
Цей рекомендаційний документ з найкращої медичної практики, заснованої на доказах ефективності, у першу чергу призначений для практикуючих лікарів та профільних професійних асоціацій в Україні.
Ця адаптована клінічна настанова має бути переглянута не пізніше 2014 р. мультидисциплінарною робочою групою за участю головного позаштатного спеціаліста МОЗ України, практикуючих лікарів, які працюють у ЗОЗ, що надають первинну та вторинну медичну допомогу, науковців, організаторів охорони здоров’я, представників профільних професійних асоціацій, представників інших громадських організацій, які зацікавлені в підвищенні якості медичної допомоги тощо.
1. Резюме
Эти материалы являются новой редакцией Рекомендаций по лечению инсульта Европейской инициативной группы по инсульту (EUSI), которые были впервые опубликованы в 2000 году [1, 2] и позднее переведены на несколько языков, в том числе испанский, португальский, итальянский, немецкий, греческий, турецкий, литовский, польский, русский и китайский. Первое обновление этих рекомендаций было опубликовано в 2003 году [2]. В 2006 году Европейской инициативной группой по инсульту было принято решение о том, что следующую редакцию рекомендаций должен подготовить более крупный авторский коллектив. В то же время новое Европейское инсультное общество, Европейская организация инсульта (ESO) приняли решение об обновлении рекомендаций. Таким образом, новые рекомендации были подготовлены членами как Европейской инициативной группы по инсульту, так и Европейского инсультного общества. В декабре 2007 года члены авторского коллектива провели трехдневную встречу в Гейдельберге (Германия), где обсудили окончательную версию новых рекомендаций. Члены авторского коллектива разделились на шесть групп, обсуждавших различные темы. В каждой группе было два сопредседателя и 5 экспертов. Для того чтобы избежать необъективности и конфликта интересов, никто из председателей не участвовал в клинических испытаниях или исследованиях, которые обсуждались в данной группе. В приложении к электронной версии этой статьи размещена форма «конфликта интересов». Однако, учитывая большое количество авторов, подробное описание не опубликовано в печатном варианте.
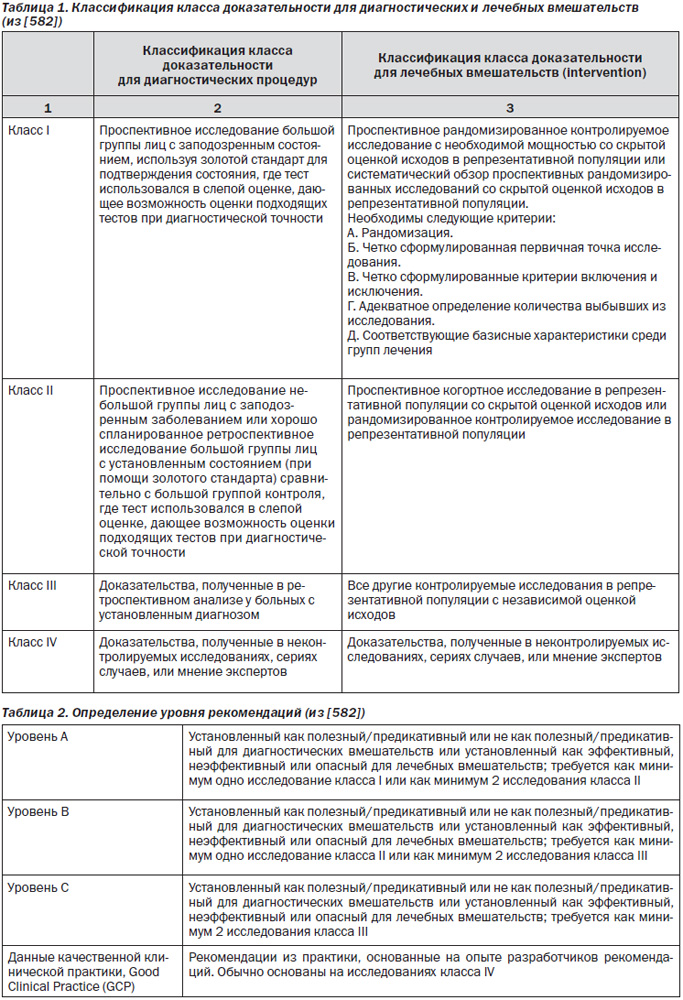
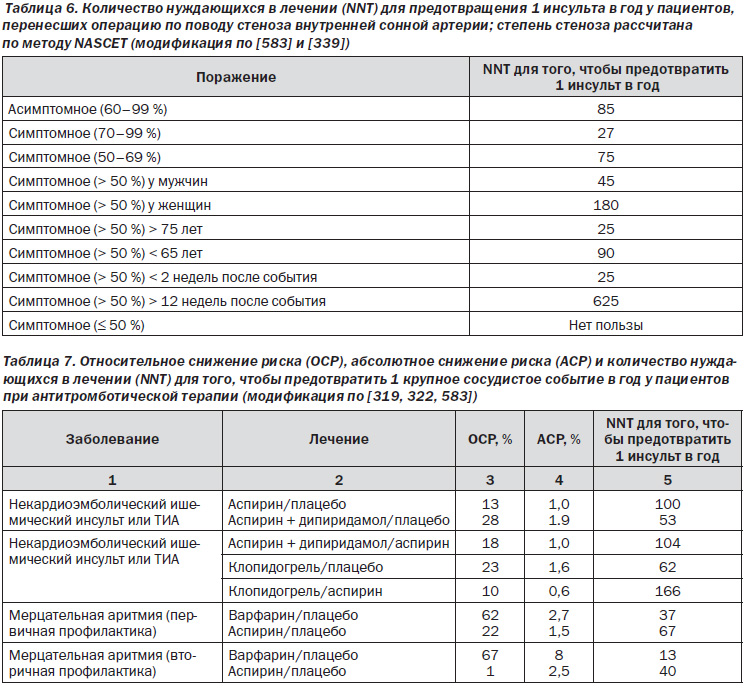
Данные рекомендации касаются как ишемического инсульта, так и транзиторных ишемических атак, которые в настоящее время считаются самостоятельным состоянием. Если имеются различия в рекомендациях для этих двух заболеваний, это особо подчеркнуто; приведенные рекомендации имеют силу (правомочны) для обоих состояний. Отдельные рекомендации для внутримозговых кровоизлияний и субарахноидальных кровоизлияний уже имеются [3] или будут отдельно подготовлены. Качество доказательности и уровень включенных рекомендаций определены в соответствии с критериями Европейской федерации неврологических сообществ (EFNS) (таблицы 1, 2). Обзор освещает направления экстренной помощи, помощь в отделении острых нарушений мозгового кровообращения (инсульта), диагностику, первичную и вторичную профилактику, базисную терапию инсульта, дифференцированную терапию, включая экстренную помощь, терапию осложнений и реабилитацию.
Изменения в рекомендациях, которые неизбежны с появлением новых доказательств, будут постоянно вноситься в on-line версию, которую можно найти на сайте ESO. Для принятия важного решения в тактике лечения можно обратиться к on-line версии. (Примітка робочої групи: посилання по тексту можна відкрити в Інтернеті (нажати на посилання та Ctrl).)
2. Введение
Инсульт является одной из лидирующих причин заболеваемости и смертности в мире [4]. Существуют большие различия в распространенности, заболеваемости и смертности от инсульта между странами Восточной и Западной Европы [5]. Это обусловлено различиями факторов риска с более высоким уровнем артериальной гипертонии и других факторов риска, которые приводят к большему количеству тяжелых инсультов в Восточной Европе [5]. Значимые региональные различия также были обнаружены и в Западной Европе. По степени распространенности инсульт является наиболее значимой причиной заболеваемости и длительной нетрудоспособности. Он также является второй по распространенности причиной деменции, наиболее частой причиной эпилепсии у взрослых и частой причиной депрессии [6, 7].
В течение последнего десятилетия было опубликовано множество обзоров и рекомендаций по лечению инсульта или специфических аспектов помощи при инсульте [2, 8–18]. Обновленная Хельсенборгская декларация сфокусировалась на стандартах помощи при инсульте и исследованиях потребностей в противоинсультной помощи в Европе [19]. В будущем координация всех рекомендаций по инсульту будет осуществляться Всемирной организацией инсульта (WSO) при поддержке ESO и других национальных и региональных обществ.
Коментар робочої групи
Розповсюдженість інсульту в різних країнах становить від 140 до 500 випадків на 100 тис. населення. У 2005 р. у світі зареєстровано 16 млн первинних випадків інсультів та 5,7 млн смертей унаслідок цього. У перспективі прогнозують зріст випадків інсульту та з них летальних: у 2015 р. — до 18 млн і 6,5 млн, у 2030 р. — до 23 млн та 7,8 млн відповідно.
В Україні за рік реєструють близько 110 тис. мозкових інсультів, з яких біля 40 тис. закінчуються летально.
За період 2000–2010 рр. кількість інсультів в Україні збільшилася у 1,6 раза, а всіх ЦВЗ — з 3,4 до 4,5 %. Ризик розвитку інсульту зростає з віком. Так, у молодому віці він виникає у 1 з 30 тис. осіб, у віці 75–84 років — у 1 з 45 осіб. Слід відзначити, що у осіб віком старше 25 років захворюваність і смертність від інсульту підвищується у 2 рази з кожним десятиліттям. На сьогодні частка осіб пенсійного віку становить 23–25 % популяції, а згідно з прогнозами у 2025 р. становитиме 30 %, і, відповідно, збільшиться кількість осіб похилого віку з вікозалежною патологією головного мозку.
Щороку реєструють понад 360 тис. нових випадків ЦВЗ. Збільшення кількості випадків ЦВЗ відзначається за рахунок як інсультів, так і хронічних порушень мозкового кровообігу.
ЦВЗ у 78 % випадків призводять до розвитку інвалідності, 46 % хворих на інсульти помирають протягом 1-го місяця, а з тих, хто виживає, повертаються до праці 10 %, у 48 % спостерігаються геміпарези, які призводять до інвалідності, у 30 % — розвиваються психоорганічні синдроми. Інсульт займає 1-ше місце серед причин стійкої втрати працездатності, охоплюючи 53 % всіх причин.
Встановлено, що ішемічний інсульт серед дорослого населення та осіб працездатного віку на 100 тис. населення становив 57,0 і 9,9 відповідно, геморагічний інсульт — 29,7 і 17,9, внутрішньомозковий крововилив — 26,8 і 15,4, субарахноїдальний крововилив — 2,8 і 2,5, неуточнений — 11,2 і 2,0 відповідно. Хронічні порушення мозкового кровообігу за поширеністю були у 70–100 осіб на 1 тис. населення, а смертність досягла 60,8 % у структурі загальної смертності від ЦВЗ.
Смертність від внутрішньомозкових крововиливів була майже в 2 рази вищою, ніж у країнах Європи. Співвідношення ішемічного інсульту та геморагічного у країнах Європи становило 7 : 1, в Україні серед дорослих — 1,6 : 1, осіб працездатного віку — 1 : 1,9. Від внутрішньомозкових крововиливів померла 12 271 особа (26,8 на 100 тис. населення), осіб працездатного віку — 4248 (15,4 на 100 тис. населення), що становить 34,6 % усіх померлих.
За період 2003–2005 рр. зафіксовано деяке зниження захворюваності на інсульт в Україні порівняно з 2000–2002 рр., проте протягом 2006–2010 рр. цей показник знову значно виріс. Смертність від субарахноїдальних крововиливів була високою протягом 2003–2005 рр., а в 2006–2010 рр. відзначена тенденція до зниження [Зозуля І.С., 2011].
3. Осведомленность населения и образование
Рекомендации
— Для увеличения осведомленности населения об инсульте рекомендованы образовательные программы (класс II, уровень В).
— Для увеличения осведомленности об инсульте среди профессионалов (парамедиков/врачей неотложной помощи) рекомендованы образовательные программы (класс II, уровень В).
Концепция «время — мозг» означает, что помощь при инсульте должна быть экстренной. Соответственно, основной задачей на догоспитальном этапе оказания медицинской помощи при инсульте является минимизация задержек при транспортировке. Распознавание признаков и симптомов инсульта самим пациентом или родственниками и окружающими, характер первого медицинского контакта и способ транспортировки в стационар имеют, в итоге, большое значение.
Задержки при оказании экстренной помощи при инсульте были выявлены на различных уровнях [20]:
— На уровне населения — связаны с неспособностью распознать симптомы инсульта и обратиться за экстренной помощью.
— На уровне скорой помощи и персонала скорой помощи — связаны с задержкой первоочередной госпитализации пациентов с инсультом.
— На уровне стационара — связаны с задержкой выполнения нейровизуализации и неэффективной стационарной помощью.
Большое количество времени теряется за пределами стационара [21]: для пациентов с инсультом в Португальском университетском госпитале это является причиной задержки начала терапии в 82 % случаев [22]. Работы, в которых описаны демографические, социальные, культуральные, поведенческие и клинические факторы, связанные с длительным догоспитальным этапом, могут быть целью образовательных кампаний [23, 24].
Промежуток времени от появления первых симптомов до звонка в службу экстренной помощи является одним из значимых факторов задержек на догоспитальном этапе [25–28]. Основными причинами задержек обращения за медицинской помощью является не только неосведомленность о симптомах инсульта и непонимание их серьезности, но также отрицание болезни и надежда, что симптомы пройдут сами. Это означает, что обучение населения распознаванию симптомов инсульта и изменение отношения людей к острому инсульту могут уменьшить время от начала возникновения симптомов до контакта со скорой помощью.
Сами пациенты редко проявляют настороженность: во многих случаях обращаются за медицинской помощью члены семьи [28–30]. Информирование и обучение должно быть направлено как на лиц с высоким риском развития инсульта, так и на людей, их окружающих.
Осведомленность об инсульте различается в зависимости от демографических и социально-культуральных факторов и индивидуальных медицинских знаний. Распознание признаков инсульта значительно варьирует в зависимости от характера симптомов и от того, как были заданы вопросы (например, вопрос с вариантами ответа на него или без них) [31, 32].
Несмотря на то что большинство населения согласно с тем, что инсульт — это неотложное состояние и необходимо немедленно обратиться за медицинской помощью, на практике только 50 % сами звонят в службу экстренной помощи. В большинстве случаев в первую очередь пациент звонит своим родственникам или семейному врачу; в ряде исследований от 45 до 48 % пациентов были госпитализированы семейным врачом [29, 33–36].
Большинство исследований продемонстрировало, что только 33–50 % пациентов распознают симптомы инсульта. Имеются огромные различия между теоретическими знаниями об инсульте и реакцией при его развитии. В некоторых исследованиях показано, что пациенты с лучшими знаниями о симптомах инсульта не всегда поступают в стационар в более ранние сроки.
Наиболее часто используемым способом информирования об инсульте являются средства массовой информации [37–39], а также друзья и родственники, которые знают об инсульте; только в редких случаях информация поступает от семейных врачей и из книг [40– 44]. Способ получения информации зависит от возраста: пожилые люди более часто получают информацию из оздоровительных кампаний или от семейных врачей, в то время как более молодые люди — из телепередач [38–40].
В экспериментальных клинических исследованиях оценивалась роль образованности населения и его осведомленности об инсульте. В восьми нерандомизированных исследованиях была оценена эффективность образовательных мероприятий и их влияние на задержку госпитализации или на использование тромболизиса [45–52]. В шести исследованиях в качестве эксперимента образовательная программа была единой для населения, парамедиков и врачей, в двух других — образование было направлено только на население. Только проект TLL включал контрольную группу [50, 51]. Во всех исследованиях результаты оценивались до и после образовательной программы. Количество проведенных тромболизисов увеличилось после проведения образовательных программ в основной группе в исследовании TLL, но только в течение 6 месяцев после их окончания [51]. Это означает, что информирование населения о симптомах инсульта должно проводиться постоянно.
Для увеличения точности постановки диагноза инсульта и скорости госпитализации в стационар обучение должно быть также направлено на парамедиков и персонал отделений неотложной помощи [53].
Обучение студентов-медиков элементарным знаниям об инсульте во время первого года обучения в медицинском колледже продемонстрировало более высокий уровень сохранности этих знаний [55]. Объем последипломного образования является универсальным, но обучающие программы для специалистов по инсульту все еще неодинаковы в Европе. Для преодоления такой гетерогенности и увеличения количества специалистов, оказывающих помощь при инсульте, некоторые страны (например, Франция, Великобритания) разработали и внедрили национальные учебные планы. В противоположность этому ряд других стран осуществляют специализацию внутри неврологических обучающих программ. Для координации обучения были учреждены программы European Masters Programme for Stroke Medicine (http://www.donau-uni.ac.at/en/studium/strokemedicine/index.php) и Stroke Summer Schools (http://www.eso-stroke.org).
4. Направление и транспортировка пациента
Рекомендации
— Рекомендуется немедленный контакт со скорой медицинской помощью и приоритетный выезд СМП (класс II, уровень В).
— Рекомендуется первоочередная транспортировка с предварительным информированием принимающего стационара (класс III, уровень В).
— Пациент с подозрением на инсульт должен быть без промедления доставлен в ближайший стационар с отделением острых нарушений мозгового кровообращения (инсульта), где оказывается экстренная помощь (класс III, уровень В).
— Диспетчеры и выездной персонал скорой медицинской помощи должны быть обучены методикам диагностики инсульта с использованием простых приемов, таких как тест «лицо — рука — речь» (FAST) (класс IV, GCP).
— Рекомендованы немедленная госпитализация в блок интенсивной терапии, клиническое обследование, лабораторные тесты и нейровизуализация, доступность использования необходимых медикаментов в принимающем стационаре (класс III, уровень В).
— В отдаленных районах и сельской местности рекомендуется использование вертолетов для транспортировки, с целью увеличения доступности лечения в стационаре (класс III, уровень С).
— В отдаленных районах и сельской местности необходимо использовать возможности телемедицины для увеличения доступности лечения в стационаре (класс II, уровень В).
— Пациенты с подозрением на ТИА должны быть госпитализированы без промедления в клинику для ТИА или в стационар с отделением острых нарушений мозгового кровообращения (инсульта), который может обеспечить диагностику и экстренную помощь (класс III, уровень В).
Успешное лечение пациента с острым инсультом начинается с осознания как населением, так и врачами [56] факта, что инсульт является неотложным состоянием, таким же, как острый инфаркт миокарда или травма. Однако на практике большинство пациентов с ишемическим инсультом не получают тромболитическую терапию, потому что они недостаточно быстро поступают в стационар [22, 36, 57, 58]. Экстренная помощь пациенту с острым инсультом основывается на четырех последовательных шагах:
— Быстрое распознавание и немедленное реагирование на инсульт или ТИА.
— Немедленное обращение за экстренной помощью и приоритет для СМП.
— Первоочередная транспортировка с оповещением принимающего стационара.
— Немедленная госпитализация в отделение интенсивной терапии, клинический осмотр, лабораторные тесты, нейровизуализация и назначение адекватной терапии в принимающем стационаре.
В тот момент, когда появились симптомы инсульта, пациенты или их родственники, должны обратиться в СМП. Службе СМП следует иметь алгоритм опроса для диагностики острого инсульта во время телефонного контакта или в электронном виде [33, 59]. Диспетчеры СМП и парамедики должны быть в состоянии диагнос-тировать инсульт, используя простые методики, такие как тест «лицо — рука — речь» [60]. Они также должны быть готовы оказать необходимую помощь пациентам, которые нуждаются в неотложной помощи вследствие ранних осложнений или сочетания инсульта с другими состояниями, такими как спутанность сознания, судорожные приступы, рвота или нестабильность гемодинамики.
Пациенты с симптомами инсульта должны быть без промедления доставлены в ближайший медицинский центр с отделением острых нарушений мозгового кровообращения (инсульта), в котором выполняется экстренная терапия. Пациенты с давностью симптомов инсульта в пределах трех часов должны быть осмотрены и транспортированы в первую очередь [20]. На каждой территории должна быть организована сеть отделений острых нарушений мозгового кровообращения (инсульта) или, если нет возможности в организации таких отделений, сеть медицинских центров с возможностью оказания экстренной помощи при инсульте, с подготовленным персоналом и системой экстренной транспортировки, доступных большинству населения [61, 62].
Если врачу звонит или приходит на консультацию пациент с симптомами инсульта, врач должен рекомендовать или организовать транспортировку больного через систему СМП в ближайший стационар с отделением острых нарушений мозгового кровообращения (инсульта), в котором выполняются экстренные терапевтические манипуляции. Персонал бригады СМП должен информировать инсультное отделение и описать клинический статус пациента. Доверенным лицам, которые могут описать симптомы или медицинские документы пациента, следует быть вместе с больным.
Несколько специальных исследований были посвящены оценке вклада разных мероприятий в уменьшение времени от момента появления симптомов до госпитализации и увеличение процента применения методов экстренной (ранней) терапии. В большинстве исследований был использован дизайн оценки результатов до и после проведенных мероприятий, они не были ни рандомизированными, ни слепыми касательно вида мероприятия или оценки исходов, отсутствовал текущий контроль [23, 53]. Изучаемые мероприятия включали обучающие программы и тренинги, использование вертолетного транспорта и телемедицины, реорганизацию догоспитального и госпитального протоколов ведения больных с острым инсультом.
Наиболее быстрым способом является прямая транспортировка в отделение неотложной помощи машиной скорой помощи или службой экстренной помощи [28, 53, 63– 65]. Вертолетный транспорт может уменьшить время до поступления в стационар [66, 67], а также повысить доступность тромболитической терапии в удаленных районах и сельской местности [68]. На смешанных территориях (с сельской местностью и урбанизированными территориями) доставка больных может быть как воздухом, так и по земле, с использованием простых правил [69]. Нет исследований, которые бы сравнивали воздушную и наземную транспортировку специально для пациентов с инсультом. В одном исследовании, включавшем преимущественно пациентов с травмой, наземный транспорт обеспечивал более быстрое время доставки на расстояние менее 10 миль (около 16 км) от стационара; воздушный транспорт был быстрее для расстояний более 45 миль (около 72 км) [70]. Одно исследование продемонстрировало экономическую эффективность транспортировки пациентов с острым инсультом, потенциально подходящих для тромболизиса, вертолетным транспортом [71].
Телемедицина с использованием двусторонней видеоконференционной связи является подходящим, обоснованным и реальным способом приблизить тромболизис к пациентам в отдаленных или сельских стационарах, где по времени воздушный или наземный транспорт не применимы. Уровень оказания помощи, процент осложнений, ближайший и отдаленный прогноз для пациентов, получивших тромболизис после телемедицинской консультации в местном стационаре, и тех, кто лечился в центральных стационарах, одинаковый [72–81].
Утверждение протокола по инсульту, в котором прописан специальный алгоритм, включающий немедленный звонок ангионеврологу в отделение острых нарушений мозгового кровообращения (инсульта) и приоритетную транспортировку пациента в это отделение, является эффективным для увеличения процента пациентов, которым был проведен тромболизис, а также для укорочения задержек на догоспитальном этапе [82, 83].
Коментар робочої групи
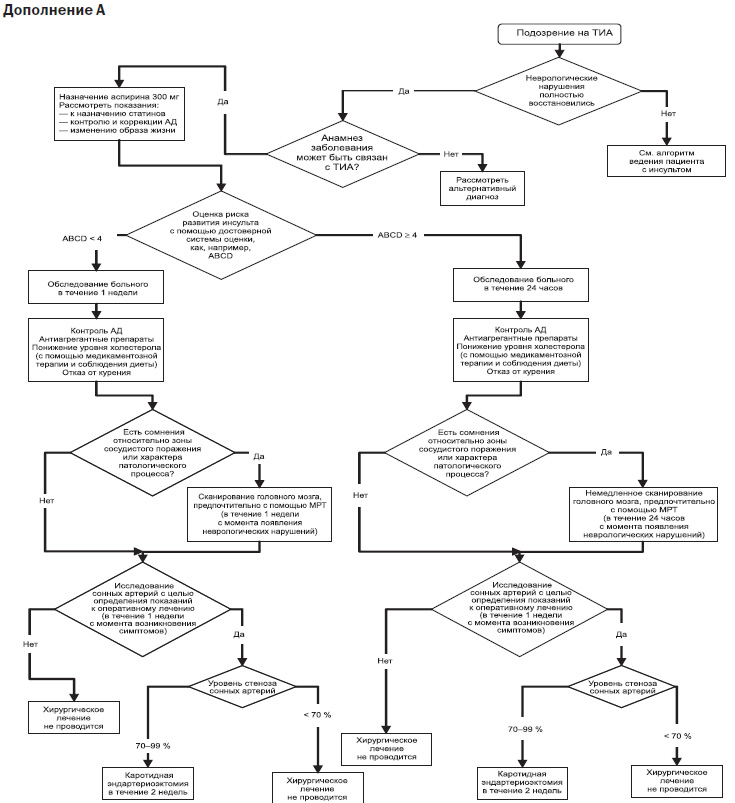
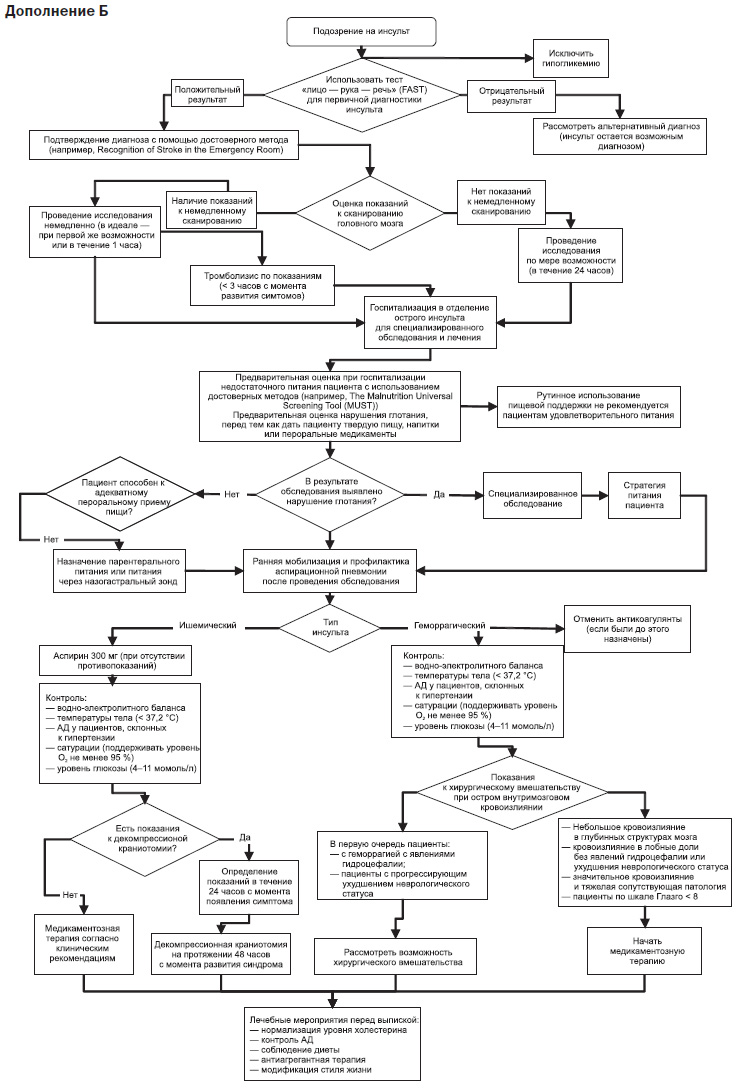
Алгоритми надання медичної допомоги пацієнтам з підозрою на ішемічний інсульт та ТІА наведені в додатках А та Б [NICE clinical guideline 68. Stroke: diagnosis and initial management of acute stroke and transient ischaemic attack (TIA)].
Недавние популяционные и госпитальные эпидемиологические исследования продемонстрировали высокий риск развития инсульта сразу же после ТИА [6, 84]. Наблюдательные исследования показали, что экстренная оценка больных с ТИА в клинике и немедленное начало лечения снижают риск инсульта после ТИА [85, 86]. Это подчеркивает необходимость экстренной госпитализации больных с ТИА для обследования и немедленного лечения.
Коментар робочої групи
В Україні надання медичної допомоги хворим з цереброваскулярними захворюваннями на догоспітальному етапі регламентується наступними нормативно-правовими документами:
1) Наказ МОЗ України від 30.07.2002 р. № 297 «Про вдосконалення медичної допомоги хворим з цереброваскулярною патологією»;
2) Наказ МОЗ України від 17.01.2005 р. № 24 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Медицина невідкладних станів»;
3) Наказ МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія».
Існують розбіжності стосовно ведення пацієнтів з гострими порушеннями мозкового кровообігу на догоспітальному етапі між твердженнями клінічних настанов та вимогами нормативних документів.
Нормативними документами МОЗ України вимагається незалежно від форми інсульту в/в введення розчину магнію сульфату у дозі 7–10 мг/кг маси тіла; в/в введення пірацетаму 2 г болюсно [1], хоча ефективність цих препаратів не доведена.
При виявленні ознак ішемічного інсульту, відповідно до наказу МОЗ України від 17.01.2005 р. № 24 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Медицина невідкладних станів», показане введення антикоагулянтів або прийом 300 мг ацетилсаліцилової кислоти, проте відповідно до тверджень клінічних настанов, лише проведення нейровізуалізаційного обстеження дозволяє достовірно встановити тип гострого порушення мозкового кровообігу та визначити подальше лікування. Застосування антикоагулянтів у хворих із геморагічним інсультом є протипоказаним. Крім того, не доведений ефект застосування антикоагулянтів у хворих з ішемічним інсультом.
Існує нагальна необхідність у розробці та затвердженні комплексного протоколу надання медичної допомоги пацієнтам із гострим порушенням мозкового кровообігу, який би послідовно включав всі етапи надання медичної допомоги: на догоспітальному етапі з визначенням порядку взаємодії медичних працівників первинної медико-санітарної допомоги, служби екстреної та швидкої медичної допомоги та медичних закладів спеціалізованої (вторинної) медичної допомоги з метою забезпечення термінового транспортування та госпіталізації пацієнтів у спеціалізовані інсультні відділення.
5. Экстренная помощь
Рекомендации
— Рекомендуется создание протокола догоспитального и госпитального оказания помощи пациентам с острым инсультом (класс III, уровень С).
— Рекомендуется использование вспомогательных тестов (таблица 3) (класс IV, GSP).
Задержки в стационаре могут составлять до 16 % общего времени, прошедшего между возникновением инсульта и компьютерной томографией (КТ) [22]. Причины задержки в стационаре:
— Неспособность распознать инсульт как неотложное состояние.
— Плохо подходящий внутрибольничный транспорт.
— Задержки в медицинском обследовании.
— Задержки в выполнении нейровизуализации.
— Нерешительность (неуверенность) при определении возможности проведения тромболизиса [20, 21, 24].
Протокол медицинской помощи при инсульте позволяет организовать более эффективную помощь, несмотря на то что метаанализ [87] не подтвердил его рутинного применения. Подобный протокол может уменьшить задержку времени «от двери» до попадания в отделение, «от двери» до времени нейровизуализации [88, 89], «от двери до иглы» [89] и, соответственно, «от двери» до артериографии (ангиографии).
Система оказания медицинской помощи при инсульте должна объединить врачей и фельдшеров скорой помощи, сотрудников блока интенсивной терапии и специалистов по инсульту. Объединение и сотрудничество между врачами скорой помощи, приемного отделения, радиологами, специалистами клинической лабораторной диагностики и неврологами очень важно для быстрого начала лечения [90–92]. Сотрудничество врачей скорой помощи и приемного отделения позволило увеличить число тромболизисов [93]. В стационарах, где пациенты не госпитализируются напрямую в отделение острых нарушений мозгового кровообращения (инсульта), необходимо внедрить систему, которая бы позволяла приемному отделению как можно быстрее предупреждать инсультную бригаду. Регулярное информирование врачей приемного отделения или специалистов по инсульту во время транспортировки позволило уменьшить время задержки в стационаре [82, 94–96], увеличить число тромболизисов [93, 94], снизить продолжительность пребывания в стационаре [96] и снизить больничную летальность [93].
Высокодостоверные методы распознавания инсульта крайне необходимы для быстрой диагностики инсульта [97]; заболевания, имитирующие инсульт, такие как мигрень и эпилептические припадки, могут создавать существенные проблемы [98, 99]. Использование тестов распознавания инсульта, таких как тест «лицо — рука — речь» и тест ROSIER, может помочь правильному распознаванию инсульта персоналом приемного отделения [60, 98, 100].
Невролог или специалист по инсульту должны быть вовлечены в оказание неотложной помощи пациенту с инсультом и доступны в приемном отделении [99]. Сравнение помощи невролога и не невролога в двух исследованиях, проведенных в США, продемонстрировало, что неврологи используют более исчерпывающие и дорогостоящие тесты, но их пациенты имеют более низкую госпитальную и 90-дневную летальность и более независимы при выписке [101, 102]. В то же время это может оказаться неверным для некоторых стран, например Великобритании, где большинство специалистов по инсульту не являются неврологами, но демонстрируют высокий уровень в оказании медицинской помощи пациентам с ТИА и инсультом.
Реорганизация отделения острых нарушений мозгового кровообращения (инсульта) поможет избежать препятствий и ненужной внутрибольничной транспортировки. Методы нейровизуализации должны находиться в непосредственной близости к инсультному или приемному отделению, и пациенты с инсультом должны иметь приоритет для обследования [90]. Нейрорадиологи должны быть оповещены как можно быстрее [90]. В финском исследовании внутрибольничные задержки были уменьшены за счет перемещения компьютерного томографа ближе к приемному отделению и приведению в исполнение системы предупреждения [95]. Тромболизис должен начинаться в комнате КТ или в непосредственной близости от томографа. Ангиографический блок должен быть реально доступным в случае необходимости эндоваскулярного вмешательства.
Должны быть доступны написанные протоколы помощи больным с инсультом; центры, использующие подобные протоколы, чаще применяют тромболизис [93]. Постоянное совершенствование плана действий также позволяет снизить задержки на госпитальном этапе [81, 103]. Должен быть определен и продуман стандарт для каждого лечебного учреждения и внедрен на региональном и национальном уровне. Минимальным требованием является контроль времени «от двери» до нейровизуализации и «от двери» до начала терапии.
В то время как у небольшого количества пациентов с инсультом имеются жизнеугрожающие состояния, у многих возникают значимые физиологические изменения или сочетанная патология, симптомы и признаки, которые могут прогнозировать последующие сложности, такие как обширный инфаркт миокарда, кровотечение, повторный инсульт. Такие проблемы, как гипертонические кризы, сочетанный инфаркт миокарда, аспирационная пневмония, сердечная и почечная недостаточность, должны быть распознаны как можно раньше. Тяжесть инсульта оценена по Шкале Национального института здоровья (NIHSS) [104].
Исходная оценка должна включать:
— Определение дыхания и функции легких.
— Ранние признаки дисфагии, предпочтительно с использованием теста оценки глотания [105].
— Оценку сопутствующих заболеваний сердца.
— Измерение артериального давления и ЧСС.
— Определение оксигенации с использованием, если возможно, пульсоксиметров.
Одновременно должны быть выполнены клинический анализ крови, биохимическое исследование, определение уровня глюкозы, коагулограмма и осуществлен внутривенный доступ. Обследование должно быть дополнено данными из медицинского анамнеза, которые включают факторы риска инсульта и сердечной патологии, перечень принимаемых препаратов, состояния, которые могут предрасполагать к развитию кровотечений, признаки заболеваний, имитирующих инсульт. Анамнез злоупотребления лекарствами, употребления оральных контрацептивов, перенесенных инфекций, травм или мигрени может быть важным ключом, особенно у молодых пациентов.
6. Инсультная служба и отделения острых нарушений мозгового кровообращения (инсульта)
Рекомендации
— Все пациенты с инсультом должны лечиться в отделении острых нарушений мозгового кровообращения (инсульта) (класс I, уровень А).
— Все пациенты с инсультом должны получать высокотехнологичную медицинскую и хирургическую помощь, при необходимости (класс III, уровень В).
— Развитие клинической системы, включающей телемедицину, расширяет возможности высокотехнологичной специализированной помощи при инсульте (класс II, уровень В).
6.1. Обеспечение инсультной службы
Все пациенты с острым инсультом нуждаются в специализированной мультидисциплинарной помощи в условиях отделения острых нарушений мозгового кровообращения (инсульта), и некоторые пациенты будут нуждаться в дополнительной высокотехнологичной помощи. Система здравоохранения должна организовать такую инфраструктуру, которая позволяла бы предоставить подобные высокотехнологичные манипуляции всем нуждающимся в них пациентам: единственной причиной перевода пациента из отделения острых нарушений мозгового кровообращения (инсульта) может быть его состояние, не позволяющее проводить активную терапию. Недавнее коллегиальное соглашение определило роль первичных и комплексных (высокотехнологичных) инсультных центров [11, 106] (таблица 4).
Первичные инсультные центры определены как центры с необходимым штатным расписанием, инфраструктурой, протоколами, что обеспечивает возможность проведения адекватной диагностики и лечения для большинства пациентов с инсультом. Некоторые пациенты с редкими нарушениями, сложным инсультом или полиорганными заболеваниями могут нуждаться в более специализированной помощи и ресурсах, которые не доступны в первичном инсультном отделении.
Комплексные инсультные центры определены как центры, которые предоставляют диагностическую и лечебную помощь большинству пациентов с инсультом, но также высокотехнологичную медицинскую и хирургическую помощь (новые диагностические и реабилитационные методики, специальные исследования, автоматический мониторинг множества физиологических параметров, интервенционную радиологию, сосудистую хирургию и нейрохирургию).
Рекомендовано организовывать сети клиник с использованием телемедицины для содействия в лечении, которое не доступно в отдаленных стационарах. Использование rt-PA во время телемедицинских консультаций возможно и безопасно [107]. Создание сети клиник, использующих телемедицину, позволяет увеличить число тромболизисов [80, 108], обеспечить лучшее качество помощи при инсульте и лучшие клинические исходы [80].
6.2. Отделения острых нарушений мозгового кровообращения (инсульта)
Последние систематические обзоры подтвердили значимое снижение смертности (абсолютное снижение на 3 %), инвалидности (увеличение на 5 % независимых пациентов) и потребности в стационарной помощи (снижение на 2 %) у пациентов, которые лечились в отделении острых нарушений мозгового кровообращения (инсульта), по сравнению с теми, кто лечился в общем отделении. У всех пациентов, независимо от пола, возраста, подтипа инсульта и его тяжести, была продемонстрирована польза от пребывания в отделении острых нарушений мозгового кровообращения (инсульта) [61, 109]. Эти результаты были подтверждены в большом обсервационном исследовании повседневной практики [110–112]. Несмотря на то что лечение в отделении острых нарушений мозгового кровообращения (инсульта) более дорогое, чем в отделении общей неврологии, оно позволяет снизить затраты на дальнейшее лечение [113, 114] и является экономически выгодным [115–118].
Отделение острых нарушений мозгового крово-обращения (инсульта) должно являться отдельным отделением в структуре стационара, в которое поступают только (или почти только) больные с острым инсультом, которое укомплектовано мультидисциплинарным штатом сотрудников [61]. Основными специалистами мультидисциплинарной бригады являются врачи, медицинские сестры, инструктора ЛФК (кинезитерапевты) и трудотерапии (эрготерапевты), логопеды и социальные работники [119]. Мультидисциплинарная бригада должна работать координировано, проводя регулярные встречи для планирования лечения пациента. Необходимо постоянно проводить обучающие программы и тренинги для персонала. Типичными компонентами помощи в отделении острых нарушений мозгового кровообращения (инсульта) в исследованиях явились [119]:
— Медицинское обследование и диагностика, включающая визуализацию (КТ, МРТ), ранняя оценка необходимого ухода и терапия.
— Ведение больных в острейшем периоде, включающее раннюю мобилизацию, профилактику осложнений, терапию гипоксии, гипергликемии, повышения температуры тела и дегидратации.
— Продолженная реабилитация с использованием координированной работы мультидисциплинарной бригады и оценка необходимости реабилитации после выписки.
Как первичный, так и комплексный инсультные центры принимают больных с острым инсультом и оказывают им помощь в течение нескольких дней. Реабилитационное инсультное отделение принимает пациентов через 1–2 недели после развития инсульта и оказывает им помощь в течение нескольких недель, если это необходимо. Большинство доказательств эффективности специализированных инсультных отделений получены из исследований комплексных инсультных центров и реабилитационных инсультных отделений [61, 120]. Мобильные инсультные бригады, которые обеспечивают помощь при инсульте в ряде больниц, значимо не влияют на исход заболевания и не могут быть рекомендованы [121]. Такие бригады обычно работают в стационарах, где невозможно создать инсультное отделение.
Отделение острых нарушений мозгового кровообращения (инсульта) должно быть достаточного размера, чтобы обеспечить специализированной мультидисциплинарной помощью всех поступающих в стационар. В небольших стационарах это может быть достигнуто путем организации одного комплексного инсультного отделения, однако в крупных стационарах чаще создаются отдельно острое инсультное отделение и реабилитационное отделение.
Коментар робочої групи
В Україні організація медичної допомоги хворим з цереброваскулярними захворюваннями регламентується наказом МОЗ України від 30.07.2002 р. № 297 «Про вдосконалення медичної допомоги хворим з цереброваскулярною патологією».
Наказ регламентує госпіталізацію в інсультне відділення всіх хворих із гострими порушеннями мозкового кровообігу в перші 6–48 годин з моменту розвитку інсульту незалежно від тяжкості стану, віку хворого, характеру та локалізації процесу, проте, відповідно до тверджень клінічних настанов, скорочення проміжку часу між початком гострого порушення мозкового кровообігу та наданням спеціалізованої допомоги — ключовий момент, який впливає на перебіг захворювання та результати лікування. Вважається найбільш ефективним проміжок часу впродовж 3 годин з моменту розвитку гострого порушення мозкового кровообігу.
Даним наказом не визначено проведення пацієнтам з гострим порушенням мозкового кровообігу процедури нейровізуальних досліджень.
В даний час подібні інсультні відділення функціонують лише в декількох великих містах України, що недостатньо для забезпечення надання медичної допомоги пацієнтам з ішемічним інсультом відповідно до тверджень клінічних настанов. Переважна більшість пацієнтів з ішемічним інсультом проходить стаціонарне лікування в гострому періоді в центральних районних та міських лікарнях у відділеннях інтенсивної терапії загального профілю та неврологічних відділеннях, що не дозволяє забезпечити проведення нейровізуальних методів обстеження в межах «терапевтичного вікна» і, відповідно, провести системну тромболізисну терапію.
7. Диагностика
7.1. Диагностическая визуализация
Рекомендации
— Пациентам с подозрением на ТИА или инсульт рекомендуется проведение в экстренном порядке КТ (класс I) или МРТ (класс II) головного мозга (уровень А).
— При проведении МРТ головного мозга рекомендуется использование диффузионно-взвешенных изображений (ДВИ) и градиентных Т2*-взвешенных изображений (класс II, уровень А).
— Пациентам с ТИА, малым инсультом и спонтанным регрессом симптоматики рекомендуется проведение в срочном порядке методов сосудистой визуализации (ультразвук, КТ-ангиография или МР-ангиография) (класс I, уровень А).
Визуализация головного мозга и сосудов, питающих его, являются решающим методом в диа-гностике инсульта и ТИА. Нейровизуализация позволяет исключить внутримозговое кровоизлияние и состояния, имитирующие инсульт, и зачастую определить тип инсульта, его причину, а также жизнеспособность вещества мозга, что влияет на выбор терапии. Сосудистая визуализация позволяет определить место и причину окклюзии и выявить пациентов с высоким риском повторного инсульта.
7.1.1. Общие положения
При проведении нейровизуализации приоритет должен отдаваться больным с инсультом, так как фактор времени для них является решающим. Пациентам с подозрением на инсульт и ТИА все общие и специфические исследования должны проводиться в экстренном порядке, сразу по прибытии в клинику, что позволит незамедлительно начать лечение. Обследование больных с ТИА также должно быть экстренным, так как более чем у 10 % этих пациентов в течение последующих 48 часов может развиться инсульт. Быстрому проведению нейровизуализации может содействовать оповещение врача-радиолога догоспитальной бригадой; инсультная служба должна работать в тесном взаимодействии с сотрудниками отделения нейровизуализации. В острой стадии должны применяться чувствительные и специфичные методы нейровизуализации. Нейровизуализация должна обеспечивать информативные изображения и быть в то же время простой в техническом исполнении. Для выбора правильного метода визуализации необходимо быстрое прицельное неврологическое обследование больного. При этом должно приниматься во внимание состояние пациента [122]; в частности, до 45 % пациентов с тяжелым инсультом МРТ-исследование проводиться не может по тяжести состояния и наличию противопоказаний [123–125].
7.1.2. Визуализация у больных с острым инсультом
Пациенты, поступившие в первые 3 часа заболевания, могут быть кандидатами на проведение внутривенного тромболизиса [126]; КТ головного мозга обычно достаточна для проведения рутинного тромболизиса. Пациенты, поступившие позднее, могут обследоваться на предмет исследования возможностей расширения терапевтического окна для проведения тромболизиса и других методов реперфузии.
Рутинная КТ является доступным методом, позволяющим исключить состояния, имитирующие инсульт, и дифференцировать ишемический и геморрагический инсульты в течение первых 5–7 дней от развития заболевания [127–129].
Экстренная КТ головного мозга — наиболее предпочтительный метод исследования больных в остром периоде инсульта по соотношению цена — качество, но не достаточно чувствительный для исключения хронических внутримозговых гематом. Таким образом, КТ головного мозга — менее чувствительный метод исследования, чем МРТ, но для диагностики ранних ишемических изменений такой же специфичный [131]. У 2/3 пациентов со среднетяжелым и тяжелым инсультом возможна визуализация ишемических изменений на КТ в течение первых часов от развития заболевания [131–135], однако визуализация ишемического очага у пациентов с малым инсультом в первые часы заболевания возможна не более чем в 50 % случаев [136]. Обучение распознаванию ранних КТ-признаков ишемических изменений [135, 137, 138] и использование шкальных систем [134] позволят улучшить диагностику в остром периоде заболевания.
Ранние КТ-признаки ишемического инсульта включают снижение коэффициента поглощения, отек ткани мозга со сглаженностью борозд и извилин, гиперденсивность артерий, являющуюся высокоспецифичным признаком внутрисосудистого тромбоза [139]. КТ является высокоспецифичным методом ранней диа-гностики ишемического повреждения головного мозга [132, 140, 141]. Наличие ранних КТ-признаков ишемии не является противопоказанием для проведения тромболизиса в первые 3 часа от развития инсульта, однако при наличии гиподенсивного очага размером более 1/3 бассейна средней мозговой артерии эффект от тромболизиса может быть незначительным [126, 134, 135, 142, 143].
В некоторых центрах отдают предпочтение МРТ как рутинному методу исследования при остром инсульте. МРТ с диффузионно-взвешенным режимом (ДВИ) является более чувствительным методом для диагностики ранних ишемических изменений, чем КТ [131]. Высокая чувствительность этого метода особенно актуальна в диагностике инсультов в вертебрально-базилярном бассейне, лакунарных и небольших корковых очагов. МРТ также позволяет диагностировать небольшие и старые геморрагические очаги в отдаленном периоде благодаря Т2*-взвешенным изображениям (градиент-ное эхо) [144]. При этом ДВИ может быть не информативным при уже сформировавшемся очаге [145].
Ограниченная диффузия на ДВИ, выявляемая при помощи измеряемого коэффициента диффузии (ИКД), не имеет 100% специфичности в диагностике ишемического повреждения мозга. Несмотря на то, что измененная ткань по данным ДВИ часто переходит в инфарктную зону, она может восстановиться, что свидетельствует о том, что ДВИ позволяет визуализировать не только необратимо поврежденную ткань [146, 147]. Ткань с незначительным снижением ИКД может оказаться необратимо поврежденной; в настоящее время не определен порог ИКД, позволяющий отличить некротизированную ткань от жизнеспособной [148, 149]. Другие режимы МРТ (Т2, FLAIR, Т1) не обладают достаточной чувствительностью для определения ранних признаков ишемии головного мозга.
МРТ головного мозга особенно актуальна у пациентов с редкими типами инсульта или при других состояниях, имитирующих инсульт, когда по результатам КТ головного мозга картина не ясна. При подозрении на артериальную диссекцию для подтверждения внутристеночной гематомы необходимо проведение пациенту МРТ шеи в Т1-взвешенном режиме с подавлением сигнала жировой ткани.
Метод МРТ менее пригоден для исследования пациентов в возбужденном состоянии или больных с рвотой и аспирацией. При необходимости должны продолжаться реанимационные мероприятия во время проведения нейровизуализации (особенно больным с тяжелым инсультом), иначе во время проведения исследования у больного может развиться гипоксия [125]. Риск аспирации возрастает у пациентов с нарушенным самостоятельным дыханием.
У отдельных больных с ишемическим инсультом может быть использована перфузионная КТ или МРТ и ангиография (например, при поздней госпитализации, неясном терапевтическом окне) для решения вопроса о возможности проведения тромболитической терапии; хотя нет ясных доказательств связи определенных перфузионных паттернов с большей или меньшей эффективностью тромболизиса [150–153]. Пациентам с окклюзией артерии на интракраниальном уровне может проводиться внутриартериальный тромболизис [154, 155]. Пациенты с тандемной окклюзией внутренней сонной и средней мозговой артерий имеют меньше шансов для эффективного системного тромболизиса, чем пациенты с изолированной окклюзией средней мозговой артерии [156]. У пациентов с окклюзией ствола средней мозговой артерии наблюдается высокая частота тяжелых окклюзий экстракраниальных артерий в каротидной системе [157–158].
Несоответствие между объемом мозговой ткани с критической гипоперфузией (которая может восстановиться после реперфузионной терапии) и объемом инфарктной ткани (которую нельзя восстановить даже с помощью реперфузии) можно установить со средней степенью чувствительности с помощью МРТ в диффузионно-перфузионном режиме [159], однако этот метод еще не является доказанной стратегией для прогнозирования эффективности тромболитической терапии в течение первых 9 часов [160]. Существуют разные взгляды на то, как лучше идентифицировать необратимо поврежденную ткань мозга и определять критически сниженный мозговой кровоток [150, 153, 161]. Измерение уровня МР-перфузии является проблематичным [162], существует большое количество ассоциаций между параметрами перфузии ткани мозга и клиническим и рентгенологическим исходами инсульта [150]. Снижение мозгового кровотока на КТ связано с последующим повреждением ткани мозга [151, 152], однако, значимость КТ-перфузии для терапевтических стратегий еще не установлена. Несмотря на то, что разрастание зоны инфаркта мозга может выявляться у большой части пациентов с несоответствием, у 50 % пациентов, не имевших несоответствия по данным нейровизуализации, распространение зоны инфаркта может быть не завершено, и терапевтические мероприятия у таких больных могут быть эффективными [153, 163]. Несоответствие клинических и томографических признаков, т.е. несоответствие объема поражения ткани мозга по данным ДВИ или КТ и распространенности поражения, предполагаемой в соответствии с тяжестью состояния больного, может давать противоречивые заключения [164, 165]. Таким образом, ни перфузионная КТ, ни перфузионная МРТ не могут быть рекомендованы в качестве рутинных методов для определения тактики лечения.
Микрокровоизлияния, обнаруживаемые при помощи Т2*-режима МРТ более чем у 60 % пациентов с геморрагическим инсультом, ассоциированы с более старшим возрастом больного, наличием артериальной гипертензии, сахарного диабета, лейкоареоза, лакунарного инсульта и амилоидной ангиопатии [166]. Риск развития симптоматической внутричерепной гематомы не был повышен после проведения тромболитической терапии у пациентов с ишемическим инсультом с выявленными до начала лечения микрокровоизлияниями на Т2*-взвешенной МРТ [167].
Сосудистая визуализация должна проводиться в сжатые сроки для выявления у больных ограниченного стеноза артерий с целью последующего проведения этим пациентам эндартерэктомии или ангиопластики. Широко доступными методами должны быть неинвазивное исследование экстра- и интракраниальных артерий с использованием цветного дуплексного сканирования, КТ-ангиографии или контрастной МР-ангиографии. Эти исследования относительно безопасны, в то время как риск возникновения инсульта у больных с симптоматическим стенозом каротидных артерий при проведении интраартериальной ангиографии составляет 1–3 % [168, 169]. При недостаточной информативности перечисленных методов может быть использована дигитальная субтракционная ангиография.
Ультразвуковые методы, МР- и КТ-ангиография позволяют визуализировать каротидный стеноз. Систематические обзоры и метааналитические исследования данных, полученных от отдельных больных, свидетельствуют о том, что наиболее чувствительным и специфичным неинвазивным методом визуализации каротидной системы является контрастная МР-ангио-графия, затем следуют ультразвуковая допплерография и КТ-ангиография; неконтрастная МР-ангиография обладает минимальной достоверностью [170, 171].
По данным некоторых исследований, ТИА и малый инсульт в вертебрально-базилярной системе ассоциированы с высоким риском повторного инсульта [172]. Ультразвуковое исследование экстракраниального отдела позвоночных артерий информативно и полезно, однако ультразвуковое исследование интракраниального отдела вертебрально-базилярной системы может быть обманчивым в связи с его низкой специфичностью. Некоторые данные указывают на то, что МР-ангиография с контрастированием и КТ-ангиография являются лучшими неинвазивными методами визуализации интракраниального отдела позвоночных и основной артерий [173].
В отличие от других методик ультразвуковое исследование является быстрой неинвазивной процедурой, которая может проводиться при помощи портативных приборов. Поэтому данная методика применима у больных, которым невозможно проведение МР- или КТ-ангиографии [158]. Тем не менее при проведении одной только допплерографии результаты могут быть недостаточно информативными; качество их часто зависит от врача, проводившего исследование и требует привлечения квалифицированных специалистов, хотя возможно проведение исследования в динамике у постели больного.
Транскраниальная допплерография применима для диагностики патологии крупных сосудов на основании мозга. Однако от 7 до 20 % пациентов с острым инсультом пожилого возраста не имеют адекватных акустических окон [174, 175]. Эту проблему можно решить, используя контрастные вещества для ультразвуковой диагностики, которые позволяют оценить уровень перфузии в острой стадии [176–178] и проводить непрерывное мониторирование церебрального кровотока [179]. Комбинированное использование ультра-звуковых методов и МР-ангиографии обеспечивает превосходные результаты, сопоставимые с дигитальной субтракционной ангиографией [180]. У больных с окклюзирующими процессами в экстрацеребральных артериях (выраженный стеноз и окклюзия сонных артерий) ухудшается церебральная реактивность и ауторегуляция, коллатеральный кровоток становится неадекватным, что повышает риск повторного инсульта [181, 182]. Транскраниальный допплер — единственная методика, позволяющая выявить циркуляцию эмболов в интракраниальных сосудах [183], что часто встречается у пациентов с атеросклерозом крупных артерий. У больных с симптомным стенозом сонных артерий эмболии являются независимым фактором риска развития ранних повторных инсультов и ТИА [184] и могут использоваться в качестве суррогатного маркера для оценки эффективности антитромботической терапии [185]. Транскраниальная допплерография с микроэмболодетекцией может применяться у больных с открытым овальным окном, при котором происходит шунтирование кровотока [186].
Коментар робочої групи
В Україні медична допомога пацієнтам із стенотичними ураженнями екстра- та інтракраніальних судин регламентується наказом МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія». Відповідно до данного наказу пацієнтам після перенесеного ішемічного інсульту, у яких виявлені оклюзійно-стенотичні ураження мозкових артерій, що потребують хірургічного лікування, показана госпіталізація до нейрохірургічного відділення.
7.1.3. Методы визуализации у больных с ТИА, малым инсультом и инсультом со спонтанным регрессом симптомов
У пациентов с ТИА имеется высокий риск развития повторных инсультов (более 10 % в первые 48 часов) [187]. Поэтому больным с ТИА необходимо проведение экстренной диагностики для терапии сосудистой патологии, устранения активных факторов риска, гемодинамически значимых стенозов и других источников эмболии. Сосудистая визуализация является более приоритетной у больных с ТИА и малым инсультом, чем у больных с большим инсультом, которым не требуется в срочном порядке проведения методов сосудистой хирургии. Превентивное лечение, проведенное в экстренном порядке, может снизить частоту развития инсульта, инвалидизации и смертности [86, 188]. Простые клинические шкальные системы позволят выявить пациентов из групп высокого риска [187]. Больные с малым инсультом и быстрым спонтанным восстановлением также находятся в группе риска по развитию повторных инсультов [58]. У больных с широким спектром заболеваний головного мозга может появляться преходящий неврологический дефицит, клиническая картина которого очень сходна с ТИА. КТ позволяет выявить некоторые из этих заболеваний (например, внутримозговое кровоизлияние, субдуральная гематома, опухоли) [130], однако некоторые заболевания лучше визуализируются при МРТ (рассеянный склероз, энцефалит, гипоксическая энцефалопатия), другие же состояния не визуализируются вовсе (острая метаболическая энцефалопатия). Редкая причина ТИА — внутричерепная гематома.
У 20–25 % больных с ТИА обнаруживается острое ишемическое повреждение по данным ДВИ [145, 189, 190]. Эти пациенты находятся в группе высокого риска по развитию тяжелого повторного инсульта [190]. Тем не менее в настоящее время нет убедительных данных о преимуществе ДВИ перед использованием клинических шкал в диагностике развития инсульта [191]. Риск развития повторного тяжелого инсульта также высок у больных с ТИА и наличием инфаркта на КТ [192].
Возможность визуализации даже очень маленького ишемического очага на DWI особенно актуальна у больных, поступивших в стационар поздно, и у больных с легким неинвалидизирующим инсультом, когда клинически затруднительно поставить диагноз [131]. Геморрагический очаг вне острой стадии можно визуализировать только с использованием Т2*-взвешенных изображений МРТ, т.к. на КТ он не визуализируется [144].
Коментар робочої групи
Надання медичної допомоги пацієнтам із транзиторними ішемічними атаками регламентуються наказом МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія». Відповідно до даного наказу МОЗ, діагностичний критерій, який відрізняє ішемічний інсульт від транзиторної ішемічної атаки, полягає у збереженні вогнищевої неврологічної симптоматики і/або загальномозкових порушень більше 24 годин.
Провідним інструментальним методом діагностики ішемічного інсульту є АКТ головного мозку, яка дозволяє виключити інтракраніальну геморагію і виявити морфологічні прояви ішемії мозку. Структурні зміни ішемічного характеру в мозковій речовині при МРТ дослідженні ви-значаються з більшою точністю.
7.2. Другие диагностические тесты
Рекомендации
— Больным с острым инсультом и ТИА рекомендуется проведение раннего клинического обследования, включающего оценку физиологических параметров, а также рутинных анализов крови (класс I, уровень А).
— Всем пациентам с ТИА и инсультом рекомендовано проведение ряда лабораторных исследований крови (таблица 5).
— Рекомендуется проведение ЭКГ в 12 отведениях всем больным с ТИА и острым инсультом. Дополнительно рекомендуется проведение мониторинга ЭКГ у больных с инсультом и ТИА (класс I, уровень А).
— Больным с инсультом и ТИА рекомендуется проведение холтеровского мониторирования ЭКГ после острейшего периода заболевания при наличии аритмий и неустановленном варианте инсульта (класс I, уровень А).
— Проведение эхокардиографии рекомендуется только ряду пациентов (класс III, уровень В).
7.2.1. Исследование сердца
Патология сердца и изменения на ЭКГ часто встречаются у больных с инсультом [193]. При остром инсульте с поражением коры островка часто выявляются удлинение интервала QT, депрессия ST и инверсия зубца Т [194, 195]. Следовательно, всем больным с инсультом и ТИА необходимо проведение ЭКГ в 12 отведениях.
После острого нарушения мозгового кровообращения необходимо рутинное проведение мониторинга сердечной деятельности для выявления серьезных аритмий. Пока еще не установлено, может ли постоянный мониторинг ЭКГ у постели больного заменить холтеровское мониторирование для выявления мерцательной аритмии (МА) при остром инсульте. Холтеровское мониторирование предпочтительнее рутинной ЭКГ для выявления МА с подозрением на эмболический вариант инсульта у больного с синусовым ритмом [196]; тем не менее проведения ЭКГ в 12-канальном режиме может быть достаточно для выявления МА [197]. Согласно данным недавних систематических обзоров, мерцательная аритмия по результатам холтеровского мониторирования была впервые зарегистрирована у 4,6 % больных с недавно перенесенными инсультом и ТИА, независимо от данных первоначальной ЭКГ и клинического осмотра [198]. Продленный мониторинг, увеличенное время записи событий и сокращенное холтеровское мониторирование у больных с нелакунарным типом инсульта могут увеличить диа-гностическую ценность [199].
Эхокардиография может выявить множество потенциальных причин инсульта [200], однако существуют противоречия в отношении того, каковы показания и какие разновидности исследования должны применяться у больных с инсультом и ТИА. Трансэзофагальная кардиография является более предпочтительным методом, чем трансторакальное исследование, в выявлении кардиальных источников эмболии [201] независимо от возраста [202].
Эхокардиография особенно показана следующим категориям больных:
— с наличием кардиальной патологии в анамнезе, выявленной при объективном исследовании или по данным ЭКГ;
— с подозрением на кардиальный источник эмболии (при церебральных инфарктах в разных сосудистых бассейнах);
— с подозрением на патологию аорты;
— с подозрением на парадоксальную эмболию;
— при неустановленной причине инсульта.
Трансторакальная эхокардиография может быть использована для выявления пристеночных тромбов, особенно в верхушке левого желудочка; это исследование обладает чувствительностью и специфичностью > 90 % для выявления пристеночных тромбов левого желудочка после инфаркта миокарда [203]. Трансэзофагальная эхокардиография предпочтительнее при исследовании дуги аорты, левого предсердия и межпредсердной перегородки [200]. Этот метод позволяет также стратифицировать риск развития тромбоэмболических осложнений у больных с МА [204].
Роль КТ и МРТ сердца в выявлении источников эмболии у больных с инсультом не была систематически исследована.
7.2.2. Анализы крови
Анализы крови, выполнение которых необходимо при экстренном поступлении больного, указаны в таблице 3. Последовательность проведения анализов зависит от типа инсульта и его вероятной этиологии (таблица 5).
Коментар робочої групи
В Україні обстеження хворих з гострим порушенням мозкового кровообігу по ішемічному типу регламентується наказом МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія» та наказом МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія».
8. Первичная профилактика
8.1. Контроль сосудистых факторов риска
Рекомендации
— Необходимо регулярно контролировать уровень артериального давления. Снижения артериального давления рекомендуется достигать путем изменения образа жизни и назначения индивидуальной фармакотерапии (класс I, уровень А) c целью достижения целевого значения 120/80 мм рт.ст. (класс IV, GCP). Для лиц с пороговой артериальной гипертензией (120–139/80–90 мм рт.ст.), застойной сердечной недостаточностью, инфарктом миокарда, диабетом или хронической почечной недостаточностью показано назначение антигипертензивной терапии (класс I, уровень А).
— Необходимо регулярно контролировать уровень глюкозы крови. Коррекцию уровня глюкозы крови рекомендовано осуществлять изменением образа жизни и назначением индивидуальной фармакотерапии (класс IV, уровень С). Пациентам с сахарным диабетом следует интенсивно снижать артериальное давление (класс I, уровень А) с целью достижения целевых значений ниже 130/80 мм рт.ст. (класс IV, уровень С).
— Необходимо регулярно контролировать уровень холестерина крови. Коррекцию уровня холестерина крови (нижние границы 150 мг/дл; 3,9 ммоль/л) рекомендуется осуществлять изменением образа жизни (класс IV, уровень С) и назначением статинов (класс I, уровень А).
— Рекомендуется отказ от курения (класс III, уровень В).
— Рекомендуется отказ от злоупотребления алкоголем (класс III, уровень В).
— Рекомендуется регулярная физическая активность (класс III, уровень В).
— Рекомендуется соблюдение диеты с ограничением употребления поваренной соли и насыщенных жиров, обогащенной богатыми клетчаткой фруктами и овощами (класс III).
— Лицам, имеющим повышенный индекс массы тела, рекомендуется придерживаться диеты для снижения веса (класс III, уровень В).
— Не рекомендуется дополнительное употребление витаминов с антиоксидантными свойствами (класс I, уровень А).
— Не рекомендуется назначение гормональной заместительной терапии в качестве первичной профилактики инсульта (класс I, уровень А).
Здоровый образ жизни, заключающийся в отказе от курения, низком или нормальном индексе массы тела, умеренном употреблением алкоголя, регулярных физических упражнениях и сбалансированной диете, ассоциирован со снижением риска развития ишемического инсульта (ОР 0,29; 95% ДИ 0,14–0,63).
8.1.1. Высокое артериальное давление
Высокое (> 120/80 мм рт.ст.) артериальное давление (АД) непосредственно связано со смертностью от сердечно-сосудистых заболеваний и общей летальностью без доказательства каких-либо пороговых величин [206]. Понижение АД существенно снижает риск развития инсульта и сердечных заболеваний в зависимости от степени понижения [207–209]. Уровень АД должен быть снижен до 140/85 мм рт.ст. или ниже [210]; антигипертензивная терапия должна быть более агрессивной у пациентов с сахарным диабетом [211]. Для достижения вышеуказанных целевых значений АД часто требуется комбинация двух или более гипотензивных препаратов.
Большинство исследований по сравнению эффективности гипотензивных средств разных групп не выявили преимущества какого-либо класса препаратов [207, 208, 212]. Однако в исследовании LIFE (Losartan Intervention for Endpoint reduction in hypertension) было показано, что лозартан предпочтительнее атенолола у пациентов с гипертрофией левого желудочка (NTT в профилактике инсульта 270) [213, 214]. Исследование ALLHAT (Antihypertensive and Lipid-Lowering treatment to prevent Heart Attack) показало, что хлорталидон был более эффективным по сравнению с амлодипином и лизиноприлом [215]. Как альтернатива на начальном и последующем этапах антигипертензивной терапии может быть обоснованным назначение бета-блокаторов [210]. У лиц пожилого возраста необходимо конт-ролировать изолированную систолическую гипертензию (систолическое артериальное давление > 140 мм рт.ст. и диастолическое артериальное давление < 90 мм рт.ст.) [208, 216].
Коментар робочої групи
В Україні первинна профілактика розвитку можливих ускладнень з боку серцево-судинної системи у хворих з підвищеним артеріальним тиском регламентується наказом МОЗ України від 03.07.2006 р. № 436 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія», п. 1.2 «Протокол надання медичної допомоги хворим із гіпертонічною хворобою (есенціальною артеріальною гіпертензією) І–ІІ стадії».
8.1.2. Сахарный диабет
В настоящее время нет доказательств того, что обеспечение контроля уровня глюкозы крови приводит к снижению риска развития инсульта [217]. Артериальное давление у пациентов с сахарным диабетом следует поддерживать ниже 130/80 мм рт.ст. [211]. Терапия статинами снижает риск развития серьезных сердечно-сосудистых заболеваний, включая инсульт [218–220].
8.1.3. Гиперлипидемия
По данным анализа 26 исследований статинов (всего 95 000 пациентов), риск развития инсульта при их назначении был снижен с 3,4 до 2,7 % [221]. В основном это было обусловлено снижением риска нефатальных инсультов с 2,7 до 2,1 %. Обзорный анализ включал результаты Heart Protection Study, в котором оценивались результаты эффективности статинов при вторичной профилактике [222]; это исследование выявило миопатию у одного дополнительного пациента на 10 000 пролеченных пациентов в год [222]. В настоящее время нет данных, позволяющих предположить, что применение статинов у пациентов с уровнем липопротеинов низкой плотности ниже 150 мг/дл (3,9 ммоль/л) позволяет предотвратить инсульт.
8.1.4. Курение
Обсервационные исследования показали, что курение является независимым фактором риска развития ишемического инсульта [223] у мужчин и женщин [224–228]. Курение супругов может быть ассоциировано с увеличением риска инсульта [229]. Метаанализ 22 исследований показал, что курение удваивает риск развития ишемического инсульта [230]. У лиц, бросивших курить, риск снижается до 50 % [225]. Запрет курения на рабочих местах реализует пользу для здоровья и экономические выгоды [231].
8.1.5. Употребление алкоголя
Злоупотребление алкоголем (> 60 г в день) увеличивает риск развития ишемического (ОР 1,69; 95% ДИ 1,34–2,15) и геморрагического (ОР 2,18; 95% ДИ 1,48–3,20) инсульта. Однако употребление небольших количеств алкоголя (< 12 г в день) ассоциировано со снижением риска обоих типов инсульта (ОР 0,83; 95% ДИ 0,75–0,91), ишемического инсульта (ОР 0,80; 95% ДИ 0,67–0,96), а умеренное употребление (12–24 г день) — со снижением риска ишемического инсульта (ОР 0,2; 95% ДИ 0,57–0,91) [232]. Употребление красного вина по сравнению с другими алкогольными напитками ассоциировано с наименьшим риском инсульта [233]. Злоупотребление алкоголем повышает риск инсульта посредством повышения уровня артериального давления [234].
Коментар робочої групи
За рекомендаціями, наведеними у клінічній настанові Американської асоціації серця та Американської асоціації інсульту, пацієнти з інсультом, які зловживають алкоголем, повинні відмовитися від вживання або суттєво зменшити кількість алкогольних напоїв (клас І, рівень С). Помірне вживання алкоголю (до 30 мл в день для чоловіків і до 15 мл для невагітних жінок) може бути прийнятне, для осіб, які не вживають алкоголю недоцільно рекомендувати його вживання (клас II, рівень В) [Furie K.L., Kasner S.E., Adams R.J. et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guideline for healthcare professionals from the american heart association/american stroke association // Stroke. 2011; 42: 227.]
8.1.6. Физическая активность
Метаанализ когортных исследований и исследований случай — контроль показал, что у физически активных лиц риск инсульта или смерти ниже, чем у лиц с низкой физической активностью (ОР 0,73; 95% ДИ 0,67–0,79). Также у людей с умеренной физической активностью риск инсульта ниже, чем у физически неактивных лиц (ОР 0,80; 95% ДИ 0,74–0,86) [235]. Эта ассоциация связана с благоприятным влиянием физической активности на массу тела, артериальное давление, уровень холестерина сыворотки крови и толерантность к глюкозе. Физическая активность в свободное от работы время (от 2 до 5 часов в неделю) была независимо ассоциирована с более легкой степенью тяжести инсульта при поступлении и лучшим краткосрочным исходом события [236].
8.1.7. Диета
8.1.7.1. Употребление фруктов, овощей и рыбы
В обсервационных исследованиях было выявлено, что употребление в пищу большого количества фруктов и овощей ассоциировано со сниженным риском развития инсульта по сравнению с их употреблением в незначительном количестве (ОР 0,96 для каждого добавления 2 порций в день; 95% ДИ 0,93–1,00) [237]. Риск ишемического инсульта был ниже у лиц, употреблявших в пищу рыбу по крайней мере один раз в месяц (ОР 0,69; 95% ДИ 0,48–0,99) [238]. Употребление в пищу цельных злаков было ассоциировано со снижением сердечно-сосудистых заболеваний (ОШ 0,79; 95% ДИ 0,73–0,85), но не инсульта [239]. Употребление кальция в составе молочных продуктов было ассоциировано со снижением смертности от инсульта в японской популяции [240]. Однако в последующих исследованиях не было выявлено взаимосвязи между употреблением жиров или холестерина и риском инсульта у мужчин [241]. В рандомизированном контро-лируемом исследовании среди женщин не отмечалось снижения частоты развития коронарных событий и инсульта, несмотря на увеличение в рационе питания доли фруктов, овощей и злаков и сокращение на 8,2 % употребляемых в пищу жиров [242].
Коментар робочої групи
Рекомендовано дотримання дієти з обмеженим вживанням солі, насичених жирів і холестерину, зі збільшенням вживання продуктів, які багаті на харчові волокна, — фруктів, овочів, цільних злаків, а також збільшення кількості полінасичених жирних кислот омега-3 в раціоні харчування).
Два популярних варианти здорової дієти: середземноморська дієта й дієта, призначена для контролю гіпертензії (DASH), достовірно зменшують ризик інсульту, а також інфаркту й смертності (Sacks F.M., Campos H. Dietary therapy in hypertension // N. Engl. J. Med. 2010; 362: 2102).
8.1.7.2. Витамины
Недостаток витамина D связан с увеличением риска инсульта [248], однако дополнительный прием кальция и витамина D не снижает этот риск [249], также как и прием токоферола и бетакаротина [250]. Метаанализ исследований, оценивающих эффективность дополнительного приема витамина Е, выявил, что его назначение в высоких дозах может увеличивать летальность (≥ 400 МЕ/сут) [251].
Высокий уровень гомоцистеина ассоциирован с увеличенным риском развития инсульта (ОШ 1,19; 95% ДИ 1,05–1,31) [252]. Введение в рацион населения зерновых продуктов, обогащенных фолиевой кислотой, осуществленное Инспекцией по контролю над качеством пищевых и лекарственных продуктов США (US Food and Drug Administration), привело к снижению уровня смертности от инсульта по сравнению с таковым в странах без соответствующей фортификации [253]. Метаанализ выявил, что дополнительное употребление в пищу фолиевой кислоты может снижать риск инсульта (ОР 0,82; 95% ДИ 0,68–1,00) [254]; при этом более выраженное снижение риска наблюдалось в исследованиях с длительным периодом назначения фолиевой кислоты или с более выраженным эффектом уменьшения уровня гомоцистеина, а также в странах, где не было внедрено употребление обогащенных зерновых продуктов.
Коментар робочої групи
Для пацієнтів з ішемічним інсультом і транзиторними ішемічними атаками відповідно до рекомендацій Американської кардіологічної асоціації/Американської асоціації інсульту 2011 р. за наявності гіпергомоцистеїнемії рекомендовано вживання фолієвої кислоти [Furie K.L., Kasner S.E., Adams R.J. et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guideline for healthcare professionals from the american heart association/american stroke association // Stroke. 2011; 42: 227]. Проте докази щодо попередження рецидиву інсульту завдяки зменшенню рівня гомоцистеїну на разі відсутні.
8.1.8. Постменопаузальная эстроген-заместительная терапия
Частота инсульта у женщин в менопаузе возрастает. Однако в анализе, основанном на 16-летнем наблюдении за 59 337 женщинами в постменопаузе, участвующими в Nurses’ Health Study, имелась лишь слабая ассоциация между инсультом и замещением эстрогенов [255]. Согласно исследованию HERS II, гормонозамещение у здоровых женщин ассоциируется с увеличенным риском ишемического инсульта [256]. Систематизированный Кокрейновский обзор [257] выявил, что заместительная гормональная терапия связана с увеличением риска инсульта (ОР 1,44; 95% ДИ 1,10–1,89). В последующем анализ рандомизированного контролированного исследования Women’s Health Initiative выявил, что риск инсульта возрастает только у женщин, длительно применяющих заместительную гормональную терапию (> 5 лет; ОР 1,32; 95% ДИ 1,12–1,56) [258, 259].
8.2. Антитромботическая терапия
Рекомендации
— Женщинам в возрасте 45 лет и старше, не имеющим риска внутричерепных кровоизлияний и заболеваний желудочно-кишечного тракта, рекомендуется назначение малых доз аспирина, хотя эффект очень низкий (класс I, уровень А).
— Рекомендуется назначение малых доз аспирина мужчинам для первичной профилактики инфаркта миокарда, однако риск развития ишемического инсульта у них не снижается (класс I, уровень А).
— Другие антитромбоцитарные препараты, кроме аспирина, не рекомендуются для первичной профилактики инсульта (класс IV, GCP).
— Назначение аспирина может быть рекомендовано пациентам с неклапанной мерцательной аритмией моложе 65 лет, не имеющим сосудистых факторов риска (класс I, уровень А).
— При отсутствии противопоказаний пациентам с неклапанной мерцательной аритмией в возрасте от 65 до 75 лет, не имеющим сосудистых факторов риска, рекомендуется назначение аспирина или перорального антикоагулянта (МНО 2,0–3,0) (класс I, уровень А).
— При отсутствии противопоказаний рекомендуется назначение перорального антикоагулянта (МНО 2,0–3,0) пациентам с неклапанной мерцательной аритмией старше 75 лет или моложе, но имеющим такие сосудистые факторы риска, как высокое артериальное давление, дисфункция левого желудочка или сахарный диабет (класс I, уровень А).
— Пациентам с мерцательной аритмией, которые по тем или иным причинам не могут принимать пероральный антикоагулянт, следует назначить аспирин (класс I, уровень А).
— Пациентам с мерцательной аритмией и механическими протезированными клапанами сердца рекомендуется длительная антикоагулянтная терапия для достижения целевого уровня МНО в зависимости от типа протеза, но не менее 2,0–3,0 (класс II, уровень В).
— Рекомендуется назначение малых доз аспирина пациентам с асимптомным стенозом внутренней сон-ной артерии (ВСА) > 50 % для снижения риска сосудистых событий (класс II, уровень В).
Коментар робочої групи
«Аспірин» — це торгова назва лікарського засобу ацетилсаліцилова кислота.
8.2.1. Лица с низким риском
В шести крупных рандомизированных исследованиях была проведена оценка эффективности применения аспирина с целью первичной профилактики сердечно-сосудистых (СС) заболеваний у мужчин и женщин (47 293 человека принимали аспирин, 45 580 составили контрольную группу), средний возраст больных был 64,4 года [260–265]. Аспирин снижал частоту коронарных и СС эпизодов, но не уменьшал частоту инсульта, смертность в результате СС эпизодов или общую летальность [266]. У женщин аспирин снижал как частоту инсульта в целом (ОШ 0,83; 95% ДИ 0,70–9,97), так и частоту ишемического инсульта (ОШ 0,76; 95% ДИ 0,63–0,93) [267]. В отдельном 10-летнем исследовании 39 875 здоровых женщин в возрасте 45 лет и старше аспирин снижал как частоту инсульта в целом (ОР 0,83; 95% ДИ 0,69–0,99), так и частоту ишемического инсульта (ОР 0,76; 95% ДИ 0,63–0,93) и незначительно увеличивал риск развития геморрагического инсульта. При этом применение аспирина не снижало риск фатальных или нефатальных инфарктов миокарда и смерти от сердечно-сосудистых эпизодов [268].
В настоящее время нет данных об опыте применения других антитромбоцитарных препаратов с целью первичной профилактики у лиц с низким риском.
8.2.2. Лица, имеющие сосудистые факторы риска
Систематизированный обзор рандомизированных, плацебо-контролируемых исследований аспирина у пациентов с повышенным АД, но без первичного сердечнососудистого заболевания выявил, что аспирин не снижает частоту инсультов и сердечно-сосудистых заболеваний в целом [267]. В исследовании CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance) было показано, что комбинация клопидогреля и аспирина была менее эффективна, чем изолированное применение аспирина в подгруппе пациентов с множественными сосудистыми факторами риска, но без ишемических эпизодов [269].
8.2.3. Атероматоз крупных артерий
Пациенты с атеросклеротическим поражением артерий имеют повышенный риск инфаркта миокарда, инсульта и смерти от сердечно-сосудистых причин. Аспирин снижает частоту инфаркта миокарда у пациентов с асимптомным атеросклерозом сонных артерий [270] и частоту инсульта после операции на каротидной артерии [271].
8.2.4. Мерцательная аритмия
Мерцательная аритмия является значимым независимым фактором риска развития инсульта. Метаанализ рандомизированных исследований со временем наблюдения за пациентами как минимум 3 месяца показал, что прием антитромбоцитарных препаратов снижает частоту инсульта (ОР 0,78; 95% ДИ 0,65–0,94) у пациентов с неклапанной МА [272]. Варфарин (при условии достижения целевого уровня МНО 2,0–3,0) более эффективно, чем аспирин, снижает частоту инсульта (ОР 0,36; 95% ДИ 0,26–0,51) [272]. Учитывая, что риск развития инсульта у пациентов с МА значительно варьирует, необходима стратификация риска для назначения антикоагулянтов, аспирина или отсутствия необходимости назначения антитромботической терапии [14]. Пероральные антикоагулянты более эффективны у пациентов с МА, имеющих один или более сосудистых факторов риска, таких как системная эмболия в анамнезе, возраст старше 75 лет, повышение артериального давления или снижение функции левого желудочка [14]. Метаанализ, упомянутый выше, выявил, что риск возникновения крупных внечерепных кровоизлияний был ниже риска развития инсульта [272]. Исследования WASPO (Warfarin vs. Aspirin for Stroke Prevention in Octogenarians) и BAFTA (Birmingham Atrial Fibrillation Treatment of the Aged) показали эффективность и безопасность варфарина у пациентов пожилого возраста. Исследование ACTIVE W (Atrial Fibrillation Clopidogrel Trial with Ibesartan for prevention of Vascular Events) показало, что назначение комбинации клопидогреля с аспирином менее эффективно, нежели назначение варфарина, и приводит к такой же частоте развития кровотечений [275].
Пациентам с протезированным сердечным клапаном, независимо от наличия мерцательной аритмии, следует назначать длительную терапию антикоагулянтами для достижения целевого уровня МНО в зависимости от типа протеза (биопротезированные клапаны — 2,0–3,0; механические клапаны — 3,0–4,0) [276].
8.3. Операции на сонных артериях и ангиопластика
Рекомендации
— Операции на сонных артериях не рекомендованы пациентам со значимым асимптомным стенозом (степень стеноза по критериям NASCET 60–99 %), за исключением пациентов, имеющих высокий риск развития инсульта (класс I, уровень С).
— Каротидная ангиопластика, с установкой стента или без, не рекомендована пациентам с асимптомным каротидным стенозом (класс IV, GCP).
— До и после операции пациентам рекомендуется назначать аспирин (класс I, уровень А).
Результаты исследования эффективности операций на сонных артериях у пациентов с асимптомным стенозом показали, что, несмотря на снижение риска развития ипсилатерального инсульта (ОР 0,47–0,54) и инсульта в целом, абсолютное преимущество оперативного лечения мало (около 1 % в год) [277–279], тогда как частота интраоперационного инсульта или смерти составляет 3 %. Консервативное лечение предпочтительнее для большинства асимптомных лиц; только в центрах с уровнем интраоперационных осложнений 3 % и менее рассматривается возможность хирургического вмешательства. Пациенты с высоким риском инсульта (мужчины со стенозом более 80 % и ожидаемой продолжительностью жизни более 5 лет) могут быть направлены для оперативного лечения в соответствующие центры [277, 279]. Степень стенозов классифицирована согласно критериям исследования NASCET (дистальный стеноз) [280].
Проведение каротидной эндартерэктомии (КЭАЭ) эффективно у молодых пациентов, а также у пациентов пожилого возраста, но только мужского пола [277]. Каротидная эндартерэктомия не несет пользы пациентам с окклюзией ВСА, контралатеральной оперируемой артерии [281, 282]. Чем больше степень стеноза, тем выше риск развития ипсилатерального инсульта [281, 283]; КЭАЭ, вероятно, эффективна независимо от степени стеноза в пределах 60–99 % [277]. Каротидная эндартерэктомия не приносит пользы пациентам, ожидаемая продолжительность жизни которых составляет менее 5 лет. Пациентам, которым показана операция КЭАЭ, не следует отменять прием аспирина [284]. После операции пациенты должны наблюдаться врачом. В настоящее время нет данных рандомизированных исследований о преимуществе и риске применения каротидной ангиопластики по сравнению с КЭАЭ у пациентов с асимптомными стенозами сонных артерий [285].
Коментар робочої групи
Показання до оперативного лікування асимптомних атеросклеротичних стенозів магістральних церебральних артерій (МЦА) — сонних і хребтових в екстра- та інтракраніальних сегментах — регламентуються наказом МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія»: «Клінічний протокол надання нейрохірургічної допомоги хворим з наслідками ішемічного інсульту, при оклюзіях і стенозах прецеребральних та мозкових артерій, які не викликають розвиток мозкового інфаркту. Шифр за МКХ-10: I 65.0-3, I 66.0-4, І 67.0, І 67.2, І 67.5, І 67.8, І 69.3».
За визначеними показаннями (ступінь стенозу, морфологічні особливості бляшки, вік хворого та інше) хірургічне лікування асимптомних атеросклеротичних стенозів високого ступеня має переваги над медикаментозною профілактикою інсульту за умов ризику інтраопераційних ускладнень (смерть або інсульт) менше 3 %. При ураженнях сонних артерій екстракраніально рекомендується проведення каротидної ендартеректомії (КЕА). При наявності факторів ризику для КЕА (супутня соматична патологія, недостатня компенсованість колатерального мозкового кровоплину, рестенози після КЕА, пострадіаційні стенози та інші) або при локалізації стенозу в ділянці, недоступній для прямої операції (екстракраніальні ураження на рівні С2 хребця і вище), показано проведення реконструктивних ендоваскулярних втручань (ангіопластика і стентування).
9. Вторичная профилактика
Рекомендации
— Рекомендуется регулярный контроль уровня артериального давления. Рекомендуется снижение уровня артериального давления после острейшего периода инсульта, включая пациентов с нормальным уровнем артериального давления (класс I, уровень A).
— Необходимо регулярно контролировать уровень глюкозы крови. Коррекцию уровня глюкозы крови рекомендовано осуществлять изменением образа жизни и назначением индивидуальной фармакотерапии (класс IV, GCP).
— Пациентам с сахарным диабетом 2-го типа, которые не нуждаются в использовании инсулина, рекомендуется прием пиоглитазона (класс III, уровень В).
— Рекомендуется терапия статинами у пациентов с некардиоэмболическим инсультом (класс I, уровень A).
— Рекомендуется отказ от курения (класс III, уровень С).
— Рекомендуется отказ от злоупотребления алкоголем (класс IV, GCP).
— Рекомендуется регулярная физическая активность (класс IV, GCP).
— Рекомендуется соблюдение диеты с ограничением употребления поваренной соли и насыщенных жиров, обогащенной богатыми клетчаткой фруктами и овощами (класс IV, GCP).
— Лицам, имеющим повышенный индекс массы тела, рекомендуется придерживаться диеты для снижения веса (класс IV, уровень С).
— Не рекомендуется дополнительное употребление витаминов с антиоксидантными свойствами (класс I, уровень А).
— Не рекомендуется назначение гормональной заместительной терапии в качестве вторичной профилактики инсульта (класс I, уровень А).
— Рекомендуется лечение расстройств дыхания во время сна, таких как синдром сонных апноэ, при помощи постоянного положительного давления в дыхательных путях (класс III, уровень GCP).
— Рекомендуется эндоваскулярное закрытие открытого овального окна у больных с криптогенным инсультом (класс IV, GCP).
9.1. Повышенное артериальное давление
В метаанализе 7 рандомизированных контролируемых исследований было выявлено снижение частоты повторных инсультов после перенесенного инсульта или ТИА (ОШ 0,76; 95% ДИ 0,63–0,92) [286]. Данный метаанализ включил следующие исследования: PATS (исследование диуретика индапамида), HOPE (рамиприл) and PROGRESS (периндоприл с или без индапамида) [287–290]. Снижение частоты повторных инсультов не зависело от уровня АД и характера перенесенного инсульта [290], следовательно, мониторинг и контроль уровня АД должны проводиться постоянно после инсульта или ТИА. Абсолютные цифры целевого уровня АД и степень его снижения неизвестны и должны быть индивидуализированы, однако положительные результаты достигаются при среднем снижении уровня АД на 10/5 мм рт.ст., нормальный уровень АД должен быть определен < 120/80 мм рт.ст. [291]. Однако не следует значительно снижать АД у больных с предполагаемым гемодинамическим инсультом или у больных с билатеральным стенозом сонных артерий. Антагонист рецепторов к ангиотензину эпросартан может быть более эффективным по сравнению с блокатором кальциевых каналов нитрендипином [292].
Коментар робочої групи
В Україні вторинна профілактика у хворих з підвищеним артеріальним тиском та перенесеним інсультом в анамнезі регламентується наказом МОЗ України від 03.07.2006 р. № 436 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія», п. 1.3 «Протокол надання медичної допомоги хворим із гіпертонічною хворобою (есенціальною артеріальною гіпертензією) ІІІ стадії».
9.1.1. Сахарный диабет
В проспективное двойное слепое рандомизированное исследование PROactive было включено 5238 пациентов с сахарным диабетом 2-го типа с анамнезом макрососудистых осложнений, которые получали пиоглитазон или плацебо. Среди больных после перенесенного инсульта (n = 486 в группе, получавшей пиоглитазон, n = 498 в группе плацебо) была выявлена тенденция к снижению комбинированного показателя смерти и сосудистых событий (РР 0,78; 95% ДИ 0,60–1,02; P = 0,067) в группе, получавшей пиоглитазон. При вторичном анализе было выявлено, что прием пио-глитазона снижал частоту фатального или нефатального инсульта (РР 0,53; 95% ДИ 0,34–0,85; P = 0,0085) и смерти от сердечно-сосудистых событий, нефатального инфаркта миокарда или нефатального инсульта (РР 0,72; 95% ДИ 0,52–1,00; P = 0,0467) [293].
9.1.2. Гиперлипидемия
В исследовании SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels) было показано снижение частоты повторных инсультов при терапии аторвастатином (РР 0,84; 95% ДИ 0,71–0,99) [294]; тогда как в Исследовании защиты сердца (Heart Protection Study) прием симвастатина снижал частоту сосудистых событий у больных с инсультом в анамнезе, а также уменьшал частоту заболеваемости инсультом у больных с другими типами сосудистых поражений (ОР 0,76) [222]. Ни в одном исследовании не оценивалась эффективность терапии статинами при разных типах инсульта, в исследование SPARCL не включались пациенты с предполагаемым кардиоэмболическим инсультом [222, 294]. В обоих исследованиях отмечалось умеренное увеличение риска развития геморрагического инсульта [222, 294]. Показатель абсолютного снижения риска при терапии статинами был низкий (NNT 112–143 в течение 1 года). Отмена принимаемых статинов в остром периоде инсульта может увеличивать риск смерти или инвалидизации [295].
9.1.3. Курение
Отсутствуют специальные данные по вторичной профилактике. См. раздел по первичной профилактике.
9.1.4. Диета
9.1.4.1. Избыточная масса тела
Отсутствуют специальные данные по вторичной профилактике. См. раздел по первичной профилактике. Снижение массы тела после инсульта может приводить к уменьшению уровня АД [246].
9.1.4.2. Витамины
В метаанализе исследований, посвященных первичной и вторичной профилактике, было выявлено, что бета-каротин может увеличивать риск смерти от сердечно-сосудистых событий (ОР 1,10; 95% ДИ 1,03–1,17) событий [296]. Дополнительный прием витамина Е не предупреждает развитие сосудистых событий [297]. Жирорастворимые антиоксидантные добавки могут увеличивать смертность [298].
Витамины, снижающие уровень гомоцистеина (фолаты, В12, В6), не снижают частоту повторного инсульта и могут увеличивать частоту сосудистых событий [299–302], однако в настоящее время проводятся дальнейшие исследования [303].
9.1.5. Расстройства дыхания во сне
Расстройства дыхания во время сна могут являться одновременно как фактором риска, так и следствием инсульта, и связаны с худшим восстановлением и увеличением риска смерти в отдаленном периоде инсульта [304]. Более 50 % больных с инсультом страдают нарушениями дыхания во сне, главным образом синдромом обструктивного апноэ во сне (ОАС). Возможен спонтанный регресс данных нарушений после инсульта, однако в ряде случаев необходима терапия. Методом выбора лечения ОАС является поддержание постоянного положительного давления в дыхательных путях. Подача кислорода и другие способы вентиляции легких могут использоваться при других (например, центральных) расстройствах дыхания во сне.
9.1.6. Открытое овальное окно
В ряде исследований случай — контроль и описаниях отдельных случаев была выявлена связь между наличием открытого овального окна (ООО) и криптогенным инсультом как у пациентов молодого возраста, так и у пожилых [305, 306]. В двух популяционных исследованиях не было выявлено значимой связи между ООО и инсультом [307, 308]. У больных с изолированным ООО общий риск развития инсульта низкий, однако при сочетании ООО с аневризмой межпредсердной перегородки, евстахиевым клапаном, сетью Киари или с инсультом в анамнезе риск повторного инсульта является высоким [309]. У пациентов с ООО и с наличием или без наличия аневризмы межпредсердной перегородки может выполняться эндоваскулярное закрытие ООО [310], что снижает риск повторного инсульта по сравнению с консервативной терапией [311], однако данные рандомизированных контролируемых исследований пока отсутствуют.
9.1.7. Постменопаузальная эстроген-заместительная терапия
Постменопаузальная эстроген-заместительная терапия не предупреждает развития сосудистых событий и может увеличивать степень тяжесть инсульта [312].
9.2. Антитромботическая терапия
Рекомендации
— Пациентам, перенесшим инсульт, рекомендуется прием антитромботической терапии (класс I, уровень А).
— Больные, которым не показана антикоагулянтная терапия, должны получать антитромбоцитарную терапию (класс I, уровень А). Рекомендуется назначение комбинации аспирина и дипиридамола, или клопидогреля. В качестве альтернативы возможно использование аспирина или трифлузала (класс I, уровень А).
— Комбинация клопидогреля и аспирина не рекомендована для пациентов после недавно перенесенного инсульта, за исключением специальных показаний (например, нестабильная стенокардия, или не-Q-образующий инфаркт миокарда, или недавнее стентирование) с продолжительностью терапии до 9 месяцев (класс I, уровень А).
— У пациентов, перенесших инсульт на фоне приема антитромбоцитарных препаратов, необходима повторная оценка патофизиологических механизмов и факторов риска инсульта (класс IV, GCP).
— Терапия оральными антикоагулянтами (МНО 2,0–3,0) рекомендована больным после перенесенного ишемического инсульта, связанного с мерцательной аритмией (класс I, уровень А). Прием оральных антикоагулянтов не рекомендован больным с частыми падениями, низкой приверженностью терапии, неконтролируемой эпилепсией, желудочно-кишечными кровотечениями (класс III, уровень С). Пожилой возраст не является противопоказанием для терапии оральными антикоагулянтами (класс I, уровень А).
— Пациенты с кардиоэмболическим инсультом, не связанным с мерцательной аритмией, должны получать оральные антикоагулянты (МНО 2,0–3,0) при высоком риске повторного инсульта (класс III, уровень С).
— Антикоагулянтная терапия не рекомендована для пациентов после некардиоэмболического инсульта, за исключением некоторых ситуаций, таких как атерома аорты, фузиформная аневризма основной артерии, диссекция артерий шеи или открытое овальное окно в сочетании с доказанным тромбозом глубоких вен голени или с аневризмой межпредсердной перегородки (класс IV, GCP).
— При наличии противопоказаний к терапии оральными антикоагулянтами рекомендована терапия низкими дозами аспирина в сочетании с дипиридамолом (класс IV, GCP).
9.2.1. Антитромбоцитарная терапия
Антитромбоцитарная терапия уменьшает частоту развития сосудистых событий, включая нефатальный инфаркт миокарда, нефатальный инсульт и сосудистую смерть у пациентов, перенесших инсульт или ТИА (ОР 0,78; 95% ДИ 0,76–0,80) [313].
9.2.1.1. Аспирин
Прием аспирина снижает риск сосудистых событий независимо от дозы (от 50 до 1300 мг в сутки) [314–317], хотя высокие дозы (более 150 мг в сутки) увеличивают риск побочных эффектов. У больных с симптомным атеросклерозом интракраниальных артерий прием аспирина так же эффективен, как и терапия оральными антикоагулянтами, и сопровождается меньшими осложнениями [318].
9.2.1.2. Клопидогрель
Клопидогрель незначительно более эффективен по сравнению с аспирином в профилактике сосудистых событий (ОР 0,91; 95% ДИ 0,84–0,97) [319]. Клопидогрель может быть более эффективен у пациентов с высоким сосудистым риском (с инсультом в анамнезе, атеросклерозом периферических артерий, симптомным поражением коронарных артерий или диабетом) [269].
9.2.1.3. Дипиридамол
Эффективность дипиридамола в снижении риска повторных инсультов близка к аспирину [320].
9.2.1.4. Трифлузал
Эффективность трифлузала в снижении риска повторных инсультов близка к аспирину, однако характерно меньшее количество побочных эффектов [321].
9.2.1.5. Комбинация дипиридамола и аспирина
Комбинация аспирина (38–300 мг/сутки) и дипиридамола замедленного высвобождения (200 мг дважды в сутки) снижает риск сосудистой смерти, инсульта или инфаркта миокарда по сравнению с аспирином (ОР 0,82; 95% ДИ 0,74–0,91) [320, 322]. Прием дипиридамола может вызывать головную боль, для снижения частоты которой рекомендуется постепенное увеличение дозы [323, 324].
9.2.1.6. Комбинация клопидогреля и аспирина
Комбинация клопидогреля и аспирина не снижает риска ишемического инсульта, инфаркта миокарда, сосудистой смерти или частоты повторных госпитализаций по сравнению с приемом одного клопидогреля [325], однако приводит к увеличению частоты жизнеугрожающих и выраженных кровотечений. Подобным образом в исследовании CHARISMA было выявлено, что комбинация клопидогреля и аспирина не приводит к снижению риска инфаркта миокарда, инсульта или смерти от сердечно-сосудистых причин по сравнению только с аспирином [269]. У больных с острым коронарным синдромом в течение 12 месяцев или после коронарного стентирования комбинация клопидогреля и аспирина снижает риск новых сосудистых событий [326].
Коментар робочої групи
Відповідно до наказу МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія», п. 1.23 «Клінічний протокол надання нейрохірургічної допомоги хворим з ішемічним інсультом», після виписки всі хворі (незалежно від виду лікування у гострому періоді) зобов’язані постійно приймати антиагрегантні препарати, проте не вказані назви препаратів, дози, схеми застосування.
9.2.2. Пероральные антикоагулянты
Терапия пероральными антикоагулянтами после некардиоэмболического ишемического инсульта по эффективности не превосходит терапию аспирином, однако приводит к большему количеству кровотечений [327–329]. Оральные антикоагулянты (МНО 2,0–3,0) снижают риск повторного инсульта у пациентов с неклапанной мерцательной аритмией (как при постоянной, так и при пароксизмальной форме) [330], а также при большинстве других состояний, сопровождающихся кардиальной эмболией. Антикоагулянтную терапию необходимо продолжать длительное время или как минимум в течение 3 месяцев после кардиоэмболического инсульта, возникшего на фоне острого инфаркта миокарда [331]. Существуют противоречивые мнения о том, когда необходимо начинать терапию антикоагулянтами. После ТИА или малого инсульта терапия должна начинаться немедленно, однако в случае тяжелого инсульта с признаками обширного инфаркта по данным методов нейровизуализации (например, при размере очага поражения более 1/3 бассейна СМА) антикоагулянтную терапию необходимо начинать через несколько недель (вопрос в каждом случае должен решаться индивидуально).
У пациентов с мерцательной аритмией и стабильной ИБС не следует комбинировать пероральные антикоагулянты с аспирином [332]. Терапия антикоагулянтами может быть предпочтительной у пациентов с атеромой аорты [333], фузиформной аневризмой основной артерии [334] или диссекцией артерий шеи [335]. В продолжающемся в настоящее время исследовании ARCH проводится сравнение комбинации клопидогреля и аспирина с оральными антикоагулянтами во вторичной профилактике у больных с атеросклеротическим поражением дуги аорты.
9.2.3. Повторные сосудистые события на фоне антитромбоцитарной терапии
Подходы к терапии больных, перенесших повторные сосудистые события на фоне антитромбоцитарной терапии, остаются неясными. Необходим поиск альтернативных причин инсульта и индивидуализированная коррекция факторов риска. Альтернативными терапевтическими стратегиями могут быть: модификация образа жизни, переход на прием другого препарата или комбинация с другим антитромбоцитарным препаратом, терапия оральными антикоагулянтами.
Коментар робочої групи
Варто звернути увагу на результати дослідження, проведеного Приходою І.В. та Подорожко О.А., які наводяться нижче [Прихода И.В., Подорожко О.А. Вторичная профилактика ишемического инсульта и транзиторной ишемической атаки // Ремендиум. Журнал о рынке лекарств и медицинской техники. — 2006. — 7. — С. 18-23].
«Показательными в этом отношении являются следующие статистические данные. В течение последних двух лет нами проанализировано проведение вторичной профилактики ИИ или ТИА у 100 больных (65 мужчин и 35 женщин, средний возраст 60,7 ± 2,5 года), перенесших один или несколько ИИ на фоне артериальной гипертензии. Относительно регулярный прием антигипертензивных препаратов под контролем артериального давления проводили 30 % больных. Постоянный прием антиагрегантов отмечен у 25 % больных. Гипохолестериновой диеты придерживались только 5 % больных, лечение статинами практически не проводилось (1 %). В 16 % случаев имел место значительный стеноз (более 70 % диаметра) или закупорка внутренней сонной артерии на стороне ИИ, однако хирургическое лечение не проводилось ни в одном случае. При этом стоит отметить, что эти показатели получены при обследовании жителей города Луганска — крупного индустриально-промышленного и научно-технического центра Донбасса с широко развитой сетью лечебно-профилактических учреждений. Нетрудно предположить, что аналогичные показатели у жителей села будут еще более удручающими в силу определенных объективных и субъективных особенностей медицины сельского региона.
Таким образом, между общепринятыми стандартами и рекомендациями по вторичной профилактики ишемического инсульта или ТИА и ее реальным состоянием на сегодняшний день существует огромная дистанция, быстрейшее сокращение которой и должно стать главной задачей отечественной клинической медицины в целом и профилактологии в частности».
9.3. Хирургические методы и ангиопластика
Рекомендации
— Операция КЭАЭ рекомендована пациентам со стенозами сонных артерий 70–99 % (класс I, уровень А) и должна выполняться только в центрах с показателем периоперационных осложнений (любой инсульт и смерть) менее 6 % (класс I, уровень А).
— Рекомендовано как можно более раннее выполнение КЭАЭ после последнего ишемического события, в идеале в течение первых 2 недель (класс II, уровень В).
— Рекомендовано выполнение операции КЭАЭ для некоторых пациентов со стенозом 50–69 %; у мужчин с полушарной симптоматикой КЭАЭ может иметь пре-имущества (класс III, уровень С). Операция КЭАЭ при стенозе 50–69 % должна выполняться только в центрах с показателем периоперационных осложнений (любой инсульт и смерть) менее 3 % (класс I, уровень А).
— Операция КЭАЭ не рекомендована пациентам со стенозами сонных артерий менее 50 % (класс I, уровень А).
— Рекомендован прием антитромбоцитарных препаратов как до, так и после операции КЭАЭ (класс I, уровень А).
— Каротидная чрескожная транслюминальная ангиопластика и/или стентирование рекомендована для некоторых пациентов (класс I, уровень А) с тяжелым симптомным стенозом сонных артерий: при наличии противопоказаний для КЭАЭ, при стенозах в хирургически недоступном месте, рестенозе после КЭАЭ, стенозах после лучевой терапии (класс IV, GCP). Пациенты должны получать комбинацию клопидогреля и аспирина непосредственно после стентирования и далее как минимум в течение 1 месяца (класс IV, GCP).
— Эндоваскулярные методы лечения могут использоваться у пациентов с симптомным интракраниальным стенозом (класс IV, GCP).
9.3.1. Каротидная эндартерэктомия
Расчет степени стеноза рекомендуется выполнять согласно критериям исследования NASCET. В исследованиях ECST (European Carotid Surgery Trialists) и NASCET использовались различные методики для расчета степени стеноза, тем не менее возможен взаимный пересчет данных, полученных в этих исследованиях [336]. Операция КЭАЭ снижает риск повторного инсульта или смерти (ОР 0,52) у пациентов с выраженным ипсилатеральным стенозом внутренней сонной артерии [280, 337, 338]. Существуют также преимущества КЭАЭ у больных с менее выраженными стенозами ипсилатеральных артерий (50–69 %) [338]. Хирургическое лечение потенциально опасно у пациентов с менее выраженными стенозами (< 50 %) [338].
Операция КЭАЭ должна выполняться как можно раньше после последнего ишемического события, в идеале в течение первых 2 недель [339]. Методика проведения операции очень важна в профилактике инсульта, наложение заплаты на сонную артерию может уменьшать риск периоперационной окклюзии или повторного стеноза [340].
У пациентов старшего возраста (> 75 лет) без органной недостаточности или серьезных заболеваний сердца операция КЭАЭ имеет преимущества [339]. Для женщин с выраженными симптомными стенозами (> 70 %) необходимо проведение операции КЭАЭ, тогда как при менее выраженной степени стеноза необходима консервативная терапия [341]. Для пациентов с amaurosis fugax, выраженным стенозом сонной артерии и высоким сосудистым риском необходимо решение вопроса о КЭАЭ, при наличии amaurosis fugax и менее выраженных факторах риска преимущество имеет консервативная терапия. Для пациентов с умеренным интракраниальным и выраженным экстракраниальным стенозами необходимо рассмотрение вопроса о КЭАЭ.
Преимущество операции КЭАЭ менее выражено у пациентов с лакунарным инсультом [342]. У больных с лейкоареозом имеется повышенный периоперационный риск [343]. Окклюзия контралатеральной внутренней сонной артерии не является противопоказанием для КЭАЭ, однако увеличивает периоперационный риск. Преимущество операции КЭАЭ является минимальным у пациентов с субокклюзией сонной артерии.
9.3.2. Ангиопластика и стентирование сонных артерий
В ряде исследований было проведено сравнение стентирования сонных артерий (ССА) и операции КЭАЭ во вторичной профилактике инсульта (таблица 9) [344–347]. В исследование SAPPHIRE (Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy) было включено более 70 % пациентов с асимптомными стенозами, поэтому данные этого исследования не следует рассматривать в рамках вторичной профилактики [346]. В исследовании CAVATAS (Carotid and Vertebral Artery Transluminal Angioplasty Study) большинству больных в группе эндоваскулярного лечения выполнялась ангиопластика, стентирование проводилось только в 26 % случаев [347]. В двух недавно завершившихся исследованиях были получены противоречивые результаты. В частности, в исследовании SPACE (Stent-protected Angioplasty versus Carotid Endarterectomy in symptomatic patients) было выявлено, что частота таких осложнений, как ипсилатеральный инсульт или смерть до 30-го дня, в группе ССА составила 6,8 %, в группе КЭАЭ — 6,3 % (абсолютные различия 0,5 %; ДИ — 1,9–2,9 %; P = 0,09) [345]. Французское исследование EVA3S (Endarterectomy versus Stenting in Patients with Symptomatic Severe Carotid Stenosis) было прекращено досрочно после включения 527 пациентов по соображениям безопасности. Относительный риск любого инсульта или смерти после ССА по сравнению с КЭАЭ составил 2,5 % (95% ДИ 1,2–5,1) [344]. Метаанализ данных исследований показал значительно более высокий риск любого инсульта или смерти в течение 30 дней после ССА (ОШ 1,41; 95% ДИ 1,07–1,87; P = 0,016) по сравнению с КЭАЭ, однако была выявлена значительная гетерогенность данных в этом анализе (P = 0,035) [348]. В отдаленном периоде регистрировалось незначительное количество ипсилатеральных инсультов после обоих вмешательств (таблица 9).
Коментар робочої групи
Показання до оперативного лікування симптомних атеросклеротичних стенозів естра- та інтракраніальних судин (сонних і хребтових) в екстракраніальних сегментах регламентуються наказом МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія».
9.3.3. Стено-окклюзирующие процессы интракраниальных и позвоночных артерий
9.3.3.1. Экстра-интракраниальный анастомоз
Экстра-интракраниальный анастомоз между поверх-ностной височной и средней мозговой артериями не имеет преимуществ при стенозах или окклюзиях СМА или ВСА в профилактике инсульта [349].
9.3.3.2. Стентирование при стенозах интракраниальных или позвоночных артерий
У пациентов с симптомным стенозом интракраниальных артерий ≥ 50 % имеется высокий риск повторного инсульта как при поражении каротидной, так и при поражении вертебрально-базилярной систем (12 % после 1 года и 15 % после 2 лет в бассейне пораженной артерии) [318, 350]. При выраженных стенозах (≥ 70 %) риск значительно более высокий, чем при стенозах меньшей степени выраженности (от 50 до 70 %) [350]. Частота повторного инсульта после стентирования достигает 5–7 % после 1 года и около 8 % после 2 лет [351, 352], однако частота осложнений, связанных с ангиопластикой или стентированием, может достигать 6 % [353–355]. Рандомизированных исследований, сравнивавших ангиопластику и стентирование или комбинацию этих процедур при интракраниальных стенозах, не проводилось. В ряде нерандомизированных испытаний была показана выполнимость и достаточная эффективность интракраниального стентирования, однако сохранялся высокий риск рестеноза [355, 356]. Стентирование экстракраниальных сегментов позвоночных артерий технически осуществимо с небольшим периоперационным риском (как, например, было продемонстрировано в исследовании SSYLVIA), однако с высокой частотой рестенозов [356].
Коментар робочої групи
В Україні хірургічне лікування стенотичних уражень церебральних артерій регламентується наказом МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія», п. 1.24 «Клінічний протокол надання медичної допомоги хворим із наслідками ішемічного інсульту, при оклюзіях і стенозах прецеребральних та мозкових артерій, які не викликають розвиток мозкового інфаркту».
Даний наказ визначає, що «Хірургічне лікування при стенотичних ураженнях церебральних артерій може виконуватись у спеціалізованих нейрохірургічних та судинних відділеннях з необхідним досвідом відповідних оперативних втручань. При лікуванні хворого у судинному або в рентген-хірургічному відділенні обов’язкова участь невролога в обґрунтуванні показань до проведення операції. До основних критеріїв, які враховуються у визначенні показань до оперативного лікування (прямого або ендоваскулярного), відносяться ступінь звуження артерії, клінічний перебіг захворювання, ризик втручання для життя хворого і ризик розвитку післяопераційних неврологічних ускладнень».
Показання до оперативного лікування симптомних атеросклеротичних стенозів МЦА — сонних і хребтових в інтракраніальних сегментах — регламентуються наказом МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія»: «Клінічний протокол надання нейрохірургічної допомоги хворим з наслідками ішемічного інсульту, при оклюзіях і стенозах прецеребральних та мозкових артерій, які не викликають розвиток мозкового інфаркту. Шифр за МКХ-10: I 65.0-3, I 66.0-4, І 67.0, І 67.2, І 67.5, І 67.8, І 69.3».
За визначеними показаннями можливе проведення реконструктивних ендоваскулярних втручань (ангіопластика і стентування) при симптомних інтракраніальних стенозах МЦА високого ступеня.
10. Базисная терапия инсульта
Рекомендации
— Рекомендуется проведение мониторинга неврологического статуса, частоты сердечных сокращений, артериального давления, температуры и сатурации кислородом в течение 72 часов у больных с сохраняющимся неврологическим дефицитом (класс IV, GCP).
— Рекомендуется подача кислорода в случае снижения показателя сатурации кислородом ниже 95 % (класс IV, GCP).
— Рекомендуется регулярный мониторинг жидкостного и электролитного баланса у пациентов с тяжелым инсультом или с расстройствами глотания (класс IV, GCP).
— Раствор хлорида натрия 0,9% рекомендуется для восполнения водного баланса в течение первых 24 часов от начала инсульта (класс IV, GCP).
— Не рекомендуется рутинное снижение артериального давления в острейшем периоде инсульта (класс IV, GCP).
— Рекомендуется осторожное снижение артериального давления у пациентов с высоким давлением при повторных измерениях (> 220/120 мм рт.ст.), с выраженной сердечной недостаточностью, расслоением аорты или гипертонической энцефалопатией (класс IV, GCP).
— Следует избегать резкого снижения артериального давления (класс II, уровень С).
— Рекомендовано возмещение объема жидкости при низком артериальном давлении, возникшем вследствие гиповолемии или явившимся причиной неврологического ухудшения в остром периоде инсульта (класс IV, GCP).
— Рекомендуется мониторинг уровня глюкозы (класс IV, GCP).
— При уровне гликемии > 180 мг/дл (> 10 ммоль/л) рекомендуется снижение уровня глюкозы сыворотки крови при помощи инсулина (класс IV, GCP).
— При гипогликемии (< 50 мг/дл [< 2,8 ммоль/л]) рекомендуется внутривенное введение декстрозы или инфузия 10–20% раствора глюкозы (класс IV, GCP).
— Рекомендуется поиск сопутствующей инфекции при повышении температуры тела > 37,5 °C (класс IV, GCP).
— Рекомендуется лечение лихорадки (при температуре > 37,5 °C) при помощи парацетамола и физического охлаждения (класс III, уровень С).
— Профилактическое назначение антибиотиков не рекомендуется у пациентов с ненарушенным иммунитетом (класс II, уровень В).
Под базисной терапией подразумеваются основные терапевтические стратегии, направленные на стабилизацию состояния тяжело больных пациентов и коррекцию тех нарушений, которые могут осложнить восстановление неврологических функций [2, 106]. Базисная терапия включает поддержание функций дыхания и кровообращения, коррекцию метаболических и волемических нарушений, контроль уровня артериального давления, профилактику и лечение таких состояний, как припадки, венозные тромбозы, дисфагии, аспирационные пневмонии и другие инфекционные осложнения, коррекцию повышенного внутричерепного давления. К сожалению, многие аспекты базисной терапии не были адекватно исследованы в рандомизированных клинических исследованиях.
Общепринятой практикой является активный мониторинг неврологического статуса и таких жизненно важных показателей, как артериальное давление, пульс, уровень глюкозы и температура тела. Для оценки неврологического статуса могут быть использованы такие общепризнанные неврологические шкалы, как Шкала инсульта NIH [104] или Скандинавская шкала инсульта [357]. Исходя из рандомизированных клинических испытаний, не существует прямых указаний, с какой частотой должен выполняться мониторинг показателей. Однако в исследованиях, касающихся организации отделений для лечения острых нарушений мозгового кровообращения [119], практиковалось наблюдение и обследование как минимум каждые 4 часа в течение первых 72 часов от начала заболевания.
В клинических исследованиях с использованием длительного дистанционного мониторинга [358, 359] было показано некоторое преимущество в отношении выявления осложнений и уменьшения продолжительности пребывания в отделении, однако клинические исходы были неубедительны. В более интенсивном мониторинге нуждаются определенные группы пациентов, в частности, с расстройствами уровня сознания, прогрессирующим неврологическим дефицитом или с сопутствующими кардиореспираторными заболеваниями. Тщательный мониторинг также требуется в течение первых 24 часов после тромболитической терапии. Процедуры, требующие инвазивных вмешательств, таких как установка центрального венозного катетера или измерение внутричерепного давления, должны выполняться только у очень узкого контингента больных.
10.1. Легочная функция и защита дыхательных путей
Нормальная дыхательная функция с адекватной оксигенацией крови крайне важна в острейшем периоде для защиты ишемизированной ткани мозга. Однако не доказана эффективность применения подачи кислорода с низкой скоростью в качестве рутинной терапии [360].
Выявление и лечение гипоксии крайне важно и требует индивидуального подхода у пациентов с обширным поражением ствола головного мозга или полушария, эпилептическими припадками или такими осложнениями, как пневмония, сердечная недостаточность, тромбоэмболия легочной артерии и обострение бронхообструктивных заболеваний. Улучшить оксигенацию обычно удается при помощи подачи кислорода (2–4 литра) через назальный катетер. Искусственная вентиляция легких крайне необходима у пациентов с тяжелыми дыхательными расстройствами. Перед началом искусственной вентиляции легких должны быть обсуждены следующие вопросы: прогноз заболевания, сопутствующие заболевания, желание самого пациента.
10.2. Поддержание сердечной деятельности
Аритмии, особенно мерцательная аритмия, довольно часто встречаются после инсульта; частыми осложнениями также являются сердечная недостаточность, инфаркты миокарда и внезапная смерть [361, 362]. У незначительного количества пациентов с инсультом определяется повышенное содержание уровня тропонина, которое свидетельствует о повреждении миокарда [363]. Всем пациентам при поступлении в стационар необходимо выполнять ЭКГ. Мониторинг сердечной деятельности должен проводиться с целью выявления мерцательной аритмии. Необходимо стремиться к поддержанию оптимального сердечного выброса с поддержанием высоких цифр АД и нормальной частотой сердечных сокращений. Использование инотропной поддержки не является рутинной практикой, но инфузионная терапия обычно используется для коррекции гиповолемии. Повышение сердечного выброса должно приводить к увеличению перфузии головного мозга. Иногда может потребоваться восстановление нормального сердечного ритма с помощью медикаментов, кардиоверсии или водителей ритма.
10.3. Инфузионная терапия
Большинство пациентов с инсультом при поступлении в стационар дегидратированы, и это может быть связано с плохим исходом заболевания [364]. Несмотря на ограниченную доказательность клинических исследований, внутривенная инфузионная терапия обычно является частью лечения острого инсульта, особенно у пациентов с риском дегидратации (пациенты с угне-тением уровня сознания и нарушением функции глотания). Не рекомендуется использование раствора декстрозы в раннем периоде инсульта в соответствии с опытом ведения гипергликемических состояний [365]. Большая часть исследований не показала положительного влияния внутривенной инфузионной терапии и гемодилюции на исход инсульта [366].
10.4. Коррекция артериального давления
Мониторинг и коррекция артериального давления — противоречивая область в ведении пациентов с инсультом. У больных с повышенным или пониженным уровнем артериального давления в первые 24 часа чаще возникает неврологическое ухудшение и неблагоприятный исход [367]. Пониженное артериальное давление в дебюте инсульта встречается редко [368] и может быть результатом обширного инфаркта мозга, сердечной недостаточности, ишемии, гиповолемии или сепсиса. Артериальное давление можно адекватно повысить путем введения кристаллоидных растворов. Пациенты со сниженным сердечным выбросом обычно нуждаются в инотропной поддержке. Тем не менее клинические исследования по активному повышению пониженного артериального давления у пациентов с острым инсультом не дали положительных результатов. В систематических обзорах не было получено данных о влиянии различных препаратов, снижающих АД, на клинические исходы [369].
В небольших исследованиях суррогатных маркеров церебрального кровотока при помощи ОФЭКТ было выявлено, что ни периндоприл, ни лозартан не снижают церебральный кровоток при использовании данных препаратов в течение первых 2–7 дней от начала инсульта. Несколько продолжающихся в настоящее время исследований должны ответить на вопрос, может ли снижаться артериальное давление после острого инсульта и сколько следует продолжать гипотензивную терапию после инсульта [371, 372].
При отсутствии доказательной базы многими специалистами создаются собственные протоколы коррекции высоких цифр АД. В некоторых центрах принято снижение уровня АД в тех ситуациях, когда оно превышает пределы 220 мм рт.ст. (систолическое) или 120 мм рт.ст. (диастолическое). Однако в ряде центров принято снижать АД только в случае тяжелой сердечной недостаточности, острой почечной недостаточности, расслоении дуги аорты или злокачественной гипертензии. При использовании тромболитической терапии уровень систолического АД не должен превышать 185 мм рт.ст. Необходимо избегать использования нифедипина вследствие быстрого снижения уровня АД [373]. В Северной Америке с гипотензивной целью наиболее часто используются лабеталол и урапидил, иногда рекомендуется использование нитропруссида натрия.
10.5. Коррекция уровня глюкозы
Частота гипергликемии достигает 60 % у больных с инсультом без диабета в анамнезе [374, 375]. Имеется тесная связь гипергликемии после инсульта с более обширными очагами инфаркта с вовлечением коры и с плохим функциональным исходом [376–378]. Не существует убедительных доказательств того, способна ли активная сахароснижающая терапия улучшить исходы у больных. В крупном рандомизированном исследовании коррекции гликемии при помощи глюкозо-калиево-инсулиновой смеси по сравнению с физиологическим раствором не было выявлено различий по летальности или функциональному исходу у пациентов с умеренной гипергликемией (медиана 137 мг/дл [7,6 ммоль/л]). Данная терапия была достаточно интенсивной и вызывала эпизоды гипогликемии. В настоящее время рутинное использование инфузий инсулина у больных с умеренной гипергликемией не может быть рекомендовано. Тем не менее обычной практикой в инсультных отделениях является снижение уровня гликемии, если она превышает 180 мг/дл (10 ммоль/л) [119]. Внутривенное применение физиологического раствора и отказ от использования растворов глюкозы в течение первых 24 часов после инсульта является общепринятой практикой и обычно приводит к снижению уровня гликемии [365].
Гипогликемия (< 50 мг/дл [< 2,8 ммоль/л]) может имитировать острый ишемический инсульт, купировать ее необходимо внутривенным болюсным введением раствора декстрозы или инфузией 10–20% раствора глюкозы [379].
10.6. Коррекция температуры тела
В экспериментальных исследованиях была показана связь гипертермии с увеличением объема очага инфаркта и плохим исходом [380]. Повышение температуры тела возможно при помощи центральных механизмов или в результате сопутствующей инфекции и связано с неблагоприятным клиническим исходом [381–383]. При повышении температуры тела необходим поиск инфекционного процесса. Исследования с использованием антипиретиков дали неубедительные результаты, использование парацетамола при повышении температуры (> 37,5 °C ) является обычной практикой у больных с инсультом.
11. Специфическая терапия
Рекомендации:
— Внутривенное введение rtPA (0,9 мг/кг, максимально — 90 мг), с введением 10% дозы болюсом и последующей инфузией в течение 60 минут, рекомендуется в течение 3 часов после начала ишемического инсульта (класс I, уровень А).
— Внутривенное введение rtPA может быть также успешным при остром ишемическом инсульте после 3 часов от начала заболевания (класс I, уровень В), но не рекомендуется для рутинного использования в клинической практике.
— Использование мультимодального визуализационного критерия может быть полезно для отбора пациентов на тромболизис, но не рекомендуется для рутинного использования в клинической практике (класс III, уровень C).
— Перед тромболитической терапией рекомендуется снижение артериального давления, в случае повышения его до 185/110 мм рт.ст. и выше (класс IV,GCP).
— Внутривенное введение rtPA может быть использовано у пациентов с припадками в начале заболевания, если неврологический дефицит связан с острой церебральной ишемией (класс IV, GCP).
— Внутривенное введение rtPA также может быть назначено избранным пациентам младше 18 лет и старше 80 лет, хотя это находится за пределами настоящих инструкций к препарату, принятых в Европе (класс III, уровень C).
— В качестве дополнительного метода лечения острой окклюзии СМА в течение 6-часового терапевтического окна рекомендуется внутриартериальное лечение (класс II, уровень В).
— Внутриартериальный тромболизис рекомендуется в случае острой базилярной окклюзии для избранных пациентов (класс III, уровень B). Внутривенный тромболизис в случае базилярной окклюзии является допустимой альтернативой даже после 3 часов (класс III, уровень B).
— Не рекомендуется начинать прием аспирина или другой антитромботической терапии, если планируется проведение тромболитической терапии (класс IV, GСP).
— Использование других антитромбоцитарных препаратов (одиночно или комбинированных) не рекомендуется в лечении острого ишемического инсульта (класс III, уровень С).
— Не рекомендуется назначение ингибиторов гликопротеиновых IІb–IIIa рецепторов (класс I, уровень A).
— У пациентов с острым ишемическим инсультом не рекомендуется раннее назначение нефракционированного, низкомолекулярного гепарина и гепариноидов (класс I, уровень A).
— В настоящее время отсутствуют рекомендации по лечению острого ишемического инсульта при помощи нейропротективных препаратов (класс I, уровень A).
Коментар робочої групи
Проведення базисної терапії пацієнтам з ішемічним інсультом визначається наказом МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія». На відміну від клінічних настанов в лікувальній програмі, затвердженій наказом, передбачене використання ноотропних препаратів та нейропротекторів, ефективність яких не доведена і не рекомендована.
11.1. Тромболитическая терапия
11.1.1. Внутривенное введение тканевого активатора плазминогена
Тромболитическая терапия с помощью rtPA (0,9 мг/кг массы тела, максимальная доза 90 мг), вводимого в течение 3 часов после начала инсульта, значительно улучшает исход у пациентов с острым ишемическим инсультом [126]: NNT, необходимое для достижения благоприятного клинического исхода после 3 месяцев, равно 7. С другой стороны, в результате исследований ECASS (European Cooperative Acute Stroke Study) и ECASS II не было обнаружено статистически значимого превосходства rtPA в отношении первичных конечных точек при терапии в первые 6 часов [384, 385]. Исследования rtPA, включившие в целом 2889 пациентов, выявили значительное уменьшение числа пациентов с летальным исходом и зависимостью (ОШ 0,83; 95% ДИ 0,73–0,94) [386]. Объединенный анализ индивидуальных данных исследований rtPA продемонстрировал, что даже в течение 3-часового окна раннее начало лечения приводит к лучшим результатам (0–90 мин: ОШ 2,11; 95% ДИ от 1,33 до 3,55; 90–180 мин: ОШ 1,69; 95% ДИ от 1,09 до 2,62) [387]. Этот анализ предполагает благоприятный результат до 4,5 часа. Продолжающиеся исследования (ECASS III, IST-3) являются дальнейшими исследованиями положительного эффекта rtPA за пределами 3-часового терапевтического окна.
Коментар робочої групи
rtPA — це умовне скорочення терміну «рекомбінантний тканинний активатор плазміногену (рТАП)»
Исследование NINDS (National Institute of Neurological Disorders and Stroke) продемонстрировало, что размеры ранних ишемических изменений (используя оценку ASPECT) не оказывают влияния на лечение в течение 3-часового терапевтического окна [388]. Однако Европейские регулирующие агентства не рекомендуют лечение rtPA у больных с тяжелым инсультом (NIHSSS ≥ 25), при распространенных ранних ишемических изменениях на КТ или в возрасте старше 80 лет (в отличие от рекомендацией США). Тем не менее обсервационные исследования предполагают, что rtPA, данный в течение 3 часов от начала инсульта, является безопасным и эффективным у пациентов старше 80 лет [389–391], что, однако, требует больше рандомизированных данных. Эффект половой принадлежности на чувствительность к rtPA не является очевидным [392].
Тромболитическая терапия является безопасной и эффективной в госпиталях любого типа, если диагноз поставлен врачом, являющимся специалистом в области инсульта, и снимок КТ оценивается опытным специалистом [393–395]. Риск и потенциальная польза rtРА должны обсуждаться всякий раз, когда это возможно, с пациентом и его семьей до того, как лечение будет начато.
Артериальное давление должно быть ниже 185/110 мм рт.ст. до проведения тромболизиса и 24 часа после. Требуется контроль высокого артериального давления [126]. Нарушение протокола связано с повышением уровня смертности [396, 397].
В небольшом рандомизированном исследовании продолженное ультразвуковое исследование было связано с повышенным уровнем ранней реканализации после rtРА [398]; этот эффект может быть усилен использованием микропузырьков [399]. Впрочем, рандомизированное клиническое исследование было остановлено по неизвестным причинам.
Внутривенное введение rtРА может быть успешным также в случае острого ишемического инсульта после 3 часов от начала заболевания, но не рекомендуется в рутинной клинической практике. Использование мультимодального визуализационного критерия может быть полезно для избранных пациентов. Несколько крупных исследований предполагают лучшую безопасность и возможно лучшую эффективность у пациентов, получавших rtРА после 3 часов, на основании дополнительных визуализационных данных [131, 160, 400, 401]. Впрочем, доступные данные о несоответствии, выявляемые с помощью мультимодальных КТ и МРТ, являются слишком ограниченными для ведения тромболизиса в рутинной практике (см. также раздел по визуализации) [153].
Пациенты с припадками в начале инсульта исключались из тромболитических исследований в связи с возможным послеприпадочным параличом Тодда. Серии случаев предполагают, что тромболизис может быть использован у пациентов в случае верификации нового ишемического инсульта [389].
Анализ результатов выявил следующие возможные факторы, связанные с повышенным риском осложнений в виде внутричерепных кровоизлияний после использования rtРА [402]:
— повышенный уровень глюкозы;
— диабет в анамнезе;
— выраженные симптомы инсульта;
— пожилой возраст;
— длительный промежуток времени до лечения;
— предшествующий прием аспирина;
— застойная сердечная недостаточность в анамнезе;
— недостаточная активность ингибитора активатора плазминогена;
— нарушение протокола NINDS.
Впрочем, ни один из этих факторов не перевешивает потенциальную выгоду от лечения rtPA.
11.1.2. Другие тромболитические препараты для внутривенного введения
Внутривенное введение стрептокиназы было связано с недопустимым риском кровоизлияний и смерти [403, 404]. Внутривенное назначение десмотеплазы от 3 до 9 часов после острого ишемического инсульта у пациентов, отобранных на основании визуализации области диффузионно-перфузионного несоответствия, было связано с повышенным уровнем реперфузии и лучшими клиническими результатами по сравнению с плацебо в двух небольших рандомизированных клинических исследованиях [405, 406]. Эти данные не были подтверждены в фазе III DIAS (Desmoteplase in Acute Ischemic Stroke) II исследования, однако планируется продолжение исследований.
11.1.3. Внутриартериальный и комбинированный (ВВ + ВА) тромболизис
Внутриартериальная тромболитическая терапия при проксимальной окклюзии СМА с помощью проурокиназы была связана со значительно лучшими результатами в исследовании PROACT II (Pro-urokinase for Acute Ischemic Stroke) [154]. Дополнительные меньшие рандомизированные клинические исследования с проурокиназой (PROACT I) или урокиназой (MELT) и метаанализ PROACT I, PROACT II и MELT показали выгоду внутриартериальной тромболитической терапии у пациентов с проксимальной окклюзией СМА [407]. Внутриартериальный тромболизис с rtPA не подтвержден рандомизированными клиническими исследованиями, но данные наблюдений и нерандомизированных сравнений доступны [155, 408].
Уже начато рандомизированное исследование, сравнивающее стандартное внутривенное введение rtPA с комбинированным внутривенным и внутриартериальным введением (IMS3) [409].
Внутриартериальное лечение острой базилярной окклюзии при помощи урокиназы или rtPA было доступно на протяжении более чем 20 лет, но оно еще не исследовано адекватно рандомизированными клиническими исследованиями [410], хотя обнадеживающие результаты были получены при обсервационных исследованиях [411, 412]. Систематический анализ не выявил значительных различий между внутривенным и внутриартериальным тромболизисом при базилярной окклюзии [413].
Коментар робочої групи
Проведення системної внутрішньовенної тромболітичної терапії передбачено програмою проведення диференційної терапії пацієнтам з ішемічним інсультом (наказ МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія» та наказ МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія», п. 1.45 «Алгоритм лікувально-діагностичних заходів при гострих порушеннях мозкового кровообігу (ішемічний інсульт)».
На теперішній час в Україні внутрішньовенна тромболітична терапія проводиться лише у незначної частки пацієнтів з ішемічним інсультом. Причинами цього є:
— утруднення в проведенні нейровізуальних досліджень у пацієнтів із гострим порушенням мозкового кровообігу в терміні до 3 годин із моменту розвитку інсульту;
— відсутність затвердженого протоколу проведення тромболізису;
— недостатня кількість інсультних відділень, оснащених медичним обладнанням для проведення нейровізуальних методів дослідження головного мозку та укомплектованих кваліфікованим персоналом для проведення внутрішньовенної системної тромболітичної терапії.
11.1.4. Устройства для внутриартериальной реканализации
Исследование MERCI (Mechanical Embolus Removal in Cerebral Embolism) оценивало устройство для удаления тромба из внутричерепных артерий. Реканализация была достигнута у 48 % (68/141) пациентов, у которых устройство использовалось в течение 8 часов после появления симптомов инсульта [414]. Ни для какого реканализационного оборудования не проведено рандомизированных клинических исследований с конечными данными.
Коментар робочої групи
У результаті розвитку медичних технологій та удосконалення медичної апаратури на теперішній час значно розширено можливості реканалізаційних інтервенційних втручань при тромбоемболічних інсультах (порівняно з роком написання даних рекомендацій). Ендоваскулярні втручання дозволяють ефективно здійснювати видалення тромбів при тромбооклюзіях церебральних артерій в екстра- та/або інтракраніальних ділянках.
11.2. Антитромбоцитарная терапия
Результаты двух больших рандомизированных слепых исследований продемонстрировали эффективность и безопасность аспирина при его назначении в первые 48 часов после перенесенного инсульта [415, 416], в абсолютных цифрах это означало дополнительно 13 выживших и независимых пациентов на каждую 1000 пролеченных больных. Более того, лечение увеличивало отношение шансов благоприятного исхода (OR 1,06; 95% CI 1,01–1,11): у дополнительных 10 пациентов наблюдалось полное восстановление на каждую 1000 пролеченных пациентов. Антиагрегантная терапия приводила к небольшому, но достоверному увеличению количества симптомных внутримозговых кровоизлияний (у дополнительных 2 пациентов на 1000 пролеченных).
Рандомизированное двойное слепое плацебо-контролируемое исследование показало, что аспирин (325 мг), принимаемый однократно с началом терапии в первые 48 часов от ишемического инсульта и далее ежедневно в течение 5 дней, значительно не уменьшал степень тяжести инсульта по сравнению с плацебо (RR 0,95; 95% CI 0,62–1,45) в группе пациентов с неглубоким парезом [417]. Исследований клопидогреля, дипиридамола или их комбинации в остром периоде ишемического инсульта не проводилось.
В двойном слепом исследовании II фазы ингибитор гликопротеиновых IІb–IIIa рецепторов абциксимаб не продемонстрировал эффективности в отношении благоприятного функционального исхода, определяемого по модифицированной шкале Рэнкина через 3 месяца, по сравнению с плацебо (OR 1,20; 95% CI 0,84–1,70) [418]. Исследование III фазы эффективности и безопасности абциксимаба было прекращено досрочно после включения 808 пациентов вследствие значительной частоты симптомных или фатальных кровоизлияний в группе, получавшей абциксимаб, по сравнению с плацебо (5,5 % vs. 0,5 %; P = 0,002). В данном исследовании также не было выявлено эффективности абциксимаба в отношении функционального исхода инсульта [419].
11.3. Ранняя антикоагулянтная терапия
Эффективность подкожного введения нефракционированного гепарина в низких или средних дозах [415], надропарина [420, 421], сертопарина [422], тинзапарина [423], дальтепарина [424] и внутривенного введения данапароида [425] была не доказана при назначении в первые 24–48 часов от развития инсульта. Улучшению исхода заболевания и снижению частоты повторных инсультов было противопоставлено увеличение частоты геморрагических осложнений. По результатам метаанализа, включившего результаты 22 исследований, на 1000 пациентов с инсультом, леченных антикоагулянтами, повторные ишемические инсульты развивались у девяти пациентов (OR 0,76; 95% СI 0,65–0,88), внутричерепные гематомы — более чем у девяти больных на 1000 (OR 2,52; 95% СI 1,92–3,30) [426]. Однако качество этих исследований было разным. Исследовались в основном нефракционированный гепарин, низкомолекулярный гепарин, гепариноиды, пероральные антикоагулянты и ингибиторы тромбина.
Коментар робочої групи
Станом на 01.06.2012 р. лікарські засоби сертопарин, тинзапарин, дальтепарин, данапароїд не зареєстровані в Україні.
Некоторые исследования оценили взаимоотношение риск — польза при очень раннем назначении нефракционированного гепарина в остром периоде ишемического инсульта. По данным одного исследования, у пациентов с нелакунарным инсультом, которым назначалась антикоагулянтная терапия в первые 3 часа от развития заболевания, был выше индекс самообслуживания (38,9 % vs. 28,6 %; Р = 0,025), смертности (16,8 % vs. 21,9 %; Р = 0,189) и симптомных внутримозговых гематом (6,2 % vs 1,4 %; Р = 0,008) [427]. По данным исследования RAPID (предотвращение ишемического повреждения мозга при раннем назначении антикоагулянтов), пациенты, которым назначался нефракционированный гепарин, имели меньший процент повторных инсультов и примерно сходный процент серьезных геморрагических осложнений по сравнению с группой, получавшей аспирин [428]. Геморрагические осложнения в группе больных, леченных нефракционированным гепарином, были связаны с неадекватной дозой препарата в плазме. В свете этих результатов эффективность раннего назначения нефракционированного гепарина оспаривается [429, 430].
В клинических исследованиях еще не определена эффективность гепаринотерапии при разных подтипах инсульта. Метаанализ исследований, включивших только пациентов с кардиоэмболическим инсультом, которым антикоагулянтная терапия назначалась в первые 48 часов от развития симптоматики, выявил недостоверное снижение частоты повторных инсультов и незначительное снижение смертности и инвалидизации [431]. Несмотря на небольшое количество данных, некоторые специалисты рекомендуют назначение полной дозы гепарина пациентам с кардиальным источником эмболии и высоким риском реэмболии, артериальной диссекцией и высокой степенью стеноза артерий перед оперативным лечением. Противопоказаниями для назначения гепаринотерапии являются: большой объем инфаркта (более 50 % бассейна средней мозговой артерии), неконтролируемая артериальная гипертензия и наличие микроциркуляторных нарушений в мозге.
11.4. Нейропротекция
Нейропротективной программы, продемонстрировавшей достоверное улучшение исхода заболевания, не существует. Результаты недавних исследований RCTs эффективности ловушек свободных радикалов [432] и сульфата магнезии [433] оказались негативными. Продолжается III фаза рандомизированного плацебо-контролируемого исследования антиоксидантной терапии с использованием мочевой кислоты, назначаемой после системного тромболизиса rtPA. II фаза испытания показала безопасность терапии [434]. Метаанализ результатов исследований выявил умеренную эффективность цитиколина [435]; клинические исследования эффективности этого препарата продолжаются.
Коментар робочої групи
Слід зазначити, що, незважаючи на відсутність доказів ефективності використання нейропротекторів та розчину сульфату магнію при наданні медичної допомоги пацієнтам з ішемічним інсультом, використання цих препаратів регламентується наказом МОЗ України від 17.01.2005 р. № 24 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Медицина невідкладних станів» та наказом МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія».
Існує необхідність приведення вимог нормативних документів, затверджених МОЗ України щодо проведення застосування лікарських засобів з недоведеною клінічною ефективністю, до тверджень клінічних настанов.
11.5. Отек мозга и повышенное внутричерепное давление
Рекомендации
— Хирургическая декомпрессия в течение 48 часов после начала симптомов рекомендуется у пациентов в возрасте до 60 лет с развившимся злокачественным инфарктом СМА (класс I, уровень C).
— Осмотерапия может быть использована для лечения предполагаемого повышенного внутричерепного давления (класс III, уровень C).
— Нет никаких рекомендаций насчет гипотермической терапии у пациентов с инфарктом, сопровождающимся объемным эффектом (класс IV, уровень GCP).
— Вентрикулостомия или хирургическая декомпрессия может проводиться при больших мозжечковых инфарктах, сдавливающих ствол мозга (класс III, уровень C).
Отек, сопровождающийся объемным эффектом, является главной причиной ухудшения состояния и смерти у пациентов с большими супратенториальными инфарктами. Угрожающий жизни отек головного мозга обычно развивается между 2-м и 5-м днем после начала инсульта, хотя у третьей части пациентов нарастание неврологической симптоматики может отмечаться в течение 24 часов после появления симптоматики [436, 437].
11.5.1. Медикаментозное лечение
Медикаментозное лечение пациентов с большими инфарктами, сопровождающимися объемным эффектом и отеком мозга, основывается в основном на данных наблюдения. Базовый подход включает положение головного конца кровати под углом 30 градусов, исключение вредных воздействий, устранение болевых ощущений, правильную оксигенацию и нормализацию температуры тела. Если доступно мониторирование внутричерепного давления (ВЧД), церебральное перфузионное давление должно поддерживаться выше 70 мм рт.ст. [438]. Внутривенное введение 10%-ного раствора глицерола (4 250 мл 10%-ного глицерола до 30–60 минут) или маннитола (25–50 г каждые 3–6 часов) является медикаментозным лечением первого выбора при клинических или рентгенологических признаках злокачественного отека [439, 440]. Гипертонические солевые растворы, вводимые внутривенно, также вероятно эффективны [441]. В качестве заместительных жидкостей следует избегать использования гипотонических и глюкозосодержащих растворов. Дексаметазон и кортикостероиды не приносят пользы [442]. Болюсное введение тиопентала может привести к быстрому и значительному снижению ВЧД и может быть также использовано для лечения острого криза. Лечение барбитуратами требует мониторинга ВЧД и энцефалографии (ЭЭГ) и тщательного наблюдения за гемодинамикой, так как может наблюдаться падение артериального давления.
11.5.2. Гипотермия
Умеренная гипотермия (а именно температура мозга между 32 и 33 °C) снижает частоту смертельных исходов у пациентов с тяжелыми инфарктами в бассейне СМА, но может вызвать ряд серьезных побочных эффектов включающих резкое повышение ВЧД во время обратного согревания [443, 444]. В небольшом рандомизированном контролируемом исследовании умеренная гипотермия в сочетании с хирургической декомпрессией привели к лучшим клиническим результатам, чем изолированное хирургическое лечение (P = 0,08) [445].
11.5.3. Хирургическая декомпрессия
Злокачественный инфаркт в бассейне СМА
Объединенный анализ 93 пациентов, включенных в исследования DECIMAL (decompressive craniectomy in malignant middle cerebral artery infarcts), DESTINY (decompressive surgery for the treatment of malignant infarction of the middle cerebral artery) и HAMLET (hemicraniectomy after middle cerebral artery infarction with life-threatening edema trial), показал, что по сравнению с контрольной группой через год у пациентов в группе декомпрессионной хирургии было больше пациентов с баллом по модифицированной шкале Рэнкина (мшР) ≤ 4 или ≤ 3 и был более высокий процент выживших (NNTs 2, 4 и 2 соответственно) [446, 447].
Не отмечалось положительной динамики у пациентов, перенесших хирургическое лечение в вегетативном состоянии (мшР 5). Критериями включения в данный комбинированный анализ являлись возраст 18–60 лет, балл по шкале NIH > 15, уровень сознания 1 балл или выше при ответе на вопрос 1а по NIHSSS, признаки инфаркта СМА на КТ 50 % и более или > 145 см3 по ДВИ, появление симптомов < 45 часов (хирургическое лечение < 48 часов). Исследование последующих выживаемости и функционального статуса свыше одного года в настоящее время продолжается в исследованиях DECIMAL и DESTINY [447].
Систематический обзор 12 обсервационных ретроспективных исследований выявил в качестве плохого предрасполагающего фактора возраст старше 50 лет. Время хирургического вмешательства, сторона инфаркта, клинические признаки вклинения и вовлечение других сосудистых территорий не сильно ухудшают конечный результат [448].
Инфаркт мозжечка
Вентрикулостомия и декомпрессивное хирургическое лечение являются методом выбора для мозжечковых инфарктов, сопровождающихся объемным эффектом, хотя имеется недостаток рандомизированных контролируемых исследований. В случае супратенториальных инфарктов, сопровождающихся объемным эффектом, операция должна проводиться перед развитием признаков вклинения. Прогноз среди выживших пациентов может быть весьма благоприятным даже у пациентов, находящихся в коме перед операцией.
Коментар робочої групи
Відповідно до наказу МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія», п. 1.23 «Клінічний протокол надання нейрохірургічної допомоги хворим з ішемічним інсультом», можливе хірургічне декомпресійне втручання, показане у випадку розвитку прогресуючого ішемічного набряку і пов’язаних з ним грубих дислокаційних ускладнень.
12. Предупреждение и лечение осложнений
Рекомендации
— Для лечения инфекционных осложнений после инсульта рекомендовано использование антибиотиков (класс IV, GCP).
— Профилактическое использование антибиотиков не рекомендовано, и левофлоксацин может быть вреден для пациентов с острым инсультом (класс II, уровень B).
— Ранняя регидратация и использование компрессионных чулок рекомендовано для уменьшения риска тромбоэмболий (класс IV, GCP).
— Ранняя мобилизация рекомендована для предотвращения таких осложнений, как аспирационная пневмония, тромбозы глубоких вен и пролежни (класс IV, GCP).
— Подкожное введение гепарина или низкомолекулярных гепаринов показано пациентам с высоким риском венозных тромбозов и ТЭЛА (класс I, уровень A).
— Назначение антиконвульсантов рекомендовано для профилактики повторных постинсультных судорожных припадков. Профилактическое использование антиконвульсантов у пациентов, не имевших эпиприпадков во время развития инсульта, не рекомендовано (класс IV, GCP).
— Оценка степени риска рекомендована у каждого пациента с инсультом (класс IV, GCP).
— Добавки с кальцием/витамином D рекомендованы пациентам после инсульта с риском падений (класс II, уровень B).
— Бисфосфонаты (алендроновая кислота, этидроновая кислота и ризедроновая кислота) рекомендованы женщинам, имевшим переломы (класс II, уровень B).
— Пациентам с недержанием мочи рекомендована консультация специалиста (класс III, уровень C).
— Обязательна оценка функции глотания, однако недостаточно данных, рекомендующих специфическое лечение таких нарушений (класс III, GCP).
— Питание per os рекомендовано пациентам без дисфагии (класс II, уровень B).
— Ранняя постановка назогастрального зонда (в первые 48 часов) рекомендована пациентам с нарушениями глотания (класс II, уровень B).
— Гастростомия не рекомендована в первые 2 недели после развития инсульта (класс II, уровень B).
12.1. Аспирация и пневмония
Бактериальная пневмония является одним из наи-более серьезных осложнений после инсульта [449], и основная причина ее — аспирация [450]. Аспирационные осложнения наиболее часто наблюдаются у пациентов с нарушениями сознания и дисфагиями. Кормление через рот возможно только у пациентов, способных спокойно глотать маленькие порции жидкости и с сохранным кашлевым рефлексом по команде. Постановка назогастрального зонда или гастростомия способны предотвратить аспирационные пневмонии; гипостаз, нарушения кашлевого рефлекса и иммобилизация увеличивают такой риск. Частые изменения положения пациента в кровати и дыхательные упражнения способствуют предотвращению аспирационных пневмоний. Иммуносупрессивное состояние после инсульта также способствует развитию постинсульт-ных инфекций [451, 452]. Профилактическое использование левофлоксацина (500 мг/100 мл в день в течение 3 дней) не лучше, чем оптимальная профилактика инфекций у пациентов с острым инсультом, и обратно связано с исходом к 90-му дню (OR 0,19; 95% CI 0,04–0,87; Р = 0,03) [453].
12.2. Тромбозы глубоких вен и ТЭЛА
Риск тромбозов глубоких вен и ТЭЛА может быть снижен путем ранней гидратации и ранней мобилизации. Использование компрессионных чулок эффективно предотвращает венозные тромбоэмболии у хирургических пациентов, их эффективность у пациентов с инсультом не изучена [454]. У пациентов с инсультом использование низкомолекулярных гепаринов уменьшает риск тромбозов глубоких вен (OR 0,34; 95% CI 0,19–0,59) и ТЭЛА (OR 0,36; 95% CI 0,15–0,87) без увеличения риска интрацеребральных (OR 1,39; 95% CI 0,53–3,67) или экстрацеребральных (OR 1,44; 95% CI 0,13–16) геморрагий. NNT: 7 и 38 для тромбозов глубоких вен и ТЭЛА соответственно, низкие дозы нефракционированного гепарина снижают риск тромбозов (OR 0,17; 95% CI 0,11–0,26), но не влияют на частоту ТЭЛА (OR 0,83; 95% CI 0,53–1,31); риск интрацеребральных геморрагий статистически незначимо увеличивается (OR 1,67; 95% CI 0,97–2,87) [455].
Тем не менее профилактическое использование подкожно низких доз гепарина (5,000 в/в дважды в день) или низкомолекулярных гепаринов показано пациентам с высоким риском тромбозов глубоких вен и ТЭЛА (особенно в состоянии иммобилизации, ожирения, с диабетом, повторным инсультом) [456, 457].
12.3. Пролежни
Основная стратегия для профилактики пролежней заключается в частых перемещениях в кровати, рациональном питании и влажной обработке кожи [458]. Кожа пациентов должна содержаться в сухости и чистоте. Для пациентов с высоким риском пролежней должны использоваться водные или воздушные противопролежневые матрасы.
12.4. Эпиприпадки
Парциальные или вторично-генерализованные припадки могут наблюдаться у пациентов в остром периоде инсульта. Для купирования судорог используются стандартные антиэпилептические препараты. В профилактических целях антиконвульсанты не используются.
12.5. Психомоторное возбуждение
Психомоторное возбуждение может быть не только следствием инсульта, но и осложнением лихорадки, колебаний давления или инфекций. Адекватная терапия этого состояния подразумевает использование седативных и антипсихотических препаратов.
12.6. Падения
Падения после инсульта наблюдаются у более чем 25 % больных и могут случаться в момент развития заболевания [459], во время реабилитационных мероприятий [460] и в отдаленном периоде [461]. Факторы риска падений после инсульта — когнитивное снижение, депрессии, нарушения чувствительности [463, 464]. Около 5 % инцидентов заканчиваются серьезными травмами, такими как переломы бедра, которые случаются в 4 раза чаще, чем в сопоставимой возрастной группе без инсульта [467]. Упражнения [469], прием кальция [470], бисфосфоната [471] укрепляют костную ткань и уменьшают опасность переломов у пациентов с инсультом. Протекторы бедра способствуют снижению риска переломов у пациентов из группы высокого риска, однако очевидно снижение мотивации к их использованию у таких больных [472].
12.7. Инфекции мочеполовой системы
Серьезной проблемой является возникновение уроинфекций при катетеризации мочевого пузыря [473, 474]. Периодическая катетеризация не снижает риска инфекций. Как только урологическая инфекция диа-гностирована, необходимо назначение антибиотикотерапии. Профилактического назначения антибиотиков следует избегать в связи с риском формирования бактериальной резистентности.
Нарушения мочеиспускания часто наблюдаются после инсультов, особенно у пожилых, обездвиженных и когнитивно сниженных пациентов [475]. Наблюдения показывают, что нарушения мочеиспускания развиваются у 40–60 % больных в остром периоде инсульта и у 15 % остаются в течение года [476]. Нарушения мочеиспускания — серьезный предиктор плохого функцио-нального восстановления после инсульта. Несомненно, что наблюдение специалиста, правильная оценка нарушений, терпеливый уход со стороны среднего медперсонала в значительной степени помогают справиться с нежелательными симптомами после инсульта [477, 478].
12.8. Дисфагия и кормление
Орофарингеальная дисфагия развивается у 50 % больных с полушарным ишемическим инсультом [479]. Преобладают явления дисфагии в остром периоде инсульта и снижаются до 15 % к концу 3-го месяца [480]. Дисфагия ассоциируется с высоким риском медицинских осложнений и увеличивает риск внезапной смерти [479].
Голодание или недостаточное питание приводит к активизации катаболических процессов и отягчает течение острого инсульта. Случаи недостаточного питания («недоедания») варьируют от 7 до 15 % в остром периоде [481, 182] и от 22 до 35 % спустя 2 недели от развития инсульта [483]. Среди пациентов, требующих длительной реабилитации, «недоедание» может достигать 50 % [484]. Недостаточное питание является предиктором плохого функционального восстановления [485] и высокой смертности [486, 487]. Рутинные добавки для всех пациентов с инсультом не уменьшают риск осложнений [488]. Неадекватное кормление способствует риску «недоедания» при инсульте.
Для пациентов с дисфагией оптимально энтеральное питание с помощью назогастрального зонда или гастростомии. Исследование раннего (спустя 48 часов от развития инсульта) и отсроченного (спустя 1 неделю) кормления с помощью назогастрального зонда не обнаружило значимой разницы, хотя наблюдалась тенденция к некоторому снижению смертности в ранней группе [488]. Исследование длительного (в течение 30 суток) кормления с помощью назогастрального зонда или гастростомы показало, что использование гастростомии не лучше и даже потенциально более опасно, чем кормление через зонд [488]. Сравнительные исследования кормления через гастростому или назогастральный зонд в течение длительного времени не показали статистически значимых различий [489, 490]. Кроме того, использование гастростом не улучшает качество жизни [491, 492].
13. Реабилитация
Даже при наличии оптимального инсультного отделения, включающего возможность проведения тромболитической терапии, менее одного из трех пациентов полностью восстанавливаются после инсульта [387]. Задачей реабилитации является возможность дать людям с ограниченными возможностями достичь и поддержать на оптимальном уровне физические, интеллектуальные, психологические и/или социальные функции [493]. Цели реабилитации могут меняться: от минимизации повреждения в начале до более сложных вмешательств, разработанных для поддержки активного участия.
Коментар робочої групи
Реабілітація сприяє відновленню функцій, які були втрачені внаслідок інсульту.
Основні завдання рухової реабілітації в ранньому відновлювальному періоді полягають у подальшому розвитку активних рухів, зниженні спастичності, подоланні синкінезій, вдосконалення функції ходьби, підвищення толерантності до фізичних навантажень, тренування стійкості вертикальної пози, навчання навичкам самообслуговування.
Під реабілітацією розуміють комплекс заходів (медичних, психологічних, педагогічних, соціальних, юридичних), направлених на відновлення втрачених в результаті хвороби або травми функцій, на відновлення соціального статусу особи, тобто на її соціальну і психологічну реадаптацію.
Тема реабілітації пацієнтів, які перенесли ішемічний інсульт, більш детально висвітлена в адаптованих клінічних настановах, прототипом яких стали SIGN 118.
13.1. Требования к реабилитации
Рекомендации
— Для всех пациентов с инсультом рекомендуется направление в инсультное отделение для получения координированной мультидисциплинарной реабилитации (класс I, уровень А).
— Рекомендуется раннее начало реабилитации (класс III, уровень С).
— Возможна ранняя выписка пациента из инсульт-ного отделения при стабильности медицинских показателей в случае инсульта легкой или средней степени тяжести при условии дальнейшего продолжения реабилитации мультидисциплинарной бригадой в амбулаторных условиях (класс I, уровень А).
— Рекомендуется продолжать реабилитацию в течение первого года после выписки из больницы (класс II, уровень А).
— Рекомендуется увеличивать продолжительность и интенсивность реабилитации (класс II, уровень В).
Ключевой характеристикой отделения для лечения острых нарушений мозгового кровообращения (инсульта) является реабилитация, осуществляемая мультидисциплинарной бригадой [494]. В исследовании Stroke Unit Trialists’Collaboration было показано улучшение выживаемости и функционального исхода у пациентов, пролеченных в отделениях для лечения острых нарушений мозгового кровообращения: дальнейшее наблюдение в течение 5 и 10 лет выявило сохраняющуюся эффективность по сравнению с группой контроля [495, 496]. Финансовые и социальные вложения в продолженную госпитализацию немедленно повысили интерес у органов здравоохранения в плане содействия раннего возвращения пациентов в общество. Мультидисциплинарная команда, специализированная по инсульту, работающая с пациентами, рано выписанными из стационара, и включающая (как минимум) сестринскую помощь, ЛФК и эрготерапию, может значительно уменьшить количество койко-дней для отдельных больных с легкими или умеренными повреждениями [497, 498]. Однако требуется специализированная служба для работы с выписанными пациентами; смертность значительно увеличивается при ранней выписке, если пациент остается под обычным амбулаторным наблюдением [499].
Метаанализ показал, что продолжение реабилитации в течение 1 года после инсульта снижает риск функциональных ухудшений и улучшает активность в повседневной жизни [500]. Вмешательства, включающие эрготерапию, ЛФК и мультидисциплинарный подход, могут создать оптимальную модель данной службы.
13.2. Начало, продолжительность и интенсивность реабилитации
Оптимальное время начала реабилитации не известно. Сторонники ранней терапии, ссылаясь на данные функциональной нейровизуализации [501] и исследования на животных [502, 503], считают ранний период инсульта наиболее важным для начала реабилитации. Раннее начало реабилитации является ключевым компонентом в отделении для лечения острых нарушений мозгового кровообращения [61], однако нет согласованности в определении «ранней терапии». Исследования, сравнивающие раннее и позднее начало реабилитации, показали улучшение прогноза, если терапия начата в пределах 20–30 дней [504, 505]. Множественные непосредственные осложнения инсульта (тромбоз глубоких вен, пролежни, формирование контрактур, задержка стула и гипостатическая пневмония) связаны с недостаточной подвижностью [506], и, соответственно, мобилизация является фундаментальным компонентом ранней реабилитации. Оптимальное время начала первой мобилизации не ясно, она, видимо, хорошо переносится в течение первых нескольких дней [507]. Предварительные результаты продолжающегося исследования AVERT по реабилитации в течение первых 24 часов показали, что немедленное начало ЛФК хорошо переносится и не увеличивает количество осложнений [508].
Имеются несколько исследований по проведению реабилитации свыше одного года после инсульта с недостаточно убедительными данными для составления рекомендаций касательно этой фазы [509].
Большая интенсивность реабилитации, особенно время, затраченное на активность в повседневной жизни (ADL), связана с лучшими функциональными результатами [510, 511]. Систематическое изучение реабилитационной терапии, направленное на улучшение функционирования руки, также предполагает дозозависимые отношения, хотя гетерогенность включаемых исследований нивелируется формализованными измерениями размера эффекта [512]. Наилучшие результаты отмечались в исследованиях с упражнениями на нижних конечностях и базовых тренировках ADL.
Организация качества помощи может быть значительно более важной, чем абсолютное время проведения терапии [523]. При сравнении специализированной инсультной мультидисциплинарной бригады и обычной реабилитационной бригады, основанной на работе в отделении, специализированная бригада достигает лучших результатов со значительно меньшим количеством часов терапии [514].
13.3. Элементы реабилитации
Рекомендации:
— Рекомендуются лечебная физкультура, однако оптимальный способ терапии не ясен (класс I, уровень А).
— Эрготерапия рекомендована, но оптимальный способ терапии не ясен (класс I, уровень А).
— Хотя рекомендуется оценка коммуникативного дефекта, но нет убедительных данных для рекомендации специфического лечения (класс III , GCP).
— Рекомендуется обеспечивать информацией пациентов и людей, ухаживающих за ними, но доказательная база не подтверждает использования службы связи, касающейся инсульта, для всех пациентов (класс II, уровень В).
— Реабилитация показана для всех пациентов с инсультом, но доказательная база недостаточна по выбору методов подходящей терапии для самых тяжелых пациентов (класс II, уровень В).
— Хотя оценка когнитивных нарушений желательна, но нет достаточных данных для рекомендации специфического лечения (класс I, уровень А).
— Рекомендуется наблюдение пациентов для выявления депрессии в период нахождения в стационаре и после выписки (класс I, уровень В).
— Медикаментозная и немедикаментозная терапия рекомендуется для улучшения настроения (класс 1, уровень А).
— Лекарственная терапия может использоваться для лечения постинсультной эмоциональной лабильности (класс I, уровень В).
— У некоторых пациентов для лечения постин-сультных невропатических болей показано применение трициклических антидепрессантов (класс III, уровень В).
— Ботулотоксин может быть использован для лечения постинсультной спастичности, однако функциональная польза не очевидна (класс III, уровень В).
Результаты исследований по инсультным отделениям показали преимущества специализированной инсультной мультидисциплинарной бригады [515]. Состав этой команды формально не расписан, но обычно в состав входит врач — специалист по инсульту, медсестринский штат, врач ЛФК, эрготерапевт, логопед.
13.3.1. Лечебная физкультура
Оптимальные методики лечебной физкультуры для постинсультной реабилитации неясны [516, 517], но существуют некоторые доказательства в поддержку специфических воздействий. Некоторые исследования показали, что сила может быть улучшена при использовании дозозависимых методик, без повышения спастичности [512]. Функциональная электростимуляция может повышать мышечную силу, но ее эффективность в клиническом исходе не уточнена.
Систематический обзор не выявил эффективности тренировок на тредмиле для улучшения ходьбы [519]. Электромеханический гейт-тренинг в комбинации с физическими упражнениями может быть более эффективным, чем просто физкультура [520]. Имеются недостаточные данные для широкого внедрения данного аппарата и сопутствующего оборудования [521].
Кардиоваскулярная тренировка может отрицательно влиять на течение восстановительного периода инсульта. Физическая нестабильность ухудшает активную реабилитацию и является предиктором риска для дальнейшего исхода [522]. Метаанализ показал, что аэробная нагрузка может улучшать способность к тренировкам у лиц с легким или средней тяжести пост-инсультным дефицитом [469].
Принудительно индуцированная двигательная терапия включает упражнения, направленные на паретичную конечность с ограничением подвижности здоровой конечности. Исследование EXITE выявило позитивные результаты данного метода через 3–9 месяцев после инсульта у группы со стабильными показателями, с сохранением позитивных результатов для руки в течение 1 года [523].
13.3.2. Эрготерапия
Систематический обзор 9 исследований, сравнивающих применение эрготерапии в составе терапии ADL с обычным ведением больных, показал улучшение функционального исхода заболевания у группы больных с эрготерапией [524]. Нет достаточных данных, чтобы сделать выводы об оптимальной модели проведения эрготерапии (ЭТ). Метаанализ исследований, включающих применение ЭТ, показывает улучшение уровня ADL. Наилучшие результаты показаны при лечении пожилых пациентов и использовании целенаправленных вмешательств [525]. Специфическая эрготерапия, основанная на повреждении, не приводит к улучшению ADL. Исследования по проведению ЭТ для ухода в амбулаторных условиях показали снижение функциональных отклонений у группы больных с активным вмешательством [526]. Не существует данных, полученных в результате контролируемых исследований, свидетельствующих об эффективности ЭТ спустя год после перенесенного инсульта.
13.3.3. Логопедическая терапия
Логопедическая терапия может оптимизировать безопасность глотания, способствовать восстановлению навыков коммуникации. В 2 исследованиях с правильной логопедической терапией дисфагии было показано отсутствие разницы по сравнению с обычным лечением [527]. Исследование, сравнивавшее простые письменные инструкции по коррекции афазии и диз-артрии, не выявило различий между группами [528].
Афазия и дизартрия — частые симптомы, возникающие вследствие инсульта и влияющие на качество жизни [529]. Систематический обзор проводимой логопедической терапии при дизартрии в условиях непрогрессирующего повреждения головного мозга не выявил качественной доказательной базы для пользы данной терапии [530]. Также в систематическом обзоре по логопедической терапии при афазии не было представлено качественных доказательств эффективности формальных или неформальных методик [531]. Данные исследования проводились на популяционной основе со средним началом терапии через 3 месяца после инсульта, в них отсутствует информация о реабилитации в острой фазе заболевания. В 2 метаанализах с более слабым дизайном было показано, что улучшение речевой функции наступает при раннем начале логопедической терапии [534, 535]. Существуют ограниченные доказательства эффективности принудительно-индуцированной терапии у пациентов с афазией [534, 535].
13.3.4. Информационное обеспечение
Недавний систематический обзор, сравнивающий специальную справочную службу с обычным ведением, не нашел доказательств улучшения ADL, состояния здоровья больного или здоровья обслуживающего персонала [536].
Неадекватное представление информации является предиктором плохого качества жизни пациента с инсультом и его семьи [537]. Имеются доказательства, что предоставление информации в группах во время учебных сессий улучшает знания более эффективно, чем предоставление информации в индивидуальном порядке [538]. По мере того как пациент в своем лечении переходит от госпитальной реабилитации к амбулаторной, вовлечение в реабилитацию ухаживающих за пациентом людей становится очень важным. Правильное обучение ухаживающих основным навыкам ухода снижает затраты на персонал и повышает качество жизни пациента [539].
13.3.5. Другие специалисты
В зависимости от потребностей пациента другие специалисты могут быть включены в лечение, например диетологи, ортопеды, социальные работники. Несмотря на то, что включение данных групп специалистов доказательно не обосновано, некоторые авторы считают, что формирование такого штата может «обогащать среду» и поощрять реабилитационную активность вне периода формальной терапии [540].
13.4. Когнитивные расстройства
Когнитивные нарушения часто сопутствуют течению инсульта и влияют на качество жизни. В настоящее время нет достаточных доказательств касательно специфической реабилитации памяти [541]. Упражнения, направленные на восстановление дефицита внимания, не привели к значительным положительным результатам, влияющим на улучшение клинической картины и качества показателя ALD [542]. Упражнения, направленные на анозогнозию (пространственное пренебрежение), улучшают течение заболевания, но эффективность для ADL не была продемонстрирована [543]. Несколько исследований оценивали эффективность упражнений, направленных на визуальные расстройства и апраксию, но не было сделано специфических выводов [544].
13.5. Сексуальная функция
Сексуальная функция может страдать после инсульта. Физический дефицит и сопутствующая сосудистая патология могут дополняться побочными эффектами проводимой терапии [545]. Это делает желательным обсуждение сексуальных и интимных проблем с пациентами [546]. Поддержка и предоставление информации пациентам очень важно: многие пациенты напрасно боятся, что активная сексуальная жизнь может привести к возникновению повторных инсультов [547].
13.6. Осложнения, возникающие при реабилитации
Реабилитация может быть скомпрометирована осложнениями, которые могут являться мощными предикторами плохого функционального восстановления и смертности больных. Общие осложнения, возникающие у пациентов в стационаре на реабилитации, включают депрессию, боль в плече, падения, нарушения мочеиспускания и аспирационную пневмонию [548]. Некоторые из них обсуждены в разделе «Профилактика осложнений».
13.7. Постинсультная депрессия
Постинсультная депрессия ассоциирована с недостаточной реабилитацией и плохим исходом [549, 550]. В клинической практике только у меньшинства пациентов с депрессией устанавливается диагноз и еще меньшая часть из них лечится [551]. Депрессия выявляется у 33 % выживших пациентов по сравнению с 13 %, соответствующими по половозрастным признакам, контрольной группы [552], но точной оценки заболеваемости депрессиями у пациентов с инсультом не проводилось [550]. Предикторами постинсультной депрессии в процессе реабилитации являются ухудшение физического дефицита, когнитивные нарушения и нарастание тяжести инсульта [550]. Нет договоренности в выборе оптимального метода скрининга и диа-гностики постинсультной депрессии. Стандартные методы диагностики депрессии могут быть неточными для пациентов с афазией и когнитивными нарушениями [553, 554].
Антидепрессанты, такие как селективные ингибиторы обратного захвата серотонина и гетероциклические антидепрессанты, могут улучшить настроение после инсульта [555, 556], но нет сведений, что данные препараты могут вызвать полную ремиссию большого депрессивного эпизода или профилактировать развитие депрессии. СИОЗС более переносимы, чем гетероциклические антидепрессанты [557]. Нет достаточных сведений для рекомендации психотерапии для лечения и профилактики постинсультной депрессии [558], хотя данная терапия может улучшать настроение. Имеется недостаточно веских данных, доказывающих эффективность психотерапии для лечения или профилактики постинсультной депрессии [558], хотя подобная терапия может улучшить настроение. Имеется недостаток твердых доказательств эффекта лечения постинсультной депрессии на реабилитацию или функциональное восстановление. Эмоциональная лабильность является травмирующим фактором для пациентов и окружающих, СИОЗС могут уменьшать эмоциональные проявления, однако влияние их на качество жизни остается неясным [559].
13.8. Боль и спастичность
Постинсультная боль в плече встречается часто [560], особенно у пациентов с двигательным дефицитом в руке и плохим функциональным статусом, и ассоциируется с плохим исходом [561]. Для профилактики могут быть использованы пассивные движения [561]. Электрическая стимуляция часто используется в терапии, но ее эффективность не доказана [562]. В Кохрейновском систематизированном обзоре не обнаружено достаточно сведений для рекомендации ортезов при сублюксации плечевого сустава [563].
Ламотриджин и габапентин могут использоваться при невропатической боли [564]. Они хорошо переносимы, однако побочным эффектом может быть влияние на когнитивную функцию. Спастичность в восстановительном периоде может негативно воздействовать на ADL и ухудшать качество жизни [565]. ЛФК, лечение положением, релаксирующая терапия, шинирование используются повсеместно, но доказательная база недостаточна [566]. Доказано, что фармакотерапия ботулотоксином эффективно снижает тонус мышц в руках и ногах, но функциональная польза менее хорошо изучена [567–569]. Пероральные препараты применяются ограничено из-за побочных эффектов [570].
13.10. Приемлемость реабилитации
Важным предиктором реабилитационного исхода является степень тяжести инсульта [549]. Прединсульт-ные заболевания также имеют важное значение для исхода реабилитации [571]. Другие факторы, такие как пол [572], этиология инсульта [573], возраст [574] и локализация повреждения [575], исследовались как потенциальные предикторы исхода реабилитации, однако нет достаточных доказательств, что эти немодифицируемые факторы оказывают влияние на реабилитацию [576]. Направление в специализированное отделение для лечения больных с инсультом улучшает исход любого инсульта независимо от возраста, пола и тяжести заболевания [61].
Отказ от реабилитации, основанный на прединсультной зависимости больного от помощи, является спорным вопросом [577, 578]. Пациенты с наиболее серьезными когнитивными и физическими нарушениями исключаются из большинства реабилитационных исследований, и, следовательно, необходимо внимательно относится к экстраполяции результатов на данную группу больных [579]. Ограниченные данные свидетельствуют, что активная реабилитация помогает пациентам с тяжелой патологией вернуться домой [580, 581]. Для тех пациентов, у которых невозможно проведение активной реабилитации, рекомендовано выполнение пассивных движений с целью профилактики контрактур и компрессионных болей [2].
14. Приложение
ESO (EUSI) Recommendation Writing Committee
Chair: Werner Hacke, Heidelberg, Germany
Co-Chairs: Marie-Germaine Bousser, Paris, France; Gary Ford, Newcastle, UK
Education, Referral and Emergency room
Co-Chairs: Michael Brainin, Krems, Austria; Josй Ferro, Lisbon, Portugal
Members: Charlotte Cordonnier, Lille, France; Heinrich P. Mattle, Bern, Switzerland; Keith Muir, Glasgow, UK; Peter D. Schellinger, Erlangen, Germany
Substantial assistance received from: Isabel Henriques, Lisbon, Portugal
Stroke Units
Co-Chairs: Hans-Christoph Diener, Essen, Germany; Peter Langhorne, Glasgow, UK
Members: Antony Davalos, Barcelona, Spain; Gary Ford, Newcastle, UK; Veronika Skvortsova, Moscow, Russia
Imaging and Diagnostics
Co-Chairs: Michael Hennerici, Mannheim, Germany; Markku Kaste, Helsinki, Finland
Members: Hugh S. Markus, London, UK; E. Bernd Ringelstein, Mьnster, Germany; Rьdiger von Kummer, Dresden, Germany; Joanna Wardlaw, Edinburgh, UK
Substantial assistance received from: Dr. Oliver Mьller, Heidelberg, Germany
Prevention
Co-Chairs: Philip Bath, Nottingham, UK; Didier Leys, Lille, France
Members: Бlvaro Cervera, Barcelona, Spain; Lбszlу Csiba, Debrecen, Hungary; Jan Lodder, Maastricht, The Netherlands; Nils Gunnar Wahlgren, Stockholm, Sweden
General Treatment
Co-Chairs: Christoph Diener, Essen, Germany; Peter Langhorne, Glasgow, UK
Members: Antony Davalos, Barcelona, Spain; Gary Ford, Newcastle, UK; Veronika Skvortsova, Moscow, Russia
Acute Treatment and Treatment of Complications
Co-Chairs: Angel Chamorro, Barcelona, Spain; Bo Norrving, Lund, Sweden
Members: Valerica Caso, Perugia, Italy; Jean-Louis Mas, Paris, France; Victor Obach, Barcelona, Spain; Peter A. Ringleb, Heidelberg, Germany; Lars Thomassen, Bergen, Norway
Rehabilitation
Co-Chairs: Kennedy Lees, Glasgow, UK; Danilo Toni, Rome, Italy
Members: Stefano Paolucci, Rome, Italy; Juhani Sivenius, Kuopio, Finland; Katharina Stibrant Sunnerhagen, Gцteborg, Sweden; Marion F. Walker, Nottingham, UK
Substantial assistance received from: Dr. Yvonne Teuschl, Dr. Isabel Henriques, Dr. Terence Quinn
15. Таблицы

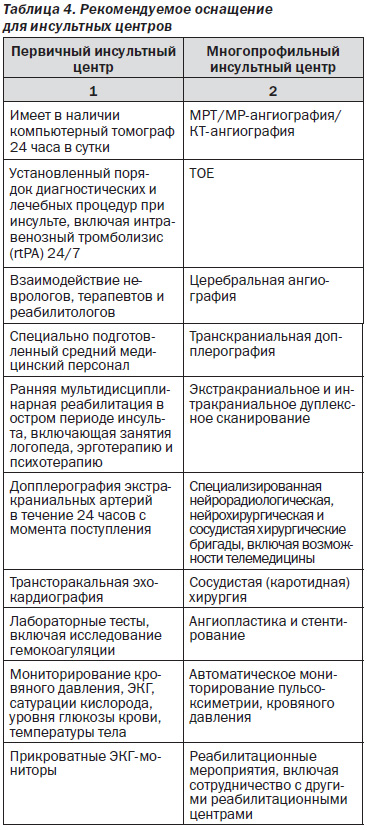
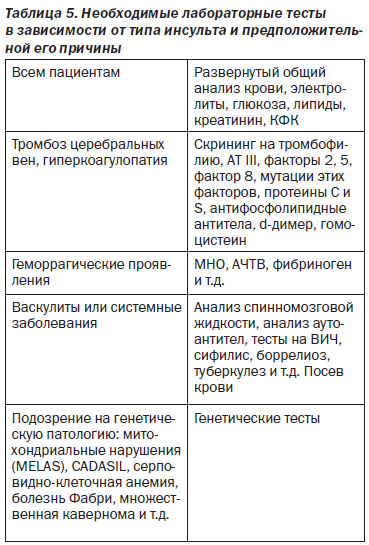
Дополнения
Коментар робочої групи
Алгоритми надання медичної допомоги пацієнтам з підозрою на ішемічний інсульт та ТІА. [NICE clinical guideline 68. Stroke: diagnosis and initial management of acute stroke and transient ischaemic attack (TIA)]
1. Furie K.L., Kasner S.E., Adams R.J. et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guideline for healthcare professionals from the american heart association/american stroke association // Stroke. — 2011. — 42. — 227.
2. Sacks F.M., Campos H. Dietary therapy in hypertension // N. Engl. J. Med. — 2010. — 362. — 2102.
3. Волошин В.П. История, современный уровень и будущее тромболитической терапии при остром ишемическом инсульте / В.П. Волошин, В.А. Яворська, Ю.В. Фломін // Укр. мед. часопис. — 2007. — № 5 (61). — ІХ/Х. — С. 9-23.
4. Зозуля І.С., Мошенська О.П. Гострий період ішемічного інсульту: сучасний погляд на проблему // Укр. мед. часопис. — 2009. — № 4 (72). — VII/VIII. — С. 67-73.
5. Зозуля І.С. Епідеміологія цереброваскулярних захворювань в Україні / І.С. Зозуля, А.І. Зозуля // Український медичний часопис. — 2011. — № 5 (85). — ІХ–Х. — С. 38-41.
6. Прихода И.В., Подорожко О.А. Вторичная профилактика ишемического инсульта и транзиторной ишемической атаки // Ремендиум. Журнал о рынке лекарств и медицинской техники. — 2006. — 7. — С. 18-23.
7. Наказ МОЗ України від 30.07.2002 р. № 297 «Про вдосконалення медичної допомоги хворим з цереброваскулярною патологією».
8. Наказ МОЗ України від 17.01.2005 р. № 24 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Медицина невідкладних станів».
9. Наказ МОЗ України від 03.07.2006 р. № 436 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія».
10. Наказ МОЗ України від 17.08.2007 р. № 487 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія».
11. Наказ МОЗ України від 13.06.2008 р. № 317 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Нейрохірургія».
12. NICE clinical guideline 68.Stroke: diagnosis and initial management of acute stroke and transient ischaemic attack (TIA).
13. LIPID MODIFICATION: Cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease, NICE, 2008.
14. Lipid Management in Adults, Institute for Clinical Systems Improvement, 2011.