Газета «Новости медицины и фармации» Гастроэнтерология (429) 2012 (тематический номер)
Вернуться к номеру
Особливості поєднаної патології травного каналу в підлітків і сучасні можливості оптимізації лікування
Авторы: Т.З. Марченко, Л.П. Сакалош, З.В. Томків, Львівський національний медичний університет імені Данила Галицького, кафедра педіатрії і неонатології ФПДО, Я.В. Томків, Львівська міська дитяча клінічна лікарня, Міський дитячий гастроентерологічний центр, Д.І. Квіт, Львівський національний медичний університет імені Данила Галицького, кафедра педіатрії і неонатології ФПДО, Львівська міська дитяча клінічна лікарня, Міський дитячий гастроентерологічний центр
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
У 30 підлітків із запорами різної етіології в поєднанні із гастродуоденальною патологією в комплексі лікування застосували як прокінетик травного каналу Праймер (ітоприду гідрохлорид), що за клінічними показниками й сонографічно-ендоскопічними характеристиками дискінезії жовчовивідних шляхів, жовчного рефлюкс-гастриту й жовчного рефлюкс-езофагіту був значно ефективнішим, ніж домперидон, застосований у 30 підлітків контрольної групи з аналогічною патологією.
підлітки, запори, гастродуоденальна патологія, поєднана гастропатологія, Праймер (ітоприду гідрохлорид), домперидон.
Вступ
Однією з актуальних проблем дитячої гастроентерології є поєднана патологія травного каналу [1], коли одночасно діагностуються три нозологічні форми [2]. Найчастіше патологія гастродуоденальної зони (функціональні, особливо хронічні захворювання) поєднується із запорами. За даними досліджень останніх років [3–5], від хронічного запору страждають 37 % пацієнтів із гастродуоденальною патологією (ГДП), із підтвердженою кореляційною залежністю між тяжкістю захворювання (гастродуоденальна деструкція) і ступенем вираженості хронічного запору. За даними цих авторів, запор випереджав маніфестацію ГДП у 47,4 % дітей, збігався в часі з її розвитком у 35,8 % дітей, лише у 16,8 % хворих час виникнення запору виявити не вдалося.
Зміна частоти дефекації, характеру калових мас, біль по ходу товстої кишки або під час дефекації виникають на фоні характерною для ГДП клінічної симптоматики.
Була розроблена [5] концепція формування хронічного запору при ГДП, основними факторами є:
— аліментарні;
— органічні (уроджені аномалії розвитку й положення товстої кишки — доліхосигма, синдром Пайра, дивертикули тощо);
— нейрогенні порушення кишкової моторики із дилатацією товстої кишки внаслідок ваготонії.
Вплив цих факторів у комплексі або ізольовано може відзначатися ще до розвитку ГДП, але при її приєднанні хронічний запор посилюється внаслідок як особливостей призначеного лікування (щадний режим з обмеженням рухової активності, характер харчування із зменшенням в раціоні рослинних волокон, прийом медикаментів із в’яжучою, антацидною, обволікаючою дією), так і наростання вагусної активності із дилатацією товстої кишки [5]. Але хронічний запор лише опосередковано впливає на виникнення ГДП, тому що основними факторами є обтяжена спадковість, хелікобактерна інфекція, кислотнопептична агресія. Тому хронічний запор при ГДП швидше наслідок, ніж причина хвороби [5].
Переважання поєднаного ураження шлунка і дванадцятипалої кишки в дітей підтверджене авторами [6] за однотипністю гістологічних змін тіла, пілоричного відділу шлунка і дванадцятипалої кишки, а інфекція H.pylori (Hp) не впливає на ступінь запального процесу й показники клітинного відновлення. Ці ж автори виявили дисбаланс процесів клітинного відновлення, що призводить до порушення фізіологічної регенерації слизової оболонки і прогнозує виникнення рецидиву хронічного процесу з подальшим розвитком деструктивних змін в органах гастродуоденальної зони. Переважання експресії проапоптозного білка регуляції над антиапоптозним не залежало від ступеня запальних змін у слизовій оболонці гастродуоденальної зони та інфікованості H.pylori.
За нашими даними [7], до 92 % дітей із хронічним гастродуоденітом (ХГД) мають ендоскопічні ознаки гастроезофагеальної рефлюксної хвороби (ГЕРХ) 0–І, а 42,4 % — у поєднанні з дуоденогастральним рефлюксом (ДГР). ХГД у поєднанні з ГЕРХ і ДГР та супутньою гіпокінетичною дискінезією жовчовивідних шляхів (ДЖВШ) виявлено у 47 % дітей [7]. Ендоскопічна верифікація жовчного рефлюксгастриту й жовчного рефлюксезофагіту спостерігалася в половини дітей із ХГД у поєднанні із гіпокінетичною ДЖВШ [7].
Як прокінетик метоклопрамід має обмеження в застосуванні в дітей через значну кількість побічних ефектів, незважаючи на його позитивний вплив на нижній стравохідний сфінктер, тому зараз найчастіше застосовується як прокінетик домперидон, що практично не діє на зону нижнього стравохідного сфінктера [8, 9] і не чинить прокінетичної дії на кишечник.
Новий для нас прокінетик для нормалізації перистальтики всього травного каналу ітоприду гідрохлорид, що використовується у світі вже 15 років, має комбінований механізм дії: одночасно він є антагоністом периферичних D2допамінових рецепторів, блокатором ацетилхолінестерази й модулятором синтезу гастроінтестинальних гормонів. Завдяки цьому він справляє виражений прокінетичний ефект на верхні і нижні відділи травного каналу. Блокування D2рецепторів сприяє збільшенню активності аденілатциклази в гладких м’язах стравоходу, шлунка, дванадцятипалої кишки, рівня цАМФ та підвищенню рухової активності цих відділів. Підвищення перистальтичної активності тонкого і товстого кишечника пояснюється холіноміметичним впливом, збільшенням періоду піврозпаду ендогенного ацетилхоліну із пролонгуванням його впливу.
Метою дослідження було вдосконалення лікувальних комплексів при поєднаній хронічній і функціональній патології травного каналу в підлітків із хронічними запорами шляхом включення в лікувальні комплекси нового прокінетика — ітоприду гідрохлориду (Праймер).
Матеріали і методи дослідження
Під спостереженням були 60 підлітків віком 12–18 років із хронічними запорами та супутньою хронічною і функціональною ГДП і гіпокінетичною ДЖВШ. Відкритим когортним методом вони були розділені на дві групи по 30 дітей. Середній вік дітей (13,6 ± 1,4 року в основній групі і 13,1 ± 1,8 року в контрольній), гендерна характеристика (переважання хлопців — 57 % в основній групі і 58 % — у контрольній), спадкова обтяженість по запорах, хронічні і функціональні ГДП і біліарні дисфункції (78 % в основній групі і 81 % — у контрольній), середня тривалість хронічних хвороб (2,1 ± 0,7 року в основній групі і 2,0 ± 0,8 року — у контрольній) і функціональних захворювань травного каналу (0,3 ± 0,1 року в основній групі і 0,31 ± 0,10 — у контрольній) були ідентичними в обох групах.
Нозологічна характеристика в обох групах підлітків також була подібною. Так, переважало поєднання синдрому подразненого кишечника (СПК) із запорами, функціональної диспепсії (ФД) із ГЕРХ 0–І, ДГР І із гіпокінетичною ДЖВШ (в основній групі — 42 %, у контрольній — 43 % дітей). ФД із ГЕРХ 0–І, ДГР І–ІІ і ДЖВШ із хронічними запорами були діагностовані у 32 % дітей основної групи і 30 % контрольної групи. ХГД у поєднанні з ГЕРХ І, ДГР І–ІІ, гіпокінетичною ДЖВШ і хронічними запорами виявлені у 20 % дітей основної групи і 19 % контрольної. Жовчний рефлюксгастрит і жовчний рефлексезофагіт були верифіковані ендоскопічно в 42 % дітей основної групи і 46 % дітей контрольної групи. Сонографічні зміни фізикохімічних властивостей жовчі (пристінковий холестаз, ехозавіса, сладж жовчі) установлені в тієї ж кількості дітей, що і жовчний рефлюксгастрит і жовчний рефлюксезофагіт (42 % дітей основної групи і 46 % дітей контрольної). Верифікація діагнозу, лікування й диспансеризація проводилися згідно з протоколами діагностики й лікування [10]. У цьому наказі як прокінетик рекомендується домперидон у лікуванні ГДП і СПК із запорами, а при функціональних запорах для нормалізації моторики травного каналу рекомендований тримебутин. Визначення Hp проводилося за допомогою дихального тесту.
У комплексі лікування підліткам основної групи як прокінетик призначали ітоприду гідрохлорид у дозі 50 мг тричі на добу до їжі протягом 14 днів, а в контрольній групі — домперидон у дозі 10–20 мг 3–4 рази на добу за 15–30 хвилин до їжі протягом 14 днів.
Оцінка клінічних даних проводилася:
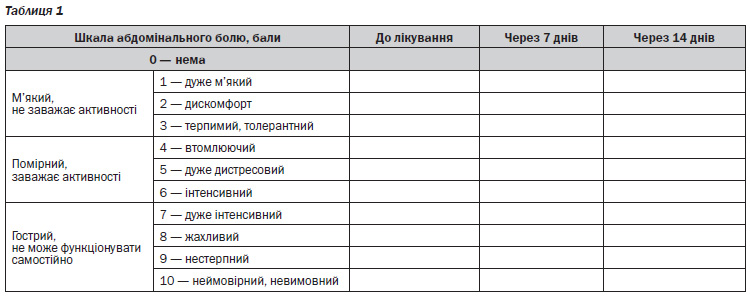
— за шкалою абдомінального болю [12] (табл. 1);
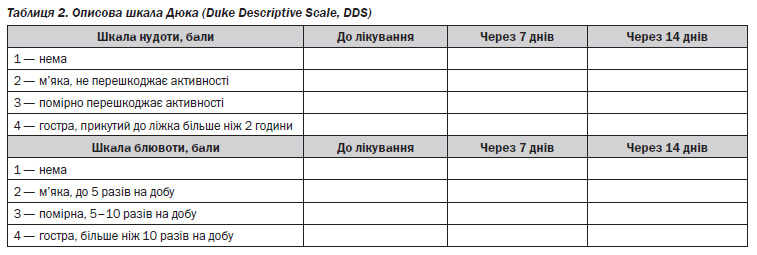
— за шкалою нудоти і блювоти Дюка [13] (табл. 2);
— за 5бальною шкалою Likert оцінювали симптоми ФД і рефлюксу (відчуття переповнення після їжі, тяжкість і здуття в надчеревній ділянці, печія): 1 бал — не турбує (симптому нема); 2 бали — спричиняє незначний неспокій (можна не звертати уваги, якщо не думати про це); 3 бали — помірно непокоїть (не вдається не помічати, але не порушує денної активності чи сну); 4 бали — сильно турбує (порушує денну активність чи сон); 5 балів — дуже непокоїть (значно порушує/тимчасово робить неможливою денну активність чи сон, потрібен відпочинок) [14];
— за динамікою частоти дефекацій на тиждень (менше 3 разів на тиждень і більше 3 разів на тиждень);
— за характером калових мас згідно з Брістольською шкалою калу [15].
Клінічні дані оцінювали до початку лікування, на 7й і 14й день лікування. Контроль за ерадикацією H.pylori здійснювали згідно з рекомендаціями протоколу [10].
Динаміка сонографічної картини пристінкового холестазу, ехозавіси й сладжу жовчі оцінювали через 4 тижні. Ендоскопічний контроль за перебігом жовчного рефлюксезофагіту проводився через 4 тижні. У цих дітей як в основній, так і в контрольних групах додатково призначали урсофальк 10 мг/кг/добу протягом 2 тижнів.
Результати та їх обговорення
Середній бал абдомінального больового синдрому, нудоти і блювоти до початку лікування в обох групах дітей був майже однаковим. Позитивна динаміка цих клінічних симптомів уже на 7й день лікування вірогідно була кращою в дітей основної групи, ніж контрольної. Так, середній бал абдомінального больового синдрому в дітей основної групи на 7й день оцінений в 1 бал, а в дітей контрольної групи — 3,1 бала (p < 0,05, рис. 1). На 14й день лікування в дітей основної групи абдомінального больового синдрому не було, у той час як у контрольній групі середній бал був 1,2 (p < 0,05, рис. 1).
Така ж динаміка була при аналізі середнього бала нудоти, коли на 7й день лікування в підлітків основної групи нудоти не було (1 бал), а в дітей контрольної групи середній бал нудоти зменшився лише на 36 % і становив 2,0 (рис. 2). На 14й день лікування нудоти не було (1 бал) в дітей основної групи, але в контролі цей показник знизився лише на 25 % і становив 1,4 (рис. 2).
Середній бал блювоти в дітей контрольної групи знизився на 20 %, а в дітей основної групи блювоти вже не було (1 бал, рис. 3). Лише на 14й день лікування блювота зникла й у дітей контрольної групи (1 бал, рис. 3).
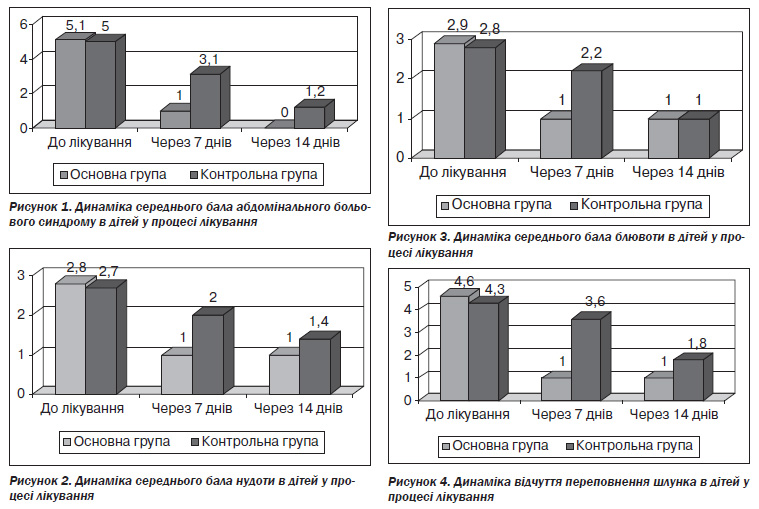
Регрес симптомів ФД і рефлюксу за шкалою Likert поданий на рис. 4–7.
Як видно із даних рис. 4–7, регрес симптомів ФД і рефлюксу був значно швидшим й ефективнішим уже на 7й день лікування в дітей основної групи порівняно з контролем. Так, на 7й день лікування в дітей основної групи вже зникли відчуття переповнення, тяжкості, здуття в надчеревній ділянці, печія, у той час як у контролі і на 14й день лікування ця симптоматика ще мала місце (рис. 4–7).
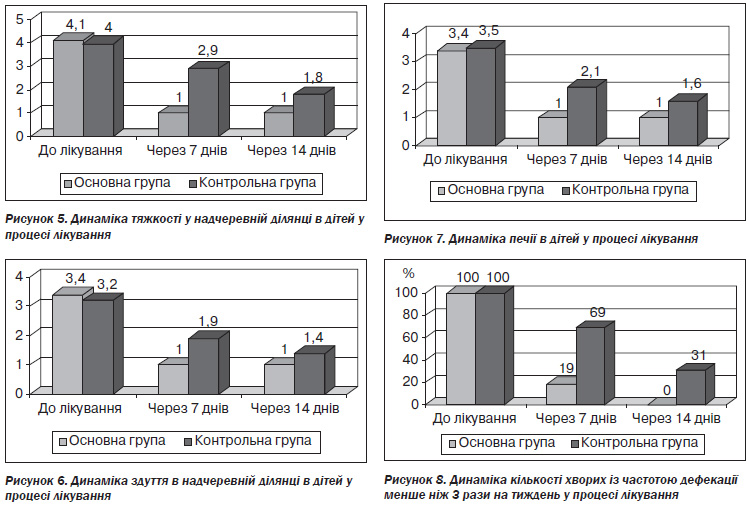
Динаміка частоти дефекації подана на рис. 8.
Як видно із даних рис. 8, на 7й день лікування в основній групі у 5 разів (на 81 %) зменшилась кількість дітей, які мали частоту дефекації менше ніж 3 рази на тиждень, у той час як у контрольній групі таких дітей стало менше лише на 31 % (в 1,4 раза, p < 0,05). На 14й день лікування всі пацієнти основної групи мали частоту дефекації більше ніж 3 рази, а в контрольній групі в 31 % дітей (p < 0,05) частота дефекації була менше ніж 3 рази на тиждень. В основній групі в дітей із доліхосигмою з’явилися самостійні дефекації вже на 7й день, а на 14й день лікування частота дефекації в усіх них була більше ніж 3 рази на тиждень. Цього ми не спостерігали в дітей із доліхосигмою в контрольній групі.
Аналіз динаміки змін характеру калових мас за Брістольською шкалою калу показав, що тип калу 1 і 2 до лікування мали 96 % дітей основної групи і 92 % — контрольної. На 7й день лікування в основній групі дітей тип калу 1 і 2 за Брістольською шкалою був характерним тільки для 31 % дітей основної групи, а в контролі — для 72 % дітей (p < 0,05). У 64 % дітей основної групи на 7й день лікування відзначався тип калу 4, а в контролі у 28 % дітей кал характеризувався за типом 2 і 3 Брістольської шкали (p < 0,05). На 14й день лікування в усіх дітей основної групи характеристика калу відповідала типу 4 Брістольської шкали, у дітей із доліхосигмою — типам 2 і 3. Але в контрольній групі дітей, на жаль, не було жодної дитини із типом калу 4 за Брістольською шкалою, тип калу 2 мали 28 % дітей. Діти контрольної групи із доліхосигмою не відгукнулися на проведене лікування.
Через 4 тижні ендоскопічна відсутність жовчі в рефлюктаті шлунка і стравоходу мала місце в 91 % дітей основної групи і в 72 % дітей контрольної групи (p < 0,05), а сонографічне зникнення фізикохімічних змін жовчі (пристінковий холестаз, ехозавіса, сладж) — у 89 % дітей основної групи і в 71 % дітей контрольної групи (p < 0,05).
Нрінфекція була виявлена в основній групі в 10 % дітей із ФД і в 16 % дітей із ХГД, а в контролі — у 9 і 18 % дітей відповідно. Проведення ерадикаційної терапії згідно з протоколами [10] було ефективним у всіх пацієнтів основної групи, що підтверджено методами і в терміни, передбачені протоколом [10]. У 3 % дітей контрольної групи із ХГД у поєднанні з ГЕРХ, ДГР, ДЖВШ і хронічними запорами вимушені були застосувати квадротерапію, що виявилася ефективною в ерадикації Нр у цих дітей.
Застосування Праймеру в підлітків не супроводжувалося побічними діями, алергічними реакціями чи реакціями непереносимості.
Ефективність Праймеру в ліквідації клінікоендоскопічних і рНметричних ознак ГЕРХ, вірогідному посиленні скоротливої активності нижнього стравохідного сфінктера, шлункової евакуації, нормалізація гастродуоденальної координації, вірогідні переваги Праймеру за безпекою й ефективністю порівняно з іншими прокінетиками, а також домперидоном доведені в багатьох роботах, у тому числі в подвійних сліпих рандомізованих дослідженнях у Європі, Росії, Україні [16–19].
Для підлітків до 18 років альтернативи Праймеру як кишковому прокінетику на сьогодні немає, тому комплексна терапія запорів при поєднанні із ГДП із порушенням езофагогастродуоденальної координації повинна бути проведена із застосуванням Праймеру, бо домперидон, не впливаючи на моторику кишечника, може мати таку побічну дію, як спазми кишечника [20].
Висновки
1. Поєднана із запорами ГДП у підлітків є однією із частих ситуацій у клінічній практиці.
2. Регрес основних клінічних симптомів, у тому числі печії, болю в надчеревній ділянці, за шкалами абдомінального больового синдрому, нудоти, блювоти, Likert був значно швидшим й ефективнішим в основній групі, що в комплексі лікування отримувала Праймер, ніж у контролі, де застосовували домперидон.
3. Частота дефекацій більше ніж 3 рази на тиждень спостерігалася у 81 % дітей основної групи вже на 7й день лікування при застосуванні Праймеру, у той час як у контрольній групі лише 31 % мали таку ж частоту дефекації. На 14й день терапії всі діти основної групи мали частоту дефекації більше ніж 3 рази на тиждень, а в контролі — лише 69 %.
4. Позитивні зміни типу калу за Брістольською шкалою були також вірогідно швидшими і більш фізіологічними в дітей основної групи, які в комплексі лікування отримували Праймер, ніж у дітей контрольної групи із застосуванням домперидону.
5. Навіть у дітей із доліхосигмою як причиною запорів та супутньою ГДП застосування Праймеру виявилося ефективним як щодо появи самостійних випорожнень, так і щодо збільшення кількості дефекацій із покращеними характеристиками типу калу за Брістольською шкалою.
6. Можливо, відсутність потреби в квадротерапії Нрінфекції в основній групі дітей, на відміну від контрольної групи, також якимось чином пов’язана із застосуванням Праймеру, що вимагає подальшого поглибленого обстеження і спостереження.
7. Виявлена краща ефективність Праймеру в ліквідації сонографічних ознак фізикохімічних змін жовчі (пристінковий холестаз, ехозавіса, сладж) й ендоскопічних ознак жовчного рефлюксгастриту й жовчного рефлюксезофагіту порівняно з домперидоном. Ці зміни були вірогідно швидшими.
8. Добра клінічна ефективність, переносимість Праймеру, відсутність побічних дій свідчить про доцільність і необхідність включення його в лікувальні комплекси поєднаної патології травного каналу в підлітків.
1. Бєлоусов Ю.В. Деякі актуальні питання педіатричної гапатології / Ю.В. Бєлоусов // ПАГ. — 2004. — № 5. — С 1720.
2. Квіт Д.І., Марченко Т.З., Томків Я.В. та ін. Диференційовані підходи до етапного лікування поєднаної гастропатології у дітей / Д.І. Квіт, Т.З. Марченко, Я.В. Томків, В.Д. Шайдич, Л.В. Заставна, Л.М. Горайська, Г.З. Вівчарівська, О.М. Морозович, Л.П. Сакалош // Современная педиатрия. — 2011. — № 1(35). — С. 5761.
3. Белоусов Ю.В., Белоусова О.Ю. Проктогенные запоры у детей / Ю.В. Белоусов, О.Ю. Белоусова // Проблеми медичної науки та освіти. — 2002. — № 4. — С. 1316.
4. Белоусова О.Ю. Кологенные запоры у детей / О.Ю. Белоусова // Сучасна гастроентерологія. — 2001. — № 4. — С. 1920.
5. Белоусова О.Ю. Хронический запор при патологии желудка и кишечника у детей — причина или следствие? / О.Ю.Белоусова // Здоровье ребенка. — 2009. — № 4(19). — С. 128131.
6. Коржинський Ю.С., Сакалош Л.П., Квіт Д.І., Марченко Т.З. та ін. Особливості клінічного перебігу гастроезофагальної рефлюксної хвороби у дітей // ПАГ. — 2007. — № 4. — С. 9293.
7. Марченко Т.З. Досвід застосування сиропу «Урсофальк» при жовчному рефлюксгастриті і жовчному рефлюксезофагіті у дітей / Т.З. Марченко, Д.І. Квіт, Ю.С. Коржинський, Я.В. Томків, Л.В. Заставна, В.Д. Шайдич, Г.З. Вівчарівська, Л.М. Горайська // Сучасна гастроентерологія. — 2009. — № 5(49). — С. 7072.
8. De Caestecker J. Prokinetics and reflux: a promise unfulfilled // Eur. J. Gastroenterol. Hepatol. — 2002. — Vol. 14. — Р. 57.
9. Finney J.S., Kinnersley N., Hughes M. et al. Metaanalysis of antisecretory and gastrokinetic compounds in functional dyspepsia // J. Clin. Gastroenterol. — 1998. — Vol. 26. — Р. 312320.
10. Наказ МОЗ України № 438 «Про затвердження Протоколів діагностики та лікування органів травлення у дітей» від. 26.05.2010.
11. Корниенко Е.А. Неинвазивные методы диагностики инфекции, вызванной Helicobacter pylori / Е.А. Корниенко, В.Е. Милейко, В.А. Самокиш, О.Н. Нажиганов // Педиатрия. — 1999. — № 1. — С. 3741.
12. Pain: Clinical Manual. — 2nd ed. / Ed. by M. McCaffery, C. Pasero. — St. Louis, MO: Mosby, 1999.
13. Instruments for Clinical HealthCare Research. — 3rd ed / Ed. by M. FrankStromborg, S.J. Olsen. — Jones and Bartlett Publishers, 2004. — P. 585586.
14. Осьодло Г.В. Сучасні аспекти діагностики і лікування функціональної диспепсії / Г.В. Осьодло, Т.В. Куц, С.М. Прокопчук // Здоров’я України. — 2010. — № 1. — С. 4445.
15. Lewis S.J. Stool form scale as a useful guide to intestinal transit time / S.J. Lewis, K.W. Heaton // Scand. J. Gastroenterol. — 1997. — № 32(9). — P. 9204.
16. Finney J.S., Kinnersley N., Hughes M. et al. Metaanalysis of antisecretory and gastrokinetic compounds in functional dyspepsia // J. Clin. Gastroenterol. — 1998. — Vol. 26. — Р. 312320.
17. Inoue K., Sanada Y., Fijimura J. et al. Clinical effect of itopride hydrochloride on the digestive symptoms of chronic gastritis with reflux esophagitis // Clin. Med. — 1999. — Vol. 15. — Р. 18031808.
18. Babu S. Drug therapy of gastroesophageal reflux disease (GERD): focus on itopride hydrochloride // Ind. Practitioner. — 2003. — Vol. 56(12). — P. 827830.
19. Щербинина М.Б. Новые стратегии в лечении гастроэзофагеальной рефлюксной болезни / М.Б. Щербинина, Е.В. Закревская, Т.А. Скороход // Сучасна гастроентерологія. — 2010. — № 4(54). — С. 8389.
20. Інструкція для медичного застосування препарату мотиліум®. [Електронний ресурс]: http://mozdocs.kiev.ua/likiview.php?id=364