Газета «Новости медицины и фармации» 1-2 (442-443) 2013
Вернуться к номеру
Хроническое обструктивное заболевание легких: определение, эпидемиология, патофизиология, клиническая характеристика, диагностические критерии, классификация (сообщение 1)
Рубрики: Семейная медицина/Терапия, Нефрология, Терапия
Разделы: Медицинское образование
Версия для печати
Хроническое обструктивное заболевание легких (ХОЗЛ) представляет собой серьезную медицинскую и социальную проблему, являясь одной из ведущих причин снижения качества жизни и работоспособности, инвалидизации и летальности [1, 2, 5].
В 2011 году комитет GOLD (Global Іnitiative for Obstructive Lung Disease — Глобальная инициатива по обструктивному заболеванию легких) — «Глобальная стратегия диагностики, лечения и профилактики ХОЗЛ» (Global Strategy for Diagnosis, Management, and Prevention of COPD) издал новый, существенно переработанный вариант клинических рекомендаций [1], в которых отражены вопросы классификации, диагностики, клиники, лечения и профилактики ХОЗЛ.
Определение
ХОЗЛ — распространенное, поддающееся профилактике и лечению заболевание, которое характеризуется персистирующим ограничением проходимости дыхательных путей (обычно прогрессирующим) и ассоциируется с повышенным хроническим воспалительным ответом в дыхательных путях и легких на действие вредных частичек или газов. Наличие частых обострений и сопутствующих заболеваний оказывает существенное влияние на тяжесть заболевания и прогноз [1].
Распространенность
ХОЗЛ характеризуется широкой распространенностью. По данным масштабного метаанализа, его распространенность в мире составляет в среднем 7,6 %, в Европе — 7,4 % [2]. Заболевание наблюдается значительно чаще у курильщиков и бывших курильщиков, чем у некурящих; у лиц старше 40 лет по сравнению с более молодыми; чаще у мужчин, чем у женщин; среди городских жителей почти вдвое чаще, чем у жителей сельской местности. Однозначно отмечается низкий уровень диагностики ХОЗЛ. Так, по данным популяционных скрининговых исследований, среди лиц с выявленным впервые ХОЗЛ только у 20 % был поставлен этот диагноз ранее [3].
Морбидность и летальность
При оценке морбидности традиционно учитываются качество жизни, количество обращений к врачу и госпитализаций по поводу обострений заболевания, а также изменения лечебного режима. В большинстве стран число обращений к врачу по поводу ХОЗЛ намного превосходит таковое по поводу бронхиальной астмы, пневмонии, рака легких и туберкулеза [1]. На показатели морбидности при ХОЗЛ могут влиять сопутствующие хронические заболевания (например, сердечнососудистые заболевания, болезни опорнодвигательного аппарата, сахарный диабет, тревожнодепрессивные расстройства).
ХОЗЛ ассоциируется с высоким риском смертности. На протяжении последних 30 лет отмечен неуклонный рост летальных исходов, обусловленных ХОЗЛ. По прогнозам экспертов Всемирной организации здравоохранения, к 2030 году ХОЗЛ будет занимать 4е место среди других причин летальности.
Социальноэкономическое значение
ХОЗЛ обусловливает высокие финансовые затраты — как прямые (бюджетные ресурсы системы здравоохранения для обеспечения диагностики и лечения), так и непрямые (экономические потери вследствие инвалидизации, больничных листов, преждевременной смертности, дополнительные затраты семей, ухаживающих за больным). В Европейском союзе общие прямые затраты на болезни органов дыхания составляют примерно 6 % всего бюджета здравоохранения, среди которых на ХОЗЛ приходится 56 % [1].
Этиология, патоморфология, патофизиология
К факторам риска развития ХОЗЛ относят:
— активное и пассивное курение (главный фактор!);
— длительное воздействие профессиональных (производственная пыль) или бытовых (загрязнение атмосферного воздуха, продукты сгорания топлива) поллютантов на дыхательные пути;
— возраст более 40 лет (в связи с длительной экспозицией агрессивных факторов — курение и профессиональные вредности);
— частые респираторные инфекции;
— нарушение развития легких в детстве;
— наследственная предрасположенность (в т.ч. генетически детерминированный дефицит a1антитрипсина).
Эпидемиологические исследования подтверждают, что активное курение табака является важнейшим фактором риска развития ХОЗЛ. Если пациент курит или курил ранее, необходимо оценить интенсивность курения (стаж курения, количество сигарет в день) и рассчитать индекс курения (ИК):
ИК (пачколет) = [количество сигарет в день ´ стаж курения (годы)]/20.
Так, при курении 1 пачки (20 сигарет) в день в течение 10 лет или 0,5 пачки (10 сигарет) в течение 20 лет ИК составляет 10 пачколет. ИК более 10 пачколет является наиболее важным фактором риска ХОЗЛ.
Примерно в 25 % случаев развитие ХОЗЛ обусловлено другими ингаляционными агрессивными факторами (профессиональными, экологическими, бытовыми и др.). Риск развития ХОЗЛ повышается у лиц старше 40 лет. При комбинации интенсивного курения с возрастом старше 40–50 лет риск развития ХОЗЛ достигает 85 % [4].
Вдыхаемые сигаретный дым или другие ингаляционные агрессивные факторы вызывают воспаление в легких, характеризуя нормальный защитный ответ организма. В то же время этот ответ приобретает патологический характер при развитии ХОЗЛ. Механизмы такого воспалительного ответа остаются малоизученными, но могут быть генетически детерминированы. В качестве основных механизмов развития ХОЗЛ рассматриваются оксидативный стресс и избыток протеиназ в легких. Оксиданты, генерируемые сигаретным дымом или другими выдыхаемыми вредными частицами, высвобождаются из активированных воспалительных клеток — макрофагов и нейтрофилов. Биомаркеры оксидативного стресса выявляются в конденсатах выдыхаемого воздуха, мокроте и в системной циркуляции у больных ХОЗЛ. Оксидативный стресс отчетливо нарастает при обострении ХОЗЛ.
Получены убедительные доказательства о нарушении в легких больных ХОЗЛ баланса между протеазами, которые разрушают компоненты соединительной ткани, и протеиназами, противодействующими этому. Протеиназаобусловленная деструкция эластина — главного компонента соединительной ткани легких — является ведущей причиной развития эмфиземы.
ХОЗЛ присущ специфический характер воспаления, включающий наряду с присутствием нейтрофилов и макрофагов увеличение числа СD8 (цитотоксических) Тс1лимфоцитов, представленных только у курящих. Эти клетки совместно с нейтрофилами и макрофагами высвобождают воспалительные медиаторы и энзимы, взаимодействуя со структурными клетками воздухоносных путей, легочной паренхимы и легочных сосудов [3].
Множество воспалительных медиаторов, наблюдаемых у больных ХОЗЛ, привлекают воспалительные клетки из циркуляции (хемотаксические эффекты), усиливают воспалительный процесс (провоспалительные цитокины) и индуцируют структурные изменения (факторы роста) [2].
Хотя ХОЗЛ и бронхиальная астма (БА) ассоциируются с хроническим воспалением респираторного тракта, имеются различия в составе воспалительных клеток и медиаторах при этих заболеваниях, что объясняет различия в клинических симптомах и ответе на терапию. У части больных с ХОЗЛ наблюдаются клинические проявления, присущие БА, и подобные БА воспалительные реакции с повышением уровней эозинофилов [1, 4].
Характерными для ХОЗЛ патофизиологическими изменениями являются гиперсекреция слизи, ограничение скорости воздушного потока и «воздушные ловушки», приводящие к гиперинфляции легких [1–3].
Гиперсекреция мокроты (стимулируется рядом медиаторов и протеаз), приводящая к хроническому продуктивному кашлю, является признаком хронического бронхита и не всегда ассоциируется с бронхиальной обструкцией (т.е. ХОЗЛ). Вместе с тем не у всех больных с ХОЗЛ наблюдаются симптомы, связанные с гиперсекрецией мокроты [4].
Морфологически на начальных этапах ХОЗЛ имеет место негнойное воспаление и гиперсекреция слизи в бронхах диаметром более 2 мм, менее выраженное продуктивное воспаление — в бронхиолах меньшего диаметра при отсутствии изменений в зоне ацинусов (дистальный респираторный отдел легких). Характерными особенностями воспаления при ХОЗЛ являются: увеличение количества нейтрофилов, макрофагов и лимфоцитов CD8+ (этот тип воспаления отличается от воспаления при бронхиальной астме, при которой преобладает эозинофильный компонент) [1, 3].
Персистенция ХОЗЛ и особенно развитие обострений заболевания сопровождается прогрессированием структурных изменений в бронхах. Так, продуктивное воспаление в бронхиолах диаметром менее 2 мм сопровождается утолщением стенок бронхиол, формированием бронхиолоэктазов и полипозного бронхиолита с формированием вентиляционных нарушений обструктивного характера. Выраженность воспаления, экссудации и фиброза в дистальных воздушных путях коррелирует прежде всего со снижением объема форсированного выдоха за первую секунду (ОФВ1) и отношения ОФВ1 к форсированной жизненной емкости легких (ФЖЕЛ). Периферическая обструкция ведет к ограничению скорости воздушного потока и прогрессивному увеличению «воздушных ловушек» во время выдоха, результируясь в повышенную воздушность легких — гиперинфляцию (hyperinflation). Гиперинфляция развивается на ранних стадиях ХОЗЛ и является ведущим механизмом в развитии экспираторной одышки. Динамическая (при физических нагрузках) гиперинфляция приводит к усилению одышки и снижению толерантности к физической нагрузке (ТФН) [2–4].
С развитием центрилобулярной (преимущественно в верхних сегментах легких) эмфиземы начинается опустошение капиллярного русла, утолщение стенок артериол за счет пролиферации интимы, а в зонах эмфиземы — и мышечной оболочки их стенок. В последующем эмфизема распространяется на значительный объем легких (носит двусторонний панлобулярный или иррегулярный характер) [5].
Постепенная деструкция легочной паренхимы, обусловленная эмфиземой, способствует увеличению «воздушных ловушек» на выдохе. Бронходилататоры, уменьшающие «воздушные ловушки», улучшают клиническую картину и ТФН при ХОЗЛ [3, 6].
Деструкция паренхимы, обусловленная эмфиземой, способствует как ограничению воздушного потока, так и нарушениям газового обмена. Нарушения альвеолярной вентиляции и уменьшение легочного васкулярного объема ведут к прогрессируюшему ухудшению показателя Va/Q и задержке СО2 (т.е. гипоксемии и гиперкапнии). Все эти факторы способствуют нарушению контрактильных свойств дыхательной мускулатуры [2–4].
На поздних стадиях течения ХОЗЛ может развиваться легочная гипертензия, которая обусловлена главным образом гипоксической вазоконстрикцией малых легочных артерий. При этом развиваются структурные изменения артериальных сосудов малого круга в виде гиперплазии интимы, медии и гладкой мускулатуры. Наряду с этим развивается дисфункция эндотелия сосудов [6].
Уменьшение количества легочных капилляров, обусловленное эмфиземой, также способствует повышению давления в легочной циркуляции, появлению мозаичной гипертрофии кардиомиоцитов правого желудочка (ПЖ) с гипертрофией сосочковых и трабекулярных мышц, а затем и фиброза ПЖ. При этом повышается жесткость его миокарда, снижается коронарная перфузия, что в конечном итоге приводит к правожелудочковой сердечной недостаточности. Развивающаяся вследствие дилатации ПЖ трикуспидальная недостаточность еще более увеличивает перегрузку ПЖ объемом, снижает объем крови, изгоняемый в легочную циркуляцию, и снижает давление наполнения левого желудочка. Постепенно повышается давление в правом предсердии, в случае открытого овального окна может развиваться значимый сброс крови справа налево (дополнительный фактор снижения оксигенации артериальной крови) [4].
Обострения — эпизоды с нарастанием респираторных симптомов — часто наблюдаются у больных с ХОЗЛ и обусловлены обычно инфекционными факторами (бактериями и вирусами, а также их ассоциациями). При обострениях ХОЗЛ наблюдается увеличение гиперинфляции и «воздушных ловушек» со снижением экспираторной проходимости воздушных путей, что ведет к усилению одышки, ухудшению отношения Va/Q и гипоксемии. Гиперкапния и ацидоз существенно снижают сократимость миокарда, что является важным механизмом декомпенсации хронического легочного сердца (ХЛС) при обострениях ХОЗЛ. Другие заболевания и патологические состояния (пневмония, тромбоэмболия ветвей легочной артерии, декомпенсация левожелудочковой недостаточности) могут напоминать обострения ХОЗЛ или даже принимать участие в их формировании [1–3].
Таким образом, основными патофизиологическими этапами ХОЗЛ являются:
- гиперсекреция слизи и негнойное продуктивное воспаление, которые создают условия для нарушения мукоцилиарного клиренса (мукостаз) и развития инфекционного процесса;
- структурные изменения стенок дистальных бронхиол с формированием персистирующих вентиляционных нарушений обструктивного характера и «воздушных ловушек» — гиперинфляции легких;
- эмфизематозная трансформация паренхимы легких (склероз межальвеолярных перегородок) с постепенным нарушением перфузионной функции легких (процессов газообмена);
- прогрессирующая легочная гипертензия и формирование хронического легочного сердца с недостаточностью кровообращения.
Клиническая характеристика
Жалобы
Больные ХОЗЛ на ранних этапах заболевания часто не предъявляют какихлибо определенных жалоб. Развернутая клиническая картина ХОЗЛ наблюдается через 10–20 и более лет после начала регулярного курения или экспозиции вредных веществ окружающей среды.
Характерные клинические проявления ХОЗЛ включают хроническую и прогрессирующую одышку, кашель и выделение мокроты.
Одышка — кардинальный симптом ХОЗЛ, являющийся ведущей причиной снижения качества жизни, толерантности к физической нагрузке и трудоспособности. В типичных случаях больные ХОЗЛ описывают одышку как ощущение затрудненности дыхания, тяжести в грудной клетке, нехватки воздуха и/или удушье (gasping).
Хронический кашель и продукция мокроты могут наблюдаться задолго до развития ограничения проходимости дыхательных путей, и, напротив, существенное нарушение проходимости дыхательных путей может развиваться у лиц без предшествующего кашля и/или выделения мокроты. Сочетание одышки, кашля и выделения мокроты позволяет предположить наличие ХОЗЛ с высокой вероятностью.
Хронический кашель часто является первым симптомом развивающегося ХОЗЛ и может существенно уменьшаться или даже исчезать после прекращения курения или воздействий вредных частичек окружающей среды. На начальных этапах заболевания кашель нередко носит интермиттирующий характер, но на далеко зашедших стадиях заболевания наблюдается ежедневно (нередко на протяжении всего дня). Хронический кашель при ХОЗЛ может быть непродуктивным. В ряде случаев ХОЗЛ может развиваться без кашля.
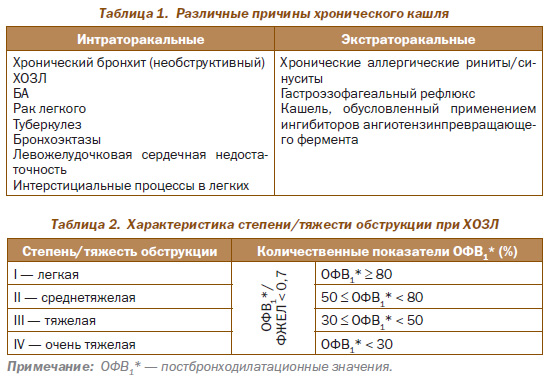
Кашель может быть представлен также при целом ряде заболеваний и патологических состояний, не имеющих отношения к ХОЗЛ, что требует дифференциальной диагностики. В табл. 1 представлены различные причины, обусловливающие развитие хронического кашля.
Кашель и регулярная продукция мокроты в течение 3 или более месяцев в течение 2 последовательных лет (при отсутствии других причин) — критерии диагностики хронического бронхита без обструкции. Наличие значительного количества мокроты (обычно гнойной) или кровохарканье предполагает наличие бронхоэктазов. Наличие гнойной мокроты отражает увеличение воспалительных маркеров и может свидетельствовать о начале инфекционного обострения. После исключения вышеперечисленных причин констатируют наличие идиопатического кашля.
Свистящее дыхание и ощущение сдавления грудной клетки — неспецифические симптомы ХОЗЛ, которые чаще наблюдаются при развитии обострений заболевания. При этом свистящие хрипы могут выслушиваться над легкими на вдохе и выдохе. Источником свистящего дыхания также может быть уровень гортани (при этом отсутствуют сухие хрипы над легкими при аускультации). Чувство сдавления грудной клетки является следствием активного участия межреберной мускулатуры в акте дыхания.
У многих больных ХОЗЛ имеют место cистемные (внелегочные) проявления, существенно влияющие на качество жизни и выживаемость. Ограничение проходимости дыхательных путей и особенно гиперинфляция легких неблагоприятно влияет на кардиальную функцию. Утомляемость, анорексия и исхудание с потерей мышечной массы — обычные симптомы у больных с тяжелым ХОЗЛ. Персистенция воспалительных медиаторов в циркуляции способствует потере мышечной массы и снижению веса вплоть до развития кахексии, а также ухудшению течения ИБС, сердечной недостаточности, остеопороза, сахарного диабета, депрессии и тревоги, снижению сексуальной активности.
При приступообразном кашле могут развиваться симптомы беттолепси́и (греч. bēttō — кашлять и lēpsis — приступ) — появление на высоте кашлевого приступа синкопальных состояний, длящихся от нескольких секунд до нескольких минут (иногда в сочетании с судорогами). В основе подобных приступов лежат нарушения кровоснабжения мозга, вызванные повышением внутригрудного давления и гипервентиляцией [5].
При развитии ХЛС появляются и прогрессируют симптомы недостаточности кровообращения в виде гепатомегалии, периферических отеков, асцита [6].
Анамнестические данные
В диагностике ХОЗЛ важное место отводится детально проведенному анамнезу, включающему выявлению основных факторов риска заболевания:
— курение и другие вредные факторы окружающей среды;
— указания на наличие астмы, аллергии, синуситов, носовых полипов, частых респираторных инфекций, особенно в детстве;
— наличие заболеваний легких у кровных родственников;
— наличие сопутствующих заболеваний сердечнососудистой (ишемическая болезнь сердца, артериальные гипертензии, метаболический синдром), мышечноскелетной системы (деформации грудной клетки, миопатии).
Физикальное исследование
Данные физикального исследования легких не играют решающей роли в ранней диагностике ХОЗЛ, однако обязательно учитываются при постановке такого диагноза в комплексе с показателями функции внешнего дыхания (ФВД).
Результаты объективного исследования у больных ХОЗЛ зависят от степени бронхиальной обструкции, наличия эмфиземы легких и легочной недостаточности (ЛН), признаков ХЛС и пр.
Так, при осмотре обращают внимание на участие дыхательной мускулатуры в акте дыхания, которое ассоциировано с тяжелой обструкцией (III–IV степени).
У лиц с развитием эмфиземы при осмотре грудная клетка имеет нередко бочкообразную форму, заполненные надключичные промежутки, границы легких смещены книзу, при перкуссии — коробочный перкуторный звук, ослабление везикулярного дыхания.
Цианоз/акроцианоз характеризуется как теплый и является признаком гипоксии/гиперкапнии, наблюдается при тяжелой дыхательной/сердечной недостаточности.
Признаком бронхиальной обструкции является наличие сухих (свистящих и жужжащих) хрипов преимущественно на выдохе, количество которых нередко увеличивается в горизонтальном положении.
Одышка у больных ХОЗЛ носит экспираторный характер и, даже будучи выраженной, не приводит к положению ортопноэ.
Отсутствие какойлибо патологии в физикальных данных не исключает наличия ХОЗЛ.
Исследование функции внешнего дыхания
Исследование функции внешнего дыхания является обязательным этапом диагностики ХОЗЛ. Только спирометрия позволяет установить наличие обструктивных нарушений — ключевого диагностического признака заболевания. Она позволяет оценить ряд объемных и скоростных показателей функции легких, выявить наличие обструктивных или рестриктивных нарушений вентиляции, оценить обратимость изменений под воздействием бронходилататоров.
Главный спирометрический критерий, подтверждающий диагноз ХОЗЛ, — отношение объема форсированного выдоха за первую секунду к форсированной жизненной емкости легких (ОФВ1/ФЖЕЛ) << 0,7 после ингаляции сальбутамола в дозе 400 мкг (т.е. после проведения бронходилатационного теста). Степень тяжести обструкции оценивается по постбронходилатационной величине ОФВ1 в соответствии с классификацией, представленной в табл. 2.
Следует отметить, что до недавнего времени наличие прироста ОФВ1 ≥ ≥ 12 % (и/или ≥ 200 мл) при выполнении бронходилатационного теста считалось признаком обратимой бронхиальной обструкции, что, в свою очередь, давало основания для дифференциальной диагностики ХОЗЛ и БА. В последние годы в целом ряде масштабных исследований продемонстрировано, что до 40 % больных ХОЗЛ наблюдается положительный ответ на тест с бронходилататором, т.е. прирост ОФВ1 на величину более 12 %, причем иногда достигающую 30–40 %! Поэтому обязательным критерием диагностики ХОЗЛ является сохранение после бронходилатации ОФВ1*/ФЖЕЛ << 0,7, а не отсутствие значительного прироста ОФВ1. Таким образом, проведение бронходилатационного теста позволяет диагностировать ХОЗЛ, а также оценить тяжесть обструкции по постбронходилатационным значениям ОФВ1 (ОФВ1*).
Отношение к вопросу о целесообразности проведения скрининговой спирометрии в общей популяции неоднозначно. Эксперты GOLD считают малоприемлемым проведение скрининга для выявления больных ХОЗЛ и рекомендуют изучать спирометрические показатели у лиц с факторами риска, представленными выше.
При постановке диагноза ХОЗЛ после оценки ФВД окончательно исключают наличие состояний, при которых может наблюдаться неполностью обратимая бронхообструкция (БА, облитерирующий бронхиолит, саркоидоз, диффузные интерстициальные процессы), а также возрастное снижение ОФВ1.
Таким образом, диагноз ХОЗЛ должен рассматриваться у каждого пациента старше 40 лет с одышкой/хроническим кашлем/мокротой и/или наличием различных факторов риска, которые представлены выше.
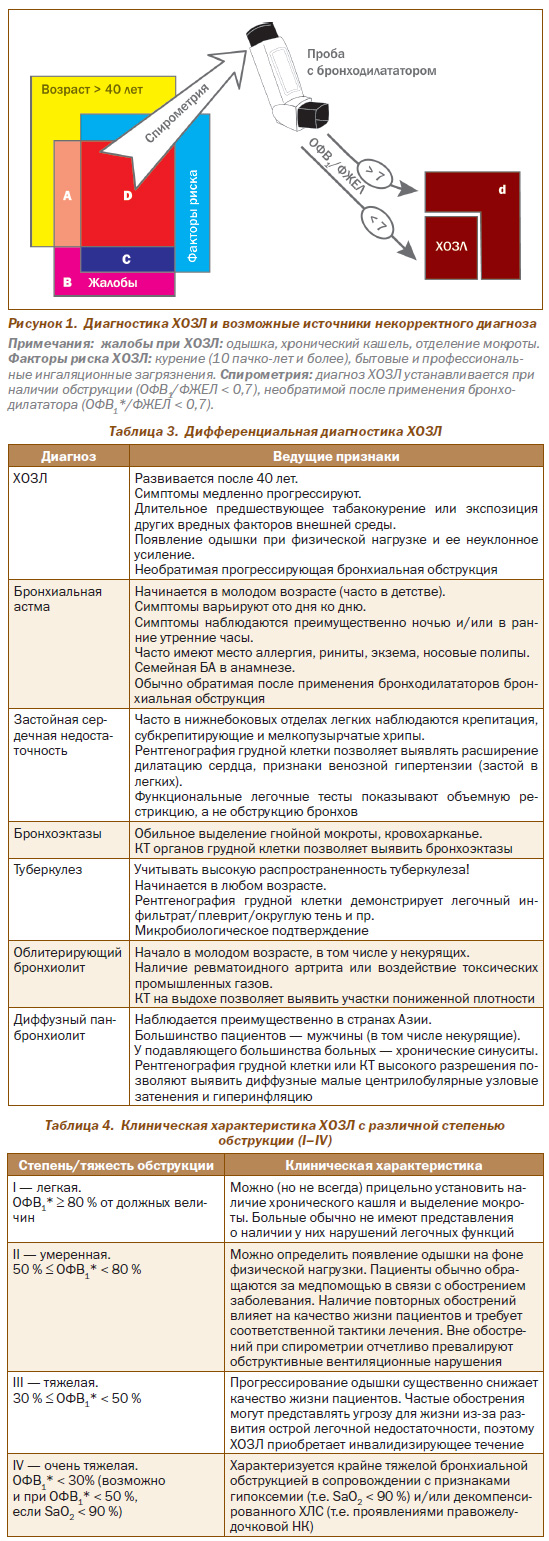
Ключевые подходы к диагностике ХОЗЛ и наиболее распространенные причины некорректной постановки диагноза проиллюстрированы на рис. 1.
Как показано на рис. 1, ХОЗЛ должно рассматриваться у всех лиц старше 40 лет, подвергавшихся воздействию факторов риска (курение, бытовые и промышленные загрязнения воздуха) и имеющих характерные клинические проявления (одышку/хронический кашель/продукцию мокроты): в таких случаях необходимо выполнение спирометрического исследования. Выявление обструкции, сохраняющейся после приема бронходилататора (необратимой или не полностью обратимой), подтверждает наличие ХОЗЛ.
Наиболее частые причины некорректной диагностики ХОЗЛ:
1. Отсутствие в анамнезе экспозиции ингаляционных факторов риска (преимущественно курения) — сегменты А и В.
2. Молодой возраст — сегмент С: у лиц моложе 40 лет вероятность наличия ХОЗЛ очень низкая (менее 2 %).
3. Отсутствие спирометрического подтверждения — сегменты D и d: без проведения спирометрии достоверный диагноз ХОЗЛ невозможен, так как у 2/3 лиц с клиническими проявлениями и факторами риска ХОЗЛ обструкция может отсутствовать или быть обратимой (d).
Дифференциальная диагностика
ХОЗЛ необходимо дифференцировать с рядом заболеваний, имеющих сходные клинические симптомы. В табл. 3 представлена краткая характеристика ХОЗЛ и заболеваний, с которыми следует проводить дифференциальную диагностику.
Клиническая оценка пациента и классификация ХОЗЛ
В рекомендациях GOLD 2011 года предложена новая классификация ХОЗЛ, базирующаяся на измененном подходе к клинической оценке состояния больного. Так, оценка клинического статуса ХОЗЛ должна основываться: 1) на интенсивности симптомов; 2) прогнозировании риска осложнений; 3) тяжести спирометрических нарушений; 4) выявлении серьезных сопутствующих заболеваний и патологических состояний (ишемическая болезнь сердца, сердечная недостаточность, фибрилляция предсердий, артериальная гипертензия, остеопороз, тревожные и депрессивные расстройства, рак легкого, сахарный диабет, почечная недостаточность, хронические инфекции).
Принципиальным нововведением является отказ от концепции стадийности заболевания. Это связано с тем, что не у каждого пациента отмечается клинически значимое прогрессирование заболевания со временем, а также с отсутствием строгой корреляции между возрастом и стадиями заболевания (например, в масштабном исследовании Jones P.W. с соавт. (2011) средний возраст пациентов на всех стадиях ХОЗЛ оказался одинаковым — около 65 лет) [5]. Наряду с этим вместо выделения стадий ХОЗЛ предлагается распределение больных по тяжести бронхиальной обструкции (см. выше табл. 2).
Клиническая характеристика больных ХОЗЛ, соответствующая указанным градациям тяжести обструкции, приведена в табл. 4.
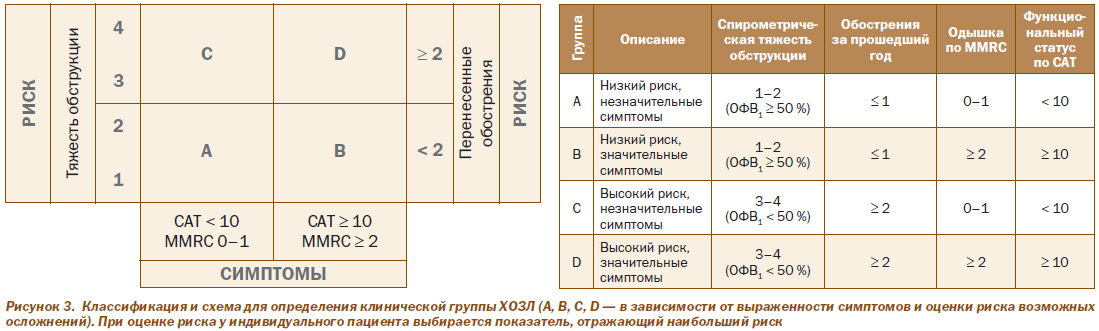
Важным нововведением является подход к комбинированной оценке ХОЗЛ. Цель комбинированной оценки — определение тяжести заболевания и риска будущих осложнений (обострений и госпитализаций) для последующего выбора лечебной тактики. Алгоритм оценки пациента в соответствии с новым подходом состоит из следующих шагов.
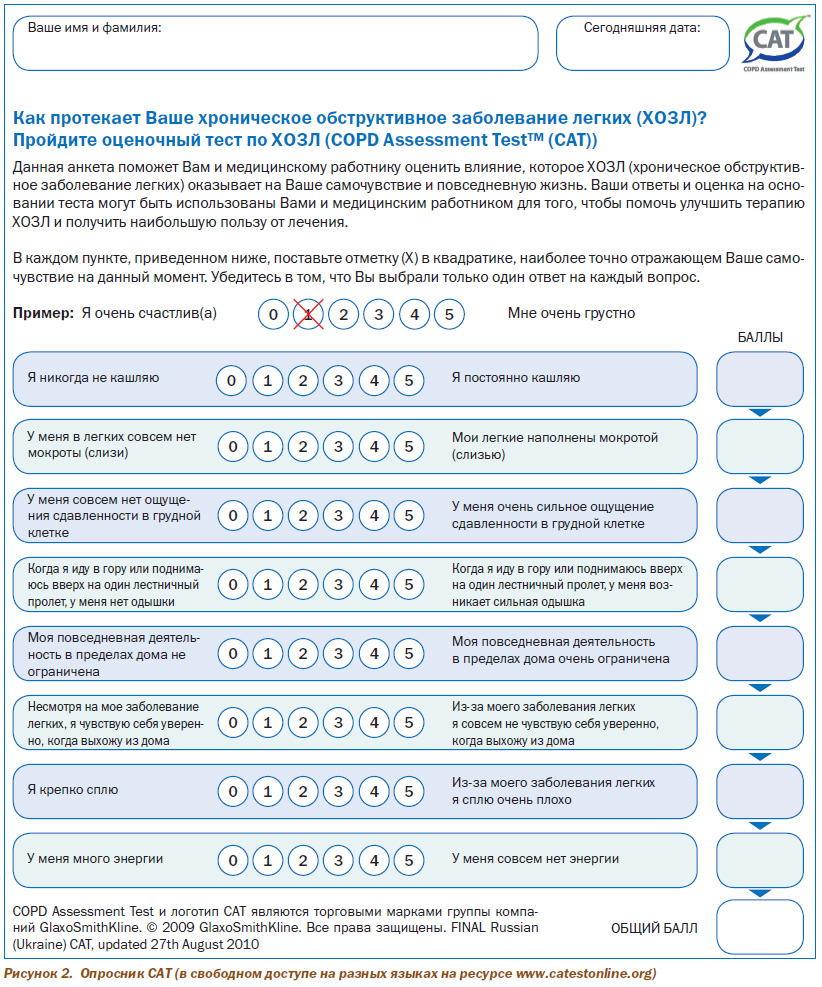
1. Оценить интенсивность симптомов. С этой целью рекомендуется использовать модифицированную шкалу одышки Медицинского исследовательского совета (Modified Medical Research Council Dyspnea Scale — МMRC) (табл. 5) или простой опросник оценки ХОЗЛ — САТ (COPD Assessment Test) (рис. 2). Предпочтение следует отдавать применению опросника САТ, так как он более полно характеризует функциональный статус пациента; использовать оба показателя нецелесообразно.
Подсчет баллов в предложенных опросниках позволяет выделить категории пациентов («малосимптомный» и «значительно симптомный»), которые следует внести в клинический диагноз. Так, «значительно симптомными» считаются больные с уровнем одышки по шкале МMRC ≥ 2 баллов или те, которые по опроснику САТ имеют ≥ 10 баллов.
2. Оценить риск осложнений ХОЗЛ. Определить риск осложнений можно двумя путями. Вопервых, на основании спирометрической тяжести обструкции. Так, при I–II степени тяжести (постбронходилатационный ОФВ1* > 50 %) предполагается невысокий риск осложнений, а при III–IV степени (ОФВ1* < 50 %) — высокий. Вовторых, следует оценить количество перенесенных обострений за прошедший год. Наличие в течение 12 месяцев 2 и более обострений ХОЗЛ, потребовавших лечения, является достоверным предиктором частых обострений и госпитализаций в будущем. Таким образом, прогнозирование риска обострений у пациента с ХОЗЛ оценивается в зависимости от спирометрической тяжести или частоты перенесенных ранее обострений. Если эти два подхода у конкретного пациента оценивают риск неоднозначно, необходимо опираться на более высокую (тяжелую) оценку.
3. Определить клиническую группу. На основании оценки выраженности симптомов и риска возможных осложнений следует определить, к какой клинической группе (A, B, C или D) относится пациент с ХОЗЛ. Схематично это представлено на рис. 2. Выделяются группа А — «Низкий риск, незначительные симптомы», группа B — «Низкий риск, значительные симптомы», группа С — «Высокий риск, незначительные симптомы» и группа D — «Высокий риск, значительные симптомы». Подавляющее большинство больных (80–90 %) относятся к группам B и D, около 10 % — к группе А и лишь несколько процентов — к группе С.
Формулирование диагноза
При формулировке диагноза ХОЗЛ должны быть указаны клиническая группа (А–D), тяжесть бронхиальной обструкции (I–IV), обострение или ремиссия заболевания, степень легочной недостаточности и наличие других осложнений заболевания. Указания на наличие хронического бронхита и/или эмфиземы — лишние и избыточные, потому что являются составными компонентами понятия ХОЗЛ.
Отдельного внимания при формулировке диагноза заслуживает характеристика таких проявлений поздних этапов ХОЗЛ, как легочная недостаточность, ХЛС, недостаточность кровообращения. Термин «легочная недостаточность» означает неспособность легких обеспечить нормальный газовый состав артериальной крови в состоянии покоя и/или при умеренных физических нагрузках. Классификация ЛН, используемая в Украине, выделяет 3 степени [6]:
— ЛН 1й степени — появляется одышка, которой раньше не было, во время привычной физической нагрузки (уровень привычной нагрузки индивидуален для каждого пациента и зависит от физического состояния и режима повседневной физической активности);
— ЛН 2й степени — одышка появляется при незначительной физической нагрузке (ходьба по ровной местности);
— ЛН 3й степени — одышка беспокоит в состоянии покоя.
В качестве иллюстрации можно привести клиническую оценку пациента 57 лет, обратившегося за помощью в связи с усилением кашля и выделением мокроты, а также одышкой 3й степени, у которого диагностирован ХОЗЛ (ОФВ1/ФЖЕЛ << 0,7, постбронходилатационное значение ОФВ1* — 57 %, 17 баллов по шкале САТ и за последние 12 месяцев он перенес 2 обострения, потребовавших госпитализации). Оценка симптомов по САТ относит его к «значительно симптомным» пациентам (группа В или D). Изза высокой частоты обострений в течение года пациент относится к группе более высокого риска — группе D. Таким образом, клинический диагноз у больного выглядит следующим образом: ХОЗЛ, бронхиальная обструкция 2й степени, клиническая группа D, обострение, ЛН 2й степени.
Описанный выше комбинированный подход к оценке больного ХОЗЛ лучше отражает многофакторность заболевания и позволяет индивидуализировать лечение в большей мере, чем использовавшаяся ранее однонаправленная оценка пациента преимущественно по степени спирометрических нарушений.

1. Vestbo J., Hurd S.S., Agusti A.G. et al. Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease, GOLD Executive Summary // American journal of respiratory and critical care medicine. — 2012. doi: 10.1164/rccm.2012040596PP[published Online First: Epub Date].
2. Halbert R.J., Natoli J.L., Gano A., Badamgarav E., Buist A.S., Mannino D.M. Global burden of COPD: systematic review and metaanalysis // The European respiratory journal: official journal of the European Society for Clinical Respiratory Physiology. — 2006. — 28(3). — 52332. doi: 10.1183/09031936.06.00124605[published Online First: Epub Date].
3. Bednarek M., Maciejewski J., Wozniak M., Kuca P., Zielinski J. Prevalence, severity and underdiagnosis of COPD in the primary care setting // Thorax. — 2008. — 63(5). — 4027. doi: 10.1136/thx.2007.085456[published Online First: Epub Date].
4. Lindberg A., Jonsson A.C., Ronmark E., Lundgren R., Larsson L.G., Lundback B. Tenyear cumulative incidence of COPD and risk factors for incident disease in a symptomatic cohort // Chest. — 2005. — 127(5). — 154452 doi: 10.1378/chest.127.5.1544[published Online First: Epub Date].
5. Jones P.W., Brusselle G., Dal Negro R.W. et al. Healthrelated quality of life in patients by COPD severity within primary care in Europe // Respiratory medicine. — 2011. — 105(1). — 5766. doi: 10.1016/j.rmed.2010.09.004[published Online First: Epub Date].
6. Гаврисюк В.К. Легочная недостаточность: механизмы развития и способы оценки // Украинский пульмонологический журнал. — 2006. — № 3. — С. 4042.