Газета «Новости медицины и фармации» 5 (449) 2013
Вернуться к номеру
Цирроз печени
Рубрики: Семейная медицина/Терапия, Гастроэнтерология, Терапия
Разделы: Медицинское образование
Версия для печати
Определение
Цирроз печени (ЦП) — хроническое полиэтиологическое прогрессирующее необратимое повреждение печени, характеризующееся нарастающим фиброзом, перестройкой нормальной структуры паренхимы печени с формированием узлов регенерации в виде ложных долек и проявляющееся развитием портальной гипертензии (ПГ) и печеночно-клеточной недостаточности.
Распространенность
Истинная распространенность цирроза печени недостаточно изучена. Очевидно, в большинстве случаев ЦП диагностируется уже на далеко зашедших стадиях поражения печени, то есть на стадии декомпенсации.
В экономически развитых странах ЦП входит в число шести ведущих причин смерти пациентов в возрасте 35–60 лет, а частота его составляет, по различным данным, от 14 до 30 случаев на 100 000 населения.
Этиология и патогенез
ЦП является конечной стадией хронического заболевания печени, а также результатом развития морфологических изменений в ней (диффузный фиброз) при ряде патологических состояний.
Наиболее частыми причинами развития ЦП являются хроническая интоксикация алкоголем и вирусные гепатиты (прежде всего гепатит С), а также неалкогольный стеатогепатит (НАСГ) и первичный билиарный цирроз (ПБЦ). Существенно реже ЦП развивается при хронической сердечной недостаточности, гемохроматозе, окклюзионных процессах в системе воротной вены (флебопортальный цирроз). Приблизительно в 10–35 % случаев этиология ЦП остается неустановленной.
Скорость формирования ЦП зависит от характеристик повреждающего фактора (вирулентности вируса, длительности приема алкоголя и т.д.) и обычно продолжается в течение многих лет. На начальных этапах развития ЦП механизмы повреждения печеночной паренхимы различны и определяются этиологическим фактором. Однако ведущие патогенетические механизмы универсальны и включают следующие стадии: 1) некроз гепатоцитов, приводящий к коллапсу печеночных долек; 2) следующее затем диффузное образование фиброзных септ; 3) и, наконец, формирование узлов регенерации. Независимо от этиологии гистологическая картина печени развившегося ЦП однотипна (за исключением ПБЦ).
Повреждение (некроз) гепатоцитов при алкогольном ЦП обусловлено непосредственным токсическим действием ацетальдегида (метаболита метанола). При хроническом употреблении алкоголя наблюдается персистенция повышенных уровней ацетальдегида, обусловливающая накопление жирных кислот и триглицеридов (ТГ) в гепатоцитах, что ведет к развитию жировой дистрофии печени. Этот процесс сопровождается стимуляцией синтеза коллагена и разрастанием фиброзной ткани, что в конечном итоге приводит к ЦП.
При репликации вирусов HBV и HCV развиваются сходные морфологические изменения, включающие апоптоз, гепатоцеллюлярный некроз и воспаление. При этом наблюдается набухание гепатоцитов (баллонная дистрофия), их сморщивание (ацидофильные изменения) и формирование ацидофильных телец. Портальные тракты расширены за счет воспалительной инфильтрации лимфоцитами и плазматическими клетками. По мере прогрессирования воспаление распространяется на печеночные дольки, вызывая повреждение пограничной пластинки и ступенчатые некрозы. Сливающиеся участки некроза в сосудистых структурах (веточки портальной и центральной вен) обозначаются мостовидными некрозами. Фиброз (коллагенизация) на начальных этапах обратим, но после образования в дольках септ, не содержащих клеток, становится необратимым. В результате превалирования процессов образования внеклеточного матрикса над его деградацией формируется рубцовая ткань. Активное участие в фиброгенезе принимают звездчатые клетки (также называемые липоцитами, перицитами), располагающиеся в пространстве Диссе между эндотелиальными клетками и поверхностью гепатоцитов, обращенной к синусоиду. В покое в звездчатых клетках печени содержатся капельки жира, включая витамин А, а также основные запасы ретиноидов организма. При различных патологических процессах в печени происходит активация звездчатых клеток, характеризующаяся их пролиферацией, увеличением в размерах, исчезновением капелек жира, а следовательно, ретиноидов. При этом увеличивается шероховатая эндоплазматическая сеть, появляется белок гладких мышц — a-актин, увеличивается количество рецепторов к провоспалительным цитокинам, стимулирующим пролиферацию и фиброгенез.
Другим ведущим фактором образования фиброзной ткани является разрушение белков матрикса под влиянием ряда ферментов, обозначаемых металлопротеазами, синтез которых происходит преимущественно в активированных звездчатых клетках (купферовских клетках).
Важное место занимают ранние изменения матрикса в пространстве Диссе — отложение коллагена I, III и V типов, что ведет к превращению синусоидов в капилляры (капилляризация) и исчезновению фенестров эндотелия, а следовательно, к нарушению метаболических процессов в гепатоцитах.
Последующее стенозирование синусоидов фиброзной тканью ведет к повышению сосудистого сопротивления в печени и развитию портальной гипертензии.
В участках гибели печеночных клеток формируются узлы регенерации, по периферии которых в области портоцентральных септ сохраняются синусоиды. При этом нарушается кровоснабжение центральной части узла, что способствует прогрессии цирротических изменений.
В патогенезе ЦП, как исхода неалкогольного стеатогепатита (НАСГ), наблюдаемого у больных СД 2-го типа, ведущую роль отводят инсулинорезистентности, которая обусловливает развитие дислипидемии с накоплением ТГ в гепатоцитах, что приводит к развитию жировой дистрофии (стадия стеатоза). Следующие параллельно оксидативный стресс и продукция провоспалительных цитокинов приводят к некрозу гепатоцитов, индукции процессов фиброзирования (стадия фиброза) и, в конечном итоге, формированию цирроза.
В патогенезе ЦП при хронической сердечной недостаточности ведущее место отводится некрозу гепатоцитов, обусловленному персистирующей гипоксемией и венозным застоем.
Этиология, патогенез и лечение первичного билиарного цирроза печени приводятся в отдельном разделе данного семинара.
Патоморфология цирроза печени
Макроскопически при ЦП поверхность печени бугристая, плотная, увеличена в размерах. У части больных в терминальной стадии ЦП имеет место уменьшение печени в размерах и ее сморщивание.
Выделяют три патоморфологические стадии ЦП:
— Начальная стадия (стадия формирования) ЦП.
— Стадия сформировавшегося цирроза.
— Дистрофическая стадия (атрофический ЦП).
При микроскопическом исследовании биоптатов печени выявляются нарушения долькового строения печени, фрагментация ее стенки, наличие узлов-регенератов или ложных долек, фиброзных прослоек или септ, окружающих ложные дольки, утолщение печеночных трабекул, изменение гепатоцитов (крупные клетки регенеративного типа, диспластические гепатоциты с полиморфными ядрами).
Классификация циррозов печени
(Акапулько, 1974; ВОЗ, 1978; А.С. Логинов, Ю.Е. Блок, 1987; Лос-Анджелес, 1994)
I. По этиологии:
1) вирусный — следствие вирусных гепатитов В, С, D;
2) алкогольный;
3) токсический;
4) аутоиммунный — следствие аутоиммунного гепатита;
5) вследствие метаболических нарушений:
a) гемахроматоз;
b) болезнь Вильсона — Коновалова;
c) недостаточность a1-антитрипсина;
d) гликогеноз IV типа;
e) галактоземия;
6. застойный — как следствие застоя в печени, обусловленного сердечной недостаточностью;
7) билиарный:
a) первичный билиарный;
b) вторичный билиарный;
8) криптогенный.
II. По морфологической характеристике:
1) мелкоузловой (узлы размером 1–3 мм);
2) крупноузловой (узлы размером более 3 мм);
3) смешанный (мелко-крупноузловой);
4) неполный перегородочный (септальный).
III. По активности и скорости прогрессирования:
1) активный (с умеренной или высокой активностью):
a) быстро прогрессирующий;
b) медленно прогрессирующий;
c) латентный;
2) неактивный.
IV. По тяжести течения:
1) компенсированный (печеночная энцефалопатия и асцит отсутствуют);
2) субкомпенсированный (печеночная энцефалопатия I–II степени, асцит, корригируемый диетическим режимом и медикаментозно);
3) декомпенсированный (печеночная энцефалопатия III степени, резистентный напряженный асцит).
V. Осложнения:
1) печеночная кома (или прекома);
2) кровотечение из варикозно расширенных вен пищевода и желудка, геморроидальных вен;
3) тромбоз воротной вены;
4) спонтанный бактериальный перитонит;
5) спонтанный бактериальный плеврит;
6) цирроз-рак (гепатоцеллюлярная карцинома).
В широкой клинической практике для оценки тяжести ЦП используется балльная шкала Child-Turcotte-Pugh (табл. 1).
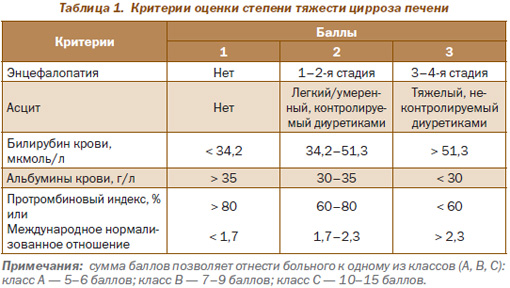
Класс А соответствует понятию «компенсированный ЦП».
Класс В соответствует понятию «субкомпенсированный ЦП».
Класс С соответствует понятию «декомпенсированный ЦП».
Клинические проявления цирроза печени
Портальная гипертензия
Определение, распространенность
В зависимости от анатомической локализации нарушений портального кровообращения различают препеченочную (портальная вена), внутрипеченочную (печень) и постпеченочную (сердце, нижняя полая вена, печеночные вены). В подавляющем большинстве случаев причиной внутрипеченочной портальной гипертензии (ПГ) является ЦП.
ПГ, характеризующаяся увеличением градиента давления между портальным и кавальным венозными бассейнами, является ведущим осложнением ЦП и устанавливается при печеночном венозном градиенте давления (ПВГД) выше 5 мм рт.ст. Клинически значимым ПВГД считается при его уровнях 10 мм рт.ст. и выше. Последствия ПГ включают развитие множественных портосистемных шунтов (варикозное расширение вен пищевода, желудка, геморроидальных), асцита/отеков, гепаторенального синдрома и печеночной энцефалопатии, определяющих клиническую картину, характер течения и прогноз.
Частота ПГ при ЦП приближается к 100 %. При ПВГД 10 мм рт.ст. наблюдается развитие интенсивной коллатеральной циркуляции, компенсирующей дальнейшее его нарастание, что ведет к формированию анастомозов, посредством которых кровь из портальной системы поступает в систему нижней полой вены (НПВ).
К основным факторам, обусловившим развитие ПГ при ЦП, относится повышение сопротивления току крови в печени и увеличение спланхнического кровотока (спланхническое кровообращение характеризуется перфузией между чревной, верхней и нижней мезентериальными артериями и портальной веной).
Диффузный фиброз печени, нодулярная перестройка ее паренхимы, капилляризация синусоидов, наличие микротромбов во внутрипеченочной сосудистой сети приводят к дисфункции синусоидальных эндотелиальных клеток (СЭК), продуцирующих в норме вазоактивные субстанции, регулирующие синусоидальную резистентность. К ним относятся вазодилататорные агенты — оксид азота (NO), простагландин Е2 и вазоконстрикторные — эндотелин-1, ангиотензин II, лейкотриены и норадреналин. Дисфункция СЭК ведет к повышению продукции вазоконстрикторов и чувствительности к ним, снижению продукции вазодилататоров. Конечным результатом этих процессов является нарушение синусоидальной релаксации и развитие ПГ.
В отличие от вазоконстрикции, имеющей место во внутрипеченочной сосудистой сети при ЦП, вне ее развивается прогрессирующая спланхническая сосудистая вазодилатация, обусловленная гиперпродукцией вазодилататорных субстанций (прежде всего NO), что ведет к повышению печеночного кровотока и затем к хронизации и усугублению ПГ.
Развитие ПГ ассоциируется с формированием портокавальных шунтов за счет расширения коллатеральных вен. В соответствии с эмбриогенезом коллатерали формируются: 1) в гастроэзофагеальных и геморроидальных сплетениях; 2) облитерированных фетальных сосудах (околопупочных) и 3) порторенальном сплетении. При этом не наступает нормализация портального давления, а развивается гипердинамическое состояние внутрипеченочного кровотока, сопровождающееся увеличением сердечного выброса и снижением периферического сосудистого сопротивления, которые обусловливают снижение эффективного артериального кровотока и развитие гипотензии.
Описанные выше механизмы нейрогуморальной дисфункции обусловливают ретенцию натрия и воды, развитие гиперволемии за счет увеличения объема циркулирующей плазмы и формирование асцита/отеков.
Патофизиология портальной гипертензии
ПГ — ведущее проявление ЦП, обусловливает развитие спланхнической артериальной вазодилатации. В результате развившейся системной артериальной вазодилатации «разряжаются» рецепторы, реагирующие на растяжение в каротидном синусе и дуге аорты, в результате чего стимулируется ренин-ангиотензин-альдостероновая система (РААС), симпатическая нервная система (СНС) и аргинин, вазопрессин (АВП-АДГ). Стимуляция РААС, СНС и АВП способствует поддержанию артериального давления (АД) за счет повышения системной сосудистой резистентности в сочетании с увеличением сердечного выброса. В то время как компенсаторная нейрогуморальная активация препятствует развитию гипотензии, имеет место почечная вазоконстрикция, ассоциируемая с ретенцией натрия и воды. Все это результируется в почечную дисфункцию, носящую функциональный характер, и не обусловлено острым тубулярным некрозом (ОТН). Следовательно, возможно восстановление почечной функции, в частности, после трансплантации печени или при устранении снижения эффективного артериального объема крови, обусловленного спланхнической вазодилатацией, посредством использования комбинации аналогов АВП с альбумином. При первом типе гепаторенального синдрома (ГРС) такой лечебный подход позволяет восстановить почечную функцию в течение 7–10 дней приблизительно у 50 % больных. Наличие почечной вазоконстрикции у больных с ЦП ассоциируется с высоким риском развития ОТН в ситуациях, включающих гастроинтестинальные кровотечения, диарею, обусловленную приемом лактулозы, сепсис или прием нефротоксических антибиотиков (в частности, аминогликозидов) или нестероидных противовоспалительных препаратов (НПВП).
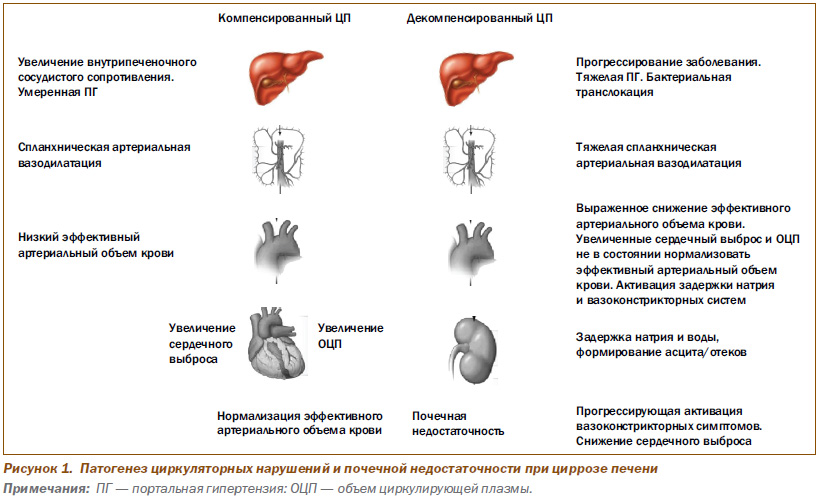
Патогенез циркуляторных нарушений и почечной недостаточности показан на рис. 1.
Клиника портальной гипертензии
В клинической практике выделяют следующие стадии ПГ:
0 стадия — отсутствует варикозное расширение вен и асцит;
I стадия — имеется варикозное расширение вен без асцита;
II стадия — имеется варикозное расширение вен и асцит;
III стадия — наблюдаются кровотечения из варикозно расширенных вен при наличии асцита;
0 и I стадии соответствуют компенсированному ЦП, II и III стадии — декомпенсированному.
Уже на ранних этапах ЦП возникают диспептические расстройства (снижение аппетита, тошнота, метеоризм). По мере нарастания и персистенции ЦП появляются слабость, утомляемость, дискомфорт в обоих подреберьях, желтуха, «сосудистые звездочки», «печеночные ладони» и др.
Характерно похудание, часто маскируемое одновременным накоплением жидкости в брюшной полости. В 25 % случаев отмечается уменьшение размеров печени, спленомегалия у 50 % больных. Гепатолиенальный синдром часто сопровождается гиперспленизмом, характеризующимся снижением в крови форменных элементов крови (лейкопенией, тромбоцитопенией, анемией) и увеличением клеточных элементов в костном мозге. Гинекомастия и импотенция у мужчин и нарушение менструального цикла у женщин объясняются появлением на фоне печеночно-клеточной недостаточности признаков гиперэстрогенемии. У половины больных повышена температура тела. В большинстве случаев лихорадка носит субфебрильный характер и сохраняется несколько недель.
Характерным проявлением ЦП и клинически значимой портальной гипертензии на II–III стадии являются варикозное расширенние вен в описанных выше сосудистых сетях, асцит и их осложнения (кровотечения, перитонит), печеночная энцефалопатия.
Клинические проявления и лечебная тактика при компенсированном и декомпенсированном циррозе печени
В настоящее время рекомендуется рассматривать компенсированный ЦП (КЦП) (класс А) в отношении диагностики, лечебных подходов и прогноза раздельно от декомпенсированного ЦП (ДЦП) (классы В и С). В связи с этим далее мы отдельно обсуждаем клинические проявления и лечебную тактику при компенсированном и декомпенсированном ЦП.
Компенсированный цирроз печени
Больные КЦП класса А характеризуются отсутствием желтухи, асцита, кровотечений из варикозных вен и энцефалопатии.
Лечебная тактика при КЦП преследует две ведущие цели: 1) лечение заболевания печени или патологических состояний, обусловивших развитие ЦП (гепатиты С или В, алкогольный гепатит, НАСГ) и 2) ранняя диагностика ЦП и профилактика его осложнений. Лечение заболеваний печени не является предметом данного обсуждения.
Диагностика гастроэзофагеальных варикозных вен и первичная профилактика варикозных кровотечений (ВК)
Всем больным с впервые диагностированным ЦП необходимо проведение ФГДС с целью диагностики варикозных вен (ВВ) пищевода и желудка и определения необходимости проведения терапии, предупреждающей первый эпизод ВК.
ВВ выявляется приблизительно у 50 % больных с ЦП. Их наличие коррелирует с тяжестью поражения печени: у лиц с классом А варикозно расширенные вены наблюдаются в 40 % случаев, а при классе С — в 85 %. Частота гастроэзофагеальных кровотечений составляет 12–15 % в год, а летальность достигает 15–20 %. В связи с этим важное место в ведении больных с КЦП отводится лечебным подходам, направленным на первичную профилактику ВК.
Показания для проведения первичной профилактики гастроэзофагеальных кровотечений включают: большие размеры ВВ (варицелы) и классы В и С ЦП.
Для первичной профилактики используются два подхода:
1) неселективные b-адреноблокаторы (b-АБ) (при отсутствии противопоказаний);
2) эндоскопическое лигирование варицел (ЭЛВ).
Неселективные b-АБ (пропранолол, надолол) уменьшают портальное давление за счет снижения сердечного выброса (b1-блокирующий эффект) и в большей мере за счет снижения притока крови в портальную вену вследствие вазоконстрикции спланхнической (чревной) сосудистой сети (b2-блокирующий эффект). В связи с этим не рекомендуется использовать селективные b-АБ с целью профилактики кровотечений.
Представлены убедительные доказательства способности неселективных b-АБ снижать частоту первичных ВК (на 15–25 %) и уменьшать летальность, обусловленную ими, а также замедлять рост варицел.
Применение b-АБ не показано больным ЦП без варицел.
Не рекомендуется использование нитратов (например, изосорбида мононитрат), являющихся потенциальными вазодилататорами. Их применение не только не снижает частоту кровотечений, но и ассоциируется с увеличением летальности вследствие усугубления вазодилатирующего состояния. Также не рекомендуется использование комбинации нитратов с b-АБ. Не получены доказательства способности сартанов снижать риск ВК. Комбинация b-АБ со спиронолактоном не повышает эффект b-АБ.
Эффективность ЭЛВ в снижении частоты ВК близка к таковой при применении неселективных b-АБ.
Риск развития декомпенсации при использовании различных медикаментов
Ацетаминофен (парацетамол) и НПВП, включая аспирин, потенциально могут вести к декомпенсации больных с КЦП или к нарастанию тяжести декомпенсации.
Парацетамол способен продуцировать дозозависимый гепатоцеллюлярный некроз с развитием тяжелой гепатотоксичности при однократном приеме 15 г препарата. У лиц с ЦП или нутритивными нарушениями высокий риск усугубления повреждения печени при использовании парацетамола в терапевтических дозировках (то есть < 4,0 г/сут).
В последние годы представлены доказательства высокого риска развития острой печеночной недостаточности при длительном применении парацетамола в дозировках менее 4,0 г/сут. В связи с этим его применение больным с ЦП должно быть регламентировано строгими показаниями, а при необходимости — использование дозы 1,0–2,0 г/сут с временным ограничением.
НПВП, наряду со способностью вызывать идиосинкразическое поражение печени, ингибируют синтез простагландинов, в связи с чем снижают эффект диуретиков, усугубляют почечную вазоконстрикцию, что, в свою очередь, повышает риск развития острого повреждения почек (ОПП) и снижения скорости клубочковой фильтрации (СКФ). Поэтому неприемлемо применение НПВП как у больных с ДЦП, так и компенсированным.
Декомпенсированный цирроз печени
В этом разделе мы обсуждаем ведущие осложнения ДЦП: асцит, кровотечения из варикозных вен, спонтанные бактериальные инфекции (спонтанный бактериальный перитонит, спонтанная бактериальная эмпиема плевры, спонтанная бактериемия), гепаторенальный синдром и печеночная энцефалопатия.
Асцит (отечный синдром)
Распространенность
Асцит является одним из наиболее частых осложнений ЦП. Удельный вес ЦП среди всех причин асцитов составляет около 75 %. У больных с компенсированным ЦП в течение 5–10 лет наблюдается развитие асцита (отечного синдрома) в 30–60 % случаев, что ассоциируется с существенным ухудшением качества жизни и прогноза. Однолетняя летальность больных ЦП при развитии асцита составляет около 40 %, а двухлетняя — 50 %. Больные с асцитом должны рассматриваться как претенденты на трансплантацию печени.
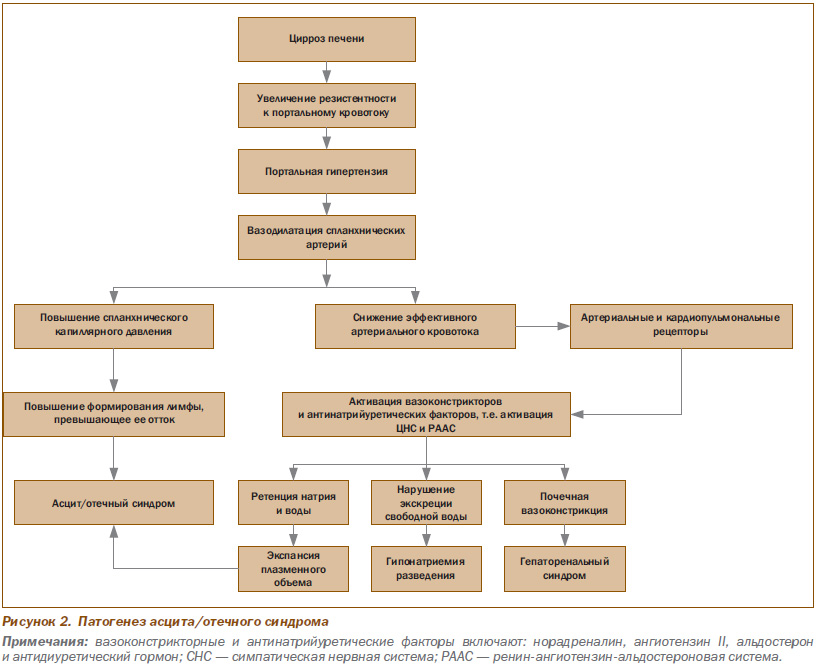
Патогенез асцита/отечного синдрома
Патогенез асцита/отечного синдрома при ЦП показан на рис. 2.
Как показано на рис. 2, повышение печеночной резистентности к портальному кровотоку, обусловленное ЦП, ведет к развитию портальной гипертензии, повышению локальной продукции вазодилататоров (прежде всего оксида азота), формированию венозных коллатералей, дилатации спланхнических артерий (ведущего патофизиологического фактора), шунтированию крови в системную циркуляцию, снижение эффективного артериального кровотока. На ранних стадиях цирроза вазодилатация спланхнических артерий умеренная и оказывает незначительное действие на эффективный артериальный объем крови. По мере прогрессирования ЦП нарастает спланхническая артериальная вазодилатация, что обусловливает выраженное снижение эффективного артериального объема, ведущего к снижению АД. Развившаяся гипотензия ведет к активации вазоконстрикторов и антинатрийуретических факторов, результатом чего является задержка натрия и воды. Комбинация портальной гипертензии и спланхнической артериальной вазодилатации повышает интерстициальное капиллярное давление и проницаемость, приводя к аккумуляции жидкости в абдоминальной полости (то есть формированию асцита). Задержка натрия почками, в свою очередь, ведет к увеличению объема внеклеточной жидкости, нарастанию асцита и формированию отеков. На этой стадии цирроза существенно нарушается почечная экскреция «свободной» воды и прогрессирует вазоконстрикция, что, в свою очередь, индуцирует развитие гипонатриемии, гиповолемии и гепаторенального синдрома соответственно.
Оценка больного с асцитом
Оценка больного с асцитом включает анамнез, физикальное исследование, абдоминальное УЗИ, лабораторное исследование функции печени, почек, электролитов крови и мочи, а также анализ асцитической жидкости.
Эксперты по изучению асцитов предлагают их классификацию по степени выраженности, определяющей лечебную тактику, что показано в табл. 2.
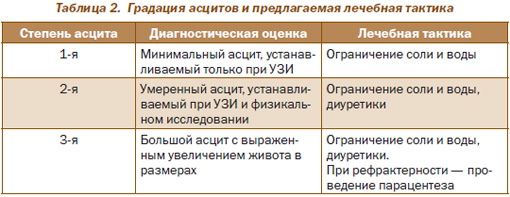
Всем больным с асцитом 2–3-й степени показано проведение диагностического парацентеза с полноценным исследованием асцитической жидкости с целью исключения других причин асцита и спонтанного бактериального перитонита (СБП). Важно определение общего белка асцитической жидкости с целью установления риска развития СБП. Риск высокий при уровнях белка меньше 15 г/л.
Для исключения СБП необходим подсчет нейтрофилов. Бактериологическое исследование асцитической жидкости должно быть проведено всем больным с асцитом.
Лечебная тактика при асците/отечном синдроме
При асците у больных с ЦП используются пероральные диуретики, начиная с низких или умеренных дозировок с повышением их при необходимости. Проведение диуретической терапии (ДТ) показано «стабильным» больным, то есть при отсутствии варикозных кровотечений, бактериальной инфекции или значимой почечной дисфункции (в частности, гепаторенального синдрома). При резистентном напряженном асците, характеризующемся абдоминальным дискомфортом и/или респираторным дистресс-синдромом, показано проведение ургентного парацентеза с удалением большого количества асцитической жидкости.
Как было отмечено выше, применение НПВП, включая аспирин, неприемлемо при асците в связи с их ингибирующим влиянием на эффект диуретиков. Это также относится к ЦОГ-2-специфическим НПВП (коксибам).
С целью профилактики СБП у больных с высоким риском его развития (уровни белка в асцитической жидкости менее 15,0 г/л) рекомендуется применение норфлоксацина (400 мг/сут).
Ведение больных с неосложненным асцитом
У больных с ЦП и асцитом имеет место высокий риск других осложнений, включающих рефрактерный асцит, СБП, гипонатриемию и гепаторенальный синдром. При их отсутствии асцит обозначается как неосложненный.
Лечебная тактика определяется степенью выраженности асцита. При асците I степени (легкий асцит) показано ограничение поваренной соли и воды, а также строгий контроль динамики его тяжести; при асците II степени (умеренный асцит) показано ограничение поваренной соли (4,6–6,9 г/сут). При нормальном уровне натрия в крови нет необходимости в существенном ограничении жидкости. Отсутствуют доказательства положительного эффекта постельного режима на увеличение диуреза.
Антагонисты альдостерона (АА) при асците/отечном синдроме у больных с ЦП более эффективны, чем петлевые диуретики (ПД). Амилорид менее эффективен, чем спиронолактон, в связи с чем должен применяться только в случаях, когда развиваются побочные эффекты. АА рассматриваются как диуретики выбора при асците/отечном синдроме у больных с ЦП.
При первом эпизоде умеренного асцита первоначально показано самостоятельное применение АА (спиронолактон с начальной дозой 100 мг/сут и при необходимости ее увеличение на 100 мг каждые 7 дней до максимальной — 400 мг/сут).
При рецидивах асцита показана комбинация АА с ПД, в американском консенсусе комбинация применяется как стартовая терапия.
Дозировки диуретиков должны адаптироваться на величину диуреза и снижение массы тела (МТ). У больных с асцитом без периферических отеков уменьшение МТ не должно превышать 0,5 кг/сут, а при наличии последних — 1,0 кг/сут.
Таким образом, при первом эпизоде умеренного асцита (II степень) рекомендуется самостоятельное применение спиронолактона с первоначальной дозой 100 мг/сут, повышение при необходимости на 100 мг каждые 7 дней до максимальной — 400 мг/сут. Больным с недостаточным ответом на максимальную дозу спиронолактона показано дополнительное назначение фуросемида, начиная с 20–40 мг/сут до максимальной дозы — 160 мг/сут или торасемида, начиная с 5–10 до 100 мг/сут (при необходимости). При проведении ДТ (особенно в течение первого месяца) необходим строгий контроль гемодинамических и биохимических показателей с целью предотвращения гипонатриемии и гипокалиемии. Применение гидрохлортиазида в дополнение к комбинации АА и ПД может ассоциироваться с увеличением риска развития гипонатриемии.
При рецидивах асцита показана комбинация АА с ПД в представленном выше режиме.
Целью лечебной тактики является устранение асцита и сохранение достигнутого эффекта при минимальных дозировках диуретиков или их полной отмене.
Особая осторожность и строгое мониторирование гемодинамических и биохимических показателей должны быть при назначении диуретиков больным с почечной недостаточностью, гипонатриемией или нарушениями уровней калия. В последнем случае перед началом ДТ показана нормализация концентрации калия. При выраженной печеночной энцефалопатии диуретики противопоказаны.
Диуретики следует отменить при тяжелой гипонатриемии (уровень натрия менее 120–125 ммоль/л), прогрессирующей почечной недостаточности, усугублении печеночной энцефалопатии. Фуросемид или торасемид следует отменить при тяжелой гипокалиемии (менее 3 ммоль/л), а калийсберегающие диуретики (в том числе АА) отменить при выраженной гиперкалиемии (калий сыворотки ≥ 6,0 ммоль/л).
Большой асцит (3-я степень)
Парацентез с удалением большого количества асцитической жидкости (ПУБКАЖ) является терапией выбора при асците 3-й степени. Анализ исследований, посвященных сравнительной оценке эффективности и безопасности между двумя лечебными подходами — ПУБКАЖ и ДТ у больных с асцитом 3-й степени, продемонстрировал, что:
1. ПУБКАЖ в комбинации с последующим введением альбумина более эффективен, чем ДТ, и существенно снижает пребывание в стационаре.
2. ПУБКАЖ в комбинации с альбумином безопаснее, чем ДТ; частота развития гипонатриемии, почечной недостаточности и печеночной энцефалопатии ниже, чем терапия диуретиками.
3. Отсутствуют различия между двумя рассматриваемыми лечебными подходами в частоте повторных госпитализаций и выживаемости; ПУБКАЖ — довольно безопасная процедура; риск локальных осложнений (кровотечения и перфорации кишечника) довольно низкий.
Вместе с тем удаление большого количества асцитической жидкости сопряжено с циркуляторной дисфункцией, характеризуемой снижением эффективного артериального объема крови — состояния, известного как постпарацентезная циркуляторная дисфункция (ППЦД), которая дает ряд неблагоприятных эффектов:
1) последующая быстрая аккумуляция асцита;
2) приблизительно у 20 % больных развивается гепаторенальный синдром или гипонатриемия разведения;
3) повышение портального давления в связи с увеличением внутрипеченочного сопротивления, обусловленного усилением влияния вазоконстрикторной системы на печеночную сосудистую циркуляцию;
4) снижение выживаемости.
Наиболее эффективным методом в предупреждении ППЦД после ПУБКАЖ является введение альбумина. Альбумин более эффективен, чем плазмозаменители (декстран, полиглюкин) в профилактике ППЦД. При удалении менее 5 л асцитической жидкости эффективность декстрана (8 г/л асцитической жидкости) или полиглюкина (150 мл/л асцитической жидкости) подобна таковой альбумина. Однако альбумин более эффективен при удалении более 5 л асцитической жидкости, что, однако, не ассоциируется с увеличением выживаемости.
ПУБКАЖ должен проводиться в условиях строгого стерильного режима. Неприемлемо проведение парацентеза при выраженной коагулопатии (протромбиновый индекс менее 40 % и/или уровень тромбоцитов крови менее 40 тыс.). При наличии диссеминированной интраваскулярной коагуляции проведение парацентеза противопоказано.
Лекарственные препараты, не рекомендуемые при асците у больных ЦП
Применение ЦОГ-2-неселективных НПВП (индометацин, сулиндак, ибупрофен, аспирин и др.) у больных с ЦП и асцитом сопряжено с высоким риском развития ОПП (острой почечной недостаточности), гипонатриемией и диуретической резистентностью. В связи с этим их использование у больных с ЦП и асцитом неприемлемо. В ряде исследований показано, что кратковременное применение ЦОГ-2-селективных НПВП (коксибов) не сопровождается ухудшением почечной функции. Однако необходимо проведение дальнейших исследований, посвященных безопасности коксибов у обсуждаемой категории больных.
Ингибиторы ангиотензинпревращающего фермента (ИАПФ) или антагонисты рецепторов ангиотензина II (АРАII) противопоказаны больным ЦП с асцитом в связи с высоким риском развития артериальной гипотензии и почечной недостаточности.
Неприемлемо также использование a1-адренергических блокаторов (празозин и др.) из-за высокого риска развития гипотензии, увеличения всасывания натрия и воды, а следовательно, увеличения асцита/отеков. Также следует избегать назначения аминогликозидов или их комбинаций с ампициллином при лечении бактериальных инфекций ввиду их нефротоксичности. Применение рентгеноконтрастных препаратов противопоказано больным с ЦП и асцитом при наличии почечной недостаточности.
Рефрактерный асцит
Рефрактерный асцит обозначается как «асцит, который не разрешается при проведении адекватных лечебных подходов (применении спиронолактона в дозе 400 мг и фуросемида 160 мг в сутки) или быстро формируется после ПУБКАЖ, несмотря на применение оптимальной ДТ».
Выделяют несколько лечебных подходов в лечении больных с асцитом, включающих повторные ПУБКАЖ с ДТ, трансъюгулярное внутрипеченочное портосистемное шунтирование (ТВПШ) и трансплантацию печени.
Диуретики не эффективны у большинства больных (более 90 %) с резистентным асцитом. ДТ следует прекратить у больных с осложнениями, вызванными диуретиками (печеночная энцефалопатия, почечная недостаточность или электролитные нарушения). В остальных случаях ДТ следует продолжать, если экскреция натрия с мочой под ее влиянием превышает 30 ммоль/л.
ТВПШ эффективно у больных с рефрактерным асцитом, но ассоциируется с высоким риском развития печеночной энцефалопатии. Кроме того, выживаемость больных, которым проведено шунтирование, не увеличивается по сравнению с пациентами, которым проводятся повторные ПУБКАЖ. Проведение ТВПШ следует рассматривать в случаях, требующих частых ПУБКАЖ, или при неэффективности парацентеза (то есть при наличии локализованных асцитов).
Разрешение асцита после ТВПШ происходит медленно, а большинство больных требуют продолжения ДТ и ограничения поваренной соли.
ТВПШ не показано больным с тяжелой печеночной недостаточностью (билирубин сыворотки более 85,5 мкмоль/л, МНО более 2,0, печеночной энцефалопатией II степени, активной инфекцией, прогрессирующей почечной недостаточностью или тяжелыми заболеваниями сердечно-сосудистой и респираторной систем.
Спонтанный бактериальный перитонит
Спонтанный бактериальный перитонит (СБП) — частая инфекция у больных с ЦП и асцитом. В прежние годы летальность при СБП превышала 90 %. В настоящее время в связи с ранней диагностикой и своевременным применением адекватной антибактериальной терапии летальность снизилась до 20 %.
Диагностика СБП
У всех больных с ЦП и асцитом имеет место высокий риск развития СБП. Распространенность его у амбулаторных пациентов составляет 1,5–3,5 % и достигает 10 % у лиц, поступающих в стационар.
СБП характеризуется:
1) локальными симптомами перитонита (абдоминальная боль, симптомы раздражения брюшины, тошнота, рвота, диарея, кишечная непроходимость);
2) симптомами системного воспаления (гипер- или гипотермия, озноб, лейкоцитоз со сдвигом лейкоцитарной формулы влево, тахикардия);
3) ухудшением печеночной функции;
4) печеночной энцефалопатией;
5) шоком;
6) почечной недостаточностью;
7) желудочно-кишечными кровотечениями.
Диагноз СБП базируется прежде всего на результатах исследования асцитической жидкости. В связи с этим диагностический парацентез следует выполнять у всех больных, поступающих в стационар (при отсутствии противопоказаний), с целью исключения СБП. Диагностический парацентез также должен быть проведен больным с желудочно-кишечными кровотечениями, шоком, лихорадкой, желудочно-кишечными симптомами, а также лицам с ухудшением печеночной или почечной функций и печеночной энцефалопатией.
Диагноз СБП устанавливается при уровнях нейтрофилов в асцитической жидкости более 250/мм3.
Бактериологическое исследование асцитической жидкости нередко дает отрицательный результат и не является решающим тестом в диагностике СБП, но служит важным параметром в выборе антибактериальной терапии. Бактериологическое исследование крови должно быть проведено у всех больных с СБП до начала антибактериальной терапии.
Спонтанная бактериальная эмпиема плевры
Спонтанная бактериальная эмпиема плевры (СБЭП) является редким осложнением у больных с ЦП с асцитом, ассоциируется в 50 % случаев с СБП и развивается при наличии гидроторакса. У больных с ЦП при наличии гидроторакса необходимо проведение торакоцентеза и исследование плевральной жидкости. Диагноз устанавливается при уровне нейтрофилов 250/мм3 в сочетании с положительной культурой плевральной жидкости или при уровне нейтрофилов в плевральной жидкости более 500/мм3 при отрицательном бактериологическом исследовании плевральной жидкости и отсутствии пневмонии.
Вторичный бактериальный перитонит
У небольшого числа больных с ЦП может развиваться перитонит вследствие перфорации или воспаления интраабдоминальных органов, обозначаемый как вторичный бактериальный перитонит (ВБП). С диагностической целью в таких случаях показано проведение компьютерной томографии.
Лечебная тактика при СБП
Эмпирическая антибактериальная терапия должна быть начата немедленно после постановки диагноза СБП. Перед началом антибиотикотерапии необходимо направить асцитическую жидкость на микробиологическое исследование и определение чувствительности к антибиотикам.
Наиболее частым патогеном при СБП является E.coli, в связи с чем эмпирической терапией первой линии рассматриваются цефалоспорины третьего поколения. Альтернативой могут служить амоксициллин/клавуланат или фторхинолоны (ципрофлоксацин или офлоксацин). Фторхинолоны не следует применять больным, которые получали их с целью профилактики развития СБП или при нозокомиальном СБП.
Разрешение СБП наблюдается приблизительно в 90 % случаев под влиянием адекватной эмпирической антибактериальной терапии. Отсутствие эффекта от эмпирической антибактериальной терапии наблюдается при резистентных микроорганизмах или ВБП. В такой ситуации необходимо применение антибиотиков в соответствии с результатами антибиотикограммы.
СБП без септического шока может индуцировать серьезные гемодинамические нарушения с развитием или усугублением печеночной недостаточности, печеночной энцефалопатии и/или гепаторенального синдрома (ГРС) I типа. При этом госпитальная летальность достигает 20 %, несмотря на разрешение инфекции.
ГРС развивается приблизительно у 30 % больных, получающих самостоятельную антибактериальную терапию, и ассоциируется с неблагоприятным прогнозом. В то же время дополнительное назначение альбумина (1,5 г/кг первоначально, а на третий день 1 г/кг) снижает частоту развития ГРС и повышает выживаемость.
Лечебная тактика при СБЭП аналогична таковой при СБП.
Профилактика СБП показана больным:
— с желудочно-кишечными кровотечениями;
— низкой концентрацией (< 15 г/л) белка в асцитической жидкости и отсутствием СБП в анамнезе (первичная профилактика);
— наличием в анамнезе СБП (вторичная профилактика).
У больных с желудочно-кишечными кровотечениями и тяжелым поражением функции печени цефтриаксон является антибиотиком выбора для профилактики СБП; при менее тяжелом поражении печеночной функции для профилактики СБП может применяться норфлоксацин (перорально).
У больных с тяжелым нарушением функции печени и низким (< 15 г/л) содержанием белка в асцитической жидкости и без СБП в анамнезе норфлоксацин (400 мг/сут перорально), применяемый с целью первичной профилактики, снижает риск СБП и увеличивает выживаемость.
У больных, оставшихся в живых после первого эпизода СБП, имеет место высокий риск рецидивов СБП. Профилактическое применение антибиотиков снижает риск рецидивов СБП; норфлоксацин (400 мг/сут перорально) является антибиотиком выбора. Альтернативным антибиотиком может служить ципрофлоксацин (750 мг 1 раз в неделю перорально).
Больные, оставшиеся в живых после перенесенного СБП, характеризуются неблагоприятным прогнозом и должны рассматриваться как кандидаты на трансплантацию печени.
Гипонатриемия
Гипонатриемия развивается нередко у больных с ДЦП и обусловлена нарушением экскреции, свободной от растворов («свободной» воды), вследствие гиперсекреции вазопрессина (антидиуретического гормона), что приводит к непропорциональному всасыванию воды по отношению к всасыванию натрия. Гипонатриемию следует констатировать при сывороточной концентрации натрия ниже 135 ммоль/л.
У больных с ЦП может развиваться гипонатриемия двух типов: гиповолемическая и гиперволемическая. Преимущественно наблюдается гиперволемический тип, характеризующийся низкими уровнями сывороточного натрия с увеличением экстрацеллюлярного объема, наличием асцита и периферических отеков, а также, в части случаев, гидроторакса. Гиперволемическая гипонатриемия может развиваться спонтанно или вследствие инфузии избыточного количества гипотонической жидкости (то есть 5 % декстрозы), а также при развитии осложнений ЦП (особенно при бактериальных инфекциях). Гиповолемическая гипонатриемия наблюдается редко, характеризуется низкими уровнями сывороточного натрия, отсутствием асцита и отеков и обусловлена чрезмерной ДТ.
Сывороточные уровни натрия являются важным маркером прогноза при ЦП, а развитие гипонатриемии ассоциируется со снижением выживаемости.
Лечебная тактика при гипонатриемии
При определении лечебной тактики важно дифференцировать гиповолемическую гипонатриемию с гиперволемической. Если уровень натрия в сыворотке составляет 125 ммоль/л и ниже, то гипонатриемия рассматривается как тяжелая, требующая немедленного лечебного вмешательства.
При гиповолемической гипонатриемии показана отмена диуретиков и применение физиологического раствора.
Лечение гиперволемической гипонатриемии представляет довольно сложную задачу. Ограничение жидкости до 1000 мл в сутки способствует повышению сывороточной концентрации натрия у небольшого числа больных и позволяет предупредить дальнейшее снижение уровней сывороточного натрия. Не представлено убедительных доказательств благоприятного эффекта физиологического или гипертонического растворов. Данные о способности альбумина корригировать уровни сывороточного натрия при гиперволемической гипонатриемии не однозначны.
В последние годы в лечении гиперволемической гипонатриемии нашли применение ваптаны, препараты селективно блокирующие V2-рецепторы вазопрессина в главных клетках соединительных трубочек почек. Этот класс препаратов позволяет эффективно повышать концентрацию натрия сыворотки. В ряде исследований продемонстрировано, что под влиянием ваптанов, используемых в течение короткого периода времени (от одной недели до одного месяца), наблюдается увеличение диуреза за счет выведения «свободной» воды и повышение концентрации натрия сыворотки у 45–82 % больных. Толваптан для внутривенного применения лицензирован в нескольких странах. Лечение толваптаном должно начинаться в стационаре, его дозировки следует постепенно увеличивать под строгим контролем уровней сывороточного натрия. Следует избегать быстрого повышения уровней натрия сыворотки (> 8–10 ммоль/сут) с целью предупреждения развития демиелинизирующего синдрома (demyelization syndrom). Наиболее часто побочным эффектом ваптанов является жажда. Частота таких побочных эффектов ваптанов, как гипернатриемия, дегидратация и почечная недостаточность, низкая.
При лечении ваптанами не следует ограничивать жидкость, применять солевые растворы, чтобы избежать быстрого увеличения концентрации натрия в сыворотке.
Печеночная энцефалопатия
Печеночная энцефалопатия (ПЭ) характеризуется спектром нейропсихических нарушений, развивающихся у больных ЦП при тяжелых нарушениях функции печени. Тяжесть ПЭ варьирует от субклинических проявлений до тяжелой энцефалопатии.
Различают: 1) острый эпизод ПЭ, развивающийся с пусковыми идентифицируемыми факторами или без таковых (спонтанно); 2) возвратную ПЭ, когда в течение одного года наблюдаются два эпизода ПЭ; 3) персистирующую ПЭ, характеризующуюся перманентным нарушением когнитивных функций.
Минимальная («субклиническая») ПЭ — асимптоматическая фаза, диагностируемая с помощью психометрических тестов.
Лечебная тактика зависит от клинического варианта ПЭ и базируется на гипотезах, объясняющих ее патофизиологию. Превалирует точка зрения о ведущей роли в развитии ПЭ нарушения метаболизма аммония при ЦП. Повышенные уровни аммония выявляются у 60–80 % больных с ПЭ, их снижение за счет или уменьшения продукции, или увеличения выведения ведет к клиническому улучшению. Аккумуляция глютамина в астроцитах мозга, индуцируемая гипераммониемией, продуцирует осмотический стресс и ведет к дисфункции астроцитов. Гипонатриемия усугубляет дисфункцию астроцитов. В норме аммоний, продуцируемый энтероцитами тонкого кишечника, метаболизируется в печени. При ЦП нарушается метаболизм аммония. Согласно «гипотезе гамма-аминобутировой кислоты (ГАБК)», предполагается, что ГАБК, взаимодействуя с аммонием, ведет к развитию ПЭ.
Эпизод печеночной энцефалопатии. Лечебная тактика при первом эпизоде печеночной энцефалопатии
Главная цель лечения включает выявление и коррекцию пусковых факторов, а также снижение концентрации аммония в мозгу.
Рекомендуемое в прошлом ограничение потребления белка не получило подтверждения благоприятного влияния на клинические проявления ПЭ.
Лечебная тактика ПЭ требует прежде всего выявления и устранения (если это возможно) пусковых факторов, что ведет к улучшению клинической картины ПЭ или ее устранению.
Около 80 % случаев развития ПЭ ассоциируется с гастроинтестинальными кровотечениями, инфекцией (включая СБП, СБЭП), преренальной азотемией, гипокальциемическим алкалозом, гипонатриемией, запором, гипоксемией, применением седативных средств или транквилизаторов.
Терапией выбора при ПЭ является лактулоза, демонстрирующая эффективность и безопасность. Лактулоза является неабсорбируемым дисахаридом, способным снижать уровни аммония в крови. Отдается предпочтение пероральному применению лактулозы. Препарат назначают в дозе 10–30 мл 3 раза в сутки, что приводит к двукратному опорожнению толстого кишечника в сутки. Первоначальные дозировки лактулозы составляют 30 мл каждые 1–2 часа до начала опорожнения толстого кишечника, а в последующем доза препарата должна ассоциироваться с 2–3 опорожнениями толстого кишечника в сутки (обычно 15–30 мл два раза в сутки). При разрешении ПЭ лактулозу можно отменить.
Обычные побочные эффекты лактулозы включают: неприятный вкус, вздутие живота, абдоминальные колики и диарею. При развитии диареи необходима отмена лактулозы, так как диарея ассоциируется с высоким риском снижения эффективного объема крови и приводит к развитию или усугублению почечной дисфункции, а также гипернатриемии, наличие которой обусловливает высокую летальность.
Альтернативные лечебные подходы при печеночной энцефалопатии
Антибиотики снижают нагрузку аммонием за счет элиминации бактерий толстого кишечника. Сообщается о благоприятных эффектах неомицина, метронидазола, риваксилина (неабсорбируемого деривата рифампицина).
Возвратная или персистирующая печеночная энцефалопатия
Больные с персистирующей ПЭ требуют проведения перманентной терапии. Одной из ведущих причин развития перманентной ПЭ является ТВПШ. Окклюзия шунта или уменьшение его диаметра могут вести к разрешению ПЭ.
Лактулоза является терапией выбора при персистирующей ПЭ. Тактика применения лактулозы в целом подобна таковой при первом эпизоде ПЭ, что представлено выше. Однако применение лактулозы у таких больных должно осуществляться длительно.
Следует избегать назначения седативных препаратов и антидепрессантов, так как они могут усугублять ПЭ вплоть до развития комы.
Гепаторенальный синдром
Определение
Развитие почечной недостаточности у больных с ДЦП (при отсутствии каких-либо идентифицируемых причин, приводящих к поражению почек) обозначается ГРС.
Патофизиология гепаторенального синдрома
Патогенез ГРС представляется сложным и многогранным. К ведущим механизмам относятся:
— Развивающаяся при ЦП дилатация висцеральных сосудов, обусловливающая уменьшение эффективного артериального объема и снижение среднего АД.
— Активация СНС и РААС, вызывающая почечную вазоконстрикцию и нарушение почечной ауторегуляции, что делает почечный кровоток более чувствительным к изменениям среднего АД.
— Развитие цирротической кардиомиопатии, ведущей к неспособности сердца компенсировать сердечный выброс при развившейся вазодилатации.
— Повышенный синтез ряда вазоактивных медиаторов (цистениловые лейкотриены, тромбоксан А2), способных нарушать почечный кровоток и/или гломерулярную микроциркуляцию.
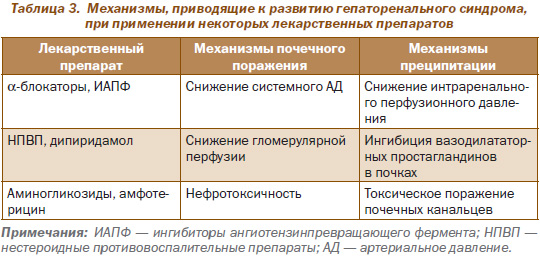
Ряд лекарственных препаратов могут способствовать развитию ГРС у больных с ЦП (табл. 3).
В 2007 г. рабочей группой по изучению асцита были предложены пересмотренные критерии диагностики ГРС.
Модифицированные критерии диагностики ГРС
— Наличие ЦП с асцитом.
— Уровни креатинина сыворотки выше 133 мкмоль/л.
— Отсутствие шока.
— Отсутствие гиповолемии, устанавливаемое на основании персистенции нарушения почечной функции (уровни креатинина сыворотки выше 133 мкмоль/л) в течение двух суток после отмены диуретиков у лиц, находящихся на диуретической терапии, или введение альбумина 1 г/кг МТ (максимально до 100 г/сут) с целью увеличения объема циркулирующей плазмы.
— Отсутствие приема в данный момент или недавно нефротоксических препаратов.
— Отсутствие паренхиматозного поражения почек, устанавливаемого при протеинурии менее 0,5 г/сут, отсутствии гематурии и нормальных параметрах почечной ультрасонографии.
Клиническая картина
Выделяют 2 типа ГРС.
І тип характеризуется быстро прогрессирующим ОПН (острой почечной недостаточностью), обычно развивающимся под влиянием пусковых факторов, ведущих к ухудшению почечной функции, а также с одновременным нарушением или ухудшением функции других органов. Этот тип обычно наблюдается при тяжелых алкогольных гепатозах или у больных с терминальной стадией ЦП после различных интеркуррентных инфекций (например, СБП). В части случаев видимые пусковые факторы отсутствуют. Обычно І тип ГРС устанавливается при повышении сывороточных уровней креатинина на 100 % и более и превышает 221 мкмоль/л.
ІІ тип ГРС развивается у больных с рефрактерным асцитом и при этом имеет место устойчивое умеренное нарушение почечной функции, часто характеризующееся существенной задержкой натрия. У больных со ІІ типом спонтанно или под влиянием различных пусковых факторов (например, СБП) может развиваться І тип ГРС.
Представляется важным своевременная диагностика ГРС, а также выявление, если это возможно, причин, обусловивших развитие почечной недостаточности, которые могут включать: гиповолемию, шок, паренхиматозные заболевания почек (гломерулонефриты, пиелонефриты, амилоидоз и др.), а также применение различных нефротоксических лекарственных препаратов (табл. 3).
Лечебная тактика
Общие подходы
Больные с І типом ГРС для предотвращения перегрузки объемами нуждаются в строгом мониторировании ряда параметров, включающих диурез, объемы циркулирующей крови и плазмы, АД, центральное венозное давление.
Важна своевременная диагностика сепсиса (посев крови, асцитической жидкости, мочи) и при положительных результатах — проведение адекватной антибактериальной терапии. При отрицательных результатах показано (с профилактической целью) продолжение приема антибиотиков.
Отсутствуют доказательства о необходимости использования b-АБ, назначенных больным с ГРС с целью профилактики кровотечений из варикозных вен.
Больным с напряженным асцитом показано проведение парацентеза с удалением большого количества асцитической жидкости и обязательным заместительным введением альбумина.
Диагноз ГРС предполагает отмену калийсберегающих диуретиков. Отсутствуют доказательства благоприятного влияния на прогноз петлевых диуретиков. Однако в ряде случаев возможно применение фуросемида или торасемида с целью увеличения диуреза и предотвращения развития гиперволемии.
Специфические лечебные подходы. Лекарст-венная терапия
Использование вазоконстрикторных препаратов сегодня рассматривается как наиболее эффективный метод лечения ГРС. Среди применяемых вазоконстрикторов наиболее хорошо изучены аналоги вазопрессина (в частности терлипрессин). Целью применения аналогов вазопрессина при ГРС является улучшение тяжелого нарушения циркуляторной функции за счет вазоконстрикции значительно дилатированных висцеральных сосудистых лож и повышение АД. В большом количестве рандомизированных и нерандомизированных исследований продемонстрировано улучшение почечной функции под влиянием терлипрессина приблизительно у 40–50 % больных с ГРС І типа. Начальная дозировка терлипрессина обычно составляет 1 мг 4–6 раз в сутки, повышается до 2 мг 4–6 раз в сутки. Лечение прекращают, если на третий день не наблюдается снижения фоновых уровней креатинина сыворотки на 25 %. При наличии такого снижения лечение терлипрессином продолжается до достижения значений креатинина сыворотки менее 133 мкмоль/л (около 88–106 мкмоль/л). При этом наблюдается повышение АД, диуреза и концентрации натрия в сыворотке. Среднее время применения терлипрессина до достижения оптимального лечебного эффекта составляет около 14 дней. Рецидивы ГРС после восстановления почечной функции нетипичны. Приблизительно у 12 % больных ГРС при применении терлипрессина наблюдаются кардиоваскулярные осложнения.
Лечение терлипрессином и другими вазоконстрикторами, по данным крупного метаанализа, ассоциируется с кратковременным увеличением выживаемости больных ГРС. Однако в большинство из анализируемых исследований не включались больные с сепсисом.
Применение терлипрессина у больных с ГРС ІІ типа также ассоциируется с улучшением почечной функции. Однако этот эффект препарата продемонстрирован в ограниченном числе исследований.
В большинстве исследований терлипрессин применялся в комбинации с альбумином (1 г/кг в первый день, а в последующем по 40 г/сут).
Среди других вазоконстрикторов (не аналогов вазопрессина) при ГРС І типа применяются норадреналин и мидодрин с октреотидом в комбинации с альбумином.
Норадреналин: постоянная инфузия в/в (0,5–3,0 мг/час). Дозировка препарата увеличивается до достижения лечебной цели (стабилизация АД, улучшение почечной функции).
В нескольких исследованиях изучены различные лечебные подходы, предупреждающие развитие ГРС у больных с ЦП. С этой целью применяется пентоксифиллин (400 мг 3 р/сут в течение 4 недель). Использование пентоксифиллина сопровождалось улучшением почечной функции. При этом не отмечено увеличения выживаемости. В двойном слепом контролируемом исследовании продемонстрирована способность норфлоксацина (400 мг/сут) снижать частоту развития ГРС у больных с далеко зашедшими стадиями ЦП с асцитом.
Показано, что ТВПШ у части больных способно улучшать почечную функцию у больных ГРС I и II типов. Однако применение ТВПШ ограничено из-за многочисленных противопоказаний.
Трансплантация печени
Трансплантация печени является терапией выбора у больных ГРС I и II типов. Ее проведение позволяет повышать выживаемость больных ГРС I типа на 65 %. Одновременная трансплантация печени и почек не показала преимуществ по сравнению с отдельной трансплантацией печени.
Данные об эффективности терапии, замещающей почки (гемодиализ, трансплантация почки) у больных ГРС I и II типов ограничены. Трансплантация почки показана больным с ГРС при отсутствии положительного эффекта от вазоконстрикторной терапии и наличии общепринятых показаний для трансплантации.
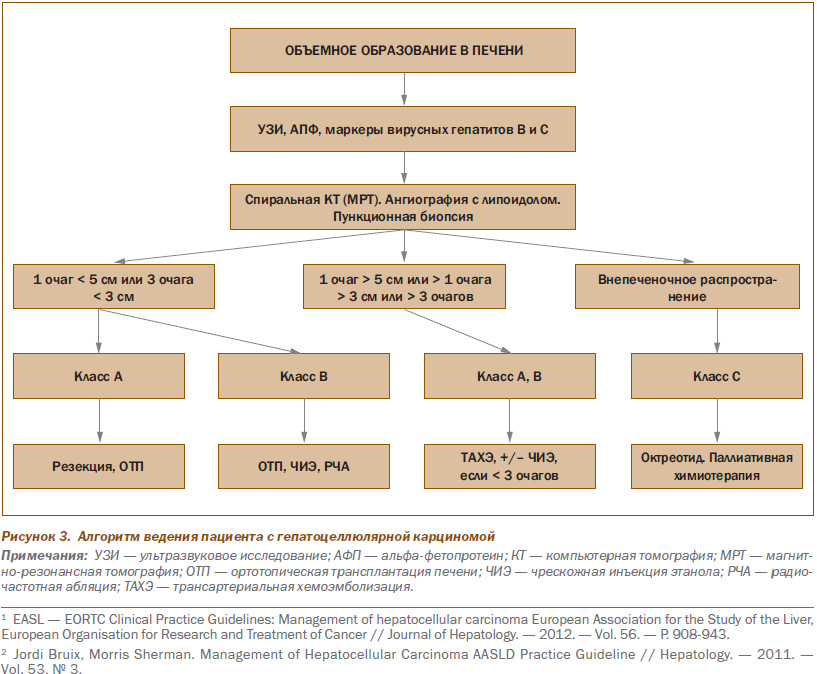
Гепатоцеллюлярная карцинома
У 2–5 % пациентов цирроз печени трансформируется в гепатоцеллюлярную карциному (ГЦК) (рис. 3). Смертность от ГЦК достигает 3 % в год1.
Рутинный скрининг на ГЦК включает:
1. УЗИ печени 1 раз в 6–12 месяцев.
2. a-фетопротеин — 1 раз в год. Диагностическое значение имеет 50-кратное превышение верхней границы нормы. Уровень пропорционален размеру опухоли. У 40 % больных с ГЦК малого размера показатель в пределах нормы.
Резекция опухоли как терапия первой линии может быть рекомендована пациентам с одиночной опухолью и сохранным венозным градиентом давления ≤ 10 мм рт.ст. или количеством тромбоцитов ≥ 100 000.
Дополнительные указания: пациенты с мультифокальной опухолью (≤ 3 см; узелки ≤ 3 см) или с незначительной портальной гипертензией должны рассматриваться как кандидаты на трансплантацию печени.
Радиочастотная абляция показала, что полное удаление опухоли диаметром менее 2 см возможно более чем в 90 % случаев, а рецидивы составляют менее 1 %2.
Периоперационная смертность пациентов составляет 2–3 %. В случае рецидивов пациента повторно оценивают как кандидата на трансплантацию печени.
Первичный билиарный цирроз
Определение
Отдельного обсуждения требует первичный билиарный цирроз (ПБЦ) печени, определяемый как хроническое холестатическое медленно прогрессирующее деструктивно-воспалительное заболевание печени, характеризующееся иммунообусловленным негнойным поражением эпителия междольковых и септальных желчных протоков, ведущим к развитию и прогрессированию дуктопении и холестаза с развитием ЦП и печеночной недостаточности.
Распространенность
ПБЦ болеют преимущественно женщины в возрасте старше 35 лет в Северной Европе (соотношение женщин к мужчинам — 10 : 1). Среди всех ЦП ПБЦ составляет 6–12 %.
По данным ряда эпидемиологических исследований, в последние 2–3 десятилетия имеет место увеличение распространенности ПБЦ: в 80-х годах XX века частота ПБЦ составляла 202 случая на 1 млн взрослого населения и 541 на 1 млн женщин старше 40 лет; в 90-х годах XX века частота ПБЦ составила 335 случаев на 1 млн взрослого населения и 940 случаев на 1 млн женщин старше 40 лет.
Летальность больных ПБЦ превышает в три раза таковую в общей популяции.
Этиология и патогенез
Этиология ПБЦ остается неизвестной. Обсуждается возможная роль различных факторов в развитии ПБЦ, включающих инфекции (бактериальные и вирусные), лекарственные средства (в частности, хлорпромазин, являющийся триггером аутоиммунного повреждения междольковых и септальных желчных ходов), ксенобиотики (химические вещества окружающей среды, пищевые приправы и косметика), гормональные факторы (учитывая существенное преобладание при ПБЦ лиц женского пола).
Ряд факторов свидетельствует о важной роли генетической предрасположенности в развитии ПБЦ. Описаны случаи семейного ПБЦ. Риск развития ПБЦ среди родственников первой линии родства в 10,5 раза превышает таковой в общей популяции подобно тому, что наблюдается при системной красной волчанке и ряде других ревматических заболеваний.
Приблизительно у 95 % больных с ПБЦ выявляются антитела к митохондриям с доминантным аутотельным ответом, направленным против двух компонентов (дигидролипоилацетилтрансферазы (Е2) и дигидролипоилгидрогеназы (Е3)) пируватдегидрогеназного комплекса. Утрата толерантности к этим аутоантигенам имеет место на ранних этапах ПБЦ, когда определяются антимитохондриальные антитела (АМА) в сыворотке еще до развития нарушений печеночной функции и симптомов заболевания. Предполагается, что образование АМА обусловлено экспозицией генетически предрасположенных лиц к неблагоприятным факторам окружающей среды.
Аберрантная экспрессия пируватдегидрогеназного комплекса выявляется на апикальной поверхности билиарных и слюнных эпителиальных клеток у больных ПБЦ, у них же в желчи и слюне обнаруживаются секреторные IgA-аутоантитела. IgA-аутоантитела к пируватдегидрогеназному комплексу могут взаимодействовать с его компонентами в эпителиальных клетках, приводя к нарушению метаболических процессов и повреждению этих клеток. CD8+-цитотоксические Т-клетки инфильтрируют портальный тракт, обусловливая хроническое портальное воспаление, присущее ПБЦ.
Ведущим механизмом гибели клеток желчного эпителия является усиленный апоптоз, инициируемый Th1-лимфоцитами.
Поражение эпителия междольковых и септальных желчных протоков обусловливает развитие холестаза, ведущего к билиарному цитолизу гепатоцитов вследствие токсических эффектов желчных кислот, накапливающихся в повышенных концентрациях в печеночных клетках из-за механической блокады оттока желчи. Это приводит к прогрессирующей деструкции мелких внепеченочных желчных протоков и, в конечном итоге, к развитию ПБЦ.
Морфологическая картина
Выделяют 4 морфологические стадии ПБЦ, отражающие динамику гистологических изменений от воспаления желчных протоков до цирроза. Важно отметить наличие неоднородной гистологической картины в различных отделах печени.
В I стадии (портальной) наблюдаются выраженные воспалительные изменения в междольковых и септальных желчных протоках с преимущественным вовлечением эпителиальных клеток. При этом выявляются инфильтраты, содержащие лимфоциты, плазматические клетки, нейтрофилы и редко эозинофилы.
II стадия (перипортальная) характеризуется деструкцией желчных протоков с их заменой лимфоидными агрегатами и развитием фиброза.
В III стадии (септальной) наблюдается существенное уменьшение воспалительных проявлений (хотя могут быть представлены лимфоидные агрегаты) и развитие септального фиброза, распространяющегося из портального тракта.
IV стадия (цирротическая) — выявляется картина микронодулярного цирроза с нарушением печеночной архитектоники и формированием регенеративных узлов на фоне выраженных фибротических изменений и признаков периферического и центрального холестаза.
Клиническая картина
Начало, течение и прогноз ПБЦ характеризуются широким разнообразием, в связи с чем вполне обосновано выделение нескольких клинических форм заболевания.
Типичная, или классическая, форма ПБЦ, составляющая около 70–80 % случаев, характеризуется медленным прогрессирующим уменьшением междольковых и септальных желчных протоков и параллельным развитием и прогрессированием печеночного фиброза, ведущего к формированию ЦП в течение 10–20 лет.
Классическая форма заболевания проходит несколько фаз, включая преклиническую, асимптоматическую, симптоматическую и печеночную недостаточность (табл. 4).
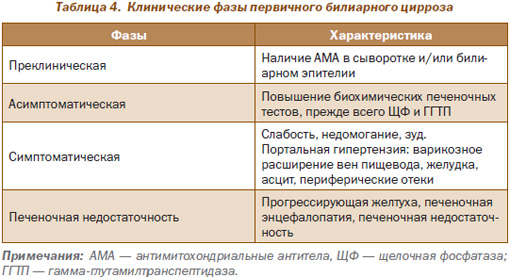
Первая фаза (преклиническая) характеризуется наличием АМА при отсутствии симптомов заболевания и нормальными биохимическими печеночными тестами.
Вторая фаза (асимптоматическая) — отсутствуют симптомы заболевания, но имеет место повышение щелочной фосфатазы (ЩФ) и гамма-глютамилтранспептидазы (ГГТП). Печеночные аминотрансферазы могут быть нормальными или незначительно повышенными. Среднее время от преклинической фазы до асимптоматической составляет 5–6 лет (с колебаниями от 1 года до 20 лет).
Следующая третья фаза (симптоматическая) характеризуется развитием симптомов (слабость, утомляемость, зуд и позже асцит, отеки, варикоз).
Четвертая фаза — печеночная недостаточность проявляется прогрессирующей желтухой, энцефалопатией.
Вторая форма ПБЦ, частота которой составляет 10–20 %, характеризуется клиническими проявлениями рецидивирующего или персистирующего аутоиммунного гепатита (АИГ). При этой форме более неблагоприятный прогноз, чем при первой (классической) форме. Она характеризуется ранним развитием фиброза печени и печеночной недостаточности.
Комбинация ПБЦ и АИГ, так называемый синдром перехлеста (overlap syndrome), характеризуется одновременными или последовательными проявлениями обоих заболеваний, что затрудняет диагностику второй формы ПБЦ. Для уточнения диагноза рассматриваемой формы ПБЦ предложены следующие три критерия:
1. Активность АЛТ в 5 раз превышает нормальные значения.
2. Значения IgG в два и более раза превышают нормальные уровни и/или выявляются антитела к гладкой мускулатуре.
3. В биоптатах печени наблюдается умеренное или тяжелое перипортальное или перисептальное воспаление.
Диагноз ПБЦ считается правомерным при наличии двух из трех вышеприведенных критериев.
Третья форма ПБЦ, выявляемая в 5–10 % случаев, представлена так называемым ранним дуктопеническим вариантом. Ведущее ее проявление — раннее начало дуктопении и тяжелого холестаза, прогрессирующего очень быстро к развитию фиброза за 5 лет.
В настоящее время ПБЦ диагностируется на более ранних стадиях заболевания, чем в прошлом. При постановке диагноза примерно у 50 % больных отсутствуют клинические проявления. Чаще (более чем в 50 % случаев) ранним признаком ПБЦ является слабость и зуд. Слабость — одна из ведущих жалоб ПБЦ. Она не ассоциируется с тяжестью заболевания, гистологической стадией, его продолжительностью и существенно ухудшает качество жизни. Слабость часто сопровождается когнитивной и эмоциональной дисфункцией, депрессией, сенсорными и автономными нарушениями периферической нервной системы, а также сонливостью в течение дня. Зуд наблюдается у 20–70 % больных и существенно ухудшает качество жизни. Появление зуда обычно предшествует за месяцы/годы началу желтухи. Зуд может носить локальный или диффузный характер, обычно усиливается ночью (особенно после контакта с шерстью, другими тканями или при повышении окружающей температуры). Причина зуда остается недостаточно изученной. В его развитии отводится роль эндогенным опиоидам.
Примерно у 10 % больных ПБЦ наблюдается дискомфорт в верхнем квадранте живота справа. Другие проявления ПБЦ включают гипотиреоидизм, остеопению, гипер- и дислипидемию.
При второй форме ПБЦ имеют место клинические и лабораторные проявления аутоиммунного гепатита (лихорадка, артралгии, миалгии, высокие уровни трансаминаз).
В фазе печеночной недостаточности выявляются повышенные уровни билирубина, тромбоцитопения, гиперглобулинемия, существенное повышение значений IgG и IgM. На поздних стадиях ПБЦ наблюдаются низкие значения протромбина и гипоальбуминемия.
Портальная гипертензия, мальабсорбция, дефицит жирорастворимых витаминов, стеаторея развиваются на далеко зашедших этапах ПБЦ. Асцит и печеночная энцефалопатия при ПБЦ развиваются редко.
Диагностика ПБЦ
Развитие холестаза и исключение причин, обусловивших билиарную обструкцию (желчно-каменная болезнь) предполагает наличие ПБЦ, диагноз которого основывается на следующих трех критериях:
1. Биохимические тесты: повышение активности ЩФ и ГГТП.
2. АМА.
3. Гистологические доказательства негнойного холангита и деструкции интерлобулярных желчных протоков, то есть невоспалительный деструктивный холангит (НВДХ).
Наличие двух из этих критериев достаточно для диагностики ПБЦ после исключения билиарной обструкции, для чего больному показано обязательное ультразвуковое исследование печени и желчевыводящих путей. При необходимости показано проведение холангиографии.
Основной признак ПБЦ — наличие в сыворотке АМА, выявляемых у 95 % больных.
Прижизненное гистологическое исследование печени (ПГИП) показано в случаях, когда отсутствуют АМА или биохимические тесты не характерны для ПБЦ. Следует отметить, что ПГИП позволяет реально оценить прогноз заболевания и помогает в выборе адекватной лечебной тактики.
Диагностика ПБЦ учитывает наличие таких факторов риска, как рецидивирующая или персистирующая инфекция мочевой системы, табакокурение, наличие у кровных родственников установленного ПБЦ или других аутоиммунных заболеваний.
Лечение первичного билиарного цирроза
Лечение ПБЦ остается сложной и трудноразрешимой задачей. В настоящее время краеугольным камнем в его лечении рассматривается урсодезоксихолевая кислота (УДХК) — 13–15 мг/кг МТ, применение которой при данном заболевании разрешено Департаментом пищевых продуктов и лекарственных препаратов США (FDA). В многочисленных контролируемых рандомизированных исследованиях продемонстрирован ряд благоприятных эффектов УДХК, включающих замедление развития и профилактики фиброза и цирротических процессов, замедление развития и прогрессирования клинических и лабораторных проявлений ПБЦ. В частности, показано улучшение биохимических печеночных параметров, включая сывороточный билирубин, являющийся ведущим прогностическим маркером при ПБЦ. В метаанализе трех КРИ, включавших 548 больных с ПБЦ, показано увеличение выживаемости (без трансплантации печени), улучшение биохимических показателей, замедление риска прогрессирования у лиц с умеренной или тяжелой клинической картиной ПБЦ, получавших УДХК в течение 4 лет.
Результаты исследований и метаанализов послужили основанием рекомендовать применение УДХК в дозе 13 мг/кг/сут (или однократно, или в два приема). Целью лечения ПБЦ является обеспечение нормализации сывороточных уровней билирубина, ЩФ, гамма-глутамилтрансферазы, аспартатаминотрансферазы, аланинаминотрансферазы в течение первого года применения УДХК. У больных при нормализации уровней этих маркеров существенно улучшается прогноз и выживаемость. В случаях, когда такая дозировка не приводит к желаемому биохимическому ответу, приемлемо увеличение дозы препарата до 20 мг/кг/сут.
Благоприятный эффект УДХК обусловлен целым рядом его фармакологических свойств, включающих противовоспалительное, цитопротекторное, антихолестатическое, холеретическое и антиапоптозное действие.
Применение УДХК характеризуется хорошей переносимостью и отсутствием серьезных побочных эффектов. Прием препарата может сопровождаться увеличением массы тела примерно на 2 кг, усилением зуда. Следует начинать лечение с 200–400 мг/сут с постепенным (в течение 4–8 недель) повышением дозы до оптимальных уровней. При развитии дискомфорта в эпигастральной области, изжоги и пищеводного рефлюкса показано назначение ингибиторов протонной помпы.
При лечении УДХК примерно у 40 % больных с ПБЦ имеет место субоптимальный лечебный ответ, в связи с чем в таких случаях требуется дополнительная (адъювантная) терапия, которая включает глюкокортикостероиды (преднизолон, будесонид) и цитостатики. Продемонстрировано, что совместное применение глюкокортикостероидов с УДХК ведет к более существенному биохимическому и гистологическому эффекту. С целью снижения дозировок глюкокортикостероидов используется их комбинация с метотрексатом, азатиоприном или микофенолатом мофетилом.
Благоприятный эффект метотрексата, используемого самостоятельно или в комбинации с УДХК, достигается у небольшого числа больных ПБЦ.
В связи с недостаточным эффектом у части больных ПБЦ могут быть назначены циклоспорин, хлорамбуцил, пеницилламин, колхицин, талидомид, которые не продемонстрировали благоприятного влияния на течение заболевания. В последние годы выясняются лечебные возможности биологически активных агентов.
Лечение симптомов и осложнений
Зуд
В качестве препарата первой линии широко используется холестирамин, хотя эффективность его сомнительна. При одновременном назначении холестирамина и УДХК следует выдерживать 4-часовой промежуток. Имеется доказательная база о благоприятном эффекте рифампицина, применяемого по 600 мг/сут в комбинации с УДХК. Однако рифампицин оказывает нефротоксическое и гепатотоксическое действие. Другие лечебные подходы включают глюкокортикоиды, сертралин и антагонисты опиоидных рецепторов. Их эффективность оценивается неодно-значно различными авторами.
Слабость
Развитие слабости при ПБЦ определяется многими факторами, и механизмы ее развития требуют дальнейшего изучения. Сообщается о способности модафинила уменьшать общую слабость и дневную сонливость.
Гиперхолестеринемия
Показана способность УДХК снижать на 15–20 % уровни общего холестерина и холестерина липопротеидов низкой плотности. Для контроля гипер- и дислипидемии показано применение статинов, позволяющее снизить риск кардиоваскулярных осложнений.
Портальная гипертензия
Лечебная тактика у больных ПБЦ при развитии портальной гипертензии аналогична таковой при других циррозах печени. Развитие ПГ при ПБЦ является показанием для трансплантации печени, которая предпочтительна ТВПШ.
Остеопения и остеопороз
Приблизительно у 30 % больных ПБЦ развивается остеопения и остеопороз. С целью профилактики развития остеопении и остеопороза и снижения их прогрессирования рекомендуется физическая активность, препараты кальция, витамин D, а также эстрогены.
Трансплантация печени
Трансплантация печени существенно увеличивает продолжительность жизни больных ПБЦ и является единственным лечебным подходом при декомпенсации цирроза или при развитии печеночной недостаточности.
Прогноз
Как мы отмечали выше, прогноз ПБЦ характеризуется широким разнообразием и зависит от целого ряда факторов, включающих форму и гистологическую стадию заболевания, комбинацию ПБЦ с АИГ, своевременность диагностики и начала адекватной терапии. Неблагоприятным являются вторая и особенно третья формы заболевания. При первой (классической, или типичной) форме прогноз определяется фазой и своевременным проведением терапии.
Важным прогностическим фактором ПБЦ являются уровни билирубина в крови:
— при уровнях билирубина крови 34,4–102,6 мкмоль/л средняя ожидаемая продолжительность жизни ≈ 4 года;
— при уровнях билирубина крови 102,6–170,0 мкмоль/л средняя ожидаемая продолжительность жизни ≈ 2 года;
— при уровнях билирубина крови выше 170,0 мкмоль/л средняя ожидаемая продолжительность жизни ≈ 1,5 года.