Журнал «» 2 (28) 2013
Вернуться к номеру
Взаимозаменяемость препаратов кандесартана с точки зрения исследования биоэквивалентности
Авторы: Зупанец И.А., Безуглая Н.П. - Национальный фармацевтический университет, г. Харьков, Сабко В.Е. - Биоаналитическая лаборатория ООО «Клинфарм», г. Ирпень, Хиль И.М. - Корпорация «Артериум», г. Киев
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
В статье представлено исследование биоэквивалентности двух лекарственных препаратов кандесартана. Показано, что оба исследуемых препарата хорошо переносятся, являются биоэквивалентными и потому взаимозаменяемы.
У статті наведене дослідження біоеквівалентності двох лікарських засобів кандесартану. Показано, що обидва досліджувані препарати добре переносяться, є біоеквівалентними й тому взаємозамінні.
This paper describes study on bioequivalence of two preparations of candesartan. It is shown that both drugs are well tolerated, bioequivalent and therefore interchangeable.
блокаторы рецепторов ангиотензина, кандесартан, биоэквивалентность, Касарк.
блокатори рецепторів ангіотензину, кандесартан, біоеквівалентність, Касарк.
angiotensin receptor blockers, candesartan, bioequivalence, Kasark.
Сердечно-сосудистые заболевания являются основной причиной заболеваемости и инвалидизации населения во всех развитых странах мира, в том числе и в Украине. Артериальная гипертензия (АГ) — основной фактор риска ишемической болезни сердца и цереброваскулярных заболеваний, которые на 88,1 % определяют уровень смертности от болезней системы кровообращения. Среди лиц с артериальной гипертензией смертность почти в 2 раза выше, чем среди лиц с нормальным артериальным давлением (АД). Несмотря на высокие показатели заболеваемости и смертности, связанные с АГ, контроль этой патологии далек от оптимального [2].
Эпидемиологические исследования, проведенные украинскими учеными, показали, что повышенное АД (> 140/90 мм рт.ст.) имеет почти 40 % взрослого населения. Среди них о наличии заболевания знают около 47 % сельских и 85,1 % городских жителей, из которых лечатся 12,4 и 61,2 %, а эффективное лечение артериальной гипертензии получают только 6,2 и 20,5 % пациентов соответственно [2].
Основная проблема АГ, к сожалению, не решена до сих пор — часть больных не знают о своей проблеме; те, которые знают, не лечатся; те, которые лечатся, лечатся неправильно, то есть целью терапии на сегодняшний день для большинства больных является просто снижение АД, улучшение самочувствия, а не достижение целевых значений АД.
К одной из основных групп антигипертензивных средств относятся БРА, они обладают гипотензивным, антипролиферативным и натрийуретическим эффектами, имеют лучшую переносимость в сравнении с ИАПФ и являются препаратами первого ряда для пациентов с АГ и диабетической нефропатией и/или сердечной недостаточностью [17].
К группе блокаторов рецепторов ангиотензина относится препарат Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум, Украина), действующим веществом которого является кандесартана цилексетил. Кандесартана цилексетил — это пролекарство, пригодное для перорального применения; во время абсорбции из желудочно-кишечного тракта кандесартана цилексетил быстро превращается в активное вещество — кандесартан и плотно связывается с ангиотензиновыми рецепторами типа 1. При АГ кандесартан приводит к дозозависимому длительному снижению АД. Антигипертензивная активность кандесартана обусловлена снижением системного периферического сопротивления, которое не сопровождается рефлекторным повышением ЧСС. После приема разовой дозы кандесартана цилексетила начало антигипертензивного эффекта наступает в течение 2 ч. При постоянной терапии кандесартаном при введении любой дозы препарата максимальное снижение АД достигается на протяжении 4 нед. и поддерживается при длительном лечении. Согласно данным метаанализа средний дополнительный эффект повышения дозы с 16 до 32 мг 1 раз в сутки был незначительным. При применении кандесартана цилексетила 1 раз в сутки обеспечивается эффективное и равномерное снижение АД в течение 24 ч с незначительным различием между эффектами максимальной и минимальной дозы.
Лекарственное средство Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум», Украина), которое является объектом исследования, представляет собой генерический аналог инновационного лекарственного средства Атаканд, таблетки по 32 мг (производства AstraZeneca, Швеция). В соответствии с приказом Министерства здравоохранения Украины № 190 «Порядок направления на дополнительные испытания лекарственных средств при проведении экспертизы регистрационных материалов» (от 17.04.2007) [5] и документом 42-7.1:2005 «Руководство по клиническим исследованиям. Лекарственные средства. Исследование биодоступности и биоэквивалентности», утвержденным приказом Министерства здравоохранения, а также соответствующими международными регламентирующими документами Европейского сообщества и Всемирной организации здравоохранения, доказательство эквивалентности in vivo генерического и инновационного лекарственных средств в твердых лекарственных формах для перорального применения должно проводиться в первую очередь путем клинических исследований по оценке их биоэквивалентности с участием здоровых добровольцев.
Материалы и методы
Клиническая часть исследования по оценке биоэквивалентности лекарственных средств Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум», Украина), и Атаканд, таблетки по 32 мг (производства AstraZeneca, Швеция), с участием здоровых добровольцев была проведена в Клинико-диагностическом центре Национального фармацевтического университета, г. Харьков.
Биоаналитическая часть исследования и статистическая обработка результатов были проведены в БАЛ ООО «Клинфарм», г. Ирпень.
Данное исследование по оценке биоэквивалентности было выполнено в соответствии с Законом Украины «О лекарственных средствах», по утвержденному Протоколу клинического исследования с соблюдением принципов надлежащей клинической (GCP) и надлежащей лабораторной (GLP) практик в соответствии с Руководствами СТ-Н МОЗУ 42-7.0: 2008 «Лікарські засоби. Належна клінічна практика» [10], СТ-Н МОЗУ 42-6.0: 2008 «Лікарські засоби. Належна лабораторна практика» [9], 42–7.1: 2005 «Лікарські засоби. Дослідження біодоступності та біоеквівалентності» [4], руководящими документами Европейского сообщества, Всемирной организации здравоохранения (WHO) и другими [1, 3, 6, 11–16].
Цели исследования: 1) основная цель: оценка биоэквивалентности двух лекарственных препаратов кандесартана — тестового препарата Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум», Украина), и референтного препарата Атаканд, таблетки по 32 мг (производства AstraZeneca, Швеция), путем сравнительного изучения их биодоступности при введении однократной дозы здоровым добровольцам; 2) дополнительная цель: изучение переносимости тестового и референтного лекарственных средств при однократном приеме.
Дизайн: сравнительное рандомизированное перекрестное с двумя периодами и двумя последовательностями исследование по изучению биоэквивалентности при введении добровольцам натощак однократной дозы каждого из сравниваемых лекарственных средств с «ослеплением» аналитического этапа исследования и дальнейшей статистической обработкой результатов.
Для оценки переносимости исследуемых препаратов был проведен анализ побочных реакций, результатов лабораторно-инструментального обследования (витальные данные; ЭКГ-обследование; клинический, биохимический анализ крови, общий анализ мочи), результатов физикального осмотра.
Биоаналитический этап исследования проводился путем определения количественной концентрации кандесартана в пробах плазмы крови, полученных от добровольцев на клинической базе, основывался на использовании метода ультраэффективной жидкостной хроматографии с тандемным масс-селективным детектированием и проводился в биоаналитической лаборатории ООО «Клинфарм» (г. Ирпень). Статистический анализ фармакокинетических (ФК) данных включал: 1) построение профилей зависимости концентрации действующего вещества от времени для каждого добровольца и препарата в исходных и логарифмически преобразованных единицах; 2) вычисление вторичных ФК-параметров (площадей под кривой, константы элиминации, периода полувыведения); 3) оценку показателей описательной статистики для оцениваемых ФК-параметров (среднее арифметическое, медиана, стандартное отклонение, коэффициент вариации); 4) дисперсионный анализ ФК-параметров, основанный на смешанной модели; 5) оценку различий между двумя лекарственными средствами и построение для нее 90% доверительных интервалов.
В качестве программного инструментального средства использована лицензионная программа WinNonlin Professional 5.3 компании Pharsight Corporation. Оценка ФК-параметров проведена с использованием модели расчетов «NCA Model 200» WinNonlin Professional 5.3.
Результаты и их обсуждение
24 здоровых добровольца мужского и женского пола приняли участие в клиническом исследовании по оценке биоэквивалентности лекарственных средств Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум», Украина), и Атаканд, таблетки по 32 мг (производства AstraZeneca, Швеция). 24 добровольца полностью завершили участие в исследовании; все полученные результаты включены в оценку переносимости и в оценку фармакокинетических параметров.
Для определения концентрации исследуемых препаратов (тестового и референтного) в плазме крови здоровых добровольцев после однократного приема каждого из препаратов было отобрано 15 проб крови (в каждый период исследования). Отбор проб крови проводили в соответствии со следующим графиком: 0 ч (до приема препарата), через 0,5; 1; 1,5; 2; 2,5; 3; 4; 6; 9; 12; 24; 36; 48 и 72 часа после приема препарата. Прием препарата проводился натощак утром в 08.00 после предшествовавшего ночного 12-часового голодания.
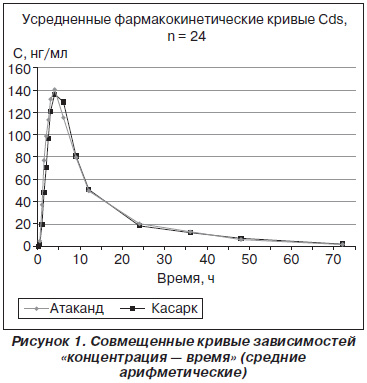
На рис. 1 представлены совмещенные кривые зависимостей «концентрация — время» для исследуемых препаратов в плазме добровольцев после однократного перорального приема препаратов Касарк и Атаканд (средние арифметические).
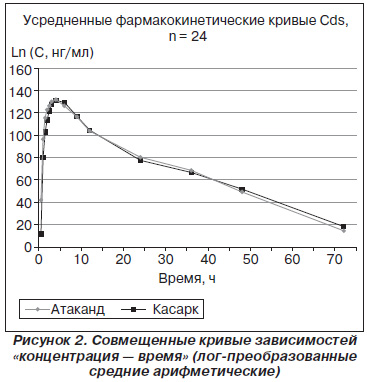
На рис. 2 представлены совмещенные кривые зависимостей «концентрация — время» для исследуемых препаратов в плазме добровольцев после однократного перорального приема препаратов Касарк и Атаканд (логарифмически преобразованные средние арифметические).
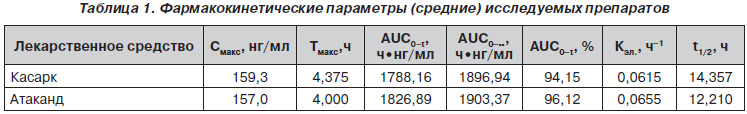
После проведения статистической обработки полученных результатов были рассчитаны фармакокинетические параметры (средние) для препаратов Касарк и Атаканд (табл. 1).
Границы 90% доверительных интервалов для отношения геометрических средних основных фармакокинетических параметров Смакс и AUC0–t были определены и составляют 80,79–111,17 % и 87,45–104,48 % соответственно. Полученные результаты соответствуют критерию биоэквивалентности в 80–125 % для AUC0–t и Смакс.
Основываясь на результатах анализа Смакс и AUC0–t, можно сделать вывод, что лекарственное средство Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум», Украина), биоэквивалентно лекарственному средству Атаканд, таблетки по 32 мг (производства AstraZeneca, Швеция), при введении перорально натощак однократной дозы здоровым добровольцам.
Анализ результатов обследования 24 здоровых добровольцев в ходе проведения данного исследования свидетельствует о сравнимой переносимости однократного применения лекарственного средства Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум», Украина), и однократного применения референтного лекарственного средства Атаканд, таблетки по 32 мг (производства AstraZeneca, Швеция). Переносимость обоих лекарственных средств оценена как «хорошая».
Выводы
1. Основываясь на результатах анализа Смакс и AUC0–t, можно сделать вывод, что лекарственное средство Касарк, таблетки по 32 мг (производства ОАО «Киевмедпрепарат», Корпорация «Артериум», Украина), биоэквивалентно лекарственному средству Атаканд, таблетки по 32 мг (производства AstraZeneca, Швеция), при введении перорально натощак однократной дозы здоровым добровольцам.
2. При приеме однократной дозы переносимость обоих лекарственных средств сравнима и оценена как «хорошая».
3. С точки зрения доказательной медицины и фармации лекарственные средства Касарк и Атаканд являются взаимозаменяемыми.
1. Бабич П.Н., Чубенко А.В. Современные статистические подходы, используемые при доказательстве биоэквивалентности // Вісник фармакології та фармації. — 2004. — № 10. — С. 35-40; № 11. — С. 14-29.
2. Коваленко В.М. Сучасний стан здоров’я народу та напрямки його покращання в Україні: аналітично-статистичний посібник / В.М. Коваленко, В.М. Корнацький, Т.С. Манойленко, О.І. Прокопишин. — К., 2005. — 141 с.
3. Лапач С.Н., Чубенко А.В., Бабич П.Н. Основные принципы применения статистических методов в клинических испытаниях. — К.: Морион, 2002. — 160 с.
4. Настанова 42-7.1:2005 «Лікарські засоби. Дослідження біодоступності та біоеквівалентності». — Київ, 2005. — 21 с.
5. Порядок направления на дополнительные испытания лекарственных средств при проведении экспертизы регистрационных материалов». — Приказ МЗ Украины от 17.04.2007 г. № 190.
6. Порядок проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань і Типового положення про комісії з питань етики. — Наказ МОЗ України № 690 від 23.09.2009.
7. Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії / Є.П. Свіщенко, А.Е. Багрій, Л.М. Єна та ін.: Посібник до Національної програми профілактики і лікування артеріальної гіпертензії. — Четверте видання, виправлене і доповнене. ННЦ «Інститут кардіології ім. М.Д. Стражеска». — Київ, 2008. — 101 с.
8. Руководство по кардиологии / Под ред. В.Н. Коваленко. — К.: Морион, 2008. — 1424 с.
9. СТ-Н МОЗУ 42-6.0:2008 «Лікарські засоби. Належна лабораторна практика». — Київ, 2009. — 48 с.
10. СТ-Н МОЗУ 42-7.0: 2008 «Лікарські засоби. Належна клінічна практика». — Київ, 2009. — 48 с.
11. Чубенко А.В., Бабич П.Н., Лапач С.Н., Ефимцева Т.К., Мальцев В.И. и др. Принципы применения статистических методов при проведении клинических испытаний лекарственных средств: Методические рекомендации. — К.: Издательский дом «Авиценна», 2003. — 60 с.
12. Additional guidance for organization performing in vivo bioequivalence studies (WHO TRS № 937, 2006, Annex 9).
13. Chow S.C., Shao J., Wang H. Sample Size Calculations in Clinical Research. — London: Taylor & Francis, 2003. — 358 p.
14. CPMP/EWP/QWP/1401/98 Rev. 1/ Corr**. Guideline on the investigation of bioequivalence. — ЕМЕА, 2010.
15. FDA Guidance for Industry «Bioanalytical Method Validation» (May 2001) / FDA Руководство для промышленности «Валидация биоаналитических методов». — Май 2001.
16. Guideline on bioanalytical method validation. — EMEA/CHMP/EWP/192217/2009, EMA, 2011.
17. Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) / G. Mancia, G. De Backer, A. Dominiczak et al. // J. Hypertens. — 2007. — Vol. 25, № 6. — Р. 1105-1187.
18. Staessen J.A. Progress in blood pressure measurement: a workshop of the European Society of Hypertension / J.A. Staessen, E. O’Brien // Blood Pressure Monitoring. — 2007. — Vol. 12, № 4. — Р. 243-244.