Журнал «» 2 (28) 2013
Вернуться к номеру
Роль аутоиммунной реактивности при артериальной гипертензии высокого кардиоваскулярного риска
Авторы: Визир В.А., Волошина И.Н. - Кафедра внутренних болезней № 2 Запорожского государственного
медицинского университета
Рубрики: Кардиология, Неврология
Разделы: Клинические исследования
Версия для печати
В исследовании проведено определение сывороточного содержания интерлейкина-17 и антител к NR2-пептиду у пациентов с артериальной гипертензией высокого кардиоваскулярного риска, установлена прогностическая значимость этих аутоиммунных маркеров для развития церебро- и кардиоваскулярных осложнений.
У дослідженні проведено визначення сироваткового вмісту інтерлейкіну-17 і антитіл до NR2-пептиду в пацієнтів із гіпертонічною хворобою III стадії з наслідками інфаркту мозку, встановлено прогностичну значущість цих автоімуних маркерів для розвитку церебро- і кардіоваскулярних ускладнень.
In a study the evaluation of serum interleukin-17 level and antibodies to NR2-peptide in patients with hypertension of high cardiovascular risk has been carried out. Also the high prognostic value of these autoimmune markers for the development of cerebro- and cardiovascular complications has been determined.
гипертоническая болезнь, интерлейкин-17, антитела к NR2-пептиду.
гіпертонічна хвороба, інтерлейкін-17, антитіла до NR2-пептиду.
essential hypertension, interleukin-17, antibodies to NR2-peptide.
Многочисленными эпидемиологическими и рандомизированными исследованиями доказано, что артериальная гипертензия (АГ) является одним из главных факторов таких осложнений, как мозговой инсульт и инфаркт миокарда, принося огромный экономический ущерб [3, 11]. Установлена непрерывная и практически линейная зависимость между уровнем артериального давления (АД) (как систолического, так и диастолического) и частотой развития инфаркта мозга [7]. По эпидемиологическим данным, у каждого пятого выжившего пациента возникает повторный ишемический инсульт в течение 5 лет после первой мозговой катастрофы [3, 7]. Несмотря на особую актуальность проблемы вторичной профилактики инсульта, патогенетические аспекты прогрессирования АГ после перенесенного инфаркта мозга (ИМ) остаются недостаточно изученными. Проведенными ранее исследованиями показано существование сложной интегральной взаимосвязи между морфофункциональными элементами нервной, эндокринной и иммунной системы, о чем свидетельствует наличие тождественных рецепторов к лимфокинам, нейропептидам и нейрогормонам на плазматических мембранах клеток нервной и иммунной системы. Выявлено, что возникающий дисбаланс нейроиммунных связей может приводить к развитию аутоиммунных реакций к антигенам мозга [5, 7, 10]. В ретроспективном наблюдении проф. С.А. Дамбиновой и соавт. (2003) было показано, что повышение титров антител к NR2-пептиду, являющемуся фрагментом NMDA-рецепторов, экспрессированных преимущественно на эндотелии гематоэнцефалического барьера и в структурах центральной нервной системы, ассоциируется с увеличением риска инсульта и транзиторной ишемической атаки [4]. Интерлейкин-17 является недавно выявленным цитокином, который модулирует процессы сосудистого воспаления, участвует в формировании гипертензивных реакций и опосредует аутоиммунный ответ [9]. Целенаправленного изучения патогенетической роли нейроиммунных маркеров и их прогностической ценности у больных с АГ, перенесших ишемический инсульт, ранее не проводилось. Не установлена взаимосвязь между одним из наиболее распространенных факторов риска АГ — ожирением и возможными иммунологическими нарушениями.
Целью исследования явилось определение прогностической значимости содержания интерлейкина-17 и антител к NR2-пептиду у больных с артериальной гипертензией высокого кардиоваскулярного риска, с сопутствующим ожирением и последствиями инфаркта мозга.
Материалы и методы
Данное клиническое исследование проводилось в соответствии с этическими принципами Хельсинкской декларации после получения соответствующего разрешения локального этического комитета ЗГМУ. Обследовано 120 больных (76 мужчин, 44 женщины) с диагнозом «гипертоническая болезнь ІІІ стадии (ГБ)», перенесших ИМ давностью более 12 месяцев различной локализации: в 39 случаях — в вертебробазилярном бассейне, у 29 пациентов — в системе каротид справа, в 33 случаях — в системе каротид слева; 19 пациентов перенесли ранее более одного ИМ. Средний возраст пациентов составил 59,0 ± 0,9 года. Критерии включения больных в исследование: установленный диагноз ГБ ІІІ стадии, наличие перенесенного ишемического инсульта давностью более 1 года, возраст больных старше 18 лет, синусовый ритм сердца, согласие на участие в исследовании. Критерии исключения: наличие вторичных артериальных гипертензий, тяжелая сердечная недостаточность, сахарный диабет, острый коронарный синдром в анамнезе давностью менее 6 месяцев, фракция выброса левого желудочка < 45 %, тяжелая почечная и печеночная недостаточность, аутоиммунные заболевания, наличие любых воспалительных процессов на момент включения.
Среди 120 больных с ГБ ІІІ ст. у 70 % было выявлено сопутствующее ожирение или избыточная масса тела [1].
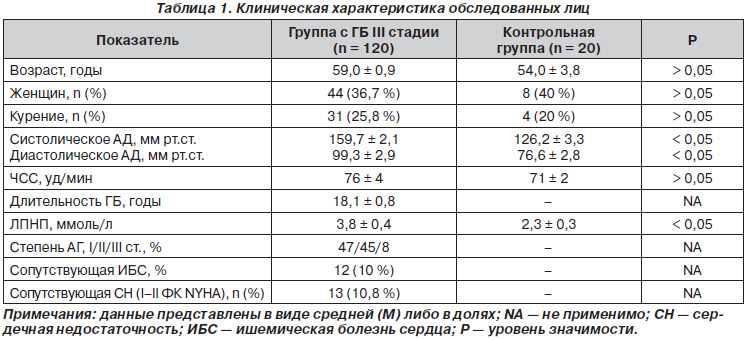
Контрольную группу составили 20 клинически здоровых лиц (12 мужчин, 8 женщин) в возрасте 54,0 ± 3,8 года, не имеющих в анамнезе артериальной гипертензии и цереброваскулярных заболеваний. Всем пациентам и волонтерам было проведено общеклиническое обследование: измерение АД, частоты сердечных сокращений (ЧСС), индекса массы тела (ИМТ), уровня липопротеидов низкой плотности (ЛПНП). Клиническая характеристика обследованных лиц представлена в табл. 1, из которой видно, что по полу, возрасту, частоте курения и массе тела группы обследуемых были сопоставимы.
Уровни нейроиммунных маркеров определяли иммуноферментным методом (ИФА) на базе центральной научно-исследовательской лаборатории ЗГМУ (зав. д.мед.н. проф. А.В. Абрамов). Образцы крови для ИФА брали из локтевой вены, контралатеральной той руке, где измерялось АД, утром, натощак, до приема медикаментов, в состоянии покоя. На момент проведения исследования все обследованные лица либо не получали постоянной антигипертензивной терапии, либо она была отменена за 48 часов до включения больных в исследование. Сыворотку крови отделяли методом центрифугирования и незамедлительно замораживали при температуре –70 °С до момента проведения анализа. Наличие аутоиммунного ответа и антител к мозговым антигенам определяли следующим образом: сывороточный уровень интерлейкина-17 измеряли с помощью наборов eBioscience (Австрия); количественное определение антител к NR2-единице рецептора NMDA — с помощью наборов Gold Dot NR2 Antibody Test, Biotech, Inc. (Германия). Полученные лабораторные данные использовались в построении последующей прогностической модели выживания.
После этапа рандомизации всем больным назначалась комплексная терапия, включавшая аспирин, аторвастатин и как минимум два антигипертензивных препарата. В соответствии с целью исследования была создана первичная конечная клиническая точка, в качестве которой рассматривали все случаи смерти по любой причине, а также случаи нефатальных церебро- и кардиоваскулярных событий (мозговой инсульт, инфаркт миокарда, фибрилляция предсердий). Период наблюдения составил 365 ± 10 дней от момента включения пациентов в исследование.
Полученные результаты представляли в виде средней (M) и стандартной ошибки среднего (m), или 95% доверительного интервала (ДИ). Оценку выживания больных осуществляли путем построения кривых выживаемости методом Каплана — Мейера. Для выявления предикторов неблагоприятного течения ГБ использовали модель пропорциональных рисков Кокса. Чувствительность и специфичность предикторов определяли путем построения ROC-кривых. Внутри- и межгрупповые различия оценивали с помощью двухвыборочного Т-теста или c2-теста в зависимости от вида данных в рамках программы StatPlus 2009. Статистически достоверными считали различия между показателями при отклонении нулевой гипотезы и уровне значимости Р < 0,05.
Результаты и их обсуждение
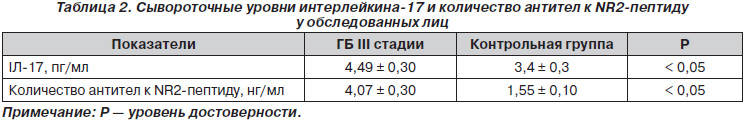
Оценка выживаемости в группе исследуемых пациентов проводилась через один год от момента включения в исследование. За указанный период кумулятивное выживание больных с АГ и последствиями ИМ составило 90,8 %. Осложнения, приведшие к смерти, были зарегистрированы в трех случаях (2,5 %). Частота возникновения всех инсультов составила 4,9 %, кардиальных осложнений — 4,16 %. Анализ сывороточного содержания нейроиммунных маркеров показал, что достоверно более высокие значения как ИЛ-17, так и количества антител к NR2-пептиду отмечались у пациентов с ГБ III стадии, перенесших ИМ, по сравнению с нормотензивными лицами без цереброваскулярной патологии (табл. 2).
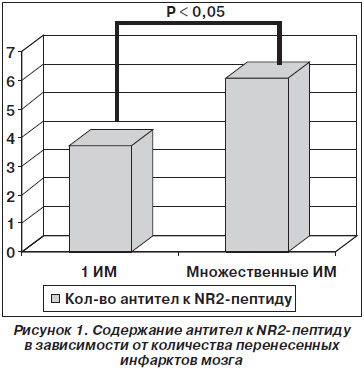
При анализе сывороточной концентрации антител к NR2-пептиду в зависимости от количества зон инфаркта мозга обнаружено, что множественные инфаркты были ассоциированы с двукратным увеличением скорости антителообразования по сравнению с теми пациентами, у которых в анамнезе был только один ишемический инсульт (рис. 1). Достоверной корреляционной взаимосвязи между индексом массы тела и уровнем антител к NR2-пептиду выявлено не было. При анализе распределения количества антител к NR2-пептиду у лиц с множественными ИМ в анамнезе было установлено, что в когорте лиц с ИМТ более 35 кг/м2 и пациентов с ИМТ менее 20 кг/м2 концентрация антител к NR2-пептиду была на 25 % (Р < 0,05) выше в сравнении с больными, имеющими ИМТ 20,1–35 кг/м2.
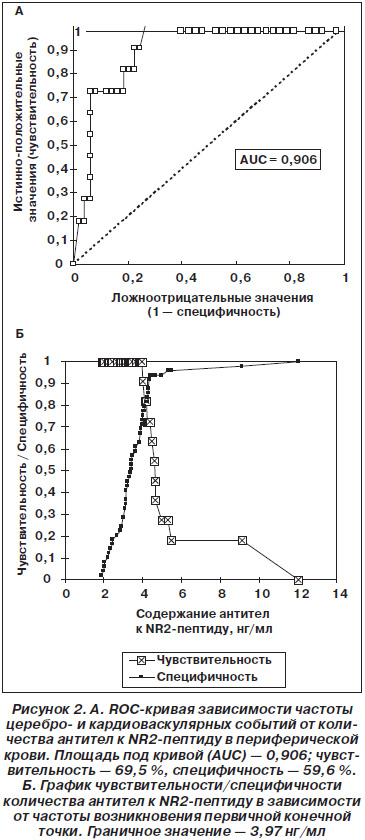
На рис. 2 представлены графические данные ROC-анализа, из которого видно, что определение количества антител к NR2-пептиду является достаточно чувствительным и специфичным методом для прогнозирования церебро- и кардиоваскулярных осложнений. Граничное значение (cut-off), при превышении которого регистрируется достоверное увеличение частоты осложнений, составило 3,97 нг/мл.
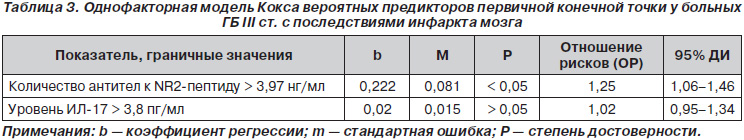
При построении модели пропорциональных рисков Кокса установлено, что достоверной прогностической значимостью обладает показатель количества антител к NR2-пептиду, в то время как повышение ИЛ-17 недостоверно коррелирует с частотой первичной конечной точки (табл. 3).
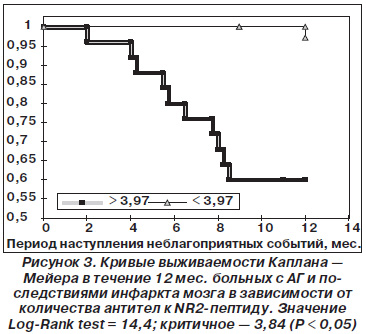
Кривые выживаемости Каплана — Мейера, распределенные в зависимости от уровня антител к NR2-пептиду, представлены на рис. 3.
Таким образом, полученные результаты исследования отражают участие аутоиммунных факторов в патогенезе прогрессирования гипертонической болезни и возникновения церебро- и кардиоваскулярных осложнений у больных, перенесших ишемический инсульт. Достоверно более высокая сывороточная концентрация ИЛ-17 у гипертензивных пациентов, перенесших ИМ, является признаком иммуновоспалительной активации с аутоиммунным компонентом. Ранее в экспериментальных исследованиях было показано, что у животных с отсутствием гена, ответственного за продукцию ИЛ-17, не наблюдается хронизация гипертензивной реакции и нарушения эндотелийзависимой вазодилатации в отличие от животных с индуцированной гипертензией. Было выявлено, что ИЛ-17 стимулирует хемотаксис клеток воспаления и частично высвобождает из них хемокины. Аккумуляция лейкоцитов в сосудистой стенке была достоверно меньшей у мышей с отсутствием ИЛ-17, чем у гипертензивных животных [2, 6]. В клинических исследованиях повышение сывороточной концентрации ИЛ-17 наблюдалось у больных с псориазом и ревматоидным артритом [8]. Элевация уровня данного цитокина у больных ГБ с последствиями инфаркта мозга не является прогностически специфичной, однако отражает степень иммуновоспалительного ответа.
Факты и последствия тяжелых иммунологических изменений в организме при остром инсульте описаны во многих исследованиях [10]. Наблюдений, касающихся изучения иммунологического статуса в отдаленные периоды после церебральной катастрофы на фоне АГ, накоплено недостаточно. В данной работе впервые получены данные о том, что в условиях стойкого, хронического повышения артериального давления, в отдаленные сроки после острой церебральной ишемии регистрируется повышение количества антител к пептидному остатку NMDA-рецепторов, т.е. аутоантигенам мозговой ткани. Первый контакт иммунокомпетентных клеток с нервной системой происходит на уровне гематоэнцефалического барьера, где NMDA-рецепторы представлены на эндотелии капилляров. Таким образом, первичная аутоагрессия происходит именно на уровне церебрального микроциркуляторного русла [4]. Очевидно, что в условиях неконтролируемой гипертензии аутоиммунный процесс приобретает хронический прогрессирующий характер с дальнейшим поражением структур центральной нервной системы. Это подтверждает выявленный нами факт почти двукратного увеличения количества антител к NR2-пептиду у больных с множественными инфарктами мозга. Несмотря на то, что данное исследование носило проспективный характер, пациенты получали комплексную терапию, включающую антиагреганты, статины и комбинированную антигипертензивную терапию, согласно существующим рекомендациям [1, 11]. За достаточно длительный период наблюдения (1 год) были получены конечные клинические точки, что отражает высокий кардиоваскулярный риск данной категории пациентов. Из прогностических моделей следует, что при превышении сывороточной концентрации количества антител к NR2-пептиду свыше 3,97 нг/мл кумулятивный риск развития церебро- и кардиоваскулярных осложнений у больных с ГБ III ст., перенесших ИМ, составляет 25 % (ОР = 1,25). Вычисленная прогностическая модель обладает достаточной степенью точности (AUC = 0,906), что позволяет рекомендовать использование данного показателя в клинической практике. Выявленные результаты относительно неоднозначного уровня антител к NR2-пептиду у больных ГБ ІІІ ст. с множественными ИМ в анамнезе и сопутствующим ожирением (а также недостаточной массой тела) требуют дальнейшего комплексного изучения.
Выводы
1. У больных с артериальной гипертензией высокого кардиоваскулярного риска с последствиями инфаркта мозга наблюдаются процессы нейроиммунной активации, проявляющиеся элевацией сывороточных концентраций интерлейкина-17 и количества антител к NR2-пептиду.
2. У больных с последствиями множественных инфарктов мозга и ожирением количество антител к NR2-пептиду достоверно выше, чем у пациентов, перенесших один эпизод острой церебральной ишемии.
3. Превышение сывороточной концентрации количества антител к NR2-пептиду более 3,97 нг/мл ассоциируется с увеличением кумулятивного риска развития церебро- и кардиоваскулярных осложнений на 25 % у больных с гипертонической болезнью III стадии с последствиями инфаркта мозга.
Перспективы дальнейших исследований
Учитывая полученные результаты об участии аутоиммунных факторов в патогенезе прогрессирования гипертонической болезни у больных, перенесших ишемический инсульт, перспективным считаем проведение дальнейших проспективных исследований по изучению патогенетической роли аутоиммунитета при цереброваскулярной патологии и метаболических нарушениях на фоне артериальной гипертензии.
1. Рекомендації української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії. Четверте видання / [ННЦ «Інститут кардіології ім. Стражеска» НАМН України]. — К., 2008. –– 79 с.
2. A distinct subset of natural killer T-cells produces IL-17, contributing to airway infiltration of neutrophils but not to airway hyperactivity / Lee K.A., Kang M.H., Lee Y.S. [et al.] // Cell. Immunol. — 2008. — Vol. 251. — P. 50-55.
3. Blood pressure and stroke: an overview of published reviews / Lawes C.M., Bennett D.A., Feigin V.L., Rodgers A. // Stroke. — 2004. — Vol. 35. — Р. 776-85.
4. Blood test detecting autoantibodies to N-methyl-D-aspartate neuroreceptors for evaluation of patients with transient ischemic attack and stroke / S.A. Dambinova, G.A. Khounteev, G.A. Izykenova [et al.] // Clin. Chem. — 2003. — Vol. 49. — Р. 1752-1762.
5. Bornstein N.M. Antibodies to brain antigens following stroke / N.M. Bornstein, B. Aronovich, A.D. Korczyn [et al.] // Neurology. — 2001. — Vol. 56. — P. 529-530.
6. Differential regulation of central nervous system autoimmunity by Th-1 and Th-17 cells / I.M. Stromnes, L.M. Cerretti, D. Liggitt [et.al.] // Nat. Med. — 2008. — Vol. 14. — P. 337-342.
7. Evidence-based practice for stroke / Langhorne P., Sandercock P., Prasad K. // Lancet Neurology. — 2009. — Vol. 8. — P. 308-309.
8. Foxp3_ CD25_ CD4_ natural regulatory T-cells in dominant self-tolerance and autoimmune disease / Sakaguchi S., Ono M., Setoguchi R. [et al.] // Immunol. Rev. — 2006. — Vol. 212. — P. 8-27.
9. Furuzawa-Carballeda J. Autoimmune inflammation from the Th17 perspective / J. Furuzawa-Carballeda, M.I. Vargas-Rojas, A.R. Cabral // Autoimmun. Rev. — 2007. — Vol. 6. — P. 169-175.
10. Peak plasma interleukin-6 and other peripheral markers of inflammation in the first week of ischaemic stroke correlate with brain infarct volume, stroke severity and long-term outcome / C.J. Smith, H.C. Emsley, C.M. Gavin [et al.] // BMC Neurol. — 2004. — Vol. 4. — P. 223-228.
11. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force documental / G. Mancia, S. Laurent, E. Agabiti-Rosei [et al.] // Blood Pressure. — 2009. — Vol. 27. — P. 2121-2158.