Газета «Новости медицины и фармации» Гастроэнтерология (457) 2013 (тематический номер)
Вернуться к номеру
Нейровегетативные особенности течения гипертонической болезни на фоне синдрома раздраженного кишечника
Авторы: Тарасова В.И. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
В настоящее время в Украине, как и во всем мире, уделяется повышенное внимание заболеваниям системы кровообращения. Это обусловлено тем, что данная патология является основной причиной смерти взрослого работоспособного населения. По прогнозам ВОЗ, к 2020 г. сердечно-сосудистые заболевания вытеснят инфекционные, при этом ишемическая болезнь сердца займет второе место, а цереброваскулярные заболевания — четвертое место в мире среди причин смертности [1, 2]. Эти причины тесно связаны с артериальной гипертензией (АГ). Число официально зарегистрированных больных с АГ в Украине в 2011 году составило 32,2 % взрослого населения [3]. 90 % всех случаев АГ составляет гипертоническая болезнь (ГБ).
Высокая частота ГБ и некоторые звенья патогенеза заболевания приводят к тому, что ГБ у взрослого населения часто сочетается с патологией других органов, особенно желудочно-кишечного тракта. Наличие сопутствующей патологии органов пищеварения зарегистрировано у 34,5 % больных ГБ [4].
По данным мировой статистики, от 30 до 50 % больных, обращающихся к гастроэнтерологу, страдают синдромом раздраженного кишечника (СРК) [5–7]. Наиболее часто СРК диагностируют у лиц молодого, трудоспособного возраста. По данным зарубежных авторов, распространенность CPK составляет от 14–27 % (у мужчин) до 30–47 % (у женщин) от общей популяции [7]. Однако, по-видимому, приведенные данные не являются достоверными, а значительно занижены. Это связано с тем, что лишь около 30 % лиц с СРК обращаются к врачу, остальные предпочитают лечиться самостоятельно [5, 7].
С учетом частоты встречаемости СРК у больных с данной патологией может наблюдаться его сочетание с ГБ. Между тем особенности течения ГБ у лиц с функциональными расстройствами кишечника изучены недостаточно.
В настоящее время причина синдрома раздраженного кишечника точно не установлена. Несмотря на сложность и неоднозначность этиопатогенеза, общепризнана роль висцеральной гиперчувствительности и нарушений моторики кишечника, а также психогенных дезадаптаций в развитии СРК. В основе заболевания лежит нарушение взаимодействия в системе «головной мозг — кишка», приводящее к нарушению нервной и гуморальной регуляции двигательной функции кишечника и развитию висцеральной гиперчувствительности рецепторов толстой кишки к растяжению. Реализация этих факторов осуществляется с участием вегетативной нервной системы (ВНС). При СРК имеется дисбаланс обоих звеньев ВНС [8, 9]. Предполагается, что состояние кишечника может оказывать влияние на тонус ВНС, в том числе на формирование и прогрессирование симпатикотонии. Однако этот вопрос до сих пор остается до конца не изученным.
В то же время к настоящему времени получено большое количество данных, свидетельствующих о роли нарушений нейрогенной регуляции кровообращения в патогенезе эссенциальной АГ. Они сопровождаются эндотелиальной дисфункцией с нарушением активности синтеза вазодилатирующих факторов и повышением активности (или чувствительности к ним) сосудосуживающих факторов. Многочисленные данные свидетельствуют о повышении тонуса симпатической нервной системы при ГБ [10, 11].
Установлено, что развитие СРК с запорами связано с гиперплазией и гиперфункцией серотонинпродуцирующих клеток, что отмечается на фоне снижения количества и функциональной активности клеток, синтезирующих вазоактивный интестинальный пептид (ВИП). В то время как при варианте с диареей выявляется увеличение численности и функциональной активности общей популяции серотонин- и ВИП-продуцирующих клеток [12, 13]. ВИП обладает наиболее выраженным среди гастроинтестинальных нейропептидов сосудорасширяющим и гипотензивным действием [14–17].
Нейропептид Y (НПY) присутствует в некоторых секретомоторных нейронах нервной системы кишечника и может угнетать секрецию воды и электролитов в кишечнике, способствуя формированию запоров [18]. Кроме того, НПY понижает симпатический и повышает парасимпатический тонус. НПY обладает выраженным вазоконстрикторным эффектом, который реализуется за счет прямого влияния на миоциты сосудов [19].
Все это обусловливает актуальность изучения особенностей ГБ у больных с такой частой функциональной патологией, как синдром раздраженной кишки, это важно при выделении группы риска неблагополучного течения ГБ, прогнозировании течения ГБ и сопутствующего СРК, при выборе рациональной индивидуализированной терапии.
Целью данной работы было изучение особенностей вегетативного статуса и уровней нейропептида Y и ВИП крови у больных ГБ и СРК и их патогенетического значения в развитии гипертонической болезни.
Материалы и методы исследования
Были обследованы 61 больной ГБ и 22 практически здоровых добровольца в возрасте от 22 до 78 лет. Среди пациентов было 26 мужчин (46,62 %) и 35 женщин (57,38 %). Давность заболевания колебалась от 4 месяцев до 26 лет. Среди пациентов 35 (57,4 %) были со II стадией заболевания и 26 (42,6 %) — с III стадией ГБ.
У 29 больных (47,5 %) гипертоническая болезнь сочеталась с синдромом раздраженного кишечника. Диагноз СРК устанавливался в соответствии с международными критериями заболевания (Рим III). Для исключения органического заболевания органов брюшной полости пациентам по показаниям выполнялись дополнительные лабораторные и инструментальные методы исследования. У всех участников был изучен тонус вегетативной нервной системы с помощью специальных опросников и таблицы Вейна.
Для выяснения вопроса о возможной роли изменения активности нейропептидов при сопутствующем синдроме раздраженного кишечника в патогенезе ГБ у 25 больных содержание вазоинтестинального полипептида и нейропептида Y в плазме крови определяли иммуноферментными методами с помощью наборов Bachem Peninsula Laboratories, Inc. В качестве величин сравнения использовали данные, полученные при обследовании группы практически здоровых добровольцев.
Статистическая обработка проводилась с помощью методов вариационной статистики с использованием пакета программ Мiсrоsоft Ехсеl (2007) и Statystica 6.0 с вычислением t-критерия Стьюдента. Различия между величинами считали достоверными при значении р < 0,05.
Результаты и их обсуждение
При изучении вегетативного статуса у обследованных больных преобладание парасимпатического тонуса диагностировалось на основании следующих признаков: данные анамнеза (глубокий продолжительный сон без сновидений, замедленный переход к бодрствованию по утрам; наибольшая работоспособность до обеда, длительная работоспособность при замедленном темпе работы; хорошая способность к сосредоточению; отсутствие ознобоподобного гиперкинеза, плохая переносимость холода, пониженная температура при инфекциях; ощущение жара, повышенная чувствительность к сухому нагретому воздуху; снижение аппетита и жажды; частые головокружения; склонность к повышенному газообразованию, дискинезии, спастические запоры, поносы, тошнота, склонность к отекам; частые аллергические реакции); характерологические, личностные, эмоциональные расстройства (угнетенность, пугливость, апатичность, эмоциональная тупость, отсутствие побудительных импульсов, обилие неврастенических, ипохондрических жалоб и проявлений); усиление сосудистого рисунка, выраженный длительный и стойкий красный дермографизм; брадикардии, аритмии; медленное глубокое дыхание; повышенная кислотность желудочного сока; снижение функции щитовидной железы; гипогликемия; гипертрофия лимфоидной ткани; повышенная температура тела, теплые кисти.
Преобладание тонуса симпатической нервной системы диагностировалось при наличии следующих признаков: данные анамнеза (непродолжительный сон или бессонница, позднее засыпание, беспокойный сон, тревожные сновидения; высокая, но кратковременная работоспособность, преимущественно в вечернее время; непереносимость чрезмерно жарких и переполненных помещений, удовлетворительная переносимость холода, склонность к потливости или зябкости, лихорадочное течение инфекций; повышение аппетита и жажды; атонические запоры; отсутствие склонности к отекам; редкие аллергические реакции); характерологические, личностные, эмоциональные расстройства (рассеянность и неспособность сосредоточиться, повышенная отвлекаемость, быстрая смена мыслей; чрезмерная возбудимость при малейших психических раздражениях, большая боязливость и повышенная чувствительность к боли); слабая выраженность сосудистого рисунка, белый дермографизм; тахикардии, длительное возвращение к исходному пульсу после нагрузки, повышение САД, ДАД; нормальное или учащенное дыхание; нормальная или пониженная кислотность желудочного сока; повышение функции щитовидной железы; склонность к гипергликемии; холодные кисти, онемение в конечностях, парестезии в конечностях по утрам.
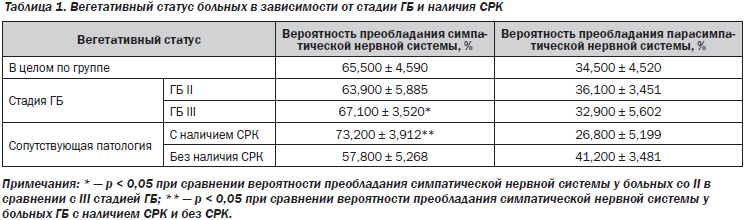
Установлено, что ваготония имела место у 18 (29,5 %) пациентов, симпатикотония — у 43 (70,5 %), что подтверждает литературные данные о несомненном участии нарушений ВНС в возникновении и развитии ГБ. Анализ зависимости вегетативного тонуса от половой принадлежности показал, что у женщин, страдающих ГБ, симпатикотония выявлялась достоверно чаще (80,0 %), чем у мужчин (57,7 %), р = 0,004.
Исследование вегетативного статуса в зависимости от стадии ГБ выявило, что среди пациентов с III стадией заболевания вероятность преобладания симпатической нервной системы выше, чем у больных со II стадией — 67,100 ± 3,520 % и 63,900 ± 5,885 % соответственно, р = 0,047 (табл. 1). То есть по мере прогрессирования гипертонии нарастает вегетативный дисбаланс, оказывая неблагоприятное воздействие на органы-мишени и способствуя большему количеству осложнений.
В ряде работ отмечается повышение тонуса и реактивности парасимпатической нервной системы у лиц с СРК при отсутствии статистически значимых различий в отношении симпатической реактивности. Другими же исследователями выявлено, что у таких пациентов наиболее часто встречается симпатикотония и симпатический тип реактивности [8, 9]. У всех обследованных больных гипертонической болезнью нами был изучен вегетативный статус в зависимости от наличия СРК. У большинства пациентов с ГБ с наличием СРК была выявлена симпатикотония — 22 больных (81,5 %). Причем, как следует из приведенной таблицы, вероятность преобладания симпатического тонуса ВНС у таких пациентов была достоверно выше, чем у лиц без наличия СРК, — 73,200 ± 3,912 и 57,800 ± 5,268 % соответственно (р = 0,041).
Как показывают данные молекулярно-биологических, физиологических и фармакологических исследований, ВИП является потенциальным вазодилататором, вызывая атропин-резистентное расширение кровеносных сосудов, а также обеспечивает компенсаторное положительное хронотропное и инотропное влияние на сердце человека [14, 15]. Вазоактивный интестинальный полипептид регулирует продукцию других регуляторных субстанций пептидной и непептидной природы, включая оксид азота. Результаты наших исследований выявили достоверное исходное снижение уровня ВИП в плазме всех обследованных больных ГБ в сравнении со здоровыми добровольцами — 0,480 ± 0,044 нг/мл и 0,770 ± 0,094 нг/мл соответственно (р = 0,004). Причем анализ концентрации ВИП у больных гипертонической болезнью без и с наличием сопутствующей патологии кишечника показал достоверно более низкие уровни ВИП в обеих группах в отличие от здоровых лиц. При этом отмечалась тенденция к снижению уровня этого пептида у лиц с ГБ без СРК (0,420 ± 0,066 нг/л) в сравнении с пациентами с сопутствующим СРК (0,550 ± 0,056 нг/л), разница составила 25 %. Полученные результаты позволяют высказать мнение о том, что дополнительное снижение активности вазоинтестинального пептида, выступающего нейромедиатором и нейромодулятором, у больных СРК блокирует его вазодилатирующее действие, способствуя развитию гипертензии.
В экспериментах продемонстрировано, что в нейрогуморальной регуляции АД принимает участие и нейропептид Y [18, 19]. Нами установлено также более низкое содержание НПY в плазме крови больных ГБ (1,280 ± 0,602 нг/мл и 1,630 ± 0,721 нг/мл соответственно), причем разница со здоровыми добровольцами составила 21,4 %. Статистически значимого различия в содержании НПY у обследованных в зависимости от наличия СРК не было выявлено, однако у больных без СРК уровень НПY был несколько выше (1,330 ± 0,582 нг/мл), чем у пациентов с наличием СРК (1,230 ± 0,645 нг/мл), что согласуется с имеющимися данными литературы. Низкий уровень НПY при синдроме раздраженного кишечника, вероятно, связан со значительным подавлением его секреции серотонином, синтезируемым энтероэндокринными клетками толстой кишки. Известно, что нейропептид Y понижает симпатический и повышает парасимпатический тонус. Следовательно, уменьшение его содержания может способствовать развитию симпатикотонии у таких больных. Дальнейшие исследования в этом направлении, безусловно, перспективны, поскольку изменения активности нейропептида Y могут быть одним из механизмов, ответственных за развитие гипертензии.
Итак, в формировании гипертонической болезни так же, как и СРК, значительная роль принадлежит нейровегетативным особенностям, под воздействием которых нарушается баланс нейротрансмиттеров и регуляторных пептидов, в частности ВИП и нейропептида Y. Понижение уровней плазменных НПY и ВИП, возможно, играет роль в патофизиологических процессах развития гипертонии на фоне синдрома раздраженного кишечника. Происходит сбой регулирующих механизмов функционального состояния кишечника и формирование висцеральной гиперчувствительности, что, безусловно, влечет за собой развитие системных нарушений. Комплексное клиническое обследование пациентов с ГБ показало, что у большинства из них были выявлены признаки симпатикотонии, причем у пациентов с наличием СРК преобладание симпатического тонуса было достоверно. Таким образом, наряду с общепринятыми стандартами исследований в программу комплексного обследования пациентов с гипертонической болезнью целесообразно добавить изучение вегетативного статуса.
1. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document // J. Hypertension. — 2009. — № 27. — P. 2121-2158.
2. The seventh report of Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure // JAMA. — 2003 — Vol. 21, № 289 (19). — Р. 2560-2571.
3. Дорогой А.П. Термін виконання «Програми профілактики і лікування артеріальної гіпертензії в Україні» закінчився, проблеми залишилися. Що далі? // Артериальная гипертензия. — 2011. — № 3 (17). — С. 29-36.
4. Філиппов Ю.О., Шмігель З.М. Стан показників здоров’я населення адміністративних територій України за діяльності гастроентерологічної служби // Гастроентерологія. — 2003. — Вип. 34 — С. 3-12
5. Дзяк Г.В., Залєвський В.І., Степанов Ю.М. Функційні захворювання кишечника. — Днепропетровск: ПП «Ліра ЛТД», 2004. — 200 с.
6. Маев И.В., Черемушкин С.В. Синдром раздраженного кишечника. Римские критерии III // Гастроэнтерология. Приложение к Consilium medicum. — 2007. — Т. 9, № 1. — С. 11.
7. Lembo A.J., Drossman D.A. Contemporaty diagnosis and management of irritable bowel syndrome. — 2002. — 148 p.
8. Kellow J.E., Delvaux M., Aspiroz F. et al. Principles of applied neurogastroenterology: phsycology motility-sensation // Gut. — 1999 — Vol. 45 — P. 17-24.
9. Жуков Н.А, Сорокина Е.А., Ахметов В.А., Березняков Т.Н. Дисфункция вегетативной нервной системы в формировании СРК и принципы ее коррекции // Рос. журнал гастроэнтерологии, гепатологии, колопроктологии. — 2004. — Т. 14, № 5. — С. 35-41.
10. Ольбинская Л., Боченков Ю. Симпатическая гипереактивность в развитии артериальной гипертензии с метаболическими нарушениями: подходы к фармакотерапии // Врач. — 2004. — № 7. — С. 4-8.
11. Конради А.О., Захаров Д.В., Рудоматов О.Г. и др. Спектральный анализ вариабельности сердечного ритма при различных вариантах ремоделирования левого желудочка у больных гипертонической болезнью // Артериальная гипертензия. — 2000. — Т. 6, № 2. — С. 33-38.
12. Осадчук А.М., Осадчук М.А., Балашов А.В., Кветной И.М. Патогенетические аспекты клинических вариантов синдрома раздраженного кишечника с позиций нарушения диффузной эндокринной системы и клеточного обновления колоноцитов // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2008. — Т. 18, № 1. — С. 38-44.
13. Ивашкин В.Т., Шептулин А.А., Соловьева А.Д., Полуэктова Е.А., Белхушет С., Марданова О.А. Новые возможности патогенетического лечения синдрома раздраженного кишечника // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2007. — № 4. — С. 60-67.
14. Voice J., Dorsam G., Chan R. et al. Immunoeffector and immunoregulatory activities of vasoactive intestinal peptide // Regulatory peptides. — 2002. — V. 109. — P. 199-208.
15. Madden K., Felten D. Experimental basis for neural-immune interactions // Phisiol. Rev. — 1995. — V. 75, № 1. — P. 77-106.
16. Burian B., Ortner A., Prassl R., Zimmer A., Mosgoeller W. Clinical potential of VIP by modified pharmako-kinetics and delivery mechanisms // Endocrine, Metabolic & Immune Disorders — Drug Targets. — 2012. — V. 12 (4). — P. 344-350.
17. Zigmond R.E. Fundamental neuroscience. — N-Y.: L. Academic Press, 1999. — P. 207.
18. Da Silva A.A., do Carmo J.M., Kanyicska B., Dubinion J., Brandon E., Hall J.E. Endogenous melanocortin system activity contributes to the elevated arterial pressure in spontaneously hypertensive rats // Hypertension. — 2008. — V. 51. — P. 884-890.
19. Паштиани Р.В. Нейропептид Y и показатели суточного артериального давления у больных гипертонической болезнью // Український медичний альманах. — 2003. — № 3. — С. 119-121.