Газета «Новости медицины и фармации» 17 (471) 2013
Вернуться к номеру
Вопросы рационального выбора и безопасности антимикробной терапии в педиатрии
Авторы: Татьяна Чистик
Рубрики: Семейная медицина/Терапия, Антибиотикотерапия
Разделы: Медицинские форумы
Версия для печати
Рациональная антибиотикотерапия в педиатрии остается одной из наиболее актуальных проблем современной медицины. Значение этой проблемы возрастает по мере увеличения случаев резистентности распространенных возбудителей инфекционных заболеваний к существующим антимикробным средствам и в связи с резким уменьшением количества новых антибиотиков, поступающих на фармацевтический рынок. Одной из наиболее проблемных областей применения антибиотиков являются инфекции верхних и нижних дыхательных путей, лорорганов, что определяется прежде всего значением этих инфекций в структуре заболеваемости и смертности детского населения.
19–20 сентября 2013 года в Харькове состоялась XV Всеукраинская научнопрактическая конференция, посвященная памяти выдающегося ученогопедиатра, членакорреспондента НАН Украины, АМН Украины, РАМН, доктора медицинских наук, профессора В.М. Сидельникова. В рамках конференции прошел научный симпозиум «Этиотропная терапия в современной детской инфектологии», на котором рассматривались важнейшие вопросы безопасности антимикробной терапии в педиатрии, диагностика и лечение внебольничных пневмоний, бактериальных осложнений острых респираторных инфекций.
С докладом «Антибактериальная терапия неосложненных внебольничных пневмоний у детей» выступил заведующий кафедрой факультетской педиатрии и медицинской генетики Днепропетровской медицинской академии, доктор медицинских наук, профессор Александр Евгеньевич Абатуров.
Пневмония является одним из наиболее частых и серьезных заболеваний легких у детей. Основу ее этиотропного лечения составляет антибактериальная терапия. Эмпирический выбор антибактериальных препаратов зависит от особенностей современной этиологической структуры пневмоний. В настоящее время наряду с типичными возбудителями достаточно часто встречаются внутриклеточные микроорганизмы и грамотрицательные кокки.
Так, данные Всемирной организации здравоохранения за 2006 г. свидетельствуют, что в структуре заболеваемости внебольничными пневмониями у детей 1–13 лет главная роль принадлежит Streptococcus pneumoniaе (20–60 %), Haemophilus influenzaе (3–10 %), Staphylococcus aureus (4–12 %), Staphylococcus epidermidis (2–3 %), грамотрицательной флоре (5–8 %). Приблизительно такая же ситуация прослеживается и в Украине (Юлиш Е.И., 2010).
При исследовании этиологического фактора пневмонии у часто и длительно болеющих детей и у детей с повторными пневмониями (Юлиш Е.И., 2010) выявлена доминирующая роль Streptococcus pneumoniae (соответственно 53,6 и 58,1 %), Haemophilus influenzaе (13,6 и 16,2 %), Staphylococcus aureus (31,8 и 29,3 %), Klebsiella pneumoniaе (19,0 и 21,6 %), Pseudomonas aeruginosa (12,0 и 9,4 %), Proteus mirabilis (14,0 и 10,4 %), Esсherihia coli (9,0 и 6,8 %).
Таким образом, в связи с наметившейся тенденцией к изменению этиологической структуры внебольничных пневмоний, особенно у часто болеющих детей, необходимо проведение коррекции выбора стартового антибиотического средства, которое обладало бы действием и на грамотрицательные бактерии. Кроме того, в последние годы отмечается высокое распространение пенициллинрезистентных штаммов S.pneumoniaе, устойчивых к аминопенициллинам, цефалоспоринам I–II поколений и макролидам, в то же время показано влияние на их жизнедеятельность цефалоспоринов III поколения.
Цефподоксима проксетил (Цефодокс) — пероральный цефалоспорин третьей генерации, обладающий высокой антибактериальной активностью против широкого диапазона грамположительных и грамотрицательных бактерий.
По данным S.A. Hadley, M.A. Pfaller (2007), цефподоксим продемонстрировал высокую антибактериальную активность против Streptococcus pneumoniaе, Haemophilus influenzaе, метициллинчувствительного Staphylococcus spp., Streptococcus pyogenes, Streptococcus agalactiae, Moraxella catarrhalis, Enterobacteriaceae, Enterobacter spp., Proteus vulgaris и Morganella morganii.
Исследования, проведенные в Испании A. Fenoll и соавт. в 2007 году, показали, что штаммы Streptococcus pneumoniaе, чувствительные к действию пенициллина, чувствительны и к цефподоксима проксетилу в 99,5 % случаев. Z.Y. Sun и соавт. (2007) определили, что чувствительность Streptococcus pneumoniaе к первому (цефалексин), второму (цефаклор) и третьему (цефподоксим) поколениям цефалоспоринов соответственно составляет 6,0; 45,1 и 88,7 %.
H. Dabernat, M. Seguy, G. Faucon, C. Delmas на основании результатов исследований, проведенных в различных регионах Франции (2007), считают, что цефподоксим является одним из самых активных антибактериальных средств по отношению к Haemophilus influenzaе, независимо от их резистентности к пристинамицину, телитромицину и амоксициллину.
При сравнительном анализе антибактериальной активности наиболее часто назначаемых пероральных цефалоспоринов (цефаклор, цефдинир, цефуроксима аксетил, цефалексин) и амоксициллина было показано, что цефподоксим по активности против H.influenzaе превосходит данные лекарственные средства (H.S. Sader, M.R. Jacobs, T.R. Fritsche, 2007). В стандартном режиме при лечении детей с бактериальными инфекциями респираторного тракта цефподоксим не уступает амоксициллину с клавулановой кислотой, цефиксиму, цефуроксима аксетилу, цефаклору и даже превосходит их (Fulton B., Perry C.M., 2007). По данным 1090 исследований 22 бактериальных штаммов в 15 различных медицинских учреждениях Японии, проведенных T.U. Abe и соавт. (2002) с июня 2000 по март 2001 года, цефподоксим превосходил по антибактериальной активности цефаклор, цефдинир, цефдиторен и цефкапен. A. Aggarwal, S. Rath (2004) считают, что в регионах, где наблюдается снижение чувствительности респираторных инфекционных агентов к действию пенициллинов и макролидов, цефподоксим может использоваться в качестве препарата выбора.
Нами была проведена работа по изучению клинической эффективности перорального цефалоспорина III генерации цефподоксима проксетила (препарат Цефодокс, компания «Мегаком») в качестве стартового антибиотика при лечении внебольничных пневмоний у часто болеющих детей раннего возраста.
Методы исследования включали: сбор анамнестических данных, объективное исследование детей, проведение рентгенографии грудной клетки и бактериологического исследования мокроты и кала.
Под нашим наблюдением находилось 57 часто болеющих детей раннего возраста с неосложненной формой внегоспитальной пневмонии, в терапию которых был включен Цефодокс в качестве стартового перорального антибиотика. Цефодокс назначался внутрь из расчета 10 мг/кг массы тела ребенка в сутки в 2 приема после еды. Длительность курса лечения определялась достижением стойкой нормализации температуры тела, положительной динамикой физикальных данных и составляла в среднем 8,9 ± 1,5 дня.
Клиническую эффективность Цефодокса оценивали по критериям, приведенным в Европейском руководстве по клинической оценке противоинфекционных лекарственных средств. Клинически эффективным препарат считали, если клинические и рентгенологические симптомы заболевания полностью исчезали после лечения. Все дети наряду с Цефодоксом получали комплексную терапию, включающую муколитики, пероральную дезинтоксикационную терапию, витамины и физиотерапевтические процедуры. Предварительную эффективность лечения оценивали на 3–4й день терапии, окончательно — на 12–14й день лечения. Контроль динамики клинических показателей и безопасность лечения оценивали ежедневно.
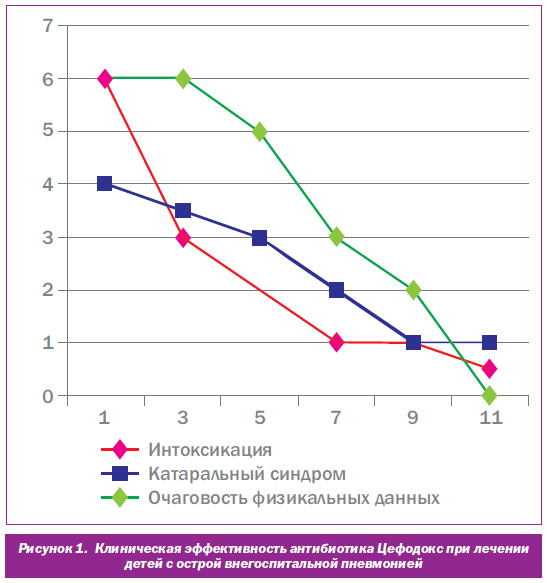
До лечения в клинической картине большинства наблюдаемых пациентов доминировали интоксикационный и катаральный синдромы: субфебрильная или фебрильная лихорадка в течение 3–5 дней, бледность и мраморность кожи, изменение поведения. Были выражены симптомы астенизации: общая слабость, недомогание, снижение аппетита. У всех пациентов наблюдались физикальные изменения.
Через три дня после начала лечения отмечалась положительная клиническая динамика течения болезни: уменьшились проявления интоксикационного синдрома (температура тела нормализовалась либо снизилась до субфебрильных цифр, повысился аппетит, уменьшилась слабость, дети стали более активными). Это позволило продолжить начатую эмпирически терапию препаратом Цефодокс.
На 8–9й день терапии отмечалась положительная динамика гематологических показателей. Контрольная рентгенография органов грудной клетки, проведенная на 10–12й день терапии, показала полное исчезновение очага пневмонической инфильтрации легких. Нормализация физикальных изменений отмечалась в среднем к 7–12му дню лечения.
По результатам микробиологических исследований кала установлено, что Цефодокс существенно не влиял на состояние микробиоценоза кишечника. Все дети хорошо переносили Цефодокс, побочных реакций не зарегистрировано.
Таким образом, цефподоксима проксетил (Цефодокс) можно рекомендовать в качестве стартового эмпирического антибиотика при лечении внегоспитальной пневмонии у часто болеющих детей раннего возраста, а также у лиц с высоким риском наличия грамотрицательной флоры.
Применение перорального цефалоспорина III генерации цефподоксима проксетила (Цефодокс) является одним из перспективных направлений антимикробной терапии с высокой активностью относительно большинства потенциальных возбудителей внебольничных пневмоний у детей (Str.pneumoniaе, Haemophilus influenzae et parainfluenzae, Moraxella catarrhalis), благоприятной фармакокинетикой и фармакодинамикой, отсутствием выраженных побочных эффектов, исключением психотравмирующего эффекта инъекций и постинъекционных осложнений.
О вопросах безопасности антимикробной терапии в педиатрии в своем докладе рассказал заведующий кафедрой госпитальной педиатрии Запорожского государственного медицинского университета, доктор медицинских наук, профессор Геннадий Александрович Леженко.
На сегодняшний день существуют серьезные проблемы, связанные с применением лекарственных средств. К ним относятся:
- offlabel — назначение лекарственных средств не по инструкции;
- нежелательные побочные реакции;
- некачественные препараты, фальсификаты лекарственных средств;
- unlicensed — нелицензированные лекарственные средства;
- острые и хронические отравления, вызванные применением лекарственных средств;
- злоупотребление лекарственными средствами;
- неблагоприятные взаимодействия лекарственных средств.
Установлено, что наибольшее количество случаев побочных реакций среди всех фармакотерапевтических групп лекарственных средств отмечается при приеме антимикробных средств для системного применения, в 2012 году этот показатель составил 36,4 %.
К основным нежелательным побочным эффектам антибиотикотерапии (Кривопустов С.П., 2011) следует отнести:
- аллергические: анафилактические, цитотоксические, иммунокомплексные и клеточные;
- токсические: нефротоксичность, гепатотоксичность, гастротоксичность, гематотоксичность;
- биологические: дисбактериоз, полигиповитаминоз, угнетение иммунной системы, вторичная инфекция и устойчивые штаммы;
- местные: тромбофлебиты, абсцессы.
Согласно основным показателям работы системы Фармнадзора Украины за 2012 год, среди всех антибактериальных препаратов наибольшее количество случаев побочных эффектов зафиксировано при применении цефтриаксона, защищенных пенициллинов, левофлоксацина, амоксициллина, т.е. побочные реакции отмечены для всех наиболее часто применяемых групп. Среди наиболее часто регистрируемых побочных реакций отмечены изменения кожи и ее придатков, нарушения работы желудочнокишечного тракта (ЖКТ), неврологические расстройства.
FDA предупредило об опасности применения пациентами, страдающими сердечнососудистыми заболеваниями, азитромицина, так как он вызывает нарушение электрической активности сердца и повышает вероятность развития аритмии. Также в группе риска находятся больные с удлиненным интервалом QT, замедленным сердцебиением, низкими уровнями калия и магния в крови. Прием азитромицина может усугубить имеющиеся нарушения и привести к такому потенциально опасному для жизни осложнению, как пируэтная желудочковая тахикардия.
Препараты группы пенициллинов и цефалоспоринов в целом хорошо переносятся пациентами, однако и они склонны вызывать аллергические реакции. По данным Л.С. Страчунского, частота возникновения аллергических реакций на пенициллин в среднем составляет около 2 %, однако, по данным других исследователей, существует значительный разброс — от 1 до 10 %. Аллергические реакции на цефалоспорины (Викторов А.П., 2006) встречаются в 2–18 % случаев, причем представители I и II генерации вызывают побочное действие чаще, чем III и IV поколение.
Перекрестное реагирование с пенициллином составляет около 10 % для цефалоспоринов I поколения и 1–3 % — II–III поколений. Это объясняется тем, что антитела к II и III поколению цефалоспоринов чаще направлены против боковых цепей, чем против кольцевых структур, в отличие от I поколения (Страчунский Л.С., Рафальский В.В., 2010).
Нарушения в работе ЖКТ являются вторыми по частоте встречаемости побочными реакциями применения антибиотиков. Решением проблемы гастроинтестинальной безопасности, в том числе и в педиатрической практике, считают использование пролекарств. Их применение обеспечивает:
- улучшение проницаемости, биодоступности;
- улучшение абсорбции, скорости всасывания;
- защиту активного вещества от разрушения;
- решение вопроса кислотной чувствительности;
- решение вопроса токсичности;
- минимизацию воздействия на микробиоценоз кишечника.
К пролекарствам относятся цефалоспорин II поколения цефуроксима аксетил и цефалоспорин III поколения цефподоксима проксетил.
Эффективность и безопасность пятидневного курса терапии цефуроксима аксетилом (250 мг 2 р/д per os) были отмечены в двойном слепом мультицентровом рандомизированном исследовании с участием 537 пациентов, страдающих вторичными бактериальными инфекциями при остром бронхите, в сравнении с 10дневным курсом амоксициллина в комбинации с клавулановой кислотой (500 мг 3 р/д per os). Данное исследование позволило сделать вывод, что бактериологическая и клиническая эффективность 5дневного курса лечения с использованием цефуроксима аксетила сопоставима с 10дневым курсом лечения амоксициллином с клавулановой кислотой. При этом частота побочных эффектов при коротком курсе цефуроксима аксетила была в 2,5 раза меньше, чем при лечении защищенными пенициллинами (15 и 37 % соответственно) (Henry D. et al., 1995).
В Украине было проведено многоцентровое исследование «ЦефПросто» по изучению эффективности цефподоксима проксетила (Цефодокс) в стартовой терапии внебольничных пневмоний у детей. Данное исследование проходило на базе 8 клинических центров, в нем приняли участие 225 пациентов в возрасте от 5 месяцев до 18 лет, госпитализированных в педиатрическое отделение стационара с диагнозом «нетяжелая внебольничная пневмония». Исследование показало высокую эффективность Цефодокса у 198 детей (88 %), умеренная эффективность отмечалась в 23 случаях (10,2 %), и только у 4 пациентов (1,8 %) была проведена замена на другой антибактериальный препарат. Также был отмечен хороший профиль безопасности Цефодокса: переносимость отмечена как «очень хорошая» у 95,5 %, «хорошая» — у 0,5 % и «удовлетворительная» — у 4 %. Гастроинтестинальные проявления, не требующие отмены препарата, зарегистрированы лишь у 4,5 % детей.
В 2007 году В.В. Бережным и соавт. было проведено исследование по изучению эффективности терапии гнойных синуситов у детей препаратом Цефодокс в сравнении с амоксициллином и клавулановой кислотой. Все пациенты (40 детей) были разделены на две равные группы. В первой группе (n = 20) после курса Цефодокса выздоровление отмечалось в 90 % случаев и клиническое улучшение — в 10 %. Побочных реакций зафиксировано не было. Во второй группе (n = 20) у пациентов, принимающих амоксициллин, выздоровление произошло у 75 %, клиническое улучшение — у 20 % и без динамики — у 5 %. Побочные реакции в виде диареи отмечались у 3 детей, аллергической сыпи — у 1.
В проспективном исследовании «Центр» изучалась эффективность ступенчатой терапии Цефодоксом в лечении 87 госпитализированных пациентов с внебольничной пневмонией. Показано, что применение терапии с использованием Цефодокса было эффективным у 93,1 % больных с внегоспитальной пневмонией. Лечение продемонстрировало и хорошую переносимость. Лишь у 2 (2,3 %) больных развились умеренные по выраженности побочные эффекты, не требующие отмены препарата.
По данным Ю.И. Фещенко и соавт. (2012), изучавших применение цефалоспоринов в ступенчатой терапии внегоспитальной пневмонии, установлено, что Цефодокс обладает минимальным риском развития дисбиоза кишечника.
С докладом «Бактериальные осложнения острых респираторных инфекций у детей: принципы и реалии антибиотикотерапии» выступила заведующая кафедрой педиатрии Украинской медицинской стоматологической академии (г. Полтава), доктор медицинских наук, профессор Татьяна Александровна Крючко.
Инфекции дыхательных путей — наиболее часто встречающиеся в амбулаторной практике. Ежегодно они уносят жизни 4,5 миллиона людей, многие из которых дети. В общемировом масштабе смертность от этой патологии составляет около 6 %.
На сегодняшний день актуальной является проблема нерационального использования антибиотиков. С одной стороны, существует необоснованно широкое применение антибактериальных препаратов при вирусных респираторных инфекциях, не осложненных бактериальной микрофлорой, проведение агрессивной антибиотикотерапии резерва при нетяжелых инфекциях. С другой стороны, отмечается неоправданный отказ от их применения при отитах и ангинах.
Нерациональное использование антибиотиков привело к появлению и широкому распространению антибиотикорезистентности микроорганизмов, устойчивых к нескольким классам антибактериальных препаратов (множественнорезистентных штаммов). По данным крупномасштабного исследования, проведенного в США (2008), использование антибиотиков в кормах сельскохозяйственных животных — фактор распространения резистентных штаммов (70 % валового производства антибактериальных препаратов потребляет сельское хозяйство). Кроме этого, пары антибиотиков встречаются в окружающей среде, например вблизи крупных фармацевтических заводов, в манипуляционных помещениях, стационарах.
За последнее десятилетие доказана роль бактериальных биопленок в развитии целого ряда инфекций человека. По данным Центра по контролю заболеваемости США, до 65 % заболеваний человека может быть связано с формированием биопленок. Отличительной особенностью бактерий, существующих в составе сообществ биопленки, является повышенная (в 50–500 раз) резистентность к антибактериальным препаратам. Так, в России 16 % штаммов P.aeruginosa в ОРИТ устойчивы ко всем доступным антибиотикам.
Другой проблемой антибиотикотерапии является сокращение исследований и разработок новых антибиотиков. Это связано с тем, что разработка зарегистрированного препарата занимает в среднем 8 лет и обходится компании в 400–800 миллионов долларов США. Поэтому экономически более привлекательным является создание новых препаратов для лечения хронических заболеваний, которые требуют более длительных курсов терапии, таких как гиперхолестеринемия, артериальная гипертензия, психические расстройства и артриты.
По результатам анализа тенденций в разработке антимикробных препаратов, проведенного B. Spellbergс и соавт., количество одобренных препаратов в период с 1998 по 2002 г. по сравнению с периодом 1983–1987 гг. сократилось на 56 %. В стадии разработки находилось 418 лекарственных средств, из них 315 относились к так называемым «новым молекулам». Только 31 препарат (10 %) относился к категории антиинфекционных средств, среди них 5 (1,6 %) — новые антибиотики. Причем ни один из этих антибиотиков не характеризовался новым механизмом действия.
Важным аспектом терапии является достижение эрадикации возбудителя. При этом обеспечивается максимальная клиническая эффективность и минимальный потенциал селекции резистентности. Неадекватная антибиотикотерапия влечет за собой отсутствие эрадикации патогена, рост резистентности, что приводит к ее распространению и селекции резистентных штаммов.
Поэтому необходимо руководствоваться стратегией рационального использования антибиотиков, в том числе и при респираторных инфекциях у детей:
- мощная стратегия «лечи сразу правильно»;
- пероральный путь приема антибиотика при нетяжелых инфекциях;
- ступенчатая терапия при более тяжелых инфекциях;
- принцип минимальной достаточности;
- использование технологии пролекарств.
Главные цели оптимизации антибактериальной терапии: повышение эффективности, предотвращение возникновения резистентности, преодоление имеющейся резистентности и фармакоэкономические преимущества.
Абсолютными показаниями к назначению антибактериальных средств являются: острый гнойный синусит; обострение хронического синусита; острый стрептококковый тонзиллит; паратонзиллит; эпиглоттит; пневмония. Дифференцированного подхода к антибактериальной терапии требуют острые средние отиты у детей до 6 месяцев и обострение хронического тонзиллита.
При выборе антибактериальной терапии необходимо учитывать: высокую природную чувствительность возбудителей, отсутствие значимой приобретенной резистентности, высокую клиническую эффективность, хорошую безопасность и переносимость, отсутствие селекции и распространения резистентных организмов, минимальную стоимость.
Тактика стартовой этиотропной терапии легких и среднетяжелых клинических форм бактериальных инфекций верхних отделов респираторного тракта должна зависеть от вида возбудителя. При фарингите и ангине, как правило, основным возбудителем является Streptococcus pyogenes (гемолитический стрептококк группы А). Поэтому в качестве антибактериальной терапии целесообразно назначение природного пенициллина (пероральные формы). Альтернативными препаратами являются макролиды или триметоприм/сульфаметоксазол. Основные возбудители синуситов и острых средних отитов — Streptococcus pyogenes, H.influenzaе, M.catarrhalis. К препаратам выбора относятся защищенные пенициллины (пероральные формы) либо цефалоспорины I, II поколений. При возникновении аллергии возможно назначение триметоприма/сульфаметоксазола или комбинации «макролиды + сульфизоксазол».
Применение пероральных цефалоспоринов при антибиотикотерапии инфекций дыхательных путей имеет несомненные преимущества, такие как:
- низкая частота резистентности;
- широкий спектр антимикробного действия;
- устойчивость к действию многих лактамаз;
- бактерицидный механизм действия;
- хорошая переносимость и низкая частота побочных эффектов;
- простота и удобство дозирования.
Кроме того, следует учесть, что аллергические реакции на цефалоспорины встречаются реже, чем на антибиотики пенициллинового ряда. В соответствии со степенью риска аллергических реакций цефалоспорины можно расположить в следующем порядке (Викторов А.П., 2006): цефтриаксон > цефоперазон > цефокситин > цефтазидим > цефотаксим > цефуроксим.
Пероральные цефалоспорины I поколения воздействуют преимущественно на грамположительные микроорганизмы. Поэтому основными показаниями к их назначению могут быть острые тонзиллиты, фарингиты, отиты, синуситы, бронхиты, неосложненные инфекции кожи и мягких тканей, а также острый гнойный артрит, в этиологии которого доминируют стафилококки.
К цефалоспоринам II поколения (цефуроксима аксетил, Цефутил) чувствительны Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae, Branhamella catarrhalis, Escherichia coli, Klebsiella pneumoniaе, Nisseria gonorrhoeae, Borrelia burgdorferi и др. Поэтому их применяют при инфекциях верхних и нижних отделов дыхательной системы, инфекции мочевой системы, инфекции кожи и мягких тканей. Основным отличием цефалоспоринов II генерации от I поколения является более высокая активность против грамотрицательной флоры.
Особенности цефалоспоринов III поколения (цефподоксима проксетил, Цефодокс):
- более высокая активность in vitro в отношении Enterobacteriaceae;
- благоприятные фармакологические свойства и хорошее проникновение в ткани;
- высокая активность в отношении различных беталактамаз;
- хорошие фармакокинетические свойства — высокая биодоступность и длительный период полувыведения;
- повышенная активность в отношении синегнойной палочки.
Результаты первого многоцентрового исследования «ЦефПросто» в Украине показали высокую эффективность и переносимость цефподоксима проксетила (Цефодокс) в лечении детей с нетяжелыми внегоспитальными пневмониями.