Газета «Новости медицины и фармации» 1-2 (485-486) 2014
Вернуться к номеру
Диагностика и лечение бронхиальной астмы. Часть 2
Авторы: Дядык А.И., Ефременко В.А., Вишнивецкий И.И., Цыба И.Н., Бабанина Т.В., Щукина Е.В. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Семейная медицина/Терапия, Аллергология , Пульмонология
Разделы: Медицинское образование
Версия для печати
Статья опубликована на с. 28-31 (Укр.)
Лечебная тактика при бронхиальной астме
Целью успешного ведения больных бронхиальной астмой (БА) являются:
— устранение и профилактика симптомов заболевания;
— достижение хорошего качества жизни;
— уменьшение потребности в применении b2-агонистов;
— по возможности сохранение легочной функции, близкой к нормальной;
— профилактика обострений;
— снижение риска побочных эффектов проводимой терапии;
— снижение смертности.
Общие вопросы лечебной тактики
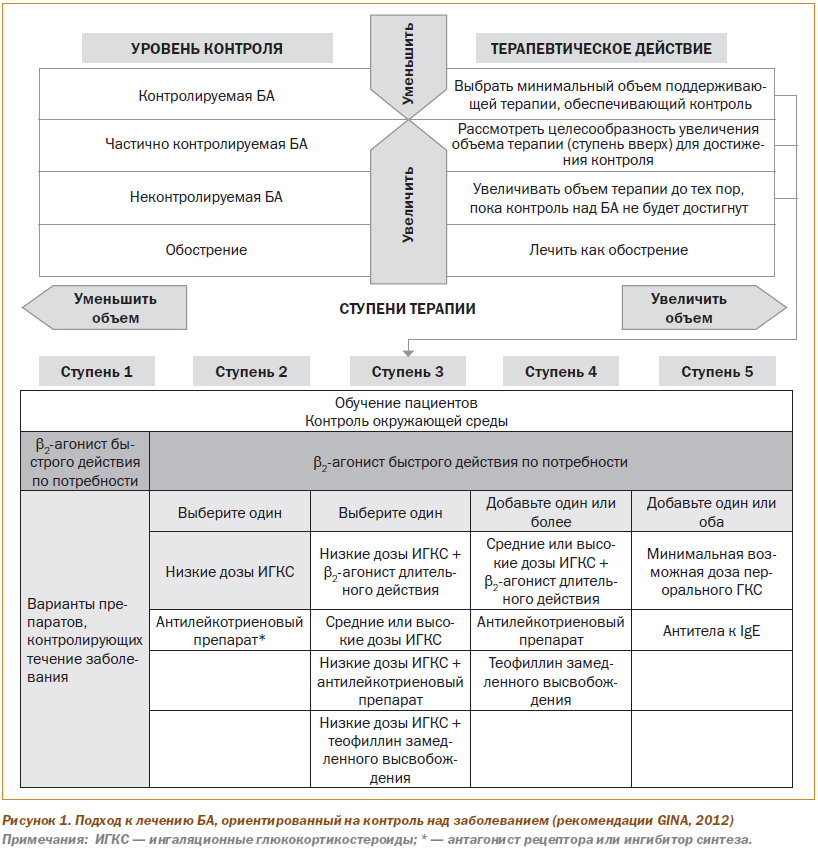
Каждому пациенту назначают лечение, соответствующее одной из пяти ступеней, или шагов, терапии. Традиционно в русскоязычной среде слово «ступень» использовалось для обозначения тяжести БА и объема необходимой терапии. Однако после 2006 года новый подход к ступенчатой терапии БА перестал быть привязан к тяжести БА. Поэтому во избежание путаницы часто понятие «ступень» используют применительно к тяжести БА, а термин «шаг терапии» — к интенсивности лечения. В данной публикации эти термины используются взаимозаменяемо. На рис. 1 представлена терапия БА на каждом шаге.
На любом шаге терапии пациенты должны использовать по потребности препараты неотложной помощи для быстрого облегчения симптомов, предпочтительнее b2-агонисты короткого действия (БАКД). К альтернативным (менее предпочтительным) препаратам для облегчения симптомов относятся ингаляционные антихолинергические средства, некоторые b2-агонисты длительного действия и теофиллин короткого действия. На шагах 2–5 пациенты дополнительно нуждаются в применении одного или более базисных препаратов.
У большинства больных с впервые выявленной БА или ранее не получавших препаратов базисной терапии следует начинать лечение со 2-го шага терапии (или 3-го — при наличии тяжелых симптомов). Показано, что даже такой малоинтенсивный режим лечения обеспечивает достижение контролируемого состояния заболевания у большинства пациентов. Обычно пациенты посещают врача через 1–3 мес. после первичного визита, затем каждые 3–6 мес. После обострения назначают визит последующего наблюдения в срок от 2 нед. до 1 мес.
Если на фоне текущей терапии БА не контролируется, следует увеличить объем терапии (перейти на следующую ступень). Обычно развернутый эффект от увеличения объема терапии и клинически значимое улучшение наступают в течение 1 мес.
При частично контролируемой БА также следует рассмотреть возможность расширения объема терапии (увеличение на одну ступень). При этом необходимо взвешивать безопасность и стоимость лечения и удовлетворенность пациента достигнутым уровнем контроля над заболеванием.
Если пациент не достигает приемлемого уровня контроля над бронхиальной астмой на фоне лечения, соответствующего 4-му шагу, можно считать, что пациент страдает БА, трудно поддающейся лечению. У таких пациентов допустимо достижение «достаточного» уровня контроля, который обеспечивал бы наилучший возможный контроль над заболеванием при наименьшем риске побочных эффектов терапии.
Если контроль поддерживается в течение 3 мес. и более, следует постепенно уменьшать объем лечения, переходя на более низкий шаг терапии. При этом целью является достижение наименьшего возможного объема лечения, обеспечивающего поддержание контроля над БА.
Даже после достижения контроля необходимо продолжать мониторирование, так как БА представляет собой вариабельное заболевание, при котором периодически требуется коррекция терапии в ответ на утрату контроля, проявляющуюся ухудшением течения заболевания или развитием обострения.
Характеристика медикаментов и других подходов, применяемых при лечении БА
Для достижения целей лечения БА используют как фармакологические, так и нефармакологические лечебные подходы.
Лекарственные препараты, используемые при лечении больных с БА, классифицируются на базисные, обеспечивающие контроль заболевания (от англ. controllers), и симптоматические (от англ. relievers), устраняющие кратковременные ухудшения симптоматики БА.
Базисная терапия характеризуется ежедневным приемом лекарственных препаратов в течение неопределенно длительного времени с целью клинического контроля БА благодаря преимущественно противовоспалительным эффектам; симптоматическая терапия — приемом быстродействующих препаратов для устранения бронхоспазма и связанных с ним симптомов.
Пути введения лекарственных препаратов включают ингаляционные, пероральные и парентеральные (внутривенные, подкожные и внутримышечные). Преимущество ингаляционного приема препарата обусловлено его непосредственным поступлением в дыхательные пути и созданием при этом эффективных местных концентраций, что снижает риск развития или уменьшения выраженности побочных эффектов препарата.
Ингаляционные препараты для лечения БА представлены в виде различных доставочных устройств, различающихся по эффективности доставки лекарственного препарата в нижние дыхательные пути, а также простоте и доступности применения. Основные классы доставочных устройств — дозирующие аэрозольные ингаляторы (ДАИ) и их модификации (например, устройства, активируемые вдохом) и дозирующие порошковые ингаляторы (ДПИ). Представляет интерес также новое устройство типа soft mist, которое без использования пропеллента создает «медленное» мелкодисперсное облачко препарата, значительно улучшающее доставку. Достоинством ДАИ является невысокая цена, что делает их хорошим выбором для пациента, способного синхронизировать вдох и нажатие на распылитель. В противном случае могут быть использованы вспомогательные средства (спейсер) или другие типы доставочных устройств. Следует помнить, что у некоторых пациентов с тяжелой БА и снижением инспираторного резерва может снижаться эффективность применения ДПИ.
Эффективность доставки препарата в нижние отделы дыхательных путей зависит от таких факторов, как тип ингалятора и форма лекарственного средства, размер частиц, скорость аэрозольного потока или облачка и простота применения устройства. В связи с этим критически важным является выбор подходящего доставочного устройства, адекватное обучение пациента и регулярная проверка техники ингаляции.
Симптоматическая терапия
Симптоматическая терапия бронходилататорами направлена на быстрое устранение бронхоконстрикции и обусловленных ею симптомов, что достигается за счет релаксации гладкой мускулатуры дыхательных путей. Бронходилататоры действуют преимущественно на гладкую мускулатуру дыхательных путей, что ведет к быстрому устранению симптомов, оказывая в лучшем случае незначительный противовоспалительный эффект.
В современной практике применяется три класса бронходилататоров: b2-адренергические агонисты, антихолинергические препараты и теофиллин, среди которых наиболее эффективны b2-агонисты.
b2-агонисты короткого действия (БАКД). Короткодействующие b2-агонисты являются средством выбора для устранения бронхоспазма при остром приступе астмы или, в некоторых случаях, для его профилактики. К ним относятся сальбутамол, тербуталин, фенотерол. Продолжительность их действия составляет 3–6 часов.
b2-агонисты активируют b2-адре-нергические рецепторы, широко представленные в дыхательных путях. При их стимуляции увеличивается внутриклеточный циклический АМФ, релаксирующий гладкомышечные клетки и ингибирующий некоторые клетки воспалительного каскада.
Ведущим механизмом действия b2-агонистов является релаксация гладко-мышечных клеток всех дыхательных путей, где они действуют в качестве функциональных антагонистов, устраняя и превентируя бронхоконстрикцию. Такой эффект обусловливает их высокую эффективность в качестве бронходилататоров при астме. Кроме того, b2-агонистам присущ ряд небронходилатирующих эффектов, включающих ингибирование освобождения медиаторов тучных клеток, снижение экссудации плазмы и ингибирование активации сенсорных нервов. В отличие от глюкокортикоидов b2-агонисты не оказывают эффект на воспалительные клетки в дыхательных путях и не снижают их гиперчувствительность.
Эффекты b-адренергических агонистов на дыхательные пути:
— Релаксация гладкой мускулатуры в проксимальных и дистальных отделах дыхательных путей.
— Ингибирование освобождения медиатора тучных клеток.
— Ингибирование экссудации плазмы и развития отека дыхательных путей.
— Увеличение мукоцилиарного клиренса.
— Увеличение секреции слизи.
— Уменьшение кашля.
— Не оказывают эффект на хроническое воспаление.
Ингаляции БАКД обычно используются для быстрого устранения симптомов БА. Необходимость в их частом применении свидетельствует о недостаточном контроле БА, требующем коррекции базисной терапии.
Развитие побочных эффектов при использовании ингаляционных b2-агонистов в большинстве случаев не является проблемой. Иногда (более характерно для пожилых) развиваются тремор, тахикардия и аритмии. У части больных наблюдается незначительное снижение плазменного калия. Этот эффект не представляет серьезной клинической проблемы и не требует назначения препаратов калия.
У больных, которые не способны принимать ингаляционные препараты, допустимо применение пероральных БАКД. Однако при этом наблюдается существенное увеличение частоты и тяжести побочных эффектов.
Антихолинергические препараты. Короткодействующие антихолинергические препараты, используемые при БА, включают ипратропиум бромид и окситропиум бромид. Их способность устранять бронхоконстрикцию уступает таковой БАКД. В метаанализе исследований, где ингаляционный ипратропиум бромид применялся в комбинации с БАКД у больных с обострением БА, было показано, что дополнительное назначение ипратропиума ассоциировалось со статистически значимым, хотя и умеренным улучшением легочной функции и существенным снижением риска повторных госпитализаций. Преимущества ипратропиума над БАКД при длительном применении не установлены. При тяжелом обострении БА антихолинергические препараты следует применять только после БАКД, так как они характеризуются медленным началом бронходилатации. Вместе с тем ипратропиум может служить альтернативным бронходилататором для больных со значительными побочными эффектами от БАКД, включающими тремор, тахикардии и аритмии.
Побочные эффекты ингаляционных ипратропиума и окситропиума включают сухость и горький вкус во рту. У пожилых больных иногда наблюдаются задержка мочи и развитие или усугубление глаукомы.
Теофиллин. В течение длительного времени пероральный теофиллин широко использовался в качестве бронходилататора. В настоящее время ведущую позицию в лечении БА заняли ингаляционные b2-агонисты благодаря своему мощному бронходилатирующему эффекту и меньшей частоте побочных эффектов.
Непролонгированные формы теофиллина у некоторых больных могут быть использованы для устранения симптомов. У лиц, получающих b2-агонисты, они не оказывают никакого дополнительного бронходилатирующего эффекта.
Эуфиллин (растворимая соль теофиллина) ранее широко использовался внутривенно для устранения симптомов у больных с тяжелой БА. Сегодня его применение ограничивается случаями тяжелого обострения астмы, рефрактерного к высоким дозировкам БАКД.
Вопросы дозирования, безопасности и побочных эффектов теофиллина более детально раскрыты ниже в разделе, посвященном базисной терапии.
Системные глюкокортикоиды. Системные ГК не рассматриваются как симптоматические препараты. Они находят применение при тяжелых обострениях БА, что рассматривается в главе, посвященной лечебной тактике при обострениях заболевания.
Базисная терапия БА
Ингаляционные глюкокортикоиды (ИГК)
ИГК сегодня рассматриваются как наиболее эффективные противовоспалительные средства в лечении персистирующей БА. В многочисленных исследованиях продемонстрирована их способность уменьшать частоту и интенсивность симптомов астмы, улучшать качество жизни и показатели легочной функции, снижать гиперчувствительность дыхательных путей, контролировать воспалительные процессы в них, снижать частоту и тяжесть обострений и летальность.
Однако важно отметить, что ИГК не излечивают астму и после прекращения их использования у многих больных наблюдается возвращение симптомов и ухудшение течения заболевания (ухудшение качества жизни и показателей легочной функции, увеличение риска обострений и связанных с ними осложнений).
Различные ИГК различаются по их активности и биодоступности. Однако эти различия не ассоциируются с заметными различиями в клинической эффективности.
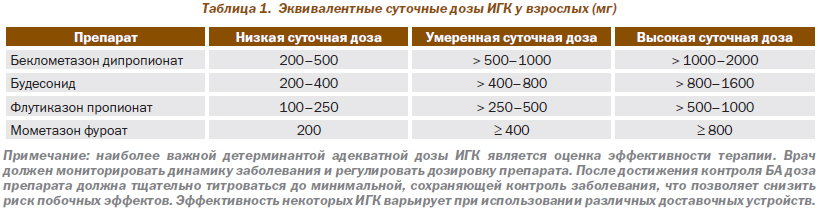
В табл. 1 показаны приблизительно эквивалентные дозы различных ИГК, базирующиеся на данных исследований.
В большинстве случаев желаемый эффект ИГК у взрослых больных достигается при использовании низких дозировок, эквивалентных 400 мг будесонида в сутки. Увеличение дозировок не всегда улучшает контроль БА, но ассоциируется с увеличением риска побочных эффектов. Следует подчеркнуть довольно широкую вариабельность эффекта ИГК у различных больных, что требует индивидуального подхода к выбору оптимальной дозировки. Часть больных с тяжелой БА нуждается в длительном применении высоких дозировок ИГК, что обеспечивает хороший контроль заболевания.
У курящих больных снижается эффект ИГК, что обычно требует увеличения дозировок.
При недостаточном контроле БА под влиянием низких или умеренных дозировок обычно следует не увеличивать их дозировку, а назначить дополнительно другой класс базисных препаратов.
Побочные эффекты ИГК. Локальные побочные эффекты ИГК включают орофарингеальный кандидоз, дисфонию и реже — кашель, обусловленный раздражением верхних дыхательных путей. Новые доставочные устройства снижают риск этих побочных эффектов. Риск развития орального кандидоза снижается при полоскании рта водой после ингаляции.
Поступающие в легкие ИГК в определенной мере проявляют системную биодоступность. Развитие системных побочных эффектов, их характер и выраженность при лечении ИГК зависят от многих факторов, включающих дозу и активность препаратов, системную биодоступность, конверсию в неактивные метаболиты в печени и периода полувыведения системно абсорбированных глюкокортикоидов. Следовательно, системные побочные эффекты неоднозначны для различных ИГК. В ряде исследований продемонстрированы менее выраженные системные эффекты у будесонида, циклесонида и флутиказона пропионата. Представлены убедительные доказательства, что у взрослых, получающих будесонид в дозе 400 мг и менее в сутки, системные побочные эффекты препарата не являются клинически значимыми.
Системные побочные эффекты, риск развития которых увеличивается у больных, длительно принимающих максимальные дозы ИГК, включают надпочечниковую недостаточность, снижение минеральной костной плотности, остеопороз, повышенный риск переломов, кушингоид и др. Имеются неоднозначные доказательства относительно риска развития катаракты, глаукомы и легочных инфекций, включая туберкулез. Тем не менее считается общепризнанным, что они не противопоказаны больным с активным туберкулезом.
Антилейкотриеновые препараты (АЛП)
АЛП включают антагонисты CysLT1-рецепторов цистеиниловых лейкотриенов (монтелукаст, пранлукаст и зафирлукаст), а также ингибитор 5-липооксигеназы (зилеутон).
АЛП обладают слабым и вариабельным бронходилатирующим эффектом, уменьшают тяжесть симптомов, включая кашель, улучшают показатели легочной функции, снижают воспаление в дыхательных путях и риск обострений БА. Они могут быть альтернативой ИГК для лечения пожилых больных с легкой персистирующей БА, а также для лиц с аспириновой астмой. АЛП менее эффективны в достижении контроля БА, чем низкие дозы ИГК. Не рекомендуется назначать АЛП вместо ИГК, так как это может привести к утрате контроля БА.
У больных с умеренной или тяжелой БА АЛП могут использоваться в качестве дополнительной базисной терапии к ИГК, позволяя при этом снижать высокие дозировки последних. Однако в качестве дополнения к терапии ИГК они уступают в эффективности ингаляционным b2-агонистам продленного действия (БАДД).
Побочные эффекты. АЛП характеризуются хорошей переносимостью, побочные эффекты характеризуются как несущественные.
Ингаляционные b2-агонисты длительного действия
БАДД, включая формотерол и сальметерол, не рекомендуется использовать в качестве монотерапии при БА, так как они не оказывают противовоспалительный эффект в дыхательных путях. БАДД более эффективны в комбинации с ИГК. Такая комбинация особенно предпочтительна в случаях, когда умеренные дозы ИГК не способны обеспечить достаточный контроль БА.
Комбинация ИГК с БАДД снижает или устраняет клинические проявления астмы, улучшает показатели легочной функции, снижает необходимость в применении b2-агонистов короткого действия, уменьшает риск обострений и частоту госпитализаций, а также позволяет достигать контроля БА у большего числа больных в более короткие сроки при более низких дозах ИГК, чем при их самостоятельном применении.
Представленные выше преимущества комбинированного применения ИГК с БАДД послужили основанием для создания ингаляторов, содержащих фиксированные комбинации ИГК с БАДД (например, флутиказона пропионат с сальметеролом; будесонид с формотеролом; беклометазон с формотеролом). Такие фиксированные комбинации характеризуются более существенным преимуществом по сравнению с самостоятельным применением ИГК и БАДД, повышают приверженность больных к лечению. Кроме того, ингаляторы, содержащие фиксированную комбинацию формотерола и будесонида, могут использоваться одновременно как для купирования симптомов (reliever), так и для регулярной базисной терапии (controller). Такой режим применения одного и того же ингаляционного средства получил название SMART-терапии (Single Inhaler Maintenance and Reliever Therapy).
БАДД, применяемые в комбинации с ИГК, способны эффективно превентировать бронхоспазм, индуцированный физической нагрузкой.
Сальметерол и формотерол обеспечивают примерно равную по продолжительности бронходилатацию. Однако формотерол проявляет бронходилатирующий эффект более быстро, чем сальметерол, что позволяет использовать его как для устранения симптомов БА, так и для их профилактики.
Побочные эффекты. Применение БАДД может быть связано с риском развития ряда побочных эффектов, включающих тахикардию, аритмии, тремор и гипокалиемию. Регулярное использование b2-агонистов (короткого и продленного действия) может привести к снижению чувствительности к ним. В ряде метаанализов показано незначительное увеличение риска смертности у больных БА, получавших БАДД в комбинации с ИГК, по сравнению с лицами, получавшими монотерапию ИГК. Однако способность комбинации ИГК с БАДД надежно контролировать течение БА, снижать частоту обострений и улучшать показатели легочной функции служит важным аргументом в необходимости дополнительного назначения БАДД к ИГК у большинства больных БА.
Тиотропий
Тиотропий — ингаляционный антихолинергический препарат продленного действия, ингибирующий констрикцию гладкомышечных клеток и секрецию слизистой бронхов. Кроме того, представлены доказательства способности тиотропия оказывать противовоспалительный эффект в дыхательных путях.
В течение десятилетий антихолинергические агенты широко используются для лечения больных с хроническими обструктивными заболеваниями легких (ХОЗЛ). Многие клиницисты относят антихолинергические средства к бронходилататорам первой линии при ХОЗЛ. В лечении БА антихолинергические препараты менее популярны, что, очевидно, связано с медленным началом их действия и менее выраженным бронходилатирующим эффектом по сравнению с БАДД.
Дополнительное применение тиотропия у больных с тяжелым течением БА, где комбинация ИГК с БАДД не способна обеспечить оптимальный контроль БА, изучено в нескольких небольших исследованиях, результаты которых неоднозначны. В одном крупном исследовании (912 больных с неконтролируемой БА на фоне применения комбинации ИГК с БАДД) продемонстрировано благоприятное влияние дополнительного назначения ингаляционного тиотропия. В группе пациентов, получавших в дополнение к ИГК/БАДД тиотропий, имела место существенная пролонгация времени до обострения БА и более выраженная бронходилатация, чем в группе лиц, получавших плацебо.
Теофиллин
Теофиллин имеет слабую бронходилатирующую эффективность. При применении в низких дозировках оказывает также небольшое противовоспалительное действие в дыхательных путях. Данные о способности таблетированного теофиллина продленного действия длительно и успешно контролировать БА отсутствуют. Он может применяться дополнительно к терапии ИГК, если не достигается достаточный контроль заболевания. Отмена теофиллина в такой комбинации может сопровождаться ухудшением контроля БА. При комбинации с ИГК теофиллин менее эффективен, чем БАДД.
Побочные эффекты. Применение теофиллина в дозе 10 мкг/кг/сут и более может сопровождаться довольно существенными побочными эффектами. В связи с этим необходим тщательный подбор дозы препарата. Побочные эффекты включают гастроинтестинальные симптомы, тахикардию, различные аритмии. Увеличение плазменных уровней теофиллина часто сопровождается увеличением риска развития побочных эффектов при заболеваниях печени, застойной сердечной недостаточности, одновременном приеме ряда лекарственных препаратов (циметидин, хинолоны, макролиды).
Кромоны: кромогликат натрия и недокромил натрия
Роль кромогликата натрия и недокромила натрия в лечении БА очень ограничена. Имеются сообщения об их эффективности у больных с легкой астмой и при постнагрузочном бронхоспазме. Их противовоспалительный эффект слабый и значительно уступает ИГК.
Побочные эффекты не существенны и включают кашель, проявляющийся во время ингаляции, и раздражение слизистой оболочки глотки.
Антитела к IgE
Применение анти-IgE-антител (омализумаб) ограничивается больными с тяжелой БА и высокими сывороточными уровнями IgE, у которых использование ИГК не способно обеспечить достаточный контроль заболевания. Применение омализумаба в комбинации с ИГК безопасно.
Системные глюкокортикоиды
Длительное применения (более 2 недель) пероральных СГК ограничивается редкими случаями тяжелой БА, не контролируемой общепринятыми лечебными подходами. Длительное применение СГК ограничено развитием тяжелых побочных эффектов, включающих развитие остеопороза, спонтанных переломов, сахарного диабета, артериальной гипертензии, ожирения, мышечной слабости, гипокалиемии, истончение кожи, угнетение гипоталамо-гипофизарно-надпочечниковой системы. Пациентам, вынужденным длительно принимать СГК, следует также принимать препараты для профилактики остеопороза.
Другие лечебные подходы, предлагаемые для контроля БА
С целью уменьшения побочных эффектов глюкокортикоидов делаются попытки их комбинации с препаратами цитотоксического действия (например, метотрексатом). Однако существенные побочные эффекты метотраксата и не подтвержденный в крупных контролируемых исследованиях эффект не позволяют сегодня рекомендовать его в широкой клинической практике.
Эффективность длительного применения макролидов при БА активно изучается. Сделать вывод об обоснованности их применения можно будет только после окончания крупных исследований.
Аллергенспецифическаяиммунотерапия (АСИТ)
Роль АСИТ в лечении БА у взрослых ограничена. Для проведения адекватной иммунотерапии необходимо знать клинически значимые антигены у конкретного пациента. С целью формирования толерантности вводятся специфические аллергены в нарастающих дозах. По данным крупного Кокрановского метаанализа (75 контролируемых рандомизированных исследований), у больных с БА специфическая иммунотерапия показала благоприятный эффект по сравнению с плацебо, включающий снижение количества и тяжести симптомов, потребности в медикаментах для базисной терапии, а также гиперреактивности дыхательных путей. Однако представленный благоприятный эффект заметно уступает традиционным медикаментозным подходам при лечении БА. Кроме того, применение АСИТ сопряжено с рядом побочных эффектов (местных и системных). Системные побочные эффекты включают анафилактические реакции, тяжелое обострение БА. Описаны летальные исходы у больных с БА при применении АСИТ.
Возможность применения АСИТ может быть рассмотрена у пациентов, у которых тщательная элиминация аллергенов и традиционная базисная терапия с применением ИГК не позволили достигнуть контроля БА.
Ведение обострений БА
Современное определение обострений БА приведено в рекомендациях Американского торакального общества и Европейского респираторного общества по определению контроля и обострений астмы (2009) и рекомендациях GINA (2012): «Обострения БА — острые или подострые эпизоды прогрессирования симптомов БА (одышки, кашля, свистящего дыхания, скованности грудной клетки или их сочетания) относительно привычного для пациента уровня. Эти эпизоды принципиально отличаются от неудовлетворительного контроля астмы: при обострении БА обычно отсутствует значительная суточная вариабельность показателей скорости воздушного потока (ключевой маркер неудовлетворительного контроля БА), но наблюдается их снижение по сравнению с состоянием до обострения.»
Можно отметить, что в современных клинических рекомендациях подчеркнута практическая невозможность отличить легкие обострения астмы (ОА) от транзиторной утраты контроля БА.
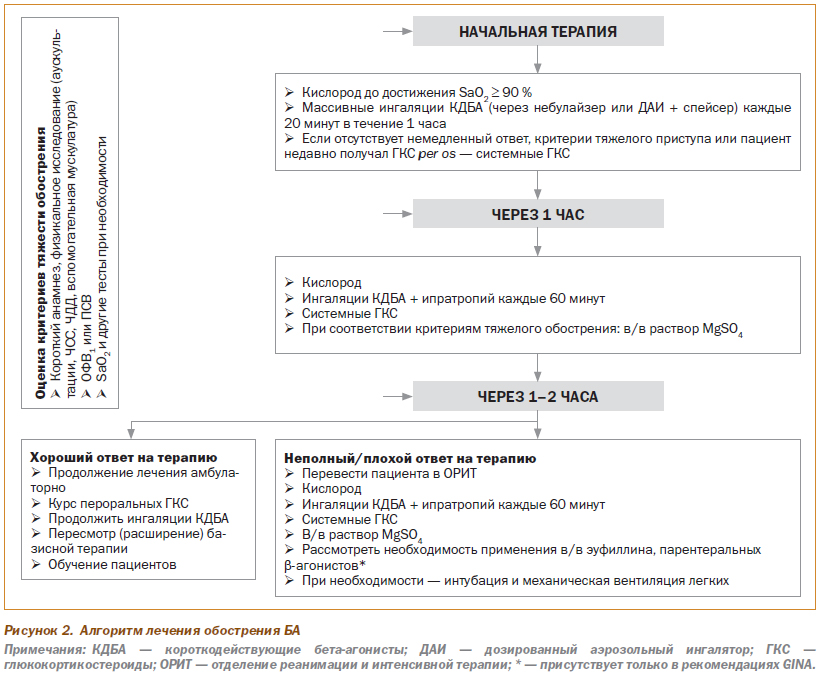
Алгоритм лечебной тактики при ОА представлен на рис. 2.
Лечение обострений БА преследует следующие цели: 1) поддержание адекватной сатурации кислорода, 2) улучшение функции внешнего дыхания и 3) уменьшение воспаления в бронхах для ускорения разрешения бронхиальной обструкции и предотвращения рецидива обострения. Для достижения этих целей применяют ряд обсуждаемых ниже лечебных подходов.
БАКД занимают ведущее место в терапии ОА. Сальбутамол, применяемый в виде как ДАИ, так и раствора для небулизации, благодаря своей высокой бронходилатирующей эффективности, быстрому началу действия и хорошей переносимости является наиболее часто используемым БАКД во всем мире. Во всех современных рекомендациях подчеркивается, что ингаляционные БАКД должны получать все пациенты с обострениями БА, ввиду того что «…это самый эффективный способ устранения бронхиальной обструкции. Примерно у 60–70 % пациентов наблюдается достаточная бронходилатирующая эффективность и хорошая переносимость повторных доз БАКД уже на начальном этапе оказания помощи при ОА» (GINA, 2012). При купировании ОА используются высокие дозы БАКД. В случае использования небулайзерных ингаляций обычно применяют сначала 5 мг сальбутамола (2 небулы), затем через каждые 20 минут дополнительно по 2,5 мг (по 1 небуле). При использовании сальбутамола в виде ДАИ со спейсером также используют высокие дозы. На начальном этапе терапии обычно применяют до 1200 мкг в течение первого часа. Обученный использованию ДАИ со спейсером медперсонал отмеряет по 1 дозе сальбутамола в спейсер, контролирует правильность вдоха пациентом и повторяет это еще 3 раза до достижения общей дозы 400 мкг. В дальнейшем такая последовательность повторяется каждые 20 минут. На следующих этапах доза сальбутамола может быть увеличена (в зависимости от тяжести обструкции) до 6–10 вдохов через спейсер каждый час.
Использование высоких доз b2-аго-нистов при тяжелой обструкции объясняется необходимостью преодоления существенных анатомических препятствий (отек слизистой, спазм, скопления слизи в просвете бронхов), а также дозозависимым характером эффективности БАКД. Безопасность таких доз подтверждена длительной клинической практикой и обширной доказательной базой. Убедительно доказано, что даже удвоение рекомендуемой дозы сальбутамола (до 2,4 мг в час, по 4 последовательные дозы через ДАИ + спейсер каждые 10 минут или по 2,5–5 мг каждые 20 минут через небулайзер) обеспечивает низкую сывороточную концентрацию и минимальное количество побочных эффектов.
У пациентов, у которых после начальной терапии сохраняется выраженная бронхиальная обструкция (ОФВ1 и ПСВ < 40–50 %), к лечению добавляются ингаляции ипратропия бромида. Установлено, что при тяжелом обострении БА он совместно с сальбутамолом заметно улучшает функцию внешнего дыхания. Применяется в виде ДАИ + спейсер последовательно до 8 доз или по 0,5 мг через небулайзер каждые 60 минут.
Обсуждая ингаляционную терапию короткодействующими бронходилататорами, уместно напомнить, что отсутствие у большей части украинских пациентов и врачей небулайзеров не является существенным препятствием для качественного лечения ОА. В ряде систематических обзоров показано, что корректное использование спейсеров (которые значительно более доступны и шире распространены) по эффективности ничем не уступает небулизации лекарственных веществ при любой степени тяжести ОА. Более того, есть данные, что использование ДАИ со спейсерами большого объема при адекватных дозах БАКД позволяет получить даже более быструю и выраженную бронходилатацию с меньшим количеством побочных эффектов по сравнению с небулайзерными ингаляциями. Это особенно ценно для пациентов с очень тяжелой обструкцией, которым необходимо наиболее быстро обеспечить доставку большой дозы БАКД (на ингаляцию необходимой дозы через ДАИ со спейсером затрачивается 1–2 минуты, тогда как на небулайзерную ингаляцию — в среднем 15–20 минут). Разумеется, использование обычного ДАИ без спейсера не имеет смысла, так как пациент с острой тяжелой бронхообструкцией обычно не в состоянии синхронизировать вдох с нажатием на клапан.
Глюкокортикоиды. Системные ГК являются основой противовоспалительной терапии при обострении БА и должны применяться у большей части пациентов, за исключением случаев очень легких ОА. Они не обладают непосредственным бронходилатирующим эффектом, но очень эффективно уменьшают выраженность воспаления в дыхательных путях, за счет чего способствуют ликвидации обструкции и ускоряют купирование обострения. При применении рекомендуемых доз системных ГК требуется не менее 6–8 ч до появления эффекта на показатели скорости воздушного потока. Такая временная задержка наступления эффекта связана с геномным механизмом действия системных ГК. Этим же обусловлено то, что пероральное и внутривенное применение системных ГК эквивалентно по скорости наступления и выраженности эффекта у большинства пациентов, из-за чего во всех рекомендациях по лечению обострений БА в/в введение системных ГК резервируется исключительно для пациентов с очень тяжелой обструкцией, у которых затруднено глотание. Рекомендуемые дозы системных ГК составляют 0,5–1 мг/кг/сутки (около 60 мг/сутки).
Не менее важна роль системных ГК для профилактики рецидивов обострения после восстановления бронхиальной проводимости. Поэтому их курс в дозе около 60 мг/сутки необходимо продолжить в течение 5–7 дней после нормализации состояния, что является обязательным компонентом лечебной программы при ОА. В рекомендациях GINA (2012) отмечено, что при курсе системных ГК такой продолжительности они могут быть отменены одномоментно, без постепенного снижения дозы.
Современные согласительные документы отводят следующее место ИГК в лечении обострений БА:
а) в очень высоких дозах (будесо-нид до 3200 мкг/сутки, флутиказон до 1500 мкг/сутки) — в качестве альтернативы курсу пероральных ГКС после стабилизации/выписки у пациентов:
1) с нетяжелым обострением БА;
2) способных корректно использовать ИГК;
3) плохо переносящих пероральные формы СГК;
b) в обычных дозах (с учетом step-up, расширения объема базисной терапии из-за обострения) — в качестве обязательного лечения, сопутствующего курсу пероральных ГКС.
Прочие медикаментозные подходы. Сульфат магнезии для в/в применения в дозе 2 г каждые 20 минут у взрослых и 25–75 мг/кг у детей (суммарно не более 2 г) улучшает вентиляционную функцию у пациентов с тяжелыми и жизнеугрожающими ОА, но не показан при нетяжелых ОА.
Применение внутривенного теофиллина (эуфиллина) для купирования бронхиальной обструкции при обострении БА в течение длительного времени являлось одним из ведущих подходов к лечению ОА. В то же время представлены убедительные доказательства, что эффективность метилксантинов в данной ситуации является менее чем скромной. Установлено, что применение эуфиллина значительно уступает ингаляционным БАКД по броходилатирующей активности. Добавление его к сальбутамолу дает дополнительный бронхолитический эффект только у 10 % пациентов, но в большинстве случаев вызывает увеличение частоты таких побочных эффектов, как тремор, тахиаритмии, тошнота, возбуждение и тревожность. В ряде случаев позиция международных экспертов относительно эуфиллина достаточно строга, в частности, четко указывается, что рутинное применение эуфиллина при ОА является недопустимым.
Не менее категоричны эксперты в отношении парентерального применения b2-аго-нистов (адреналина, раствора сальбутамола для инъекций), отмечая, что внутривенное применение b2-агонистов не имеет преимуществ перед ингаляционным путем введения, не обосновано доказательной базой и не должно применяться при ОА.
Агрессивная гидратационная терапия у взрослых и детей старшего возраста также не имеет под собой никаких доказательных обоснований и может применяться только у детей младшего возраста, у которых возможна дегидратация из-за тахипноэ и снижения потребления жидкости. У пациентов с ОА также не рекомендуется рутинное применение муколитиков, антибиотиков (в том числе макролидов), физиотерапии и седативных препаратов.