Журнал «Боль. Суставы. Позвоночник» 3 (15) 2014
Вернуться к номеру
Оцінка мікроархітектури хребта за допомогою TBS допомагає розрізнити пацієнтів з основними остеопоротичними переломами та контрольну групу залежно та незалежно від МЩКТ: Східноєвропейське дослідження TBS
Авторы: Васік Є. - Department of Physical Medicine and Rehabilitation, Railway Healthcare Center, Belgrade, Serbia; Петранова T. - Clinic of Rheumatology, Medical University, Sofia, Bulgaria; Поворознюк В. - Department of Clinical Physiology and Pathology of Locomotor Apparatus, D.F. Chebotarev; Institute of Gerontology NAMS Ukraine and Ukrainian Scientific-Medical Center for the Problems of Osteoporosis, Kiev, Ukraine; Барбу К.Г. - Department of Endocrinology, Carol Davila University of Medicine and Pharmacy, Bucharest, Romania; Караджич M. - Institute for Treatment and Rehabilitation «Niska Banja», Nis, Serbia; Гойкович Ф. - Department of Physical Medicine and Rehabilitation, Railway Healthcare Center, Belgrade, Serbia; Єлез Д. - Department of Internal Medicine, Railway Healthcare Center, Belgrade, Serbia; Вінзенрієс Р. - R&D Department, Med-Imaps, PTIB, Hopital Xavier Arnozan, Pessac, France; Ханс Д. - Bone Diseases Center, DAL, Lausanne University Hospital, Lausanne, Switzerland; Кулафік Воджіновіч Б. - Department of Internal Medicine, Railway Healthcare Center, Belgrade, Serbia; Пояна К. - Department of Endocrinology, Carol Davila University of Medicine and Pharmacy, Bucharest, Romania; Дзерович Н. - Department of Clinical Physiology and Pathology of Locomotor Apparatus, D.F. Chebotarev; Institute of Gerontology NAMS Ukraine and Ukrainian Scientific-Medical Center for the Problems of Osteoporosis, Kiev, Ukraine; Рашков Р. - Clinic of Rheumatology, Medical University, Sofia, Bulgaria; Діміч А. - Institute for Treatment and Rehabilitation «Niska Banja», Nis, Serbia;
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Новости
Версия для печати
Метою дослідження була оцінка клінічної ефективності моделі, що поєднує показники мінеральної щільності (МЩКТ) і мікроархітектури (TBS) кісткової тканини хребта, щодо виявлення остеопоротичних переломів. Східноєвропейське багатоцентрове дослідження (Сербія, Болгарія, Румунія, Україна) оцінювало роль TBS у рутинній клінічній практиці як доповнення до МЩКТ. Усі відскановані дані були отримані на денситометрах Hologic Discovery й GE Prodigy звичайним способом, що застосовується в клінічній практиці. Клінічні значення МЩКТ хребта і TBS для всіх типів остеопоротичних переломів (All-OP Fx) додатково були проаналізовані методом двохетапного дерева класифікації (МЩКТ супроводжувалось аналізом тертилів TBS). Були визначені чутливість, специфічність і точність виявлення переломів, а також був розрахований Net Reclassification Index (NRI). Дослідження включало 1031 жінку віком 45 років і старше з різних країн Східної Європи. Клінічні центри були перехресно відкалібровані за МЩКТ і TBS. Як і очікувалось, мінеральна щільність кісткової тканини хребта і TBS корелювали помірно (r2 = 0,19). Показник поширеності для всіх типів остеопоротичних переломів (All-OP Fx) становив 26%. Пацієнти з переломами мали значимо нижчі показники TBS і МЩКТ хребта, ніж особи без переломів (p = 0,01). Показник TBS асоціювався з наявністю переломів навіть після поправки на вік і МЩКТ хребта з OR (odds ratio) 1,27 [1,07–1,51]. Показники МЩКТ хребта за Т-критерієм –2,5 і нижче та TBS нижнього тертиля були подібні з погляду чутливості (35 проти 39%), специфічності (78 проти 80%) і точності (64 проти 66%). Комбінація МЩКТ хребта і TBS приводила до значного підвищення чутливості (+28%) і точності (+17%) порівняно з використанням тільки МЩКТ хребта, у той час як специфічність покращувалась помірно (+9%). Загальний коефіцієнт ефективності комбінації, визначений за допомогою NRI, становив 36%. Поєднане застосування МЩКТ хребта і TBS істотно зменшило кількість суб’єктів, які потребують додаткової діагностики МЩКТ, із 7 до 2. Ми показали, що в східноєвропейській когорті використання TBS як доповнення до МЩКТ хребта дозволяє правильно класифікувати більше ніж третину з усіх пацієнтів. Крім того, кількість осіб, які потребують додаткової діагностики, зменшилась до 2. Щоб оцінити вигоду використання TBS для системи охорони здоров’я, необхідно провести додаткові економічні дослідження.
остеопоротичний перелом, мінеральна щільність кісткової тканини, оцінка трабекулярної кісткової тканини, мікроархітектура кістки.
Статья опубликована на с. 9-19
Вступ
Остеопороз є поширеним захворюванням кісток, що призводить до збільшення їх крихкості й підвищення ризику переломів. Остеопороз характеризується зниженням кісткової маси та змінами в кістковій мікроархітектурі. У повсякденній клініній практиці золотим стандартом діагностики остеопорозу є визнаення мінеральної щільності кісткової тканини (МЩКТ) за допомогою двохенергетиної рентгенівської абсорбціометрії (ДРА). Традиційно МЩКТ вважається головним визнаальним инником міцності кісток і ризику переломів [1]. Тим не менше, було показано, що: 1) МЩКТ недостатньо для визнаення міцності кістки [2, 3]; 2) МЩКТ недостатньо для прогнозуванні переломів [4, 5]; 3) МЩКТ недостатньо для оцінки ефективності медикаментозної терапії [6]. Клюову роль у міцності кісток відіграє такий параметр, як мікроструктура кістки. Донедавна в повсякденній клініній практиці оцінити кісткову мікроструктуру було неможливо.
TBS є параметром, що характеризує сіру текстуру ДРА-зображень. TBS визнаає кількість локальних просторових варіацій відтінків сірого кольору 2D-зображення. TBS є різновидом експериментальної варіограми [9, 10]. Цей показник корелює зі стандартними параметрами 3D-мікроархітектури кістки, такими як щільність, зеплення й кількість трабекул, і негативно — з проміжками між трабекулами. Нещодавно [12] було показано, що TBS також обумовлює міцність кісток. У даному дослідженні автори показали, що TBS корелює зі SMI (r = –0,62, р = 0,01), а також індексом міцності кістки (r = 0,64, p = 0,007) незалежно від кісткової маси. TBS є непрямим методом оцінки трабекулярної структури, а також міцності кісток. Попередні дослідження показали додаткове клініне знаення TBS [13–20]. Було показано, що: 1) показник TBS здатний відрізняти осіб з переломами від осіб без переломів аналогіного віку, МЩКТ, навіть після поправки на індекс маси тіла [13–17]; 2) TBS може передбаити основні остеопоротині переломи так само, як МЩКТ, і використовуватися незалежно від цього показника [18–20]. Однак можливості використання TBS у щоденній клініній практиці ітко не визнаені.
Ми провели дане дослідження для перевірки можливостей TBS у виявленні всіх типів остеопоротиних переломів у східноєвропейській когорті. У цьому дослідженні ми зосередилися на клініному знаені комбінації TBS з МЩКТ, вираженому ерез показники утливості, специфіності, тоності, з урахуванням рекласифікації, обумовленої використанням TBS, і базуюись на показнику кількості суб’єктів, які потребують додаткової діагностики.
Матеріали і методи
Об’єкт дослідження
Ми провели ретроспективне нерандомізоване багатоцентрове дослідження за схемою «випадок — контроль». Відбір жінок проводили з використанням мединих баз даних шести центрів: Залізниного інституту охорони здоров’я в Белграді (Сербія), Ревматологіної клініки при мединому університеті в м. Софія (Болгарія), Інституту лікування та реабілітації в Нішка Баня (Сербія), Відділу клініної фізіології та патології опорно-рухового апарату в Києві (Україна) і «C.I. Parhon» та Клініки при лікарні Еліас, кафедра ендокринології Університету медицини й фармації Кароля Давіла в Бухаресті (Румунія). За період спостереження в шести центрах були відібрані 1762 жінки віком від 30 років і старше. У дослідження вклюалися жінки європеоїдної раси віком 45–85 років з індексом маси тіла (ІМТ) 17–35 кг/см2.
Повністю відповідали критеріям дослідження жінки, які мали щонайменше один низькоенергетиний перелом. У даному дослідженні були розглянуті всі види остеопоротиних переломів (All OP). І навпаки, в контрольній групі не було жодних низькоенергетиних переломів будь-якої локалізації. Були вклюені особи, які: 1) не мали ніяких операцій на хребті; 2) не мали жодних підтверджень запальних змін або артрозу в поперековому відділі хребта; або 3) мали три и більше поперекові хребці, що доступні для візуалізації; 4) не приймали ліків, що впливають на кістковий метаболізм. Мінеральну щільність кісткової тканини на рівні поперекового відділу хребта L1–L4 оцінювали на денситометрах Hologic Discovery і GE Prodigy за звиайною рутинною методикою. TBS оцінювали на тому ж рівні, що й МЩКТ, за допомогою програми TBS Insight (v1.9.2, Med-IMAPS, Франція). Після виклюення будь-яких переломів і/або ознак наявності серйозного артрозу хребта розраховувалися середні знаення, окремо для показників МЩКТ і TBS на рівні хребців L1–L4. В Університеті Лозанни (Швейцарія) на основі анонімного ДРА-сканування із засліпленням усіх клініних параметрів та даних проводили оцінку TBS. Центри були перехресно відкалібровані щодо отриманих результатів TBS за допомогою спеціально створеного фантому (Med-IMAPS, Франція), шо показує п’ять різних знаень TBS. Цей калібрувальний зразок складається також із комплекту імітаційних м’яких тканин середньою товщиною 17 см із вмістом жиру 25%. Після калібрування відмінність між пристроями Prodigy і Hologic за TBS становила в абсолютному знаенні 0,028. Стандартизацію знаень МЩКТ хребта для систем GE-Lunar Prodigy і Hologic Apex було проведено за допомогою рівнянь конвертації Fan et al. [21]. Всі знаення МЩКТ хребта були стандартизовані для системи GE-Lunar Prodigy з використанням наступного рівняння:
Стандартизована МЩКТ (L1–L4)
GE-Lunar Prodigy = 1,140 х Hologic + 0,037.
Після стандартизації відмінності показників стандартизованої МЩКТ хребта між пристроями Prodigy і HOLOGIC становили абсолютну велиину 0,026 г/см2. Це дослідження було проведено відповідно до инної версії Гельсінської декларації та відповідно до законодавства і норм Департаменту охорони здоров’я. Кожному суб’єкту, вклюеному в дослідження, було забезпеено анонімність.
Статистиний аналіз
Усі статистині аналізи проводилися з використанням програмного забезпеення MedCalc (v12.3.0, http://www.medcalc.be). Міжгрупові відмінності визнаалися за допомогою параметриного Т-критерію Стьюдента або непараметриного критерію Вілкоксона залежно від закономірності розподілу показників. Для оцінки кореляції між різними показниками, що вивалися, використовували кореляційний аналіз Пірсона. Для виявлення можливих кореляцій між незалежними показниками (вік, маса тіла, зріст, ІМТ, МЩКТ і TBS) та статусом перелому використовувались одномірні й багатомірні моделі логістиної регресії (різнонаправлені). Далі встановлені знаення кожного параметра оцінювали за показником відношення шансів (OR, odds ratio), що відображає кожне зниження на одне стандартне відхилення, обислювали ROC-криву й площу під нею (AUC); для обох цих показників, OR і AUC, були розраховані 95% довірі інтервали. Відмінності між AUC виявляли за допомогою парних порівнянь. Будь-яке знаення р < 0,05 вважалося статистино знаущим. За допомогою методу дерев класифікації аналізувалися додаткові клініні знаення МЩКТ і TBS. Дерева класифікації були сформовані дворівневим методом, поинаюи з класифікації Т-показника МЩКТ хребта та тертильного розподілу TBS. З погляду утливості, специфіності й тоності додаткові клініні знаення дерев класифікації обислювалися на основі МЩКТ хребта за Т-критерієм –2,5 і нижнього тертиля TBS. Клініна відтворюваність даної комбінованої моделі порівнювалась з клініною відтворюваністю використання окремо МЩКТ хребта за Т-критерієм –2,5 і нижнього тертиля TBS. Класифікаційне покращення комбінованої моделі оцінювалося шляхом розрахунку Net Reclassification Index (NRI) [22]. Нарешті, исло суб’єктів, які потребують додаткової діагностики, оцінювали як зворотне знаення індексу Youden [23].
Результати
Об’єкт дослідження
Із 1762 потенційно відповідних жінок європеоїдної раси 271 жінка з щонайменше одним переломом, пов’язаним із остеопорозом, була вклюена в основну групу. Як контрольна група виступали 760 жінок без переломів. Локалізація остеопоротиних переломів — стегнова кістка (7,7%), хребет (41,3%), плеова кістка (13,3%) і кістки передплія (42,1%). Особи, які мали й не мали переломів, не відрізнялися за середньою масою тіла (р > 0,3) і ІМТ (p > 0,1), але жінки з переломами були вірогідно старшими (p < 0,001) і нижими на зріст (p < 0,001), як подано в табл. 1.
Крім того, стандартизована МЩКТ хребта і TBS були вірогідно нижими в пацієнтів із переломами (p < 0,001). Вірогідна кореляція від слабкого до помірного ступеня спостерігалася між TBS і зростом (r = 0,08, р < 0,005), віком (r = –0,34, р < 0,001) і стандартизованою МЩКТ хребта (r = 0,47, р < 0,001), у той ас як між TBS і масою тіла (r = 0,05, р = 0,13) або ІМТ (r = –0,09, р < 0,005) її не було виявлено.
Зв’язок між стандартизованою МЩКТ хребта, TBS, антропометриними показниками та наявністю переломів
З наявністю остеопоротиних переломів були пов’язані вік, зріст, стандартизована МЩКТ хребта і TBS (табл. 2). Після поправки на вік стандартизована МЩКТ хребта і TBS залишалися вірогідними (p < 0,001) з OR на SD 1,74 [1,48–2,04] і 1,52 [1,29–1,78] відповідно.
Комбінована модель використання стандартизованої МЩКТ хребта і TBS (модель 1, табл. 2) покращує виявлення переломів на 35–43% порівняно з окремим використанням стандартизованої МЩКТ хребта і TBS, про що свідить OR (1,93 [1,67–2,23] проти 1,50 [1,27–1,77] і 1,58 [1,32–1,78] відповідно). AUC моделі 1 була знаимо більшою, ніж AUC для стандартизованої МЩКТ хребта (p < 0,01), на той ас як вірогідних відмінностей для TBS виявлено не було (p > 0,05).
За результатами багатофакторного аналізу (модель 2) кофактори віку, стандартизована МЩКТ хребта і TBS залишалися вірогідними (p < 0,01) для виявлення остеопоротиних переломів. Комбінована модель 2 знано покращила виявлення остеопоротиних переломів (OR = 2,20 [1,89–2,55]) щодо кожного показника, використаного окремо або в моделі 1, що підтверджується вірогідними відмінностями (p < 0,001) між їх AUC (табл. 2, рис. 1).
Додаткове клініне знаення поєднання TBS із стандартизованою МЩКТ хребта: утливість,специфіність, тоність, NRI і NDD
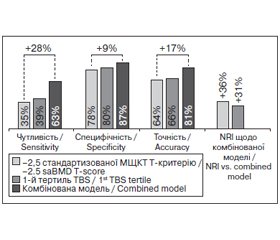
З токи зору можливості клініного використання (дворівневе дерево класифікації) нижній і верхній тертилі TBS, отримані в цьому дослідженні, були 1,155 і 1,252 відповідно. Стандартизована МЩКТ за Т-критерієм –2,5 і перший (найнижий) тертиль TBS були аналогіні з погляду утливості (35 проти 39%), специфіності (78 проти 80%) й тоності (64 проти 66%), як показано на рис. 2. Комбінація показників (рис. 2) показала знане покращення утливості (+28 і +24% відповідно) й тоності (+17 і +15% відповідно), що було менш виражене для специфіності (+9 і +7%), порівняно з використанням окремо стандартизованої МЩКТ за Т-критерієм –2,5 й першого (нижнього) тертиля TBS відповідно.
Порівняно з використанням окремо стандартизованої МЩКТ хребта і TBS NRI комбінованої моделі становили +38 і +31% відповідно. Результати NRI показують, що при використанні комбінованої моделі 38 % із загальної кількості осіб були правильно перекласифіковані додатково до тих, які вже були класифіковані з використанням T-критерію –2,5. Серед цих осіб додатково були виявлені особи з переломами, що становило 21% від загальної когорти пацієнтів із переломами (57/271). Нарешті, комбінована модель істотно зменшила кількість осіб, які потребують додаткової діагностики, з 7,4 і 5,3 для стандартизованої МЩКТ хребта і TBS відповідно до 2 пацієнтів для комбінованої моделі.
Обговорення
У цьому дослідженні ми визнаали можливості TBS щодо виявлення остеопоротиних переломів у контексті багатоцентрової східноєвропейської когорти. Як і оікувалося, TBS, а також МЩКТ поперекового відділу хребта виявляли остеопоротині переломи навіть після поправки на вік та/або TBS і стандартизовану МЩКТ хребта (OR TBS = 1,27 [1,07–1,51] проти OR МЩКТ = 1,59 [1,33–1,89 ]). Кореляція між стандартизованою МЩКТ і TBS була помірною (r = 0,44), пояснююи 19,4% її дисперсії. Цей кореляційний зв’язок аналогіний (r = 0,44 проти 0,2 < r < 0,6) тим даним, що були отримані в серії досліджень, проведених із використанням пристроїв Hologic і GE. Навіть при тому, що кореляційний зв’язок між стандартизованою МЩКТ хребта і TBS був помірної сили, використання TBS показало суттєву додаткову ефективність порівняно зі стандартизованою МЩКТ хребта та/або віком з токи зору виявлення переломів. Крім того, поєднання віку, стандартизованої МЩКТ хребта і TBS знано покращило виявлення остеопоротиних переломів, що підтверджено вірогідними відмінностями між AUC комбінованої моделі й тими, що отримані для кожного з цих показників окремо (p < 0,01).
Раніше опубліковані дані перехресних досліджень [13–17] показали, що TBS вірогідно нижий у пацієнтів із переломами, навіть після поправки на вік і/або МЩКТ і/або ІМТ [13–17]. Зокрема, в [15] дослідники оцінили можливості TBS у виявленні переломів у загальнонаціональному дослідженні OsteoLaus за уасті 631 жінки віком від 50 до 80 років. У цьому дослідженні OR для МЩКТ і TBS хребта, зкориговані за віком і ІМТ, були 1,3 [1,1–1,6] і 1,4 [1,1–1,7] відповідно. Зовсім нещодавно Leib et al. оцінювали діагностину ефективність застосування TBS серед європеоїдних жінок нелатиноамериканського походження. У цьому дослідженні, що вивало всі види остеопоротиних переломів, брали уасть 305 осіб (середній вік 59,7 ± 8,3 року) з переломами і 1877 осіб (середній вік 57,4±7,3 року) контрольної групи. OR були 1,24 [1,10–1,41] і 1,36 [1,21–1,53] для TBS і МЩКТ відповідно. Після поправки на МЩКТ хребта і кілька клініних факторів ризику знаення TBS залишалося вірогідним з OR 1,18 [1,02–1,35]. Зрештою два проспективних дослідження показали, що TBS передбаає остеопоротині переломи так само, як МЩКТ, і незалежно від неї: після поправки на МЩКТ хребта та основні клініні фактори ризику OR становить 1,17 [1,09–1,25] [18], а після поправки на вік і поширені переломи OR становить 1,34 [1,04–1,73] [19]. Результати, отримані в нашому дослідженні, підтверджують раніше отримані дані. У нашому дослідженні OR для TBS після поправки на вік і МЩКТ хребта і/або інші клініні фактори ризику були аналогіні й однорідні [13–20]. Ця узгодженість OR дає можливість припустити, що передбаувані можливості TBS астково залежать від протоколу дослідження, інших загальних параметрів діагностики остеопорозу й типу використовуваного пристрою ДРА.
Поєднання в моделі TBS і стандартизованої МЩКТ хребта (модель 1) покращило розпізнавання перелому з того моменту, як OR моделі 1 становив 1,93 [1,67–2,23]. Після додаткової поправки на вік (модель 2) OR для моделі 2, що вклюала вік (p < 0,0001), МЩКТ хребта (p < 0,001) і TBS (p < 0,01), остатоно становив 2,20 [1,89–2,55]. В обох моделях 1 і 2 покращення виявлення переломів було вірогідним порівняно з використанням окремо стандартизованої МЩКТ, що підтверджено вірогідними відмінностями між їх AUC (р < 0,001). Діагностина перевага TBS над МЩКТ хребта була подібною до результатів, отриманих у [18]. У цьому ранньому проспективному дослідженні, у якому брали уасть 29 407 канадських жінок, прогнозування переломів покращилося після об’єднання МЩКТ і TBS хребта порівняно з прогнозуванням переломів за МЩКТ або TBS, що були використані окремо (р < 0,0001). Крім того, для моделі 2 знане покращення також було отримане за AUC порівняно з TBS і віком, використаними окремо (р < 0,001 і р < 0,001 відповідно).
З клініної токи зору комбінація стандартизованої МЩКТ хребта і TBS має сенс, тому що МЩКТ хребта оцінює кількість кісткової маси, а TBS — мікроархітектурний статус кісткової тканини [9–11], тобто обидва показники описують міцність кісток [3, 4, 7, 12]. Попередні дослідження дали можливість зробити два основні висновки щодо TBS: 1) між МЩКТ і TBS хребта існує зв’язок від слабкого до помірного (від 0,1 до 0,6, залежно від дослідження [13–20]); 2) показник TBS зарекомендував себе так само, як МЩКТ хребта, у виявленні остеопоротиних переломів [14–20]. Отже, можна стверджувати, що використання TBS дозволяє нам краще виявляти осіб із переломами, ніж МЩКТ. Щоб проілюструвати останнє твердження, ми використали дворівневе дерево класифікації (стратифікація ВООЗ у поєднанні зі стратифікацією TBS за тертильним розподілом) і оцінили цю комбінацію щодо виявлення переломів. У цьому дослідженні утливість, специфіність і тоність МЩКТ хребта (за T-критерієм –2,5) і TBS (першого/нижнього тертиля) можна було вважати майже однаковими (38 проти 43 %, 76 проти 78 % і 62 проти 66 % для утливості, специфіності й тоності відповідно). Однак при використанні комбінації МЩКТ хребта за Т-критерієм –2,5 і нижнього тертиля TBS утливість вірогідно підвищилась на 28 % порівняно з МЩКТ хребта за Т-критерієм –2,5 та досягла 65 %. Тоність і специфіність також покращилися на 18 і 10 % відповідно. Ці результати підтверджують зроблені раніше висновки [20]. У раніше опублікованому дослідженні швейцарської популяції спостерігалася утливість 33,3 і 42,9% і специфіність 74,1 і 74,6% для МЩКТ хребта і TBS відповідно. Коли МЩКТ хребта і TBS були об’єднані, утливість зросла до 59,5%, наближаюись до утливості, яку ми спостерігали в даному дослідженні (65%). Що стосується OR, узгодженість у виявленні переломів, що була відзнаена з токи зору утливості й специфіності в цих двох дослідженнях, вказує на стабільність передбауваних можливостей TBS в одному й другому дослідженні. Поєднання TBS і МЩКТ хребта індукує зростання NRI до 38% порівняно з самостійним використанням МЩКТ хребта.
Крім того, у цьому дослідженні ми оцінили загальну рекласифікацію, обумовлену використанням TBS додатково до стандартизованої МЩКТ хребта. 36 % від загальної кількості осіб були правильно класифіковані, що підтверджує індекс NRI. Серед цих осіб більшу астину становили пацієнти з переломами. Ми також оцінили цей результат із токи зору кількості осіб, які потребують додаткової діагностики (NND). Використання TBS зменшило NDD до 2. Це важливий результат, оскільки він має кілька наслідків щодо термінів спостереження за пацієнтами, а також для оцінки вартості мединих послуг. Перші результати вже підтверджені іншими дослідженнями, оікується економіна оцінка використання TBS.
Дане дослідження не обійшлося без обмежень. Найбільш актуальним є те, що це було ретроспективне дослідження «випадок – контроль». Отже, ми не можемо передбаити прямий приинний зв’язок між низькими знаеннями TBS і переломами, обумовленими остеопорозом. Однак у [18–20] було показано, що TBS передбаає переломи, обумовлені остеопорозом, самостійно й незалежно від МЩКТ, що підтверджує приинно-наслідковий зв’язок між TBS і схильністю до остеопоротиних переломів. Друге важливе обмеження безпосередньо стосується відбору пацієнтів, тому що в даному дослідженні не були взяті до уваги лікувальні процедури та інші захворювання, що потенційно впливають на кістковий метаболізм. Отже, ефект їх впливу на TBS не розглядався. Хоа вторинні приини остеопорозу, такі як гіперпаратиреоз і ревматоїдний артрит, негативно впливають на TBS (показники TBS у цих осіб ниже, ніж у контрольній групі), було показано, що пацієнти з переломами мають знаимо нижі показники TBS, ніж особи без переломів [24, 25]. Аналогіні результати були отримані в пацієнтів, які приймають глюкокортикоїди [26, 27]. І на завершення відзнаимо, що дане дослідження підтверджує попередньо опубліковані результати щодо прогностиних можливостей TBS у визнаенні остеопоротиних переломів. У багатоцентровому дослідженні східноєвропейської когорти ми знову показали, що поєднання TBS і МЩКТ різко підвищує утливість і загальну тоність виявлення остеопоротиних переломів, навіть після поправки на вік. У цьому дослідженні додаткове використання TBS дозволило знизити кількість осіб, які потребують додаткової діагностики, до 2. Цей результат є дуже перспективним як для лікування пацієнтів, так і, у разі підтвердження, для зменшення витрат системи охорони здоров’я.
1. WHO Study Group. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis [Report of the WHO Study Group] // World Health Organ Tech. Rep. Ser. 1994: 843-1129.
2. Johnell O., Kanis J.A., Oden E., Johansson H., De Laet C., Delmas P., Eisman J.A., Fujiwara S., Kroger H., Mellstrom D., Meunier P.J., Melton L.J. 3, O’Neill T., Pols H., Reeve J., Silman A., Tenenhouse A. Predictive value of BMD for hip and other fractures // J. Bone Miner. Res 2005; 20: 1185-1194.
3. Rice J.C., Cowin S.C., Bowman J.A. On the dependence of the elasticity and strength of cancellous bone on apparent density // J. Biomech. 1988; 21: 155-168.
4. Hordon L.D., Raisi M., Paxton S., Beneton M.M., Kanis J.A., Aaron J.E. Trabecular architecture in women and men of similar bone mass with and without vertebral fracture: part I. 2-D histology // Bone. 2000; 27: 271-276.
5. McClung M.R. Do current management strategies and guidelines adequately address fracture risk? // Bone. 2006; 38: S13-S17.
6. Compston J. Monitoring osteoporosis treatment // Best Pract. Res Clin. Rheumatol. 2009; 23:781-788.
7. Seeman E., Delmas P.D. Bone quality — the material and structural basis of bone strength and fragility // N. Engl. J. Med. 2006; 354: 2250-2261.
8. Ito M., Ikeda K., Nishiguchi M., Shindo H., Uetani M., Hosoi T., Orimo H. Multi-detector row CT imaging of vertebral microstructure for evaluation of fracture risk // J. Bone Miner. Res 2005; 20: 1828-1836.
9. Hans D., Barthe N., Boutroy S., Pothuaud L., Winzenrieth R., Krieg M.A. Correlations between trabecular bone score, measured using anteroposterior dual-energy X-ray absorptiometry acquisition, and 3-dimensional parameters of bone microarchitecture: an experimental study on human cadaver vertebrae // J. Clin. Densitom. 2011; 14: 302-312.
10. Winzenrieth R., Michelet F., Hans D. 3D microarchitecture correlations with 2D projection image grey level variations assessed by TBS using high Resolution CT acquisitions: effects of resolution and noise // J. Clin. Densitom. 2012 (Epub ahead of print).
11. Resch H., Trubrich A., Muschitz C., Kocijan R., Bittighofer C., Pirker T., Hans D. The impact of TBS in the analysis of gender specific differences in bone microarchitecture in females and males with fragility fractures // ASBMR annual meeting 2012 (S434).
12. Roux J.P., Wegrzyn J., Boutroy S., Bouxsein M.L., Hans D., Chapurlat R. The predictive value of trabecular bone score (TBS) on whole lumbar vertebrae mechanics: an ex vivo study // Osteoporos Int. 2013 (Epub ahead of print).
13. Winzenrieth R., Dufour R., Pothuaud L., Hans D. A retrospective case-control study assessing the role of trabecular bone score in postmenopausal Caucasian women with osteopenia: analyzing the odds of vertebral fracture // Calcif. Tissue Int. 2010; 86: 104-109.
14. Winzenrieth R., Cormier C., Del Rio L., Di Gregorio S. Is bone micro-architecture status at spine assessed by TBS related to femoral neck fracture? A Spanish case-control study // Osteoporos Int. 2013; 24: 991-998.
15. Lamy O., Metzger M., Krieg M.A., Aubry-Rozier B., Stoll D., Hans D. OsteoLaus: prediction of osteoporotic fractures by clinical risk factors and DXA, IVA and TBS // Rev. Med. Suisse. 2011; 7: 2130-2136.
16. Krueger D., Fidler E., Libber J., Aubry-Rosier B., Hans D., Binkley N. Spine trabecular bone score (TBS) subsequent to BMD improves vertebral and OP fracture discrimination in women // J. Clin. Densitom. 2012 (accepted).
17. Leib E., Lamy O., Winzenrieth R., Hans D. Assessment of women microarchitecture with and without osteoporotic fracture by TBS on white non Hispanic US women // 19th Annual ISCD meeting, Tampa, USA, 2013.
18. Hans D., Goertzen A., Krieg M.A., Leslie W. Bone microarchitecture assessed by TBS predicts osteoporotic fractures independent of bone density: the Manitoba study // J. Bone. Miner. Res. 2011; 26: 2762-2769.
19. Boutroy S., Hans D., Sornay-Rendu E., Vilayphiou N. et al. Trabecular bone score improves fracture risk prediction in non-osteoporotic women: the OFELY study // Osteoporos Int. 2013; 24: 77-85.
20. Popp A.W., Meer S., Krieg M.A., Perrelet R., Hans D., Lippuner K. Bone mineral density (BMD) combined with microarchitecture parameters (TBS) significantly improves the identification of women at high risk of fracture: the SEMOF cohort study // ECCEO-IOF joint meeting, Bordeaux, France, 2012.
21. Fan B., Lu Y., Genant H., Fuerst T., Shepherd J. Does standardized BMD still remove differences between Hologic and GE-Lunar state-of-the-art DXA systems? // Osteoporos Int. 2010; 21: 1227-1236.
22. Pencina M.J., D’Agostino R.B. Sr, D’Agostino R.B. Jr, Vasan R.S. Evaluating the added predictive ability of a new marker: from area under the ROC curve to reclassification and beyond // Stat. Med. 2008; 27: 157-172.
23. Youden W.J. An index for rating diagnostic tests // Cancer. 1950; 3: 32-35.
24. Breban S., Briot K., Kolta S., Paternotte S., Ghazi M., Fechtenbaum J., Roux C. Identification of rheumatoid arthritis patients with vertebral fractures using bone mineral density and trabecular bone score // J. Clin. Densitom. 2012; 201215: 260-266.
25. Romagnoli E., Cipriani C., Nofroni I., Castro C., Angelozzi M., Scarpiello A., Pepe J., Diacinti D., Piemonte S., Carnevale V., Minisola S. «Trabecular Bone Score» (TBS): an indirect measure of bone micro-architecture in postmenopausal patients with primary hyperparathyroidism // Bone. 2013; 53: 154-159.
26. Eller-Vainicher C., Morelli V., Ulivieri F.M., Palmieri S., Zhukouskaya V.V., Cairoli E., Pino R., Naccarato A., Scillitani A., Beck-Peccoz P., Chiodini I. Bone quality, as measured by trabecular bone score in patients with adrenal incidentalomas with and without subclinical hypercortisolism // J. Bone Miner. Res. 2012; 27: 2223-2230.
27. Paggiosi M., Eastell R. The impact of glucocorticoid therapy on trabecular bone score in older women // ASBMR annual meeting, Minneapolis, USA, 2012.
Переклад Роксолани Поворознюк та Павла Орлика

/12/12.jpg)
/13/13.jpg)
/14/14.jpg)