Журнал «Актуальная инфектология» 2 (7) 2015
Вернуться к номеру
Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 99-130
Затверджено
Наказ Міністерства охорони здоров’я
31.12.2014 № 1039
Ко-інфекція (туберкульоз/ВІЛ-інфекція/СНІД) 2014
Вступ
Сучасний розвиток медицини передбачає постійне удосконалення заходів щодо діагностики, лікування та профілактики захворювань з урахуванням вимог доказової медицини. Система стандартизації медичної допомоги орієнтована на розробку медико-технологічних документів, що допомагають лікарю ефективно діяти в конкретних клінічних ситуаціях, уникаючи неефективних та помилкових втручань.
Уніфікований клінічний протокол медичної допомоги (далі — УКПМД) «Ко-інфекція (туберкульоз/ВІЛ-інфекція/СНІД)» за своєю формою, структурою та методичними підходами щодо використання вимог доказової медицини створено відповідно до наказу Міністерства охорони здоров’я України № 751 від 28.09.2012 р. «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», зареєстрованого в Міністерстві юстиції України 29.11.2012 р. за № 2001/22313.
УКПМД розроблений на основі клінічної настанови «Туберкульоз. Адаптована клінічна настанова, заснована на доказах».
В УКПМД зосереджено увагу на основних етапах надання медичної допомоги пацієнтам із поєднаною інфекцією туберкульоз/ВІЛ-інфекція/СНІД.
Використання такого підходу до лікування пацієнтів з ТБ рекомендується клінічними настановами:
1. Tuberculosis. Clinical diagnosis and management of tuberculosis, and measures for its prevention and control. NICE clinical guideline 117. March 2011.
2. British HIV Association guidelines for the treatment of TB/HIV coinfection, 2011.
3. WHO Treatment of tuberculosis: guidelines — 4th ed., 2009.
4. WHO Management of tuberculosis and HIV coinfection, Clinical protocol for the WHO European Region, 2013.
5. WHO Rapid advice: treatment of tuberculosis in children, 2010.
6. WHO Guidelines for the programmatic management of drug-resistant tuberculosis, 2008.
7. WHO Guidelines for the programmatic management of drug-resistant tuberculosis, 2011 update.
8. WHO policy on collaborative TB/HIV activities: guidelines for national programmes and other stakeholders, 2012.
9. WHO, IUATLD Guidance for national tuberculosis and HIV programmes on the management of tuberculosis in HIV-infected children: Recommendations for a public health approach, 2010.
Перелік скорочень
I. Паспортна частина
1.1. Діагноз — Туберкульоз/ВІЛ
1.2. Код МКХ-10 — В20
1.3. Для кого призначений протокол — Протокол призначений для лікарів загальної практики — сімейних лікарів, лікарів терапевтів дільничних, лікарів-фтизіатрів, лікарів-інфекціоністів, лікарів медицини невідкладних станів, інших медичних працівників, які беруть участь у наданні медичної допомоги хворим на ТБ, ВІЛ-інфікованим і хворим на СНІД та ТБ/ВІЛ.
1.4. Мета — Застосування медико-організаційних та лікувально-діагностичних підходів, що відповідають положенням доказової медицини, в процесі надання медичної допомоги хворим на поєднану інфекцію туберкульоз/ВІЛ-інфекція/СНІД в Україні.
1.5. Дата складання протоколу — 2014 р., квітень — грудень
1.6. Дата наступного перегляду — 2017 р., квітень — грудень
1.7. Члени робочої групи:
Єщенко Олена Григорівна — в.о. Голови Державної служби України з питань протидії ВІЛ-інфекції/СНІДу та інших соціально небезпечних захворювань, к.м.н., доцент (голова робочої групи);
Черенько Світлана Олександрівна — завідувач відділення фтизіатрії Державної установи «Національний інститут фтизіатрії і пульмонології імені Ф.Г. Яновського НАМН України», д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «фтизіатрія» (заступник голови з клінічних питань);
Талаєва Тетяна Володимирівна — заступник генерального директора Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», д.м.н., професор (заступник голови з координації діяльності мультидисциплінарної робочої групи);
Ліщишина Олена Михайлівна — директор Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», к.м.н. (заступник голови з методологічного супроводу);
Барбова Анна Іванівна — старший науковий співробітник лабораторії мікробіології Державної установи «Національний інститут фтизіатрії і пульмонології імені Ф.Г. Яновського НАМН України», керівник Центральної референс-лабораторії з мікробіологічної діагностики МОЗ України, к.м.н.;
Рубан Інна Леонідівна — головний лікар Київської міської дитячої клінічної туберкульозної лікарні № 13, головний позаштатний спеціаліст МОЗ України зі спеціальності «дитяча фтизіатрія»;
Дятленко Ганна Миколаївна — головний спеціаліст відділу організації медико-соціальної допомоги управління протидії туберкульозу Державної служби України з питань протидії ВІЛ-інфекції/СНІДу та інших соціально небезпечних захворювань;
Голуб Оксана Борисівна — головний лікар Київського обласного центру профілактики та боротьби зі СНІДом;
Коваль Галина Володимирівна — заступник головного лікаря з диспансерної роботи Херсонського обласного протитуберкульозного диспансеру, головний позаштатний фтизіатр Департаменту охорони здоров’я Херсонської обласної держадміністрації;
Коржов Віталій Іванович — керівник секції людей, хворих на туберкульоз або постраждалих від нього, фундації «Україна проти туберкульозу»;
Манів Леся Ярославівна — завідувач відділення бактеріовиділювачів Івано-Франківського фтизіопульмонологічного центру;
Матковський Ігор Анатолійович — головний лікар Вінницького обласного центру профілактики та боротьби зі СНІДом;
Матюха Лариса Федорівна — завідувач кафедри сімейної медицини і амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., головний позаштатний спеціаліст МОЗ України зі спеціальності «загальна практика — сімейна медицина»;
Макаренко Олена Іванівна — головний лікар Волинського обласного центру профілактики та боротьби зі СНІДом;
Нізова Наталія Миколаївна — директор Державної установи «Український центр контролю за соціально небезпечними хворобами МОЗ України»;
Павлова Ольга Вікторівна — заступник директора Державної установи «Український центр контролю за соціально небезпечними хворобами МОЗ України»;
Пилипенко Володимир Іванович — доцент історичного факультету Київського національного університету імені Т.Г. Шевченка;
Сакальська Ольга Петрівна — начальник управління протидії туберкульозу Державної служби України з питань протидії ВІЛ-інфекції/СНІДу та інших соціально небезпечних захворювань;
Сторожук Людмила Анатоліївна — начальник відділу організації медико-соціальної допомоги управління протидії ВІЛ-інфекції/СНІДу управління соціально небезпечних хвороб Державної служби України з питань протидії ВІЛ-інфекції/СНІДу та інших соціально небезпечних захворювань;
Терлеєва Яна Сергіївна — завідувач відділу планування та організації медичної допомоги хворим на туберкульоз Державної установи «Український центр контролю за соціально небезпечними хворобами МОЗ України»;
Худошина Ольга Валентинівна — заступник начальника Управління — начальник відділу з питань якості та оцінки відповідності Управління з питань якості надання медичної допомоги Міністерства охорони здоров’я України.
Методичне керівництво та координація діяльності мультидисциплінарної робочої групи
Черенько С.О., д.м.н., професор, завідувач відділення фтизіатрії ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України»
Методичний супровід та інформаційне забезпечення
|
Ліщишина О.М. |
Директор Департаменту стандартизації медичних послуг ДП «Державний експертний центр МОЗ України», к.м.н. |
|
Горох Є.Л. |
Начальник відділу якості медичної допомоги та інформаційних технологій ДП «Державний експертний центр МОЗ України», к.т.н. |
|
Шилкіна О.О. |
Начальник відділу методичного забезпечення новітніх технологій в сфері охорони здоров’я ДП «Державний експертний центр МОЗ України» |
|
Мельник Є.О. |
Начальник відділу доказової медицини ДП «Державний експертний центр МОЗ України» |
Адреса для листування: Департамент стандартизації медичних послуг ДП «Державний експертний центр МОЗ України», м. Київ. Електронна адреса: medstandards@dec.gov.ua. Електронну версію документа можна завантажити на офіційному сайті Міністерства охорони здоров’я України: http://www.moz.gov.ua та http://www.dec.gov.ua
Рецензенти:
|
Мельник В.П. |
зав. кафедрою інфекційних хвороб, фтизіатрії і пульмонології та шкірних і венеричних хвороб Київського медичного університету УАНМ, професор, д.м.н. |
|
Ніколаєва О.Д. |
доцент кафедри фтизіатрії і пульмонології Національної медичної академії післядипломної освіти ім. П.Л. Шупика, к.м.н. |
1.8. Епідемічна інформація
Останні роки ознаменувалися створенням підґрунтя для просування України до досягнення наміченої на 2015 рік Цілі розвитку тисячоліття в галузі охорони здоров’я — надання тенденції поширення туберкульозу зворотного руху.
За підсумками 2013 року відмічається стабілізація та зменшення рівня захворюваності на туберкульоз майже в усіх регіонах України. За І півріччя 2014 року показник захворюваності зменшився на 5,4 % порівняно з аналогічним періодом 2013 року.
Слід відзначити, що у 2013 році значно знизився показник поширеності туберкульозу — на 21,8 %, у І півріччі 2014 — на 18 %.
Смертність від туберкульозу у 2013 році (за даними Держкомстату України) знизилась на 6 % порівняно з попереднім роком та становила 14,2 на 100 тис. населення, за 5 місяців 2014 року смертність знизилася на 15 %. Ця тенденція свідчить про ефективність заходів з протидії туберкульозу та пов’язана із забезпеченням потреби у протитуберкульозних препаратах І та ІІ ряду.
Однак епідемія ВІЛ-інфекції в Україні та збільшення кількості ЛЖВ можуть призупинити прогрес на шляху досягнення індикаторів цілі тисячоліття щодо зниження захворюваності на туберкульоз.
Кількість ВІЛ-інфікованих осіб, які перебувають під диспансерним наглядом в Україні, на 01.09.2014 р. становить 144 655 осіб. Показник поширеності ВІЛ-інфекції — 319,7 на 100 тис. населення. У 32 865 ВІЛ-інфікованих осіб хвороба досягла кінцевої стадії — СНІДу.
Показник поширеності СНІДу — 72,6 на 100 тис. населення.
За шість місяців 2014 р. у країні зареєстровано 10 759 нових випадків ВІЛ-інфекції (показник захворюваності на ВІЛ-інфекцію — 23,7 на 100 тисяч населення), що на 0,9 % вище показника за аналогічний період попереднього 2013 року (10 727 нових випадків ВІЛ-інфекції, показник захворюваності на ВІЛ-інфекцію — 23,5 на 100 тисяч населення).
Діагноз СНІДу встановлено 5488 ВІЛ-інфікованим особам (показник захворюваності на СНІД — 12,1 на 100 тисяч населення), у тому числі 40 дітям віком до 14 років. Порівняно з аналогічним періодом 2013 р. показник захворюваності на СНІД збільшився на 7,1 % (6 міс. 2013 р. — 5162 випадки СНІДу, показник захворюваності на СНІД — 11,3 на 100 тисяч населення).
Незважаючи на розширення доступу до антиретровірусної терапії, епідемія ВІЛ-інфекції у першому півріччі 2014 року забрала життя у 1673 хворих на СНІД, у тому числі у 2 дітей (показник смертності від захворювань, зумовлених СНІДом, — 3,7 на 100 тисяч населення). Порівняно з аналогічним періодом 2013 року показник смертності від захворювань, зумовлених СНІДом, зменшився на 6,8 % (6 міс. 2013 р. — 1802 випадки смерті, показник смертності від захворювань, зумовлених СНІДом, — 3,95 на 100 тисяч населення).
Проблемним питанням щодо контролю за туберкульозом та ВІЛ-інфекцією/СНІДом залишається постійне зростання захворюваності на поєднану інфекцію ТБ/ВІЛ. З 2000 року показник захворюваності на ко-інфекцію збільшився у 45,9 раза і становив у 2013 році 10,5 випадку на 100 тис. населення, що на 1 % більше, ніж у попередньому, 2012 році. За 6 міс. 2014 року цей показник зріс на 9 % (захворіло на 84 особи більше) порівняно з аналогічним періодом 2013 року.
У 2013 році забезпечено високий рівень (до 85 %) охоплення тестуванням на ВІЛ-інфекцію вперше виявлених хворих на ТБ. Цьому сприяло значне покращення співпраці фахівців протитуберкульозних закладів та центрів СНІДу щодо надання комплексної медичної допомоги хворим на ко-інфекцію ВІЛ/ТБ. У 17 регіонах країни у штатній структурі протитуберкульозних закладів наявна ставка лікаря-інфекціоніста. Проте проблемним залишається питання профілактики ТБ серед контингентів ВІЛ-інфікованих, які знаходяться на диспансерному обліку у центрах СНІДу. Так, у 2013 році 63 % хворих із вперше встановленим діагнозом ТБ/ВІЛ знали про свій ВІЛ-статус та знаходилися на обліку в службі СНІДу до встановлення діагнозу ТБ, і лише 73 % із числа ВІЛ-інфікованих були охоплені профілактичним лікуванням ізоніазидом. Однак як позитивне явище можна розцінювати зменшення смертності від ТБ/ВІЛ на 9 % у 2013 році порівняно з 2012 роком.
Підвищення якості профілактичних заходів та посилення співпраці протитуберкульозної та служби СНІДу є пріоритетним завданням протидії соціально небезпечним хворобам на подальші роки.
II. Загальна частина
Поєднання туберкульозу та ВІЛ-інфекції, що визначається як «ко-інфекція (туберкульоз/ВІЛ-інфекція/СНІД)», — це активний легеневий або позалегеневий туберкульоз, який розвивається у ВІЛ-інфікованих осіб.
ТБ/ВІЛ діагностують у разі захворювання на туберкульоз ВІЛ-інфікованої особи, виявлення ВІЛ-інфекції у хворого на туберкульоз або коли під час проходження профілактичного чи діагностичного обстеження у пацієнта виявляють обидва захворювання одночасно.
2.1. Вплив ВІЛ-інфекції на розвиток захворювання на туберкульоз
Вірус імунодефіциту людини є важливим фактором ризику, що сприяє активації латентної туберкульозної інфекції. Ризик розвитку туберкульозу у ВІЛ-негативних осіб, інфікованих МБТ, становить 5–10 % протягом усього життя, тоді як у ВІЛ-позитивних людей він становить 10 % на рік. У ВІЛ-інфікованих осіб реактивація туберкульозу та розвиток первинного туберкульозу відбувається частіше, ніж у ВІЛ-негативних пацієнтів. Пацієнти з ВІЛ-інфекцією більш сприятливі до повторного інфікування ТБ, особливо у сімейних осередках, закритих колективах та при ув’язненні.
Активний туберкульоз сам призводить до розвитку помірної імуносупресії. ТБ не завжди вказує на виражений ступінь імуносупресії у ВІЛ-інфікованих пацієнтів, тому що може виникати перед інфікуванням ВІЛ або на ранніх стадіях ВІЛ-інфекції. У той же час розвиток ТБ у ВІЛ-інфікованих пацієнтів погіршує ураження імунної системи, сприяючи прогресуванню інших опортуністичних інфекцій, таких як кандидозний езофагіт, криптококовий менінгіт та особливо пневмоцистна пневмонія, що можуть призводити до летальних наслідків. Таким чином, ТБ безпосередньо та опосередковано має прямий вплив на рівень смертності серед ВІЛ-інфікованих пацієнтів.
2.2. Вплив туберкульозу на перебіг ВІЛ-інфекції
Розвиток ТБ у ВІЛ-інфікованих пацієнтів погіршує ураження імунної системи, сприяючи прогресуванню інших опортуністичних інфекцій, таких як кандидозний езофагіт, криптококовий менінгіт та особливо пневмоцистна пневмонія, що можуть призводити до летальних наслідків. Таким чином, ТБ безпосередньо та опосередковано має прямий вплив на рівень смертності серед ВІЛ-інфікованих пацієнтів.
Унаслідок прогресування ВІЛ-інфекції та при рівні СD4 клітин менше 50–80/мкл знижується здатність імунної системи запобігати реактивації туберкульозу та його дисемінації. Туберкульоз легень є основною клінічною формою туберкульозу у дорослих, проте його клінічні прояви залежать від рівня імуносупресії. Клінічна картина випадків туберкульозу на ранній стадії ВІЛ-інфекції подібна до такої у пацієнтів, не інфікованих ВІЛ. На ранній стадії ВІЛ-інфекції (при кількості CD4 > 350 клітин/мм3) частіше виявляють кислотостійкі бактерії (КСБ) у мазку мокротиння та характерні зміни на рентгенограмі легень. На пізніх стадіях ВІЛ-інфекції (при кількості CD4 < 200 клітин/мм3) клінічна картина нагадує первинний туберкульоз із негативними результатами мазка мокротиння, інфільтративними змінами на рентгенограмі без утворення порожнин. У випадку тяжкого імунодефіциту зростає частота позалегеневої форми туберкульозу, у тому числі міліарного з ураженням декількох органів та систем.
2.3. Ознаки та критерії діагностики захворювання
Усі ВІЛ-інфіковані пацієнти повинні бути обстежені на наявність або ризик розвитку туберкульозу, а усім хворим на туберкульоз повинно бути запропоновано консультування та тестування на ВІЛ, оскільки:
— ВІЛ-інфіковані особи відносяться до груп підвищеного ризику щодо захворювання на туберкульоз;
— туберкульоз є однією з основних причин смерті ВІЛ-інфікованих осіб;
— ВІЛ-інфекція негативно впливає на перебіг туберкульозу та ефективність лікування;
— активний туберкульоз негативно впливає на перебіг ВІЛ-інфекції та ефективність антиретровірусної терапії.
2.4. Оцінка ризику та діагностика туберкульозу у ВІЛ-інфікованих
У людей, які живуть із ВІЛ, незалежно від того, де вони отримують медичну допомогу, необхідно регулярно проводити медичні огляди на туберкульоз при кожному відвідуванні ними медичного закладу або кожному контакті з медичним працівником.
Виявлення хворих на туберкульоз серед ВІЛ-інфікованих пацієнтів проводиться при кожному зверненні останніх за медичною допомогою в регіональний центр СНІДу або в заклади первинної, вторинної (неспеціалізованої) медичної допомоги з будь-якого приводу або зі скаргами і/чи симптомами, що схожі на туберкульоз, незалежно від терміну їх існування (кашель сухий або з виділенням мокротиння, втрата маси тіла, підвищення температури, потіння вночі, втомлюваність та слабкість, біль у грудній клітці, задишка, кровохаркання); діагноз туберкульозу підтверджується фтизіатром; реєстрація випадку туберкульозу здійснюється у регіональному протитуберкульозному диспансері районним фтизіатром. Особливу увагу варто приділяти пацієнтам:
— з респіраторними симптомами незалежно від їх тривалості;
— бронхолегеневими симптомами та симптомами інтоксикації незалежно від їх тривалості;
— відомим контактом із хворим на активний туберкульоз легень у домашніх умовах або близькому оточенні;
— за наявності додаткових факторів підвищеного ризику інфікування (споживачі ін’єкційних наркотиків, зловживання алкоголем, перебування в місцях позбавлення волі).
4.2. Діагностика ВІЛ-інфекції у хворих на ТБ
Діагностика ВІЛ-інфекції у хворих на ТБ здійснюється шляхом проведення первинного обстеження на ВІЛ та поглибленого дослідження, після якого визначається тактика надання медичної, психологічної та соціальної допомоги хворому на ТБ/ВІЛ.
Кожному пацієнту на активний ТБ повинно бути проведено консультування та запропоноване тестування на ВІЛ. Медичні працівники повинні пояснити пацієнту важливість проходження тестування для прийняття відповідних рішень стосовно прийняття рішень про подальше ефективне лікування. Пацієнт має право відмовитися від проходження обстеження на ВІЛ.
Первинне обстеження пацієнта на ВІЛ повинно включати:
— тестування на ВІЛ (здійснюється відповідно до наказу МОЗ від 21.12.2010 № 1141 «Про затвердження Порядку проведення тестування на ВІЛ-інфекцію та забезпечення якості досліджень, форм первинної облікової документації щодо тестування на ВІЛ-інфекцію, інструкцій щодо їх заповнення»);
— перед- та післятестове консультування (проводиться обов’язково, з дотриманням загальних вимог Порядку добровільного консультування і тестування на ВІЛ-інфекцію (протоколу), затвердженого наказом МОЗ України від 19.08.2005 № 415 та зареєстрованому в Міністерстві юстиції України 22 листопада 2005 року за № 1404/11684).
У разі отримання позитивного результату необхідно спільно зі спеціалістами центру СНІДу провести поглиблене обстеження хворого для встановлення діагнозу відповідно до нормативних документів та призначення антиретровірусного лікування відповідно до національного клінічного протоколу антиретровірусної терапії.
4.3. Лікування хворих на ТБ/ВІЛ
4.3.1. Загальні підходи до лікування ТБ/ВІЛ
В організації лікування хворих на ТБ/ВІЛ дотримуються наступних підходів:
— лікування хворих на ТБ/ВІЛ розпочинають з призначення протитуберкульозної терапії;
— лікування ТБ у ВІЛ-інфікованих пацієнтів проводиться за тими ж схемами та тривалістю, що і у ВІЛ-негативних пацієнтів;
— якщо пацієнт уже отримує АРТ, її продовжують, а за необхідності проводять корекцію лікування з урахуванням особливих ситуацій (сумісності АРВ- та АМБ-препаратів і препаратів ЗПТ);
— призначення АРТ усім хворим на ТБ/ВІЛ здійснюється незалежно від кількості CD4-клітин і підвищує ефективність лікування цих хворих;
— профілактичне лікування ко-тримоксазолом усім хворим на ТБ/ВІЛ здійснюється незалежно від кількості CD4-клітин;
— після завершення основного курсу АМБТ протирецидивне профілактичне лікування застосовується тільки:
- за необхідності призначення АРТ пацієнтам з вираженим імунодефіцитом;
- при захворюванні на ВІЛ-інфекцію після виліковування ТБ.
4.3.2. Супровід пацієнтів з ТБ/ВІЛ
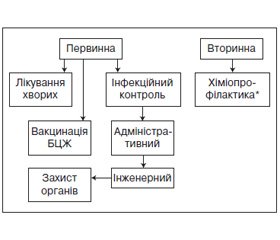
Супровід пацієнтів включає постійний моніторинг стану здоров’я пацієнта, забезпечення контролю під час отримання АМБТ на амбулаторному етапі із забезпеченням соціального супроводу, підготовку до АРТ, прийом АРТ, попередження та лікування опортуністичних інфекцій та супутніх захворювань, періодичне консультування, формування прихильності до лікування, психологічну та соціальну підтримку, скерування для забезпечення послідовності надання допомоги в повному обсязі (за потребою пацієнта).
Важливою є організація супроводу хворих на ТБ/ВІЛ командою, із залученням медичних працівників (лікар, медична сестра), соціальних працівників/робітників, психологів, представників інститутів громадянського суспільства за принципом «рівний — рівному», що працюють разом, в єдиному просторі, з урахуванням заразності пацієнта та із дотриманням вимог інфекційного контролю.
Завдання куратора (медичний працівник, соціальний працівник/робітник, волонтер, член родини тощо) щодо сприяння дотриманню режиму лікування:
— бути присутнім в момент вживання хворим антимікобактеріальних препаратів та АРВ-препаратів і переконатися, що хворий проковтнув препарати та запив їх водою;
— зразу ж після вживання добових доз препаратів у присутності хворого зробити відмітку про прийом препаратів у «Медичній картці лікування хворого на туберкульоз (ТБ 01)»;
— здійснювати контроль за прихильністю до прийому АРВ-препаратів.
/121/121.jpg)
При генералізованих формах ТБ до отримання результатів ТМЧ у осіб, які мають низький рівень СD4 (< 200 кл/мл), якщо протягом 3–4 тижнів стандартизованої терапії препаратами 1-го ряду спостерігається прогресування туберкульозного процесу, за рішенням ЦЛКК консиліуму стандартний режим ХТ може бути змінений на альтернативний режим: 2 HRZELfxKm 4 HRZ. У випадку отримання даних про наявність хіміорезистентності режим терапії має бути змінений на індивідуалізований відповідно до даних ТМЧ.
Тривалість ІФ і ПФ лікування така сама, як і у ВІЛ-негативних хворих. Лкування проводять згідно з УКПМД «Туберкульоз».
4.4.2. Основні стратегії лікування хворих на МРТБ/ВІЛ
Хворі з резистентними формами ТБ/ВІЛ лікуються відповідно до УКПМД «Туберкульоз».
Крім визначених в УКПМД «Туберкульоз» груп хворих з високим ризиком МРТБ (Rif+, контактні особи, хворі з невдачею повторного курсу ХТ), до групи високого ризику МРТБ належать ВІЛ-інфіковані хворі з невдачею першого курсу хіміотерапії, які мають низький рівень СD4 (< 200 кл/мл):
— хворі на туберкульоз легень з негативними результатами культурального дослідження мокротиння;
— хворі на позалегневий ТБ.
Цих пацієнтів необхідно представити на ЦЛКК ХР для визначення подальшої тактики лікування. У разі виключення інших причин невдалого лікування (пропуски доз, неповноцінна схема ХТ, відсутність ТБ, наявність інших опортуністичних інфекцій) за рішенням консиліуму пацієнту може бути виставлений діагноз РМРТБ і призначене стандартизоване лікування для 4-ї категорії: ZLfxCmPtCs.
Перед початком лікування хворим на туберкульоз легень/позалегеневий туберкульоз проводять культуральне дослідження мокротиння/промивних вод бронхів/пунктату лімфатичного вузла, їх реєструють за 4-ю кат. (РМРТБ) на період до остаточної верифікації діагнозу МРТБ (РРТБ) за результатами культурального дослідження. Якщо у пацієнта не отримують росту культури, то проводять увесь курс лікування стандартним режимом хіміотерапії. Якщо отримують позитивний результат культурального дослідження, то подальше лікування проводять за результатами ТМЧ: якщо МРТБ підтверджується, пацієнта переводять на індивідуальний режим ХТ згідно з даними ТМЧ.
4.4.3. Дозування протитуберкульозних препаратів згідно з УКПМД «Туберкульоз»
4.4.4. Використання кортикостероїдів у лікуванні хворих на ТБ/ВІЛ
У ВІЛ-інфікованих дорослих з ТБЛ або ТБ плеври кортикостероїди не підвищують виживаність, не зменшують кількість рецидивів і зазвичай не рекомендуються.
Стероїди призначають у випадках активного туберкульозного менінгіту та ТБ хребта і перикарду. При туберкульозному менінгіті у дорослих найбільш часто використовують наступні кортикостероїди і дози: дексаметазон 12–16 мг на день внутрішньовенно до тих пір, поки пацієнт почне приймати препарати всередину, далі можна використовувати таблетки. Преднізолон 60 мг на день протягом трьох тижнів із зниженням дози в наступні три тижні.
Використання стероїдів показано в інших ситуаціях, включаючи їх призначення для попередження стенозу сечовивідників при ТБ нирок або збільшених лімфатичних вузлів середостіння і ведення ТБ, пов’язаного із СВІС.
Кортикостероїди мають ризик підвищення артеріального тиску і рівня глюкози крові, що може призвести до затримки рідини в організмі. Не було відмічено підвищення ризику інфекційних ускладнень, хоча, за даними деяких досліджень, підвищується частота виникнення саркоми Капоші.
/122/122.jpg)
4.5. Лікування ВІЛ-інфекції у хворих на ТБ/ВІЛ
АРТ необхідно починати усім хворим на ТБ/ВІЛ незалежно від кількості CD4-клітин якомога раніше (перші 2–8 тижнів).
Якщо кількість CD4-клітин < 50 клітин/мкл, АРТ розпочинають негайно протягом перших 2 тижнів після призначення протитуберкульозного лікування.
При наявності туберкульозного менінгіту початок АРТ слід відкласти до завершення фази інтенсивної терапії ТБ.
На початку АРТ хворим, які отримують протитуберкульозне лікування, перевагу слід надавати ефавірензу, що призначають з 2 НІОТ.
Лікарі мають зважити ризики, що стосуються токсичності, побічних ефектів, СВІС, медикаментозну взаємодію.
У пацієнтів із ТБ, які мають низький рівень СD4 (< 100 кл/мл), АРТ покращує виживання.
АРТ рекомендується всім ВІЛ-інфікованим хворим на МРТБ, які потребують ПТП ІІ ряду, незалежно від кількості клітин CD4, причому починати її треба якомога раніше після початку протитуберкульозного лікування протягом перших 8 тижнів.
4.5.1. Призначення антиретровірусної терапії
Антиретровірусна терапія є стандартом лікування ВІЛ-інфекції.
Проведення АРТ разом з антимікобактеріальною терапією потребує ретельного спостереження за пацієнтами:
— через взаємодію рифампіцину та деяких антиретровірусних препаратів;
— необхідність прийому великої кількості таблеток;
— важливість досягнення високої прихильності до лікування;
— наявну токсичну дію препаратів;
— ризик розвитку синдрому відновлення імунної системи.
ННІЗТ: рифампіцин та ефавіренз. При масі тіла хворого більше 60 кг слід збільшувати дозу ефавірензу до 800 мг на добу. При масі тіла менше 60 кг слід призначати EFV у стандартній дозі (600 мг на добу). Рекомендованим є проведення терапевтичного лікарського моніторингу АРВ-препаратів через 2 тижні від початку АРТ.
Рифампіцин та етравірин. Не має жодних даних та не проведено жодних досліджень. Існує думка, що вони не повинні сумісно призначатися.
Рифабутин та ефавіренз. Якщо рифабутин призначається сумісно з ефавірензом, доза рифабутину повинна бути підвищена до 450 мг/добу через індукуючий ефект ефавірензу.
Рифабутин та етравірин. Рифабутин може бути призначений з етравірином без корекції доз.
У зв’язку з недостатнім клінічним досвідом застосування препарату для лікування вагітних, жінок, які годують груддю, і дітей Рифабутин не рекомендований для лікування цих груп хворих. (Інструкція до застосування препарату Рифабутин.)
Протипоказання до призначення рифабутину. Вагітність і період годування груддю, дитячий вік.
НІЗТ: взаємодія рифампіцину або рифабутину з НІЗТ відсутня. Рифампіцин не впливає на рівень НІЗТ, які не метаболізуються системою цитохромів печінки, тому корекція їх дози не потрібна.
ІП: поєднання ІП з рифампіцином не рекомендоване через їх несумісність. Рифабутин меншою мірою взаємодіє з ІП, тому його можна призначати замість рифампіцину в випадках одночасного проведення АРТ з застосуванням ІП. Рифабутин застосовують у дозі 150 мг 3 рази на тиждень при поєднанні з посиленими ІП лопінавір/ритонавір; саквінавір/ритонавір; дарунавір/ритонавір; атазанавір/ритонавір у стандартних дозах. При цьому слід проводити моніторинг показників функції печінки та, за можливості, терапевтичного лікарського моніторингу для ІП.
Бустерні ІП: більшість пацієнтів отримують інгібітори протеаз з низькими дозами ритонавіру (100 чи 200 мг/добу), користуючись їх самостійним ферментним інгібуванням. Ритонавір підвищує концентрацію інших інгібіторів протеаз, дозволяючи застосовувати більш переносимі дози.
Призначення комбінації лопінавір/ритонавір з додатковою дозою ритонавіру (загалом до 400 мг/добу ритонавіру, у два прийоми) у пацієнтів з невдачею застосування ненуклеозидних інгібіторів зворотної транскриптази, у яких виник ТБ, нормалізує рівень лопінавіру у 9 із 10 пацієнтів. Проте спостерігалася висока частота підвищення трансаміназ, ліпідів та шлунково-кишкової токсичності.
Ралтегравір із рифампіцином: слід застосовувати з обережністю (лише у випадку відсутності інших альтернатив). У випадку одночасного призначення доза ралтегравіру має бути подвоєною та становити 800 мг 2 рази на добу; дані про взаємодію ралтегравіру з рифабутином відсутні.
Режими антимікобактеріальної терапії без рифампіцину. Хворих на ко-інфекцію ТБ/ВІЛ можна лікувати режимами, що не включають рифампіцин, але вони малоефективні та супроводжуються високою частотою рецидивів. Вони мають бути розглянуті у пацієнтів із тяжкими токсичними реакціями від рифампіцину, де десенсибілізація та повторне введення останнього супроводжувалося невдачею, або у тих пацієнтів, МБТ яких має резистентність до рифампіцину.
/123/123.jpg)
Альтернативні схеми антиретровірусної терапії призначають відповідно до Клінічного протоколу антиретровірусної терапії ВІЛ-інфекції у дорослих та підлітків. АРТ у дітей проводять відповідно до УКПМД «ВІЛ-інфекція у дітей».
4.5.3. Невдача антиретровірусної терапії
ТБ, що виник на фоні АРТ без інших ознак імунодефіциту, не є критерієм неефективності лікування ВІЛ-інфекції. Схему АРТ змінювати недоцільно.
Якщо пацієнт отримував схеми із застосуванням ІП і на цьому фоні діагностовано ТБ, в схемах АМБТ рифампіцин слід замінити на рифабутин.
4.6. Синдром відновлення імунної системи (СВІС)
Після початку АРТ у деяких пацієнтів розвивається загострення симптомів і проявів чи рентгенологічна маніфестація ТБ, що обумовлено запальною реакцією на мікобактеріальну інфекцію через відновлення функції імунної системи.
СВІС характеризується погіршенням/негативною динамікою існуючих чи появою нових симптомів чи проявів хвороби, атиповою рентгенологічною картиною, що виникає після початку АРТ, і не є результатом невдачі лікування чи іншого хворобливого процесу. СВІС визначається як транзиторний синдром, але може тривати декілька місяців.
За виключенням тяжких випадків (прогресування туберкульозного менінгоенцефаліту і міліарного туберкульозу) розвитку СВІС АРТ не слід переривати.
Для СВІС характерно:
— очевидне прогресування туберкульозу;
— може виникати в цій же локалізації або в нових локалізаціях;
— може виникати в будь-який час після початку протитуберкульозного лікування;
— асоційований з початком чи продовженням АРТ.
СВІС найчастіше супроводжується лихоманкою та прогресуванням ураження лімфатичних вузлів, легень, появою плеврального чи перикардіального випоту, асциту, нових туберкулом ЦНС або їх прогресуванням.
Ведення випадку СВІС:
— Необхідно виключити невдачу лікування, гіперчутливість до препаратів та інші опортуністичні інфекції.
— Розглянути необхідність призначення глюкокортикостероїдів.
Лікування СВІС може потребувати застосування ГКС у середніх і високих добових дозах, іноді протягом тривалого періоду, для того щоб регулювати симптоми.
Рекомендується застосовувати преднізолон чи метилпреднізолон у дозах 1–1,5 мг/кг, з поступовою відміною протягом 1–2 тижнів.
Пацієнти, які отримують рифампіцин протягом 2 і більше тижнів, мають підвищений метаболізм ГКС, таким чином знижуючи ефективність ГКС на 33–50 %. Пацієнтам може знадобитися призначення ГКС протягом продовженого періоду часу, а СВІС може зазнати загострення, як тільки доза ГКС буде знижена, потребуючи більших доз.
При використанні ГКС у високих дозах виникають розлади обміну речовин та потенційний ризик розвитку тяжких інфекційних захворювань, наприклад цитомегаловірусного ретиніту.
4.7. Поєднання токсичних ефектів антиретровірусної та протитуберкульозної терапій
Побічні реакції широко поширені серед пацієнтів із ТБ/ВІЛ, особливо якщо вони паралельно знаходяться на АРТ.
Висип, лихоманка, гепатити — найбільш поширені побічні ефекти ПТП, особливо для рифампіцину, ізоніазиду та піразинаміду. Ненуклеозидні інгібітори зворотної транскриптази та ко-тримоксазол викликають аналогічні побічні реакції. Сумісне призначення цих препаратів призводить до труднощів клінічного прийняття рішення щодо їх ведення, особливо якщо побічні реакції від АРТ чи протитуберкульозної терапії розвинулися конкурентно.
4.8. Первинна профілактика ко-тримоксазолом
Пацієнтам одночасно з антимікобактеріальною терапією призначають ко-тримоксазол незалежно від рівня CD4-клітин на увесь курс лікування активного туберкульозу у дозі 960 мг один раз на день.
Дотримання режиму лікування ко-тримоксазолом дуже важливе, тому під час лікування ТБ ко-тримоксазол призначають під безпосереднім наглядом медичних працівників, одночасно з прийомом антимікобактеріальних препаратів.
4.9. Тактика ведення пацієнтів з ТБ/ВІЛ в особливих випадках
4.9.1. Ниркова недостатність
— Ізоніазид, рифампіцин і піразинамід практично повністю виводяться жовчю або метаболізуються до нетоксичних сполук. Відповідно, у випадку ниркової недостатності вказані препарати можна призначати у звичайних дозах.
— При тяжкій нирковій недостатності ізоніазид необхідно призначати одночасно з піридоксином для профілактики периферичної нейропатії.
— Стрептоміцин та етамбутол виводяться нирками. Вказані препарати необхідно застосовувати у менших дозах та при ретельному щомісячному контролі функції нирок (рівень креатиніну).
— У схемах АРТ необхідно уникати призначення тенофовіру через його відому нефротоксичність.
/124/124.jpg)
4.9.2. Ураження печінки
Гепатотоксичність більш притаманна для осіб, які зловживають алкоголем, та при ко-інфікуванні вірусом гепатиту С, а також у осіб, які приймають рифампіцин.
4.9.2.1. Гепатотоксичність визначається:
— якщо рівень аспартатамінотрансферази чи аланінамінотрансферази > 3 від верхньої межі норми при наявності симптомів, чи
— рівень АСТ чи АЛТ > 5 від верхньої межі норми при відсутності симптомів.
• Ізоніазид, рифампіцин і піразинамід можуть призводити до розвитку медикаментозного (токсичного) гепатиту.
• Серед вказаних препаратів піразинамід має найвищу гепатотоксичність, за ним слідує рифампіцин, котрий менше ушкоджує клітини печінки, проте може призвести до розвитку холестатичної жовтяниці.
• Для своєчасного виявлення будь-якого погіршення функції печінки необхідно регулярно оглядати пацієнта та досліджувати активність ферментів печінки; частота обстеження залежить від стану пацієнта.
4.9.2.2. Ведення гепатитів
— Негайно відмінити всі потенційно гепатотоксичні препарати, включаючи ізоніазид, рифампіцин, піразинамід, антиретровірусні препарати та ко-тримоксазол.
— Обстежити пацієнта на маркери крові вірусних гепатитів А, В та С.
— Виключити інші причини гепатотоксичності, включаючи алкоголь.
— Оскільки лікування ТБ може потребувати довшого часу, поки випадок гепатиту буде ідентифікований, може бути необхідним лікування із застосуванням двох чи більше ПТП без суттєвого ризику гепатотоксичності, таких як етамбутол, стрептоміцин, амікацин/канаміцин, капреоміцин чи фторхінолони.
— Частий моніторинг сироваткових рівнів АСТ (чи АЛТ), білірубіну та симптомів. Як тільки АСТ не перевищуватиме норму більш ніж вдвічі та наявна суттєва позитивна клінічна динаміка, препарати І ряду можуть бути відновлені з використаннями режимів поновлення терапії. Відновлення режиму можливе у повних добових дозах, як тільки рівень АСТ/АЛТ досягне < 100 МО/л.
— Якщо препарати не можуть бути поновлені чи початкова реакція становить загрозу для життя, повинні використовуватися альтернативні режими. Застосовують фторхінолони і аміноглікозиди.
4.9.2.3. Супутня патологія печінки
Усі пацієнти повинні бути обстежені на активні вірусні гепатити В та С. Найбільш високий ризик щодо гепатотоксичності серед осіб із супутньою патологією печінки становить піразинамід, потім ізоніазид, і тільки потім рифампіцин.
Ізоніазид і рифампіцин — незамінні препарати в короткострокових режимах протитуберкульозної терапії та повинні використовуватися в усіх можливих випадках, навіть при наявності супутньої патології печінки.
У пацієнтів із вихідними підвищеними рівнями трансаміназ поріг для встановлення гепатотоксичності має становити підвищення трансаміназ в 2–3 рази від верхньої межі норми.
При розвитку гепатотоксичності можуть бути використані інші режими з використанням фторхінолонів.
/124/124_2.jpg)
У пацієнтів із супутніми захворюваннями печінки повинен здійснюватися частий/ретельний клінічний і лабораторний моніторинг для розпізнавання медикаментозного ураження печінки. Цей контроль повинен включати визначення, як мінімум, кожні 2 тижні сироваткового рівня АСТ (чи АЛТ), визначення кількості тромбоцитів і протромбінового часу. Пацієнтам мають бути пояснені такі симптоми, як анорексія, нудота, блювання, біль у животі, жовтяниця, про виникнення яких вони мають обов’язково повідомити лікаря.
4.9.3. Шлунково-кишкові розлади
Біль в епігастрії/епігастральний біль, нудота, блювання — найбільш поширені/часті, особливо в перші 2–3 тижні після початку протитуберкульозної терапії. Якщо у пацієнта немає даних за наявні захворювання печінки і якщо не піддається симптоматичному лікуванню, наприклад поряд із застосуванням протиблювотних засобів, він може:
— приймати препараті під час їжі (за винятком доз рифампіцину нижче від 600 мг/добу); їжа затримує чи знижує всмоктування/абсорбцію ізоніазиду та рифампіцину, але ефект зменшується з невеликим клінічним значенням;
— змінити час дозування;
— включити в режими препарати, що не мають обмежень щодо прийомів їжі, такі як рифабутин, етамбутол, піразинамід та фторхінолони.
Необхідно уникати розділення дози ПТП, хоча розділення дози на 2 прийоми, наприклад піразинаміду, може покращити переносимість.
4.9.4. Периферична нейропатія
Нуклеозидні інгібітори зворотної транскриптази диданозин (ddI) та ставудин (d4T) викликають периферичну нейропатію, що посилюється додатковою токсичністю ізоніазиду, якщо він використовується з d4T. У пацієнтів, які вже отримують даний антиретровірусний препарат, повинна бути знайдена альтернатива ізоніазиду.
Усім пацієнтам, які отримують ізоніазид, повинен бути призначений піридоксин у добовій дозі 100 мг. При виникненні периферичної нейропатії доза піридоксину має бути підвищена до 200 мг тричі на добу.
d4T не повинен використовуватись як складова АРТ режиму, якщо відбувається одночасне призначення з ізоніазидом.
4.9.5. Висип
Висип, як правило, помірний або середнього ступеня тяжкості і виникає переважно в перші 2 місяці лікування. Висип середнього ступеня тяжкості без залучення слизових оболонок може лікуватись симптоматично. Більш поширений і прогресуючий висип, що супроводжується системними симптомами, вимагає відміни всіх препаратів та під час одужання обережного повторного введення препаратів відповідно до протоколу.
4.9.6. Абсорбція препаратів
У ВІЛ-інфікованих повідомлялося про мальабсорбцію всіх ПТП І ряду, а також етіонаміду та циклосерину. Також всмоктування препаратів може знижуватися у пацієнтів із низьким рівнем СD4-клітин через ентеропатію, зумовлену ВІЛ, та ВІЛ-асоційовані захворювання стравоходу. Субтерапевтична плазменна концентрація може призвести до невдачі лікування та розвитку резистентності до ПТП.
4.9.7. Жінки репродуктивного віку
— Рифампіцин та деякі АРВ-препарати (переважно ІП) знижують рівень естрогенів у крові; при цьому відповідно знижується ефективність пероральних контрацептивів, що містять естроген.
— У випадку використання надійних методів контрацепції жінка з ко-інфекцією ТБ/ВІЛ може отримувати стандартне протитуберкульозне лікування та ті ж схеми АРТ, що й чоловіки, включаючи ефавіренз. Якщо неможливо гарантувати надійну контрацепцію, призначення ефавірензу протипоказане, у даному випадку рекомендується використання схем з абакавіром.
— Для профілактики суперінфікування іншим штамом ВІЛ або збудниками ІПСШ усім жінкам з ТБ/ВІЛ рекомендують використання презервативів.
4.9.8. Вагітні жінки
— Для вагітних показання для призначення антимікобактеріальної терапії та АРТ такі самі, як у інших пацієнтів.
— Більшість ПТП І ряду безпечні для вагітних, за виключенням стрептоміцину, канаміцину, амікацину, капреоміцину, що мають ототоксичну дію на плід. Указані препарати не можна використовувати в період вагітності. Уникати застосування етіонаміду/протіонаміду, що можуть збільшувати частоту виникнення нудоти, блювоти на фоні вагітності, а також проявляти тератогенну дію.
— У випадку якщо жінка вирішує залишити вагітність і народжувати дитину, їй призначаються АРВ-препарати відповідно до національного протоколу.
— Застосування ефавірензу на ранніх стадіях вагітності не приводить до збільшення уроджених вад розвитку дитини або інших проявів токсичності препарату.
— При відповідному проведенні антимікобактеріальної терапії та АРТ спостереження за лікуванням вагітних проводять на підставі загальних рекомендацій для дорослих пацієнтів.
4.9.9. Споживачі ін’єкційних наркотиків
Ведення СІН з ТБ/ВІЛ має такі особливості:
— взаємодія антимікобактеріальних та АРВ-препаратів із нелегальними наркотиками та препаратами замісної терапії опіоїдів приводить до підвищення гепатотоксичності, що потребує ретельного моніторингу функції печінки;
— рифампіцин знижує рівень метадону в крові на 33–68 %, що може викликати абстинентний синдром та потребуватиме підвищення дози метадону. Альтернативою в таких випадках є застосування рифабутину;
— особам, які отримують замісну терапію метадоном, протипоказане призначення рифампіцину у комбінації з лопінавіром/ритонавіром. Альтернативою у таких випадках може бути призначення рифабутину у дозі 150 мг 3 рази на тиждень у поєднанні з лопінавіром/ритонавіром;
— ефавіренз, невірапін, лопиновір, посилений ритонавіром, викликають зниження концентрації метадону, що може призвести до абстинентного синдрому. Клінічний ефект проявляється через 7 днів сумісного прийому і може бути посилений за рахунок збільшення дози метадону на 5–10 мг в день до тих пір, поки не буде досягнутий необхідний для замісної терапії ефект;
— бупренорфін має більш безпечний, ніж метадон, профіль щодо лікарських взаємодій з антиретровірусними препаратами;
— СІН мають підвищений ризик одночасного інфікування вірусами гепатиту В та/або С і можливою взаємодією препаратів для лікування хворих на ТБ та ВІЛ-інфекцію. Лікування вірусного гепатиту С пегілірованим інтерфероном і рибавірином має бути відкладеним до кінця лікування туберкульозу;
— ймовірність порушення режиму лікування у СІН вище;
— несвоєчасна діагностика як ВІЛ-інфекції, так і ТБ через обмежений доступ цієї категорії пацієнтів до медичних послуг.
Необхідна тісна взаємодія з програмами зменшення шкоди та програм ЗПТ для надання СІН ефективних послуг, включаючи інформаційно-освітні програми, скринінг, хіміопрофілактику ТБ та прийом препаратів під контролем медичного працівника, а також виявлення СІН, які ухиляються від лікування, з метою їх залучення до лікування, у тому числі примусового.
4.10. Моніторинг пацієнтів з ТБ/ВІЛ
4.10.1. Контроль антимікобактеріальної терапії
У більшості пацієнтів лікування ТБ є ефективним (за винятком випадків медикаментозної стійкості МБТ), і приблизно з 2–3-го тижня їх стан починає покращуватися. Проте при виявленні ТБ на пізніх стадіях ВІЛ-інфекції або при пізньому встановленні діагнозу обох інфекцій на тлі лікування можуть спостерігатися клінічні або рентгенологічні ознаки прогресування ТБ.
Протягом перших 2–4 тижнів лікування хворих на ТБ доцільніше проводити у стаціонарі для забезпечення повноцінного спостереження за пацієнтом, включаючи лабораторне обстеження 1 раз на тиждень, включаючи визначення АЛТ (щонайменше через 4 тижні від початку лікування).
Необхідно регулярно оцінювати, чи дотримується він режиму прийому препаратів. У виняткових випадках причиною неефективності лікування може бути порушення всмоктування препаратів через хронічну діарею; у такому випадку необхідно забезпечити парентеральне введення АМБ-препаратів. У ВІЛ-інфікованих пацієнтів всмоктування рифампіцину може порушуватися і за відсутності діареї. При виражених побічних ефектах з боку шлунково-кишкового трату (їх частота у пацієнтів з ВІЛ-інфекцією сягає 10 %) можливо призупинити АРТ до припинення симптомів, не перериваючи при цьому лікування ТБ.
У випадку ефективного лікування після завершення підтримуючої фази АМБТ припиняється.
Прогноз щодо ТБ за умови виконання призначень сприятливий, за винятком пацієнтів з МРТБ, який потребує комплексного лікування у протитуберкульозних закладах.
4.10.2. Контроль антиретровірусної терапії
Контроль АРТ повинен включати спостереження за динамікою клінічних симптомів, імунологічними та вірусологічними показниками, токсичністю та побічними ефектами АРВ-препаратів. Після початку АРТ, особливо у пацієнтів з вираженим імунодефіцитом, може розвиватися синдром відновлення імунної системи. Клінічне загострення симптоматики після початкового покращення відмічається майже у третини пацієнтів з ко-інфекцією ТБ/ВІЛ, які розпочинають АРТ. Як правило, загострення симптоматики спостерігається через 2 місяці від початку АРТ, проте у деяких пацієнтів і через 5 діб.
4.11. Порядок спостереження за пацієнтами, які отримують високоактивну антиретровірусну терапію та антимікобактеріальну терапію
4.12. Дотримання режиму лікування
Досягнення найкращих результатів лікування як ТБ, так й ВІЛ-інфекції можливе лише за умови формування високого рівня прихильності до лікування.
Прихильність до лікування означає, що пацієнт:
— вчасно приймає ліки;
— завершує повний курс антимікобактеріальної терапії, як інтенсивної, так і підтримуючої фази, яка проводиться переважно в амбулаторних умовах;
— дотримується рекомендацій щодо дієти під час призначення АРТ;
— дотримується призначеного лікарем режиму лікування (безперервність АРТ, кратність прийому ліків, їх дозування, інші спеціальні рекомендації).
Низький рівень прихильності корелює також з підвищеним ризиком прогресування захворювання й, таким чином, збільшує витрати на лікування опортуністичних інфекцій, госпіталізацію, непрацездатність, догляд за тяжким хворим.
Перешкоди до формування високої прихильності та стратегії її покращення наведені у національному клінічному протоколі антиретровірусної терапії ВІЛ-інфекції у дорослих та підлітків.
4.13. Алгоритм виписки зі стаціонару
/127/127_2.jpg)
4.15. Профілактичне лікування ізоніазидом
Проведення шкірних проб для виявлення латентної інфекції у ЛЖВ не є обов’язковим для початку профілактичного лікування ізоніазидом.
Профілактичне лікування ізоніазидом починають в ЛЖВ, в яких виключений активний туберкульоз.
Хіміопрофілактика туберкульозу у ВІЛ-інфікованих осіб проводиться 6-місячним курсом ізоніазиду 5 мг/кг маси тіла (не більше 0,3 г) 1 раз на рік до стійкого підвищення рівня CD4-клітин вище 500 в 1 мл.
V. Ресурсне забезпечення виконання протоколу
5.1. Вимоги для закладів, що надають первинну медичну допомогу
5.1.1. Кадрові ресурси
Лікар загальної практики — сімейний лікар; медична сестра загальної практики — сімейної медицини (сестра медична, фельдшер).
5.1.2. Матеріально-технічне забезпечення
Оснащення
Відповідно до табелю оснащення
Лікарські засоби
Ізоніазид, рифампіцин, піразинамід, етамбутол (передаються за Актом прийому-передачі у вигляді Індивідуальних місячних наборів з протитуберкульозних закладів).
Антиретровірусні препарати видаються пацієнтам у регіональних центрах СНІДу.
5.2. Вимоги для закладів, що надають вторинну медичну допомогу
5.2.1. Кадрові ресурси
Лікарі — спеціалісти з внутрішніх хвороб, фтизіатри, медична сестра тубкабінету/поліклініки міськ(рай)тубдиспансеру/ДОТ кабінету, лікарі-інфекціоністи, лікарі кабінетів «Довіра».
5.2.2. Матеріально-технічне забезпечення
Оснащення
Відповідно до табельного оснащення
Лікарські засоби
ПТП 1-го і 2-го ряду; антиретровірусні препарати; ко-тримоксазол.
VI. Клінічні індикатори
Перелік індикаторів
6.1. Наявність у лікаря загальної практики — сімейного лікаря, лікарів-фтизіатрів, лікарів-інфекціоністів, лікарів кабінетів «Довіра» та Центрів профілактики та боротьби зі СНІДом локального протоколу ведення пацієнта з ТБ/ВІЛ.
6.2. Охоплення КіТ на ВІЛ-хворих на ТБ (абсолютна кількість осіб та %).
6.3. Охоплення профілактичним лікуванням ко-тримоксазолом (абсолютна кількість та %).
6.4. Відсоток хворих на ТБ/ВІЛ, які отримали АРТ (абсолютна кількість та %).
Обчислення індикаторів
6.1. Назва індикатора.
Наявність у лікаря загальної практики — сімейного лікаря локального протоколу ведення пацієнта з ТБ/ВІЛ
6.1.1. Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги. Індикатор ґрунтується на положеннях даного Протоколу.
6.1.2. Організація (заклад охорони здоров’я), що має обчислювати індикатор. Обласний, районний, міський лікар-фтизіатр. Структурні підрозділи з питань охорони здоров’я місцевих державних адміністрацій.
6.1.3. Організація (заклад охорони здоров’я), що надає необхідні вихідні дані. Дані про кількість пацієнтів, які складають чисельник та знаменник індикатора, надаються лікарями-фтизіатрами (протитуберкульозні заклади 2-го та 3-го рівнів), розташованими в районі обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
6.1.4. Характеристики знаменника індикатора.
6.1.5.1. Джерело (первинний документ). Форму первинної облікової документації № 081-1/о «Медична картка лікування хворого на туберкульоз ТБ 01», що затверджена наказом МОЗ України від 02.09.2009 № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення».
6.1.5.2. Опис знаменника. Знаменник індикатора складає загальна кількість лікарів загальної практики — сімейних лікарів (амбулаторій сімейної медицини, центрів первинної медико-санітарної допомоги), зареєстрованих у районі обслуговування.
6.1.6. Характеристики чисельника індикатора.
6.1.6.1. Джерело (первинний документ). ЛПМД, наданий лікарем загальної практики — сімейним лікарем (амбулаторією сімейної медицини, центром первинної медико-санітарної допомоги).
6.1.6.2. Опис чисельника. Чисельник індикатора складає загальна кількість лікарів загальної практики — сімейних лікарів (амбулаторій сімейної медицини, центрів первинної медико-санітарної допомоги), зареєстрованих у районі обслуговування, для яких задокументований факт наявності локального протоколу медичної допомоги пацієнтам з ТБ/ВІЛ (наданий екземпляр ЛПМД).
6.1.7. Алгоритм обчислення індикатора.
6.1.7.1. Тип підрахунку. Ручне обчислення.
6.1.7.2. Детальний опис алгоритму. Індикатор обчислюється структурними підрозділами з питань охорони здоров’я місцевих державних адміністрацій після надходження інформації від усіх лікарів загальної практики — сімейних лікарів (амбулаторій сімейної медицини, центрів первинної медико-санітарної допомоги), зареєстрованих у районі обслуговування. Значення індикатора обчислюється як відношення чисельника до знаменника та наводиться у відсотках.
6.1.8. Зауваження щодо інтерпретації та аналізу індикатора. Даний індикатор характеризує організаційний аспект запровадження сучасних медико-технологічних документів (ЛПМД) у закладах регіону, що надають первинну медичну допомогу. Якість медичної допомоги пацієнтам, хворим на туберкульоз, відповідність надання медичної допомоги вимогам ЛПМД, відповідність ЛПМД чинним УКПМД даним індикатором висвітлюватися не може, але для аналізу цих аспектів необхідне обов’язкове запровадження ЛПМД в закладах охорони здоров’я.
Бажаний рівень значення індикатора:
2014 р. — 50 %;
2015 р. — 90 %;
2016 р. та подальший період — 100 %.
6.2. Назва індикатора.
Охоплення КіТ (ДКТ та тестування) на ВІЛ-хворих на ТБ (абсолютна кількість осіб та %)
6.2.1. Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги. Індикатор ґрунтується на положеннях зазначеного протоколу.
6.2.2. Організація (заклад охорони здоров’я), що має обчислювати індикатор. Обласний, районний, міський лікар-фтизіатр. Структурні підрозділи з питань охорони здоров’я місцевих державних адміністрацій.
6.2.3. Організація (заклад охорони здоров’я), що надає необхідні вихідні дані. Дані про кількість пацієнтів, які складають чисельник та знаменник індикатора, надаються лікарями-фтизіатрами (протитуберкульозні заклади 2-го та 3-го рівнів), розташованими в районі обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
6.2.4. Характеристики знаменника індикатора.
6.2.4.1. Джерело (первинний документ). Форму первинної облікової документації № 081-1/о «Медична картка лікування хворого на туберкульоз ТБ 01», що затверджена наказом МОЗ України від 02.09.2009 № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення».
6.2.4.2. Опис знаменника. Знаменник індикатора складає загальна кількість пацієнтів із вперше виявленим туберкульозом, які були зареєстровані у звітному періоді.
6.2.6. Характеристики чисельника індикатора.
6.2.6.1. Джерело (первинний документ). Форма первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1», що затверджена наказом МОЗ України від № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення».
6.2.6.2. Опис чисельника. Чисельник індикатора складає загальна кількість пацієнтів із вперше виявленим туберкульозом, які були зареєстровані у звітному періоді і пройшли КіТ (ДКТ та тестування (пп. 5.2 + 1.2)).
6.2.7. Алгоритм обчислення індикатора.
6.2.7.1. Тип підрахунку. Ручне обчислення. При наявності автоматизованої технології, в якій обробляються формалізовані дані щодо медичної допомоги в обсязі, що «Медична картка лікування хворого на туберкульоз ТБ 01» (форма № 081-1/о) та Форми первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1» — автоматизована обробка.
6.2.7.2. Детальний опис алгоритму. Індикатор обчислюється лікарем-фтизіатром шляхом ручного або автоматизованого аналізу інформації Форми первинної облікової документації № 081-1/о «Медична картка лікування хворого на туберкульоз ТБ 01» та Медичної картки лікування хворого на туберкульоз ТБ 01 (форма № 081-1/о), що затверджені наказом МОЗ України від 02.09.2009 № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення». Індикатор обчислюється оргметодвідділами обласних протитуберкульозних закладів після надходження від усіх лікарів-фтизіатрів інформації щодо загальної кількості пацієнтів лікаря-фтизіатра з діагнозом «ВДТБ», які були зареєстровані у звітному кварталі, а також тих з них, хто пройшов КіТ (ДКТ та тестування). Значення індикатора обчислюється як відношення чисельника до знаменника та наводиться у відсотках.
6.2.8. Зауваження щодо інтерпретації та аналізу індикатора. При аналізі індикатора слід враховувати неприпустимість формального та необґрунтованого віднесення до чисельника індикатора тих пацієнтів, які не пройшли КіТ протягом звітного періоду. В первинній медичній документації мають бути задокументовані дата та схема початку лікування. Пацієнти, для яких такі записи в медичній документації відсутні, не включаються до чисельника індикатора. Цільовий (бажаний) рівень значення індикатора на етапі запровадження УКПМД не визначається заради запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
6.3. Назва індикатора.
Охоплення профілактичним лікуванням ко-тримоксазолом (абсолютна кількість та %)
6.3.1. Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги. Індикатор ґрунтується на положеннях даного протоколу.
6.3.2. Організація (заклад охорони здоров’я), що має обчислювати індикатор. Обласний, районний, міський лікар-фтизіатр. Структурні підрозділи з питань охорони здоров’я місцевих державних адміністрацій.
6.3.3. Організація (заклад охорони здоров’я), що надає необхідні вихідні дані. Дані про кількість пацієнтів, які складають чисельник та знаменник індикатора, надаються лікарями-фтизіатрами (протитуберкульозні заклади 2-го та 3-го рівнів), розташованими в районі обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
6.3.4. Характеристики знаменника індикатора.
6.3.5.1. Джерело (первинний документ). Форма первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1», що затверджена наказом МОЗ України від № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення».
6.3.5.2. Опис знаменника. Знаменник індикатора складає загальна кількість пацієнтів із ТБ/ВІЛ, які були зареєстровані у звітному періоді.
6.3.6. Характеристики чисельника індикатора.
6.3.6.1. Джерело (первинний документ). Форма первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1», що затверджена наказом МОЗ України від № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення».
6.3.6.2. Опис чисельника. Чисельник індикатора складає загальна кількість пацієнтів із ТБ/ВІЛ, які були зареєстровані у звітному періоді і якім було призначено ко-тримоксазол (п. 1.4).
6.3.7. Алгоритм обчислення індикатора.
6.3.7.1. Тип підрахунку. Ручне обчислення. При наявності автоматизованої технології, в якій обробляються формалізовані дані щодо медичної допомоги в обсязі, Форми первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1» — автоматизована обробка.
6.3.7.2. Детальний опис алгоритму. Індикатор обчислюється лікарем-фтизіатром шляхом ручного або автоматизованого аналізу інформації Медичної картка лікування хворого на туберкульоз ТБ 01 (форма № 081-1/о), що затверджена наказом МОЗ України від 02.09.2009 № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення». Індикатор обчислюється оргметодвідділами обласних протитуберкульозних закладів після надходження від усіх лікарів-фтизіатрів інформації щодо загальної кількості пацієнтів лікаря-фтизіатра з діагнозом ТБ/ВІЛ, які були зареєстровані у звітному кварталі, а також тих з них, хто отримав ко-тримоксазол. Значення індикатора обчислюється як відношення чисельника до знаменника та наводиться у відсотках.
6.3.8. Зауваження щодо інтерпретації та аналізу індикатора. При аналізі індикатора слід враховувати неприпустимість формального та необґрунтованого віднесення до чисельника індикатора тих пацієнтів з ТБ/ВІЛ, які не отримали ко-тримоксазол протягом звітного періоду. В первинній медичній документації має бути задокументована дата початку лікування ко-тримоксазолом. Пацієнти, для яких такі записи в медичній документації відсутні, не включаються до чисельника індикатора. Цільовий (бажаний) рівень значення індикатора на етапі запровадження УКПМД не визначається заради запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
6.4. Назва індикатора.
Відсоток хворих на ТБ/ВІЛ, які отримали АРТ (абсолютна кількість та %)
6.4.1. Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги. Індикатор ґрунтується на положеннях даного протоколу.
6.4.1.1. Організація (заклад охорони здоров’я), що має обчислювати індикатор. Обласний, районний, міський лікар-фтизіатр. Структурні підрозділи з питань охорони здоров’я місцевих державних адміністрацій.
6.4.2. Організація (заклад охорони здоров’я), що надає необхідні вихідні дані. Дані про кількість пацієнтів, які складають чисельник та знаменник індикатора, надаються лікарями-фтизіатрами (протитуберкульозні заклади 2-го та 3-го рівнів), розташованими в районі обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
6.4.3. Характеристики знаменника індикатора.
6.4.3.1. Джерело (первинний документ). Форма первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1», що затверджена наказом МОЗ України від № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення».
6.4.3.2. Опис знаменника. Знаменник індикатора складає загальна кількість пацієнтів із ТБ/ВІЛ, які були зареєстровані у звітному періоді.
6.4.4. Характеристики чисельника індикатора.
6.4.4.1. Джерело (первинний документ). Форма первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1», що затверджена наказом МОЗ України від № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення».
6.4.4.2. Опис чисельника. Чисельник індикатора складає загальна кількість пацієнтів із ТБ/ВІЛ, які були зареєстровані у звітному періоді і які отримували АРТ (п. 1.3).
6.4.5. Алгоритм обчислення індикатора.
6.4.5.1. Тип підрахунку. Ручне обчислення. При наявності автоматизованої технології, в якій обробляються формалізовані дані щодо медичної допомоги в обсязі, Форми первинної облікової документації № 081-2/о «Фактори впливу на перебіг захворювання та на результат лікування ТБ 01-1» — автоматизована обробка.
6.4.5.2. Детальний опис алгоритму. Індикатор обчислюється лікарем-фтизіатром шляхом ручного або автоматизованого аналізу інформації Медичної картка лікування хворого на туберкульоз ТБ 01 (форма № 081-1/о), що затверджена наказом МОЗ України від 02.09.2009 № 657 «Про затвердження форм первинної облікової документації і форм звітності з туберкульозу та інструкцій щодо їх заповнення». Індикатор обчислюється оргметодвідділами обласних протитуберкульозних закладів після надходження від усіх лікарів-фтизіатрів інформації щодо загальної кількості пацієнтів лікаря-фтизіатра з діагнозом ТБ/ВІЛ, які були зареєстровані у звітному кварталі, а також тих з них, хто отримав АРТ. Значення індикатора обчислюється як відношення чисельника до знаменника та наводиться у відсотках.
6.4.6. Зауваження щодо інтерпретації та аналізу індикатора. При аналізі індикатора слід враховувати неприпустимість формального та необґрунтованого віднесення до чисельника індикатора тих пацієнтів з ТБ/ВІЛ, які не отримали АРТ протягом звітного періоду. В первинній медичній документації мають бути задокументовані дата початку лікування АРТ. Пацієнти, для яких такі записи в медичній документації відсутні, не включаються до чисельника індикатора. Цільовий (бажаний) рівень значення індикатора на етапі запровадження УКПМД не визначається заради запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
Директор департаменту медичної допомоги
Світлана Хотіна
Список літератури знаходиться в редакції

/99/99.jpg)
/100/100.jpg)
/103/103.jpg)
/104/104.jpg)
/105/105.jpg)
/106/106.jpg)
/107/107.jpg)
/108/108.jpg)
/109/109.jpg)
/110/110.jpg)
/111/111.jpg)
/112/112.jpg)
/113/113.jpg)
/114/114.jpg)
/115/115.jpg)
/116/116.jpg)
/117/117.jpg)
/118/118.jpg)
/119/119.jpg)
/120/120.jpg)
/126/126.jpg)
/127/127.jpg)