Журнал «Почки» 3 (13) 2015
Вернуться к номеру
3G ІСШ у дитячому віці
Рубрики: Нефрология
Разделы: Руководства
Версия для печати
Статья опубликована на с. 59-76
3G.1. Вступ
У дітей ІСШ є частою проблемою, хоч і незначно меншою, ніж захворювання верхніх дихальних шляхів та інфекції шлунково-кишкового тракту. Захворюваність залежить від віку й статі. У перший рік життя, в основному в перші 3 місяці, ІСШ частіше зустрічається у хлопчиків (3,7 %), ніж у дівчаток (2 %), після чого захворюваність зменшується до 3 % у дівчаток і 1,1 % у хлопчиків. Дитяча ІСШ є найбільш поширеною причиною лихоманки невідомого походження у хлопчиків віком < 3 років. Клінічна симптоматика ІСШ у грудних дітей та дітей молодшого віку може проявлятися від лихоманки до симптомів шлунково-кишкового тракту та симптомів з боку нижніх або верхніх сечових шляхів.
(Додаткове) дослідження має бути проведене після двох епізодів ІСШ у дівчаток і одного в хлопчиків (GR: B). Метою є виключення виникнення обструкції, везикоуретрального (міхурово-сечовідного) рефлюксу (ВУР) і дисфункціонального сечовипускання, наприклад, викликаного нейропатичними розладами.
Формування ниркових рубців унаслідок хронічного пієлонефриту розвивається дуже рано через поєднання ІСШ, внутрішньониркового рефлюксу і ВУР. Іноді цей процес виникає внутрішньоутробно внаслідок дисплазії. Формування ниркових рубців може призвести до тяжких тривалих ускладнень, таких як гіпертензія і хронічна ниркова недостатність, хоча це трапляється рідко.
ВУР лікують довгостроковими профілактичними дозами антибіотиків (GR: В). Повторна хірургічна імплантація або ендоскопічне лікування залишаються опцією вибору для невеликого числа дітей з маніфестними рецидивами інфекції (GR: B).
Для лікування ІСШ у дітей короткі курси не рекомендовані, тому лікування продовжують протягом 5–7 днів і більше (GR: А). Якщо дитина тяжко хворіє, з блюванням і зневодненням, рекомендовані госпіталізація й парентеральне введення антибіотиків від самого початку (GR: А). Для отримання додаткової інформації, будь ласка, зверніться до дитячих урологічних настанов EAU.
3G.2. Епідеміологія, етіологія й патофізіологія
Сечовивідні шляхи є поширеним джерелом інфекції в дітей і немовлят. ІСШ являють собою найбільш поширену бактеріальну інфекцію в дітей < 2 років [162] (LE: 2а). Наслідки ІСШ зазвичай сприятливі, але в ранньому дитинстві вони можуть прогресувати до формування ниркових рубців, особливо в поєднанні з вродженими аномаліями розвитку сечовивідних шляхів. Пізні ускладнення, пов’язані з формуванням ниркових рубців, включають гіпертензію, протеїнурію, пошкодження нирок і навіть хронічну ниркову недостатність, що часто вимагає діалізу в дорослому віці [163] (LE 2а).
Ризик ІСШ протягом першого десятиліття життя становить 1 % у хлопчиків і 3 % у дівчаток [6]. Існує думка, що до 5 % школярок і до 0,5 % школярів мають принаймні один епізод ІСШ у шкільному віці. Захворюваність відрізняється в дітей віком < 3 місяців. У цьому віці ІСШ частіше зустрічаються в хлопчиків. Захворюваність на безсимптомну бактеріурію становить 0,7–3,4 % у новонароджених, 0,7–1,3 % — у дітей віком < 3 місяці і 0,2–0,8 % — у хлопчиків і дівчаток дошкільного віку [6]. Симптоматична бактеріурія виникає в 0,14 % новонароджених із подальшим збільшенням до 0,7 % у хлопчиків і 2,8 % дівчаток віком < 6 місяців. Загальна частота рецидивів у неонатальному періоді, за повідомленнями [6, 164], становить 25 %.
Найбільш частими патогенами є грамнегативні мікрооорганізми, головним чином кишкові бактерії. Серед них E.coli є причиною 90 % епізодів ІСШ [165]. Грам-позитивні бактерії (зокрема, ентерококи і стафілококи) є причиною захворювання в 5–7 % випадків. Внутрішньолікарняні інфекції представлені більш широким спектром агресивних бактерій, таких як Klebsiella, Serratia і Pseudomonas sp. Стрептококи групи A і B є досить поширеними в новонароджених дітей [166]. Існує зростаюча тенденція до відокремлення S.saprophyticus у ІСШ у дітей, хоча роль цієї бактерії досі дискутується [167].
Сечовивідні шляхи є стерильним простором з непроникною вистілкою. Ретроградний закид є найбільш поширеним механізмом зараження. Внутрішньолікарняні інфекції та залучення сечовивідних шляхів у рамках системної інфекції зустрічаються рідше [168].
Обструкція та дисфункція є одними з найпоширеніших причин інфекції сечових шляхів. Фімоз викликає схильність до ІСШ [169, 170] (LE: 2а). Ентеробактерії як складова кишкової флори колонізують препуціальний мішок, залозисту поверхню та дистальну уретру. Серед цих бактерій є штами E.coli, що експресують фімбрії, які прилипають до внутрішнього шару шкіри крайньої плоті та клітин уроепітелію [171].
Широкий спектр уроджених аномалій сечових шляхів може призвести до ІСШ через обструкцію, наприклад, клапанів уретри, мисково-сечовідного сегмента або сечовий застій необструктивного генезу (наприклад, синдром недостатності м’язів живота, або ВУР). Рідкісними, але важливими причинами ІСШ є зрощення статевих губ і хронічний запор [167].
Дисфункціональні сечовипускання у нормальної дитини можуть бути результатом нечастих спорожнень сечового міхура з причини різноманітних поз, таких як схрещені ноги, сидіння на п’ятах [172]. Нейропатична дисфункція сечового міхура (наприклад, розщеплення хребта або дисинергія сфінктера) може призвести до появи залишкової сечі після сечовипускання і вторинного ВУР [164].
Зв’язок між ураженням нирок та ІСШ є суперечливим. Механізм обструктивної нефропатії очевидний, але менш помітні зміни відбуваються за наявності ВУР. Майже необхідними компонентами для розвитку ураження нирок є ВУР, внутрішньонирковий рефлюкс та ІСШ. Усі ці фактори діють разом у ранньому дитинстві, коли нирка, що росте, ймовірно, є сприйнятливою до паренхіматозних інфекцій. Пізніше в дитинстві наявність бактеріурії, напевно, не має відношення до прогресування наявних рубців або є рідкісною причиною формування нових рубців. Інший фактор, що викликає непорозуміння, це те, що багато так званих рубців є насправді диспластичною нирковою тканиною, яка розвинулась в утробі [173].
Симптоми неспецифічні й варіюють залежно від віку дитини й тяжкості захворювання. Епідидимоорхіт є рідкісним. За наявності болю в мошонці та запалення потрібно розглянути можливість перекруту яєчка.
ІСШ у новонароджених можуть бути неспецифічними і без специфічної локалізації. У маленьких дітей ІСШ може проявлятися симптомами з боку шлунково-кишкового тракту, таких як блювання й діарея. У перші тижні життя 13,6 % пацієнтів з лихоманкою мають ІСШ [174]. Іноді може виникати септичний шок. Ознаки ІСШ можуть бути нечіткими в маленьких дітей, але пізніше, коли вони досягають віку 2 років, часті сечовипускання, диз–урія й надлонний, абдомінальний або поперековий біль можуть з’являтися з лихоманкою або без неї.
3G.3. Системи класифікації
ІСШ можуть бути класифіковані як перший епізод чи рецидив або відповідно до тяжкості пребігу (легкий або тяжкий). Рецидивуючі ІСШ можуть бути поділені на три групи [168]:
— Нерозв’язані інфекції: субтерапевтичний рівень антимікробної терапії, недотримання режиму лікування, мальабсорбція, резистентні патогени.
— Бактеріальна персистенція: може бути через вогнища персистуючої інфекції в сечовивідних шляхах. Можуть бути необхідними хірургічна корекція або медикаментозне лікування дисфункції сечовивідних шляхів.
— Реінфекція: кожен епізод є новою інфекцією, спричиненою періуретральною, промежинною або прямокишковою флорою.
З клінічного погляду тяжкі й прості форми ІСШ слід диференціювати, тому що певний ступінь серйозності симптомів диктує ступінь терміновості дослідження й лікування (табл. 10).
Тяжка ІСШ: тяжка ІСШ пов’язана з наявністю лихоманки > 39 °C, поганим самопочуттям, персистуючим блюванням й помірною або тяжкою дегідратацією.
Легка ІСШ: дитина з легкою ІСШ може мати тільки м’яку лихоманку, має змогу пити й приймати ліки всередину. Дитина зневоднена лише незначно або не зневоднена й має добрий очікуваний рівень відповіді на терапію. Коли очікується низький рівень відповіді на терапію, дитина повинна бути ведена як така, яка має тяжку ІСШ.
3G.4. Діагностична оцінка
3G.4.1. Фізикальне обстеження
Обов’язковим є огляд на предмет фімозу, зрощення статевих губ, ознак пієлонефриту, епідидимоорхіту й стигми розщеплення хребта (spina bifida), наприклад ділянки з надмірним оволосінням на шкірі крижів. Відсутність лихоманки не виключає наявність інфекційного процесу.
3G.4.2. Лабораторні аналізи
Остаточний діагноз інфекції в дітей вимагає отримання позитивної культури сечі [168, 175]. Сеча повинна бути отримана згідно з вимогами до зразка сечі при проведенні бактеріологічного посіву сечі [176]. Позитивний посів сечі визначається як присутність > 100 000 КУО/мл одного патогену. Зразок сечі може бути складно отримати у дітей віком < 4 років, тому існують різні поради з цього приводу і є високий ризик контамінації такого зразка сечі [177, 178].
3G.4.2.1. Забір сечі
Надлонна аспірація з сечового міхура: найбільш чутливий метод, хоча сеча може бути отримана у 23–99 % випадків [168, 177].
Катетеризація сечового міхура: це також дуже чутливий метод, хоча є ризик зараження внутрішньолікарняними збудниками [168, 179].
Пластиковий мішок, що кріпиться до геніталій: проспективні дослідження показали високу частоту хибнопозитивних результатів із рівнем 85–99 % [168, 177]. Це корисно, якщо культура є негативною [168, 177], і має прогностичну позитивну цінність 15 % [176]. Щоб правильно отримати зразок сечі в дітей віком < 2 років (у дівчаток і необрізаних хлопчиків без самостійного контролю дефекації), краще використовувати надлонну аспірацію сечового міхура або катетеризацію сечового міхура. У дітей старшого віку з контролем сфінктера збір середньої порції сечі стає можливим і надійним [177].
3G.4.2.2. Кількісна оцінка бактеріурії
Остаточна концентрація бактерій в сечі безпосередньо залежить від методу збору, діурезу, способу зберігання й транспортування зразка [175]. Класичне визначення значущої бактеріурії, що становить > 105 КУО/мл, використовується й досі та залежить від клінічних умов [175, 178].
Наявність піурії (> 5 лейкоцитів у полі зору) і бактеріурії у свіжому зразку сечі є переконливим для клінічного діагнозу ІСШ [178].
У хлопчиків, коли сеча отримана шляхом катетеризації сечового міхура, посів сечі вважається позитивним з рівня > 104 КУО/мл. Незважаючи на те, що Хоберман [180] визначив мікроорганізми у 65 % випадків з підрахунком колоній між 10 000 і 50 000 КУО/мл,
спостерігалась змішана модель культурного росту, що передбачає забруднення. У цих випадках, краще повторити дослідження або оцінити наявність інших ознак, таких як піурія, нітрити або інші біохімічні маркери [175]. Збір середньої порції сечі або збір у збірний мішок > 105 КУО/мл вважається позитивним [176] (табл. 11).
3G.4.2.3. Інші біохімічні маркери
Наявність інших біохімічних маркерів зразка сечі корисна для встановлення діагнозу ІСШ [168]. Найбільш частими маркерами є нітрити та лейкоцитарна естераза, вони, як правило, об’єднані в стік-тесті (індикаторній смужці).
Нітрити: це продукт деградації нітратів у бактеріальному метаболізмі, зокрема грамнегативних бактерій. При інфекції, що викликана грампозитивними бактеріями, тест може бути негативним [168, 176]. Обмеження нітритного тесту:
— не всі уропатогени перетворюють нітрат в нітрит, наприклад палички P.aeruginosa або ентерококи;
— навіть нітрит-продукуючі патогени можуть показати негативний результат тесту через короткий час транзиту через сечовий міхур у випадках високого діурезу й розведення сечі, наприклад у новонароджених;
— нітритний тест має чутливість лише 45–60 %, але виняткову специфічність 85–98 % [168, 178, 181].
Лейкоцитарна естераза: продукт активності лейкоцитів. Тест для лейкоцитарної естерази має чутливість 48–86 % і специфічність 17–93 % [168, 178, 180, 181].
Поєднання нітритного тесту й тесту лейкоцитарної естерази підвищує чутливість та специфічність, але з ризиком хибнопозитивних результатів [181].
Стік-тест став корисним для швидкого й надійного виключення наявності ІСШ, якщо обидва показники нітритів і лейкоцитарної естерази є негативними. Якщо тести позитивні, то краще підтвердити результати в поєднанні з клінічною симптоматикою та іншими тестами [178, 181].
Бактеріурія без піурії можна зустрічатись:
— при бактеріальному забрудненні;
— колонізації (асимптомна бактеріурія);
— зборі зразка до виникнення запальної реакції.
У таких випадках доцільно повторити аналіз сечі через 24 год, щоб прояснити ситуацію. Навіть у дітей з лихоманкою і позитивною культурою сечі відсутність піурії може поставити під сумнів діагноз ІСШ. На відміну від цього наявність безсимптомної бактеріурії із супутнім септичним вогнищем, що спричинило гарячковий синдром, слід взяти до уваги.
Бактеріурію без піурії знаходять в 0,5 % зразків. Ця цифра добре узгоджується з розрахунковим показником безсимтомної бактеріурії в дітей [180, 182] (LE: 2а).
Піурія без бактеріурії може бути пов’язана:
— з незавершеним протимікробним лікуванням ІСШ;
— сечокам’яною хворобою і сторонніми предметами;
— інфекціями, викликаними мікобактерією туберкульозу та іншими особливими бактеріями, наприклад C.trachomatis.
Отже, самі лише бактеріурія або піурія не можуть вважатися надійними параметрами для діагностики або виключення ІСШ. Їх оцінка може залежати від інших факторів, таких як ступінь гідратації, метод забору матеріалу, спосіб центрифугування, об’єм, у якому був оцінений осад, і від суб’єктивної інтерпретації результатів [183]. Незалежно від цього, відповідно до Ландау та ін. [184], піурія в дітей із гарячкою свідчить про наявність гострого пієлонефриту.
З усіх цих причин у новонароджених і дітей віком < 6 місяців піурія, бактеріурія або нітритний тест окремо мають мінімальну прогностичну цінність щодо ІСШ [185, 186] (LE: 3). Натомість позитивна прогностична цінність значного забарвлення за Грамом піурії становить 85 % [180] (LE: 2b). У дітей старшого віку піурія з позитивним нітритним тестом є більш надійною для діагностики ІСШ з позитивною прогностичою цінністю 98 %.
Поєднання бактеріурії та піурії при лихоманці в дітей з результатами > 10 лейк/мм3 і > 50 000 КУО/мл у зразку, зібраному шляхом катетеризації, є ознакою ІСШ і відрізняє інфекцію від забруднення [180, 185].
С-реактивний білок: хоча й неспецифічний для дітей з лихоманкою та бактеріурією, С-реактивний білок може бути корисним у диференціальній діагностиці між гострим пієлонефритом та іншими причинами бактеріурії. СРБ вважається діагностично значущим при концентрації > 20 мкг/мл.
Сечова N-ацетил-В-глюкозамінідаза: є маркером тубулярних пошкоджень. Її активність зростає при ІСШ з гарячкою й може стати надійним діагностичним маркером для ІСШ, хоча також підвищується при ВУР [187].
ІЛ-6: клінічне використання сечових концентрацій IL-6 при ІСШ [188] все ще перебуває на стадії дослідження.
3G.4.3. Візуалізація сечовивідних шляхів
Золотий стандарт техніки візуалізації повинен бути економічно виправданим, безболісним, безпечним, з мінімумом радіації або при її відсутності, а і також мати можливість виявити будь-яку структурну аномалію. Сучасні методи не відповідають усім цим вимогам.
3G.4.3.1. УЗД
УЗД стало дуже корисним методом у дітей через його безпеку, швидкість і високу точність у визначенні анатомії й розмірів ниркової паренхіми та збірної системи [189]. Метод є суб’єктивним і, отже, залежить від виконавця, не дає жодної інформації про функції нирок. Проте рубці можуть бути ідентифіковані, хоча і не так добре, як зі скануванням з Tc-99m DMSA [189, 190] (LE: 2а). Ця методика показала себе як дуже чутлива, і екскреторну урографію слід призначати лише у випадку, коли зображення має бути уточнене морфологічно [191] (LE: 2а).
3G.4.3.2. Радіонуклідні дослідження
Тс-99m DMSA є радіофармацевтичним препаратом, що зв’язується з базальною мембраною епітелію клітин проксимальних канальців нирок; половина дози залишається в кірковій речовині нирок протягом 6 годин. Цей метод є корисним у визначенні функціональної ниркової маси й забезпечує точний діагноз кіркових рубців, показуючи ділянки зі зниженою активністю, що свідчить про брак функції. ІСШ заважають зв’язуванню цієї речовини клітинами проксимальних канальців і можуть проявлятися ділянками дефектів наповнення в нирковій паренхімі. Дефект зірчастої форми в нирковій паренхімі може вказувати на гострий епізод пієлонефриту. Вогнищеві дефекти в нирковій корі, як правило, вказують на хронічне ураження або нирковий рубець [192–194] (LE: 2а).
Вогнищеве формування рубців або ознаки втрати гладенької однорідної поверхні ниркової речовини, про що свідчить Тс-99m DMSA, зазвичай розглядаються як ознаки, пов’язані з ВУР (рефлюкс-нефропатія) [195, 196]. Разом з тим Rushton і співавт. [197] стверджують, що значне рубцювання нирки може розвиватися незалежно від наявності або відсутності ВУР. Ransley і Risdon [198] повідомляли, що Tc-99m DMSA демонструє специфічність 100 % і чутливість 80 % при ниркових рубцях.
Використання сканування з ДМСА Тс-99m може бути корисним в ранній діагностиці гострого пієлонефриту. У 50–85 % дітей були позитивні результати протягом першого тижня. Мінімальні дефекти паренхіми, що характеризуються невеликим ділянками гіпофункції, можуть бути оборотними при антимікробної терапії [199, 200]. Однак дефекти, що тривають > 5 місяців, вважаються нирковими рубцями [201] (LE: 2а).
Сканування з Тс-99m DMSA вважається чутливішим, ніж екскреторна урографія і УЗД, у виявленні ниркових рубців [202–205]. Залишається сумнівним, чи сканування з використанням радіонуклідів може замінити ехографію в першій лінії діагностичного підходу в дітей з ІСШ [206, 207].
3G.4.3.3. Цистоуретрографія
Звичайна мікційна цистоуретерографія (МЦ): найбільш широко використовуване рентгенологічне дослідження нижніх сечових шляхів і особливо ВУР. Вона вважається обов’язковим в оцінці ІСШ у дітей < 1 року. Основними недоліками є ризик інфікування, необхідність ретроградного заповнення сечового міхура й можливий шкідливий вплив радіації на дітей [208]. В останні роки використовується цифрова низькодозова рентгенівська МЦ для оцінки наявності ВУР у дівчаток з метою мінімізації впливу радіологічного опромінення [209]. МЦ є обов’язковою при оцінці фебрильних ІСШ у дітей, навіть за наявності нормальних даних УЗД. До 23 % цих пацієнтів можуть мати ВУР [210].
Радіонуклідна цистографія (непряма): дослідження виконується шляхом продовження періоду сканування після ін’єкції Тс-99m диетилентріамін-пентаацетату (DTPA) або меркаптоацетилтригліцину (MAG-3) в межах динамічної ренографії. Вона являє собою корисну альтернативу звичайній цистографії, особливо при веденні пацієнтів з рефлексом, через більш низьку радіаційну дозу. Недоліками є низька чіткість зображення й труднощі у виявленні аномалій нижніх сечовивідних шляхів [211, 212].
Цистосонографія: мікційне УЗД з посиленням конт–растною речовиною було запропоноване для діагностики ВУР без опромінення [207, 212]. Подальші дослідження необхідні для визначення ролі цього нового методу візуалізації при ІСШ.
3G.4.3.4. Додаткові методики отримання зображень
Екскреторна урографія залишається цінним методом оцінки стану сечовивідних шляхів у дітей, але її використання при ІСШ є дискусійним, крім випадків, коли попередні методи візуалізації продемонстрували аномалії, що потребують подальшого вивчення. Основними недоліками в дітей є ризики побічної дії контрастних засобів та опромінювання [213]. Проте роль екскреторної урографії знижується зі зростанням технічної переваги КТ [214] і МРТ. Але показання до їх застосування досі обмежені при ІСШ.
3G.4.3.5. Оцінка уродинаміки
При підозрі на дисфункцію сечовипускання, наприклад при нетриманні сечі, наявності залишкової сечі, збільшенні товщини стінки сечового міхура, повинна бути розглянута доцільність уродинамічної оцінки з використанням урофлоуметрії, (відео)цистометрії, у тому числі дослідження тиску сечотоку, та електроміографії.
3G.4.4. Розклад досліджень
Скринінг новонароджених на предмет безсимптомної бактеріурії навряд чи запобігає утворенню пієлонефритичних рубців, оскільки вони зазвичай розвиваються в ранньому дитинстві. У меншості дітей з ІСШ причиною їх є урологічні порушення, але якщо вони наявні, такі розлади можуть призвести до значної захворюваності. Отже, після більше ніж двох епізодів ІСШ у дівчинки і одного — у хлопчика мають проводитися дослідження (рис. 4), але не у випадку безсимптомної бактеріурії [210–213, 215, 216]. Необхідність DTPA/MAG-3-сканування визначається результатами УЗД, особливо якщо є підозра щодо обструктивного ураження.
3G.5. Супровід хвороби
Лікування має чотири основні мети:
— усунення симптомів і ліквідація бактеріурії в гострому епізоді;
— профілактика ниркових рубців;
— запобігання рецидивній ІСШ;
— корекція супутніх урологічних пошкоджень.
3G.5.1. Тяжкі ІСШ
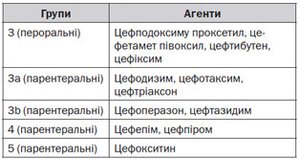
Тяжка ІСШ потребує адекватного відновлення дефіциту рідини парентеральним шляхом і відповідного антимікробного лікування, бажано цефалоспоринами (третьої генерації). Якщо грампозитивні ІСШ передбачаються при забарвленні за Грамом, корисно призначити аміноглікозиди в поєднанні з ампіциліном або амоксициліном/клавуланатом [217] (LE: 2а). Антимікробна терапія повинна бути розпочата на емпіричній основі, але з корекцією відповідно до результатів культури в найкоротший час, як це тільки можливо. У пацієнтів з алергією на цефалоспорини можуть бути використані азтреонам або гентаміцин. У разі необхідності призначення аміноглікозидів їх сироваткові рівні повинні контролюватися для корекції дози.
Слід уникати застосування хлорамфеніколу, сульфонамідів, тетрациклінів, рифампіцину, амфотерицину В і хінолонів. Застосування цефтріаксону також слід уникати через його небажаний побічний ефект жовтяниці.
Широке розмаїття антибактеріальних препаратів може бути використане в дітей старшого віку, за винятком тетрацикліну (через забарвлення зубів). Фторовані хінолони можуть призвести до токсичного ураження хряща [218], але, якщо необхідно, можуть бути використані як друга лінії терапії при лікуванні серйозних інфекцій, тому що несприятливі ускладнення з боку опорно-рухового апарату помірні та минущі [219, 220]. З огляду на безпеку в перші 24–36 годин має бути призначено парентеральне лікування. Коли дитина перестає лихоманити й здатна приймати рідину, їй може бути призначений пероральний препарат для завершення 10–14 денного лікування, що може бути продовжено в амбулаторних умовах. Це забезпечує ряд переваг, таких як менший психологічний вплив на дитину і більший комфорт для всієї родини.
Це також дешевше, обходиться без ускладнень та може запобігати опортуністичним інфекціям [180].
Оральні протимікробні препарати, яким надається перевага: триметоприм (ТМП), ко-тримоксазол (TMP плюс сульфаметоксазол), пероральні цефалоспорини або амоксицилін/клавуланат. Тим не менше показання до ТМП знижуються в районах із збільшенням резистетності до нього.
У дітей віком < 3 років із труднощами в пероральному прийомі препаратів є доцільним парентеральне лікування протягом 7–10 днів з аналогічними результатами перорального лікування [221].
Якщо є суттєві відхилення в сечовому тракті (наприклад, ВУР, обструкція тощо), повинна бути розглянута необхідність урологічного втручання. Якщо ниркових рубців не виявлено, пацієнту необхідне ретельне спостереження педіатром для контролю можливих наслідків, таких як гіпертензія, порушення функції нирок і рецидивна ІСШ.
Огляд лікування фебрильних ІСШ у дітей поданий на рис. 5, дозування антибактеріальних препаратів наведено в табл. 12 [222].
3G.5.2. Прості (легкі) ІСШ
Простими ІСШ вважаються інфекції низького ризику в дітей. Емпіричне лікування через рот ТМП, пероральні цефалоспорини або амоксицилін/клавуланат рекомендуються згідно з місцевими даними щодо резистеності флори. Пероральне лікування при неускладнених ІСШ повинно тривати 5–7 днів [223, 224] (LE: 1b). Єдина парентеральна доза може бути використана у випадках сумнівної/слабкої відповіді і при нормальній структурі сечовивідних шляхів [225] (LE: 2а). Якщо відповідь слабка або розвиваються ускладнення, дитина повинна бути направлена до лікарні для парентерального лікування [226].
3G.5.3. Профілактика
Якщо є підвищений ризик розвитку пієлонефриту, наприклад, ВУР і рецидивуюча ІСШ, рекомендуються низькі дози антибактеріальних препаратів [227, 228] (LE: 2а). Вони також можуть бути використані після гострого епізоду ІСШ до того, як діагностичне обстеження буде завершено. Найбільш ефективні такі антибактеріальні агенти: нітрофурантоїн, ТМП, цефалексин і цефаклор [227].
Подяка
Наша велика подяка співавтору, який брав участь при створенні глави з ІСШ у дітей Jorge Caffaratti Sfulcini, Відділення дитячої урології, Fundació Puigvert, Барселона, Іспанія.
/76-2.jpg)
Переклад: проф. Д.Д. Іванов, к.м.н. М.Д. Іванова;
науковий консультант: академік НАМН України проф. Л.А. Пиріг

/61-1.jpg)
/63-1.jpg)
/66-1.jpg)
/68-1.jpg)
/69-1.jpg)
/70.jpg)
/72.jpg)
/73.jpg)
/74-1.jpg)