Статья опубликована на с. 79-87
Сибирская язва (Anthrax) — опасная сапрозоонозная инфекционная болезнь людей и животных, вызываемая спорообразующей бактерией Bacillus anthracis. Характеризуется острым началом, тяжелой интоксикацией, лихорадкой, септицемией, возникновением отеков и карбункулов. Протекает в кожной, легочной (ингаляционной) и кишечной формах. Под разными названиями описание болезни встречается еще у античных авторов. Современное название болезни дал С.С. Андреевский (1760–1818), установивший в 1787 г. путем самозаражения инфекционный характер сибирской язвы. В XIX в. сибирская язва стала бичом зарождающегося промышленного животноводства. Однако к середине ХХ в. благодаря предпринятым ветеринарно-санитарным и противоэпидемическим мероприятиям в промышленно развитых странах заболеваемость сибирской язвой людей и сельскохозяйственных животных стала спорадической. Не последнее место в современном санитарном благополучии по сибирской язве сыграла вакцинация. Цель работы — показать роль российских ученых в разработке сибиреязвенных вакцин.
Исторические предпосылки появления вакцинопрофилактики инфекционных болезней
Под вакцинопрофилактикой понимается искусственное создание иммунитета (невосприимчивости) как у отдельных людей, так и у населения в целом. С глубокой древности было известно, что если у больного с легким течением натуральной оспы взять содержимое пустулы и втереть в ранку на коже здорового человека, это предотвратит развитие у него болезни в тяжелой клинической форме. Под названием «варио-ляция» способ практиковался в Западной Европе с начала XVIII века. В России его начали использовать с 1768 г., после того как императрица Екатерина Вторая (1729–1796) сделала себе и своему сыну Павлу Петровичу (1754–1801), будущему российскому императору, прививку содержимого оспенной пустулы с ручки мальчика-простолюдина. Тем самым в России были заложены противоэпидемические мероприятия с использованием специфической профилактики [1].
В начале XIX в. вариоляция благодаря наблюдательности британского хирурга Эдварда Дженнера (1749–1823) была заменена более безопасным способом специфической профилактики — вакцинацией (от латинского «вакка», что означает «корова»), то есть взятием для прививки оспенного детрита из пустулы на вымени коров, болеющих не опасной для людей болезнью — оспой коров. Во второй половине XIX в. французскому ученому Луи Пастеру (1822–1895) удалось ослабить вирулентность возбудителей некоторых инфекционных болезней и приготовить из них препараты для прививок по аналогии с дженнеровской противооспенной вакциной. Он же предложил расширить применение терминов, предложенных Дженнером, и называть вакцинами препараты на основе ослабленных микроорганизмов, используемые для профилактики инфекционных болезней, а процедуру их применения — вакцинацией. В настоящее время термин «вакцинация» означает введение человеку или животному медицинского препарата, содержащего антигенный материал, с целью вызвать иммунитет к болезни, который предотвратит заражение или ослабит его негативные последствия.
Основные этапы в разработке сибиреязвенных вакцин
Исследования по разработке сибиреязвенных вакцин можно разделить на пять этапов1.
Первый этап — получение капсулообразующих штаммов сибиреязвенного микроба с ослабленной вирулентностью и использование их в качестве живых вакцин для животных (с 1879 по 1930-е гг.).
Второй этап — получение протективных антигенов возбудителя сибирской язвы и использование их в качестве компонентов химических вакцин для людей и животных (с 1879 по 1960-е гг.).
Третий этап — получение бескапсульных штаммов B.anthracis с ослабленной вирулентностью и использование их в качестве живых вакцин для людей и животных (с середины 1930-х по 1960-е гг.).
Четвертый этап — разработка комбинированных сибиреязвенных вакцин для людей и животных, включающих бескапсульные штаммы B.anthracis и защитные (протективные) антигены возбудителя сибирской язвы различного происхождения (начало 1960–1990-е гг.).
Пятый этап — получение генно-инженерными методами сибиреязвенных вакцин для людей и животных на основе штаммов-продуцентов близкородственных бацилл (начало 1980-х гг. — настоящее время).
Живые вакцины на основе ослабленных капсулообразующих штаммов сибиреязвенного микроба
Начало первому этапу положил в 1879–1880 гг. французский исследователь Август Шаво (Auguste Chauveau, 1827–1917). Он установил, что овцы становились устойчивыми к сибирской язве при введении им малых количеств крови, содержащей возбудителя этой болезни. В то же время метод Шаво не имел четких критериев эффективности и безопасности, позволяющих осуществлять его массовое применение [2].
Решающий вклад в создание капсульных сибиреязвенных вакцин внес Л. Пастер. Изучая заболеваемость животных и птиц сибирской язвой, Л. Пастер пришел к выводу, что у кур сибиреязвенную инфекцию можно вызвать лишь в случае искусственного понижения температуры тела путем помещения их в холодную воду. При этом он также установил, что при температуре 42–43 °С (нормальная температура тела кур) у B.anthracis не отмечается спорообразования. Исходя из этих наблюдений Л. Пастер в 1881 г. впервые предложил принцип аттенуации (ослабления) вирулентности B.anthracis и разработал метод получения капсулообразующих вакцинных сибиреязвенных штаммов. Выращивая B.anthracis в курином бульоне при температуре 42–43 °С, он ежедневно проверял вирулентность культур на овцах, кроликах и морских свинках. Через 1 сутки культура убивала животных всех трех видов, на 3-и сутки она убивала только кроликов и морских свинок, а на 7-е сутки ни одно животное не погибло. Инкубированием культуры в течение 10–12 сут. была получена II вакцина Пастера (менее ослабленная), а через 20–24 сут. — I вакцина Пастера (более ослабленная). Затем культуры обеих степеней ослабления переводили в споровую форму на мясо-пептонном агаре при температуре 35 °С. Первая вакцина Пастера вызывала гибель всех зараженных белых мышей и большинства молодых морских свинок, а для кроликов была безвредна. Вторая же вакцина Пастера вызывала гибель части кроликов, а у овец вызывала лишь повышение температуры тела. Л. Пастер на ферме Pouilly-le-Fort 5 мая 1881 г. впервые привил первой вакциной 24 овцы, 1 козу и 6 коров, а 17 мая — второй вакциной. Через 2 нед. после вакцинации (31 мая 1881 г.) животных заразили вирулентной культурой. Ни одно опытное животное не заболело сибирской язвой, а контрольные животные погибли (кроме одной овцы) в течение 2 сут. (овцы и козы) или тяжело переболели (коровы). Через 8 мес. после прививки вновь осуществили заражение вакцинированных животных и снова получили положительные результаты. Иммунитет к сибирской язве вырабатывался спустя 8 сут. и сохранялся в течение одного года [2] (рис. 1).
/81.jpg)
Пастеровские вакцины создавали много проблем владельцам скота. Клетки сибиреязвенного микроба со временем лизировались, и, кроме того, пастеровские штаммы обладали высокой остаточной вирулент-ностью. Результаты их применения были противоречивыми. Привезенные в Россию в 1882 г. из Парижа вакцины Пастера не показали защитного действия на овцах землевладельца Кудрявцева из Херсонской губернии, а в имении Панкеева Таврической губернии вызвали гибель от сибирской язвы 80,3 % овец [5, 6]. Однако имя их автора оказывало гипнотизирующее воздействие на владельцев крупных поголовий скота. С 1885 г. вакцины Пастера широко применялись в России под названием «французские вакцины».
Используя предложенный Л. Пастером способ ослабления вирулентности возбудителя сибирской язвы, русский ученый Л.С. Ценковский (1822–1887) на кафедре ботаники Харьковского университета в мае 1883 г. получил две аналогичные вакцины (I и II вакцины Ценковского). Проверка полученных вакцин на белых мышах, сусликах и кроликах показала стойкое снижение вирулентности вакцинных штаммов [6].
Следующим шагом на пути получения капсулообразующих аттенуированных сибиреязвенных штаммов стали работы профессора Казанского ветеринарного института И.Н. Ланге (1845–1912). В 1891 г. он получил по методу, использованному Пастером и Ценковским, две вакцины, нашедшие широкое применение в ветеринарной практике Российской империи [7].
В 1897 г. для сравнения вакцин Ценковского, Ланге и французских министерством внутренних дел Российской империи была создана комиссия. Работы, проведенные в Саратовской и Донской губерниях, показали, что более стойкий и продолжительный иммунитет к заражению сибирской язвой создавали вакцины Ценковского. Однако последующее их применение показало, что контролировать остаточную вирулентность капсульных вакцин очень сложно. У привитых животных наблюдали поствакцинальные осложнения, вплоть до смертельных исходов [8]. Описаны также случаи заболеваний людей в результате неосторожного обращения со II вакциной Ценковского во время вакцинации животных [9].
К началу ХХ в. возможности способов снижения вирулентности капсулообразующих штаммов сибиреязвенного микроба были исчерпаны. Исследования были направлены в основном на совершенствование методов приготовления и применения таких вакцин. В 1911 году С.Н. Вышелесский (1874–1958) предложил при культивировании капсулообразующих вакцинных штаммов сибиреязвенного микроба вместо куриного бульона использовать мясо-пептонный агар. В 20-х годах ХХ века А.М. Безредка (1870–1940) рекомендовал внутрикожный метод вакцинации, показавший положительные результаты. В конце 1920-х гг. появилось новое направление создания сибиреязвенных вакцин — сапонин-вакцины: к вирулентным или аттенуированным капсулообразующим штаммам B.anthracis добавляли 2–5 % сапонина, игравшего роль адъюванта. В 1934–1935 гг. в нашей стране такую вакцину предложили Ф.А. Терентьев и А.П. Ельцов. Вакцина содержала споры II вакцины Ценковского в растворе сапонина. Ее применение заменило двукратную вакцинацию по схеме Ценковского. Количество осложнений к общему числу привитых животных составило 0,11 %, гибели животных после прививок сапонин-вакциной не наблюдалось. Перенос сроков прививок с весны на осень полностью предохранял животных от сибирской язвы в течение следующего года [2, 5].
Опыт, накопленный в течение более чем 50 лет широкого применения вакцин на основе живых капсульных штаммов (Пастера, Ценковского и др.), показал, что они так и не стали безопасными для сельскохозяйственных животных. Гибель от пост-вакцинальной сибирской язвы составляла в 1920–1930 гг. среди лошадей от 0,06 до 0,3 %, среди крупного рогатого скота — от 0,035 до 0,05 %, среди овец и коз — от 0,05 до 0,6 %. В абсолютных же цифрах поствакцинальная гибель животных в отдельные годы была огромна. Например, за 4 года (1928–1932 гг.) в СССР было привито вакцинами Ценковского 17 265 788 животных, из них погибло от поствакцинальной сибирской язвы 14 720, то есть 0,085 % [7]. Разумеется, такие вакцины не могли быть использованы в медицинской практике из-за риска развития сибирской язвы у вакцинированного человека. По-этому неизбежно было развитие других направлений конструирования сибиреязвенных вакцин, позволяющих их медицинское применение, — на основе протективных антигенов возбудителя сибирской язвы и его бескапcульных штаммов.
Вакцины на основе протективного антигена возбудителя сибирской язвы
В 1879–1880 гг. французский исследователь Туссен (Toussaint) впервые показал, что овцы не заболевали сибирской язвой при заражении вирулентной культурой, если им предварительно вводили прогретую при температуре 55 °С в течение 10 мин дефибринированную или профильтрованную кровь, содержащую B.anthracis. Он предположил наличие в крови какого-то внеклеточного компонента, способного оказывать защитный эффект [6].
В 1904 году О. Bail обнаружил в отечной сибиреязвенной жидкости иммуногенный бесклеточный антиген и назвал его агрессином. В СССР в 1930-х гг. был разработан метод получения таких сибиреязвенных агрессинов. Продуцентом обычно служила лошадь. Агрессины получали из отечной жидкости, накапливавшейся в участке введения сибиреязвенной культуры, и плевральных экссудатов животных, болевших сибирской язвой. Экссудаты с агрессинами были пригодны как для активной иммунопрофилактики, так и для получения лечебных сывороток. Наибольший вклад в эти исследования внесли Н.И. Винорадов и С.Н. Вышелесский. Однако иммунизация животных агрессинами удавалась лишь при введении большого количества отечной жидкости и не могла применяться массово, их природа оставалась неизвестной. В 1946 г. британский исследователь G. Gladstone впервые в условиях in vitro, в жидкой сывороточной среде в присутствии 0,5% бикарбоната натрия получил сибиреязвенный бесклеточный антиген — компонент сибиреязвенного токсина, названный им протективным антигеном (protective antigen — PA) [2].
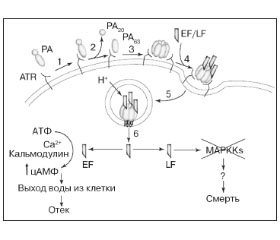
Широко развернувшаяся после этого исследовательская работа британских и американских ученых2 привела к открытию сибиреязвенного токсина. Было показано, что сибиреязвенный токсин состоит из трех компонентов: PA, отечного и летального факторов [10–13]. Модель действия сибиреязвенного токсина приведена на рис. 2.
PA является единственным иммуногеном сибиреязвенного токсина, когда он вводится отдельно. При парентеральном введении животным он не вызывает отеков и летальных исходов. Два других компонента — отечный и летальный факторы — обладают био-логически активными свойствами только в присутствии PA. С обнаружением PA разработка препарата для иммунопрофилактики сибирской язвы человека в США и Великобритании развернулась в ином направлении, чем в СССР: от живых бескапсульных вакцин к химическим вакцинам на основе сибиреязвенного PA. PA получают из фильтрата глубинной культуры вакцинного авирулентного штамма В.anthracis [13].
В Советском Союзе продолжалось совершенствование живых бескапсульных вакцин, но одновременно шло изучение возможности включения в состав вакцин PA. Первыми в СССР в условиях in vitro очищенный PA получили А.В. Машков и В.П. Бодиско в 1958 г. На протяжении 1960–1980-х гг. исследования PA осуществлялись коллективами под руководством Н.И. Александрова, Э.Н. Шляхова, Ю.В. Езепчука, М.В. Рево, Г.В. Дунаева, Н.М. Новикова, М.И. Дербина, Н.В. Садового, В.В. Кожухова. Ими были предложены новые синтетические питательные среды, отработаны технологии получения PA, изучена эффективность химической вакцины на его основе [2, 13].
Вместе с тем широкая экспериментальная проверка вакцин на основе РА, проведенная в СССР, выявила у них три существенных по сравнению с живыми бескапсульными вакцинами недостатка: необходимость в многократных прививках; кратковременность вызываемого ими иммунитета; слабая защита от ингаляционного заражения. Относительно полноценный иммунитет к возбудителю сибирской язвы создавался после курса трехкратной первичной иммунизации, поддержание иммунитета должно было подкрепляться систематически проводимыми ревакцинациями через каждые 6 мес. Последнее обусловлено тем, что действие адсорбированной вакцины направлено лишь на предотвращение заключительного этапа инфекционного процесса — поражения макроорганизма токсином сибиреязвенного микроба. Создание антитоксического иммунитета защищает от клинических проявлений заболевания, однако не исключает развития начальных стадий инфекционного процесса — колонизации B.anthracis в области входных ворот и инвазии во внутреннюю среду организма. Кроме того, по мнению некоторых исследователей, массовая вакцинация американских военнослужащих в начале 1990-х гг. химической вакциной на основе РА стала причиной развития у них болезни, названной «синдром войны в Персидском заливе». Дискуссия о причинах болезни продолжается до настоящего времени [3]3. Наличие такого количества противоречивых данных по эффективности химической вакцины на основе РА подтверждает правильность выбранного советскими микробиологами еще в 1940-е гг. курса на использование живых вакцин на основе бескапсульных штаммов B.anthracis.
Живые вакцины на основе бескапсульных штаммов B.anthracis
Ключевым моментом в повышении безопасности сибиреязвенных вакцин стало установление в середине 1930-х гг. роли капсулы возбудителя сибирской язвы в патогенезе болезни. Было установлено, что капсула — основной фактор вирулентности B.anthracis, однако она не связана с его иммуногенностью. В 1934 году N. Stamatin (Румыния) впервые выделил бескапсульный штамм сибиреязвенного микроба (штамм 1190-R) при длительном выращивании бацилл вирулентного штамма на свернутой дефибринированной или цитратной крови лошади. Изготовленная на основе этого штамма вакцина оказалась высокоиммуногенной в опытах на кроликах и овцах. В 1937 году М. Sterne в Южной Африке получил другой бескапсульный иммуногенный штамм (34F2), выращивая вирулентные сибиреязвенные клетки на 50% сывороточном агаре в атмосфере углекислого газа (10–30 об.%). В 1939 г. в Великобритании получен штамм Weybridge. До настоящего времени штаммы Sterne 34F2 и Weybridge используются во многих странах мира для вакцинации животных по сибирской язве [2, 3, 14].
К внедрению в СССР в медицинскую практику бескапсульных живых сибиреязвенных вакцин вынуждали два обстоятельства: высокая заболеваемость сибирской язвой среди людей в южных регионах СССР и угроза бактериологической войны с применением противником возбудителя сибирской язвы. В 1930-х гг. Японией были развернуты вблизи дальневосточных границ СССР несколько центров по разработке биологического оружия — отряды 731, 100 и др. [15, 16].
В 1940 году Н.Н. Гинсбург и А.Л. Тамарин, сотрудники Санитарно-технического института Красной армии (в настоящее время — ФГБУ «48 ЦНИИ Мин-обороны России», г. Киров) получили бескапсульные штаммы B.anthracis, которые могли быть использованы в качестве живых вакцин. Н.Н. Гинсбургом при выращивании на свернутой нормальной лошадиной сыворотке вирулентного штамма B.anthracis «Красная Нива» [14] получен бескапсульный штамм СТИ-1. А.Л. Тамариным из штамма ГИЭВ-III аналогичным образом выделен бескапсульный штамм B.anthracis — ГИЭВ-III бескапсульный (другие названия: НИИЭГ К-П, СТИ-3, третий вакцинный, № 3). В отличие от штамма СТИ-1 он разжижал сыворотку, а на твердом агаре обнаруживал некоторый полиморфизм колоний. С 1942 г. вакцина СТИ (взвесь спор в 30% водном растворе глицерина) стала широко применяться в СССР для иммунизации животных и людей.
Новая сибиреязвенная вакцина потребовалась на фронте. Весной 1944 г., в ходе подготовки операции по освобождению Румынии, эпидемиологической разведкой было обнаружено большое количество очагов сибирской язвы на направлениях предполагаемого наступления. Вакциной СТИ-1 было привито 9000 военнослужащих, среди привитых заболеваний сибирской язвой выявлено не было [2].
В годы Великой Отечественной войны советскими военными учеными в Санитарно-техническом институте Красной армии под руководством Н.Н. Гинсбурга разработаны технология лабораторного производства живой споровой вакцины, методы ее контроля и способы иммунизации животных. Основной вклад внесли коллективы под руководством А.Л. Тамарина, Н.А. Спицина, А.С. Груденкова и П.А. Кутырева. За разработку живой сибиреязвенной вакцины Н.Н. Гинсбургу и A.JI. Taмарину в 1943 г. была присуждена Сталинская премия [2]. Приоритет советских ученых в создании сибиреязвенных вакцин, предна-значенных для иммунизации людей, признан западными исследователями [3].
Вакцину СТИ-1 широко использовали для вакцинации овец, коз, крупного рогатого скота, верблюдов, северных оленей и др. Однократная вакцинация, например, овец, создавала у них рано наступающий и напряженный иммунитет против экспериментального заражения сибирской язвой продолжительностью не менее года.
В начале 50-х гг. ХХ века производство вакцины и штамма СТИ-1 было передано из Министерства обороны СССР в Минздрав СССР. С 1962 г. по техническим причинам сибиреязвенную вакцину стали готовить на основе штамма СТИ-1 [17].
В 1946–1949 гг. С.Г. Колесов из трупа свиньи, павшей от сибирской язвы, выделил вариант B.anthracis –Шуя-15 (Ш-15). В 1951–1952 гг. на его основе производили вакцину ГНКИ (Государственный научно-контрольный институт бакпрепаратов Минсельхоза СССР), показавшую высокую иммуногенность в опытах на овцах. Вакцина ГНКИ содержала 20 % глицерина и 40 % трехпроцентной гидроокиси алюминия и в 1953–1955 гг. была внедрена в сельскохозяйственную практику при использовании в жидком виде под названием «гидро-окисьалюминиевая сибиреязвенная вакцина ГНКИ». С 1961 г. эта вакцина без глицерина и гидроокиси алюминия (в сухом виде) применялась для вакцинации животных. Сравнительное изучение иммуногенных свойств вакцин СТИ-1 и ГНКИ путем постановки внутрикожных проб с сибиреязвенным аллергеном антраксином показало, что положительно реагировало 50,7 % животных, привитых вакциной ГНКИ, и 53,5 % животных, привитых вакциной СТИ [6].
Во Всесоюзном научно-исследовательском институте ветеринарной вирусологии и микробиологии (ВНИИВВиМ) И.А. Бакуловым, В.А. Гавриловым и В.В. Селиверстовым создана вакцина на основе бескапсульного спорообразующего штамма сибиреязвенного микроба № 55, выделенного из организма свиньи. Вакцина на его основе вызывает у привитых животных продолжительный иммунитет [18]. В настоящее время выпускается под названием «вакцина живая из штамма «55-ВНИИВВиМ» против сибирской язвы животных лиофилизированная», используется только для иммунизации сельскохозяйственных животных.
В начале 1990-х гг. в России сложилась критическая ситуация с производством сибиреязвенных вакцин для медицинского применения. Производить такие вакцины было некому. К тому же все серии единственного производственного вакцинного штамма СТИ-1, приготовленные в Тбилисском НИИ вакцин и сывороток, имели либо истекающий (10 лет), либо истекшие сроки хранения (20 и 30 лет).
В 1992 г. организацию производства сибиреязвенных вакцин взяло на себя Министерство обороны Российской Федерации, используя научную базу ФГБУ «48 ЦНИИ Минобороны России» (г. Киров). Военные исследователи установили, что вакцинный штамм СТИ-1, хранившийся в Тбилисском НИИ вакцин и сывороток, обладал резко выраженной гетерогенностью по иммуногенным и культурально-морфологическим свойствам, с делециями в гене pag (кодирует синтез PA сибиреязвенного токсина) и lef (кодирует синтез летального фактора сибиреязвенного токсина). Из предыстории приготовления серий было известно, что маточная культура СТИ-1, лиофильно высушенная в 1962 г., была получена из микробной культуры 1943 г. приготовления, то есть из родительского штамма, депонированного в ГИСК им. Л.А. Тарасевича в 1943 г. [2, 19, 20]. Маточная культура 1972 г. получена из микробной культуры СТИ-1, лиофильно высушенной в 1962 г., а микробная культура 1983 г. — из микробной культуры СТИ-1, лиофильно высушенной в 1972 г. Результаты изучения биологических свойств исходных эталонных микробных культур и приготовленных из них новых маточных культур показали, что в процессе длительного хранения при температуре 46 °С с увеличением последовательных циклов приготовления, а следовательно, пересевов на питательных средах, микробная культура штамма СТИ-1 изменяла свои культурально-морфологические свойства и не могла быть использована для приготовления вакцины.
Одной из возможных причин данного явления могло быть накопление в микробной популяции неиммуногенных сапрофитизирующихся мутантов, обладающих селективными преимуществами, при культивировании вытесняющие исходные высокоиммуногенные B.anthracis [21]. В ходе масштабной работы по сравнению иммуногенной активности штаммов из разных серий было установлено, что микробная культура, лиофильно высушенная в 1962 г., приготовленная из родительского штамма, даже после длительного хранения сохранила высокую иммунологическую эффективность и имела сравнительно стабильные культурально-морфологические свойства [12–14].
Для повышения иммуногенности вакцинного штамма был применен метод пассажа культур на морских свинках с последующим высевом культуры и отбором клонов с признаками токсинообразования, способных эффективно экспрессировать ген pag. Отобранные по Тох-признаку клоны тестировали с помощью полимеразной цепной реакции (ПЦР) на наличие у них полноразмерного гена pag и лишь после этого использовали в дальнейшей работе. Тестирование по Тох-признаку и отбор клонов по ПЦР позволило предупредить возможное увеличение диссоциации культур при частых пересевах в неселектируемых условиях. Результаты исследований биологических свойств всех приготовленных серий культур вакцинного штамма СТИ-1 выявили их соответствие регламентным требованиям в отличие от эталонов 1972 и 1983 гг. приготовления. Маточные культуры, полученные пассажем и клоновым отбором, уже не содержали RO-форм, в популяциях культур отсутствовали клоны с делециями и утратой полноразмерного гена ПА. Их иммуногенность более чем на порядок превышала таковую маточных культур 1972 и 1983 гг. сушки [22]. Россия снова получила эффективную живую бескапсульную сибиреязвенную вакцину. Одновременно в ФГБУ «48 ЦНИИ Минобороны России» (г. Киров) была создана ресурсосберегающая и экологически чистая технология серийного производства живой сухой сибиреязвенной вакцины, предназначенной для иммунизации людей4.
Комбинированные вакцины
Основные недостатки живых вакцин — длительное формирование иммунитета к заражению возбудителем сибирской язвы (до 3–4 нед.) и относительно короткий период высокой специфической резистентности, что проявляется риском его «пробоя» в первые 5–14 сут. и через 3 мес. после иммунизации. В середине 1970-х гг. среди всех заболевших сибирской язвой от 6,4 до 27,7 % составляли люди, ранее привитые живой бескапсульной вакциной [2, 13]. К тому же в случае генерализации сибиреязвенной инфекции у людей, вакцинированных живыми вакцинами, недостаточно эффективно предотвращались токсические эффекты, наблюдаемые на заключительной стадии болезни. В начале 1960-х гг. американскими исследователями (Klein, De Armon, Fernelius) предполагалось решить данную проблему путем перехода к комбинированной вакцинации: PA с последующим введением живой вакцины. Однако отказ от живых вакцин, закрепленный в США законодательно, привел к тому, что живые вакцины были исключены из схемы вакцинации на территории Соединенных Штатов [2].
В СССР такую схему вакцинации посчитали экономически неоправданной и пошли по пути создания живой сибиреязвенной вакцины. В начале 1960-х гг. Г.В. Дунаевым [2, 13] было показано, что комбинированная иммунизация PA и живой споровой вакциной значительно повышает резистентность животных к заражению вирулентными сибиреязвенными культурами. Инициатором и организатором разработки комбинированной вакцины для медицинского применения был сотрудник филиала ФГБУ «48 ЦНИИ Минобороны России» в Екатеринбурге Н.В. Садовой. Задача устранения пробоя иммунитета в первые 5–14 сут. и через 3 мес. после иммунизации была решена благодаря тому, что к спорам бескапсульного вакцинного штамма B.anthracis СТИ-1 (40–60 млн на 1 прививочную дозу) был добавлен PA сибиреязвенного микроба (30–40 ИД50)5, сорбированный на носителе и/или находящийся в простой смеси со спорами вакцинного штамма B. anthracis6 [23].
Сопоставляя значения показателей косвенных тестов и уровни защищенности против подкожного и ингаляционного заражения вирулентными культурами сибиреязвенного микроба, определенные на экспериментальных животных, с динамикой клеточных и гуморальных показателей специфической резистентности у людей, сотрудники 48 ЦНИИ МО РФ получили доказательства, что напряженный иммунитет после однократного применения комбинированной сибиреязвенной вакцины обеспечивает защиту от развития инфекции не менее чем у 80–90 % привитых. Прочный иммунитет формируется к 7–10-м сут. и сохраняется в течение 6 мес., а через 9–12 мес. определяется примерно у 50–70 % вакцинированных. Наряду с этим высокий уровень специфической резистентности после однократного применения живой вакцины (СТИ-1) развивается к 21-м сут. у 55–65 %, сохраняется до 4 мес. у 30–40 %, до 6 мес. — у 15–20 % и до 9–12 мес. — лишь у 5–10 % привитых. После аппликации адсорбированной вакцины (вакцина на основе PA) иммунитет формируется к 7–10-м сут. у 70–80 % и сохраняется до 4 мес. только у 10–15 % вакцинированных [23].
Сибиреязвенные вакцины на основе штаммов-продуцентов близкородственных бацилл, полученные по технологии рекомбинантной ДНК
Работы по получению таких вакцин ведутся с начала 1980-х гг. в США и Великобритании. Объективной причиной формирования направления стала протеолитическая активность вакцинных штаммов сибиреязвенного микроба, использовавшихся в качестве продуцентов PA. Накопление во время глубинного культивирования в культуральной среде протеолитических ферментов приводит к снижению выхода PA, что не устраивает производителей химических вакцин. А так как для вакцинации в этих странах живые бескапсульные вакцины не используют, то проблему низкого выхода PA надо решать. Поэтому и были начаты работы по переклонированию гена РА в другие продуценты. Из-за сложности технологий рекомбинантной ДНК на них возлагались большие надежды, а вакцины, которые предполагалась получить с их использованием, отнесли к вакцинам будущего, не разработав даже вакцинного препарата, охарактеризованного в доклинических исследованиях.
В 1983 году M. Vodkin и S.H. Leppla [25] клонировали ген PA в кишечной палочке. Иммунологическими методами ими были отобраны два трансформанта E.coli (pSE24 и pSE36), содержащие рекомбинантные плазмиды. Оба трансформанта синтезировали биологически и серологически активный РА в количестве от 5 до 10 нг/мл, что почти в 1000 раз меньше, чем синтезировал штамм Sterne, сами рекомбинантные плазмиды оказались нестабильными. Тогда же B.E. Ivins и S.L. Welkos [26] поставили перед собой задачу добиться уровня экспрессии клонированного гена РА, сопоставимого с тем, что наблюдали у штамма Sterne, и на основе аспорогенного штамма B.subtilis 1S53 получить рекомбинантный штамм, пригодный для использования в качестве живой сибиреязвенной вакцины. Они получили два клона B.subtilis с рекомбинантными плазмидами, включающими гены PA. Выход РА в жидкой среде составлял от 20,5 до 41,9 мкг/мл, что уже приближалось к уровню продуктивности штамма Sterne, однако исследователям не удалось преодолеть проблему нестабильности рекомбинантных плазмид7. Результаты, полученные B.E. Ivins и S.L. Welkos [26], были воспроизведены в других лабораториях, однако они не оправдали ожиданий исследователей. P.C. Turnbull установил, что протективные свойства одного из вариантов рекомбинантного РА, полученного из B.subtilis, при заражении экспериментальных животных несколькими вирулентными штаммами значительно ниже, чем в случае использования живой вакцины [27]. Г.Г. Онищенко с соавт. [19] считают, что основные трудности получения рекомбинантных штаммов-продуцентов РА создают следующие факторы:
— РА, синтезируемый клеткой штамма-продуцента, уже в низких концентрациях за счет гидрофобных участков молекулы формирует трансмембранные каналы, повреждающие клеточную стенку. Поэтому усиливая экспрессию гена РА, нельзя добиться его высокого выхода из-за гибели штамма-продуцента;
— обойти необходимость синтеза цельного РА путем клонирования генов небольших гидрофильных участков его молекулы с эпитопами иммуногенности невозможно из-за отсутствия информации о точной локализации этих эпитопов и сложностей конструирования такой плазмидной молекулы;
— высокая иммуногенность РА определяется его мультимерностью, что теоретически можно достичь, но трудно проконтролировать степень мультимеризации молекулы и все возможные эффекты, возникающие при синтезе мультимеров клеткой (протеазочувствительность; наличие участков, токсичных для клетки, и др.).
В последние 15 лет работы шли не только в направлении создания высокопродуктивных штаммов-продуцентов РА, но и получения вакцин на основе живых вакцинных штаммов других микроорганизмов (E.coli, F.tularensis, Y.pestis, Salmonella, B.subtilis), способных к персистенции в организме человека или обладающих адъювантными свойствами (лактобациллы). По мнению Г.Г. Онищенко с соавт. [19], в этом направлении пока не удалось добиться больших успехов, в частности, касающихся эффективности экспрессии РА, конструирования и экспериментального производства вакцин.
Возможно, более оптимальным является получение в качестве продуцентов РА аспорогенных вакцинных штаммов с пониженной протеолитической активностью [19]. Однако каким бы способом не был получен РА, вакцина на его основе не может быть более эффективной и при этом более дешевой и простой в применении, чем вакцина на основе живых бескапсульных штаммов B.anthracis. Поэтому наиболее оптимальной для иммунизации, особенно тогда, когда необходимо быстро создать иммунитет у человека к ингаляционному заражению возбудителем сибирской язвы, в ближайшие десятилетия будет отечественная комбинированная вакцина, сочетающая живые бескапсульные штаммы B.anthracis и РА.
***
Российские ученые cо второй половины XIX века и на протяжении всего ХХ века занимали лидирующие позиции в разработке сибиреязвенных вакцин. Им принадлежит мировой приоритет в создании сибиреязвенных вакцин, предназначенных для медицинского применения, и вакцин, способных эффективно защищать от ингаляционного поражения спорами возбудителя сибирской язвы. Своевременно выявленные перспективные направления создания таких вакцин, технологий производства, оценки их качества и способов массовой вакцинации создали серьезный задел на десятилетия вперед, что позволяет государству защитить население от вспышек сибирской язвы и актов биологического терроризма.
Список литературы
1. Губерт В.О. Оспа и оспопрививание. — СПб., 1896.
2. Онищенко Г.Г., Васильев Н.Т., Литусов Н.В., Харечко Н.Г., Васильев П.Г., Садовой Н.В. и др. Сибирская язва: актуальные аспекты микробиологии, эпидемиологии, клиники, диагностики, лечения и профилактики. — М.: ВУНМЦ МЗ РФ, 1999.
3. Artenstein A.W. Vaccines: A Biography. — New York; Dordrecht; Heidelberg; London: Springer, 2010.
4. Ivanovis G., Bruckner V. Die chemische structur der kapsel substanz des milzbrandbazillus und der serologsch identischen spezifischen substanz des Bacillus mesentericus // Z. Immunitatsforsch Exp. Ther. — 1937. — № 90(3). — Р. 304-18.
5. Вышелесский С.Н. Сибирская язва. — М., 1934.
6. Шляхов Э.Н. Эпидемиология, диагностика и профилактика сибирской язвы. — Кишинев: Картя Молдовеняскэ, 1960.
7. Терентьев Ф.А. Борьба с сибирской язвой // Ветеринария. — 1947. — № 11. — С. 28-30.
8. Архипова В.Р. Разработка эталона живой сибиреязвенной вакцины // Антракс. — Кишинев, 1964. — С. 121-3.
9. Латенко Я.П., Кириленко В.А., Залевский Л.Н. Заболевание сибирской язвой в результате неосторожного обращения с вакциной // Врачебное дело. — 1961. — № 3. — С. 122-3.
10. Smith H., Keppie J. Observations on experimental anthrax; demonstration of a specific lethal factor produced in vivo by Bacillus anthracis // Nature. — 1954. — № 173(4410). — Р. 869-70.
11. Oncü S., Sakarya S. Anthrax — an overview // Med. Sci. Monit. — 2003. — № 9(11). — Р. 276-83.
12. Mourez M., Lacy D.B., Cunningham K., Legmann R., Sellman B.R., Mogridge J. et al. 2001: a year of major advances in anthrax toxin research // Trends in Microbiol. — 2002. — № 10(6). — Р. 287-93.
13. Бургасов П.Н., Рожков Г.И. Сибирская язва. — М., 1984.
14. Гинсбург Н.Н. Живые вакцины. — М.: Медицина, 1969.
15. Доклад Международной научной комиссии по расследованию фактов бактериологической войны в Корее и Китае. — Пекин, 1952.
16. Моримура С. Кухня дьявола. — М., 1983.
17. Маринин Л.И., Онищенко Г.Г., Степанов А.В., Старицын Н.В., Померанцев А.П., Алешкин В.А. и др. Микробио-логическая диагностика сибирской язвы. — М.: ВУНМЦ МЗ РФ, 1999.
18. Бакулов И.А., Гаврилов В.А. Оценка эффективности 10-летнего применения вакцины против сибирской язвы животных из штамма 55-ВНИИ ВиМ // Ветеринария. — 1994. — № 8. — С. 11-5.
19. Онищенко Г.Г., Кожухов В.В., Васильев Н.Т., Бондарев В.П., Борисевич И.В., Дармов И.В. и др. Сибирская язва: актуальные проблемы разработки и внедрения медицинских средств защиты. — М.: Медицина, 2010.
20. Гинсбург Н.Н. Сибиреязвенная вакцина СТИ (ревизия вопроса о происхождении и сущности вакцинных штаммов) // Сборник работ НИИЭГ КА. — М., 1946. — Вып. 1. — С. 5-90.
21. Иванов В.Н., Угодчиков Г.А. Клеточный цикл микроорганизмов и гетерогенность их популяции. — К., 1984.
22. Сероглазов В.В., Кожухов В.В., Строчков Ю.И., Амосов М.Ю. Способ поддержания сибиреязвенного вакцинного штамма СТИ-1. Патент Российской Федерации, № 2142009; 1999.
23. Садовой Н.В., Кравец И.Д., Селиваненко Г.М., Харечко Г.С., Садовая Е.А., Васильев П.Г., Литусов Н.В., Елагин Г.Д., Супотницкий М.В. Вакцина сибиреязвенная комбинированная. Патент Российской Федерации, № 2115433; 1992.
24. Дербин М.И., Кузьмич М.К., Гарин Н.С. и др. Получение и изучение сибиреязвенного антигена // Журнал микробио-логии, эпидемиологии и иммунобиологии. — 1977. — № 2. — С. 63-7.
25. Vodkin M., Leppla S.N. Cloning of the protective antigen gene of Bacillus anthracis // Cell. — 1983. — № 34. — Р. 693-6.
26. Ivins B.E., Welkos S.L. Cloning and expression of the Bacillus anthracis protective antigen gene in Bacillus subtilis // Infect. Immun. — 1986. — № 54(2). — Р. 537-42.
27. Turnbull P.C. Current status of immunization against anthrax: old vaccines may be here to stay for a while // Cur. Opin. Infect. Dis. — 2000. — № 13(2). — Р 113-20.
/81.jpg)
/82.jpg)