Статья опубликована на с. 53-62
Введение
Остеоартрит является хроническим заболеванием, сопровождающимся истончением хряща в суставах, что приводит к трению костных поверхностей и, как следствие, к появлению скованности, боли и нарушению движений. Развитие остеоартрита связано с возрастом, а также с рядом других модифицируемых и немодифицируемых факторов риска, таких как ожирение, малоподвижный образ жизни, генетическая предрасположенность, плотность костей, травмы (включая спортивные и полученные на производстве) и пол. Остеоартрит является основной причиной инвалидизации среди пожилых людей во всем мире, особенно в развитых странах. Распространенность остеоартрита растет и будет расти в связи с увеличением численности населения, его старением и подверженностью таким факторам риска, как эпидемия ожирения [1].
В настоящее время существуют две основные стратегии лечения остеоартрита: симптом-модифицирующая и болезнь-модифицирующая (структурно-модифицирующая) терапия. Симптом-модифицирующие средства оказывают влияние только на симптомы болезни, такие как боль и нарушение функции, но не влияют на структурные изменения в суставе. К ним относят анальгетики (парацетамол, слабые опиаты), нестероидные противовоспалительные средства, хондропротекторы (глюкозамина сульфат, хондроитина сульфат, метилсульфонилметан), внутрисуставные кортикостероиды и ряд других средств. Структурно-модифицирующие средства замедляют структурное прогрессирование болезни, при этом они могут оказывать или не оказывать прямое влияние на симптомы. По состоянию на сегодняшний день нет ни одного лицензированного средства этой группы. Однако ведутся интенсивные исследования, и первые кандидаты для официального одобрения — это глюкозамина сульфат и хондроитина сульфат [2–4].
Например, в отношении глюкозамина сульфата по состоянию на сегодняшний день выполнено 2 метаанализа, посвященных остеоартриту коленного сустава. В одном из них (3803 пациента) не было отмечено значимого клинического влияния препарата на выраженность суставной боли и ширину суставной щели. Однако сразу несколько групп экспертов поставили под вопрос валидность полученных выводов. Недостатки этого метаанализа частично обсуждались в «Британском медицинском журнале». Было высказано мнение, что приведенные данные не являются прямо подтверждающими строгие отрицательные выводы метаанализа [5, 7]. Во втором метаанализе (эффективность глюкозамина сульфата и хондроитина сульфата оценивалась отдельно; всего 1502 пациента) сообщалось о малом/умеренном влиянии глюкозамина сульфата на минимально суженную суставную щель спустя 3 года лечения при остеоартрите коленного сустава [6, 7].
Аналогично для хондроитина сульфата было выполнено 2 метаанализа, посвященных остеоартриту коленного сустава. В одном из них (1179 пациентов) было продемонстрировано небольшое, но достоверное замедление скорости сужения минимальной ширины суставной щели: 0,13 мм за 2 года [7–9]. Выводы другого метаанализа (две подгруппы, см. выше; всего 1502 пациента) также свидетельствуют о достоверной задержке прогрессирования болезни [6, 7].
Важно отметить, что структурно-модифицирующий эффект усиливается при комбинировании глюкозамина сульфата и хондроитина сульфата. Например, в двойном слепом плацебо-контролируемом двухлетнем исследовании, включавшем 605 пациентов с остеоартритом коленного сустава, прием биологически активной добавки глюкозамина сульфата или хондроитина сульфата не приводил к развитию структурного эффекта. Но когда обе биодобавки принимались вместе, было отмечено статистически достоверное (p = 0,046) уменьшение сужения суставной щели по сравнению с плацебо: средняя разница составила 0,10 мм (95% доверительный интервал (ДИ) от 0,002 до 0,20 мм) [10].
Выше было упомянуто, что глюкозамина сульфат и хондроитина сульфат относят не только к структурно-модифицирующим, но и симптом-модифицирующим средствам. Как следствие, комбинирование этих препаратов приводит также к достоверному росту их симптом-модифицирующих эффектов [11].
В последние годы важное место среди хондропротекторов занял метилсульфонилметан — нетоксическое вещество, содержащееся в норме в организме человека. При назначении в виде монотерапии данное средство проявляет симптом-модифицирующее действие [40], которое усиливается при совместном назначении с глюкозамином и хондроитином [43, 48]. Способен ли метилсульфонилметан вызывать структурно-модифицирующее действие, предстоит выяснить в будущих исследованиях.
Учитывая значительно большую клиническую эффективность комбинированных средств, мы остановились в настоящем обзоре на комплексе Артромега®, в состав которого входят 3 хондропротективных вещества (глюкозамина сульфат, хондроитина сульфат, метилсульфонилметан), 7 вспомогательных, усиливающих компонентов (включая акулий хрящ, новозеландские зеленые мидии, гарпагофитум и др.), 8 витаминов и 6 микроэлементов (рис. 1).
Данный комплекс можно назвать усиленным, поскольку в него входят практически все компоненты, прямо или косвенно усиливающие хондропротекцию. Среди других достоинств комплекса следует отметить его производство в США в соответствии со стандартом GMP (сертификация ASI), что обеспечивает высокое качество продукта. Кроме того, низкая стоимость комплекса делает его доступным для самых широких слоев населения.
Мишени для воздействия при патологии суставов [12, 13]
Анаболическое действие
Суставной хрящ устроен таким образом, что сеть коллагена тесно переплетена с протеогликанами. Последние заряжены отрицательно, благодаря чему удерживают большое количество воды. Как следствие, суставной хрящ становится упругим, эластичным; вода также нужна для смазки суставной системы.
Типичное строение протеогликана представлено на рис. 2. Центральная его часть представляет собой длинную нить гиалуроновой кислоты, к которой сбоку с помощью связывающих белков прикреплены молекулы аггрекана. Каждый аггрекан состоит из белковой нити, к которой прикреплены хондроитина сульфат и кератана сульфат.
Учитывая это, о любом лекарственном средстве, которое способно усиливать образование в суставе коллагена или протеогликанов (за счет усиления синтеза гликозаминогликанов — гиалуроновой кислоты, хондроитина сульфата и кератана сульфата), восстанавливая тем самым целостность хряща, говорят, что оно обладает анаболическим действием.
Антикатаболическое действие
Существует множество факторов, приводящих к развитию остеоартрита. Среди них основное значение имеют возраст, избыточный вес/ожирение и травма. Старение связано с развитием в суставах дегенеративных изменений, тесно связанных с развитием воспаления (рис. 3). Избыточный вес/ожирение усиливает это воспаление двумя путями: за счет влияния на механорецепторы, а также путем выделения из жировой ткани лептина и других провоспалительных цитокинов (IL-1, IL-6, TNF-α, IL-10). Травма сустава усиливает воспаление за счет фрагментации фибронектина. При наличии этих или других причинных факторов в суставе развивается хроническое вялотекущее воспаление, вовлекающее цитокины, металлопротеиназы, простангландины, активные формы кислорода и другие медиаторы, что приводит к нарастанию степени тяжести остеоартрита.
/55.jpg)
Соответственно, о любом лекарственном средстве, которое способно противодействовать одному или нескольким медиаторам или рецепторам, представленным на рис. 3, подавляя воспаление и препятствуя тем самым дегенерации хряща, говорят, что оно обладает антикатаболическим действием.
Характеристика компонентов, входящих в состав комплекса Артромега®
Хондропротекторы
Глюкозамина сульфат и хондроитина сульфат являются хорошо известными и широко применяемыми хондропротекторами при лечении заболеваний суставов. Анаболическое действие глюкозамина сульфата сводится к способности усиливать образование протеогликанов за счет усиления синтеза гликозаминогликанов (гиалуроновой кислоты, хондроитина сульфата, кератана сульфата), поскольку он является их предшественником. Хондроитина сульфат прямо (непосредственно включаясь в состав протеогликанов) или непрямо (путем усиления метаболизма клеток) усиливает образование коллагена, гликозаминогликанов (гиалуроновой кислоты) и протеогликанов [12].
Антикатаболическое действие глюкозамина сульфата и хондроитина сульфата связано прежде всего со способностью ингибировать ось «IL-1β → активация NF-κB → активация других медиаторов воспаления» (рис. 3). Среди других медиаторов воспаления, ингибируемых глюкозамина сульфатом и хондроитина сульфатом, важное значение имеет подавление экспрессии провоспалительных цитокинов (IL-6, TNF-α и др.), матриксных металлопротеиназ (MMPs), циклооксигеназы-2 (COX-2), индуцибельной NO-синтазы (iNOS). Антиоксидантные свойства обоих лекарственных средств связаны как с подавлением экспресии iNOS, так и с прямой способностью нейтрализовать активные формы кислорода (ROS) [14–18].
Выбор производителя включить в состав усиленного комплекса Артромега® именно глюкозамина сульфат, а не глюкозамина гидрохлорид, является очень удачным, поскольку в ряде клинических исследований продемонстрирован более выраженный эффект у сульфатной соли. Пока, однако, не удается объяснить этот феномен с позиции биологической активности, позологии или фармакокинетики [19].
Метилсульфонилметан в естественных условиях содержится во фруктах, помидорах, кукурузе, люцерне, чае, кофе, человеческом и коровьем молоке. В крови взрослого человека содержится около 0,2 мг/кг
данного вещества. Метилсульфонилметан является одним из наиболее безопасных веществ в биологии: по безопасности он приближается к воде. Основным достоинством метилсульфонилметана является то, что он содержит 34 % органической серы и, попадая в организм человека, становится донатором серы для синтеза различных биологических веществ. Установлено, в частности, что метилсульфонилметан является одним из источников серы при синтезе коллагена. Последующее образование дисульфидных связей (S-S) образует поперечные сшивки между волокнами коллагена, стабилизируя коллагеновую сеть. Более того, при старении организма между волокнами коллагена образуются патологические сшивки с помощью конечных продуктов усиленного гликозилирования, что предрасполагает хрящ к развитию дегенеративных изменений, характерных для остеоартрита. Было продемонстрировано, что метилсульфонилметан замедляет эти процессы. Предполагается также, что, попадая в организм, метилсульфонилметан усиливает образование протеогликанов за счет усиления синтеза серосодержащих гликозаминогликанов (хондроитина сульфата, кератана сульфата). В то время как при остеоартрите в хряще снижается содержание серы (составляет 1/3 от нормы), метилсульфонилметан, по-видимому, восстанавливает этот уровень, проявляя вышеперечисленные анаболические эффекты [20–25].
Антикатаболические эффекты метилсульфонилметана, помимо препятствия образованию патологических сшивок, сводятся к прямому и косвенному (за счет усиления синтеза гликозаминогликанов) ингибированию оси «IL-1β → активация NF-κB → активация других медиаторов воспаления: IL-1β, IL-6, TNF-α, COX-2, iNOS и др.» (рис. 3) и проявлению данным соединением антиоксидантных свойств [26, 63, 64].
Усилители хондропротекции
Помимо традиционных хондропротекторов (глюкозамина сульфат, хондроитина сульфат) и набирающего все большую популярность метилсульфонилметана изучается большое количество других природных средств, способных восстанавливать хрящ и препятствовать развитию в нем воспалительно-дегенеративных изменений. В состав комплекса Артромега® включено 7 дополнительных компонентов, трем из которых — акульему хрящу, новозеландским зеленым мидиям и гарпагофитуму — мы дадим краткую характеристику.
Клинические эффекты акульего хряща будут более понятны, если учесть результаты работ [27, 28], в которых была изучена относительная концентрация хондроитина-4-сульфата и хондроитина-6-сульфата в хрящах здоровых людей. Было выяснено, что эпифизарный хрящ взрослых людей, после того как процессы оссификации закончились, содержит исключительно хондроитина-6-сульфат.
С другой стороны, был выполнен обзор исследований [30], в котором приводится состав хондроитина сульфата в хрящах быков, свиней, кур, акул и скатов. Молекулярный вес бычьего, свиного и куриного хондроитина сульфата (14–26 кДа) был одинаков с референсным стандартом (21,4 кДа), в то время как молекулярный вес акульего и скатного хондроитина сульфата оказался значительно выше (50–70 кДа). При этом бычьи образцы содержали такое же количество хондроитина-4-сульфата (61 %) и хондроитина-6-сульфата (33 %), как референсный стандарт (61 и 34 % соответственно), в то время как в куриных и свиных образцах был отмечен более высокий уровень хондроитина-4-сульфата (72 и 80 % соответственно). В то же время скатный и акулий образцы имели более высокие уровни хондроитина-6-сульфата (39 и 50 % соответственно) [29, 30].
Поскольку акулий хрящ имеет самое высокое содержание хондроитина-6-сульфата, являющегося строительным материалом в суставном хряще взрослых людей, то предполагается, что именно акулий хрящ будет оказывать выраженное лечебное воздействие при остеоартрите.
Все анаболические и антикатаболические эффекты акульего хряща, связанные с содержанием в нем хондроитина-6-сульфата, аналогичны тем, которые были описаны выше при рассмотрении хондропротекторов. Кроме того, для акульего хряща характерен еще один дополнительный антикатаболический эффект: белки, содержащиеся в акульем хряще, тормозят васкуляризацию (врастание сосудов) суставного хряща человека. В норме хрящ не содержит сосудов, и васкуляризация значительно усугубляет течение воспалительно-дегенеративных процессов. Акулий хрящ ингибирует эти процессы, тем самым замедляя развитие остеоартрита [31, 32].
Внедрение в лечебную практику новозеландских зеленых мидий (Perna canaliculus) было связано с интересным наблюдением: у коренного населения, проживающего на побережье Новой Зеландии (маори) и регулярно употребляющего в пищу данный моллюск, частота развития остеоартрита является низкой. Лечебные свойства новозеландских зеленых мидий были впервые научно продемонстрированы в 1974 г., и с тех пор ведутся интенсивные исследования их положительных эффектов при остеоартрите [33, 34].
В результате было выяснено, что новозеландские зеленые мидии содержат омега-3 полиненасыщенные жирные кислоты (ω-3 ПНЖК: эйкозапентаеновую кислоту, докозагексаеновую кислоту и др.). Данные жирные кислоты являются структурными аналогами арахидоновой кислоты и, встраиваясь вместо нее, нарушают работу циклооксигеназы типа 2, предотвращая образование простагландинов и липоксигеназы, нарушая образование лейкотриенов. Антиоксидантные свойства зеленых мидий связаны с содержанием в них каротиноидов и ω-3 ПНЖК (однако роль ω-3 ПНЖК в качестве антиоксидантов является спорной). Препараты зеленых мидий обладают также способностью ингибировать продукцию провоспалительных цитокинов (IL-1β, IL-6, TNF-α и др.), матриксных металлопротеиназ. Все перечисленные эффекты обусловливают антикатаболический эффект зеленых мидий при остеоартрите [35, 36, 62].
Гарпагофитум (мартиния душистая, или дьявольский коготь) произрастает в южной части Африканского континента и может быть обнаружен в песках пустыни Калахари на территории таких государств, как Намибия, Ботсвана, Южно-Африканская Республика, Замбия и Зимбабве. С медицинской целью применяют вторичные клубневидные корни (запасающие питательные вещества). Исторически еще местное население использовало гарпагофитум как обезболивающее средство. После того как растение стало экспортироваться в другие страны (Европа, Канада), его продолжили использовать как обезболивающее при артритах, тендинитах и других видах болей. Антикатаболические эффекты гарпагофитума связаны с тем, что он подавляет образование и высвобождение из макрофагов провоспалительных цитокинов –IL-1β, IL-6 и TNF-α, подавляет образование матриксных металлопротеиназ в хондроцитах, ингибирует экспрессию циклооксигеназы 2-го типа и индуцибельной NO-синтазы в фибробластах и тормозит развитие перекисного окисления липидов, что приводит к подавлению воспалительной реакции и, вторично, к развитию обезболивающего эффекта и хондропротекции [37].
Витамины и микроэлементы
В состав комплекса Артромега® входят 8 витаминов, среди них жирорастворимые — А, Е и водорастворимые — В1, В2, В3, В6, В12, С. Кроме того, в состав комплекса входят 6 микроэлементов — бор, марганец, цинк, медь, селен, хром. Витамины и минералы улучшают питание суставного хряща за счет усиления притока крови к суставу, а также за счет стимуляции метаболизма хондроцитов и внеклеточного матрикса. Ряд свойств витаминов и минералов, специфичных для суставного хряща, приведен в табл. 1.
Терапевтическое применение усиленного комплекса Артромега®
Остеоартрит
Анаболическое и антикатаболическое действие компонентов, входящих в состав комплекса Артромега®, обеспечивают симптом-модифицирующее (ослабление боли, улучшение функции) и структурно-модифицирующее (замедление структурного прогрессирования болезни) действие. Во введении к настоящему обзору мы остановились на результатах метаанализов и исследований применения глюкозамина сульфата и хондроитина сульфата для лечения остеоартрита. Ниже мы более подробно рассмотрим результаты клинических исследований метилсульфонилметана, новозеландских зеленых мидий и их комбинаций с глюкозамина сульфатом и хондроитина сульфатом для лечения той же патологии.
Эффективность монотерапии метилсульфонилметаном была подтверждена, например, в следующей работе [40]. В двойное слепое рандомизированное плацебо-контролируемое исследование было включено 50 мужчин и женщин в возрасте 40–76 лет с остеоартритом коленного сустава (около 90 % пациентов имели I–II функциональный класс по классификации Американского колледжа ревматологии 1991 г.). Пациентам назначали метилсульфонилметан 3,0 г 2 раза в день (всего 6,0 г/день) или плацебо 2 раза в день в течение 12 недель. По окончании курса лечения было выяснено, что метилсульфонилметан приводил к достоверно (p < 0,05) большему снижению боли и улучшению функции по шкале WOMAC (индекс выраженности остеоартрита университетов Западного Онтарио и Мак-Мастера) по сравнению с плацебо. Кроме того, метилсульфонилметан вызывал достоверно (p < 0,05) большее улучшение повседневной активности пациентов по шкале SF-36 (краткий вопросник-36) по сравнению с плацебо. В результате был сделан вывод о том, что метилсульфонилметан в дозе 3,0 г 2 раза в день уменьшал выраженность боли и улучшал функцию при остеоартрите коленного сустава в течение короткого курса терапии, не вызывая при этом значимых побочных эффектов. Сходные результаты были получены и в ряде других исследований [41, 42] при остеоартрите коленного и тазобедренного суставов.
Комбинированная терапия метилсульфонилметаном и глюкозамином (тип соли глюкозамина не был доступен) была изучена в следующей работе [43]. В двойное слепое рандомизированное плацебо-контролируемое исследование было включено 118 пациентов обоих полов с легким/умеренным остеоартритом. Больных разделили на 4 группы в соответствии с исследуемой терапией: глюкозамин 500 мг, метилсульфонилметан 500 мг, комбинация глюкозамина и метилсульфонилметана в тех же дозах или плацебо. Эти компоненты принимались 3 раза в день в течение 12 недель. В результате было установлено, что глюкозамин, метилсульфонилметан и их комбинация достоверно улучшали симптомы остеоартрита по сравнению с плацебо. Было отмечено достоверное снижение среднего значения (± станд. откл.) индекса боли с 1,74 ± 0,47 в исходных условиях до 0,65 ± 0,71 к 12-й неделе при лечении глюкозамином (p < 0,001), с 1,53 ± 0,51 до 0,74 ± 0,65 при лечении метилсульфонилметаном (р-значение не приведено). Комбинированная терапия приводила к более выраженному снижению среднего значения индекса боли (с 1,70 ± 0,47 до 0,36 ± 0,33; p < 0,001) (рис. 4). Спустя 12 недель терапии среднее значение индекса отечности достоверно снижалось в группах с глюкозамином и метилсульфонилметаном, однако уменьшение этого показателя в группе с комбинированной терапией было большим (с 1,43 ± 0,63 до 0,14 ± 0,35; p < 0,05). Комбинированная терапия вызывала статистически достоверное снижение индекса Лекена (шкала тяжести остеоартрита Лекена). По результатам исследования был сделан вывод о том, что глюкозамин и метилсульфонилметан обладают обезболивающим и противовоспалительным действием при остеоартрите. Однако их комбинация более эффективна в ослаблении боли, уменьшении отечности и улучшении функциональной способности суставов, чем каждый из компонентов в отдельности. Все средства хорошо переносились. Начало обезболивающего и противовоспалительного действия было более быстрым в группе с комбинированной терапией, чем в группе с глюкозамином.
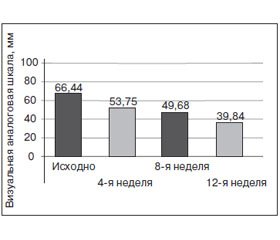
Эффективность монотерапии экстрактами новозеландских зеленых мидий была подтверждена, например, в работе S. Lau et al. [44]. В двойное слепое рандомизированное плацебо-контролируемое исследование было включено 80 пациентов обоих полов в возрасте 46–80 лет с остеоартритом коленного сустава (≥ 3 баллов по шкале Ликерта), которым назначали липидный экстракт новозеландских зеленых мидий (600 мг/день в течение первых двух месяцев, затем 300 мг/день) или плацебо в течение 6 месяцев. В результате достоверное преимущество экстракта перед плацебо было обнаружено в отношении уменьшения боли по визуальной аналоговой шкале спустя 8 недель лечения и в отношении глобальной оценки выраженности артрита по 5-балльной шкале Ликерта спустя 12 недель лечения (в обоих случаях с учетом поправок на изменения в количестве принимаемого парацетамола, данное средство принималось при необходимости). Отмеченное преимущество не было устойчивым, достоверность различий могла исчезать во время последующих визитов, что в целом позволяет оценить обнаруженные различия между липидным экстрактом новозеландских зеленых мидий и плацебо как небольшие, но достоверные. Лечение хорошо переносилось. Эффективность новозеландских зеленых мидий была подтверждена также и в ряде других исследований [45, 46] при остеоартрите коленного и тазобедренного суставов.
Поскольку основным действующим компонентом новозеландских зеленых мидий, как предполагают, являются ω-3 ПНЖК, представляет интерес исследование [12, 47], в котором изучали комбинированную терапию ω-3 ПНЖК и глюкозамина сульфатом. В двойное слепое рандомизированное сравнительное исследование было включено 177 пациентов с умеренным/тяжелым остеоартритом коленного и тазобедренного суставов, которым в течение 26 недель назначали омега-3 ПНЖК (эйкозапентаеновая кислота + докозагексаеновая кислота) в комбинации с глюкозамина сульфатом (1500 мг/день) либо только глюкозамина сульфат в той же дозе. В результате было продемонстрировано, что когда за критерий успешности терапии принимали снижение боли по шкале WOMAC ≥ 80 %, количество респондеров в группе комбинированной терапии было большим (52,2 %), чем в группе монотерапии глюкозамина сульфатом (37,9 %; p = 0,044), что свидетельствует о большей эффективности комбинации (рис. 5). Лечение переносилось хорошо.
/58.jpg)
Эффективность комбинированной терапии глюкозамином (тип соли глюкозамина не был доступен), хондроитина сульфатом и метилсульфонилметаном была изучена в работе S. Vidyasagar et al. [48]. В открытое исследование было включено 37 пациентов обоих полов в возрасте старше 50 лет с остеоартритом коленного сустава (индекс Лекена 10–18 баллов). Пациентам назначали комбинацию глюкозамина 1000 мг, хондроитина сульфата 800 мг и метилсульфонилметана 500 мг 3 раза в день в течение 12 недель. В результате по окончании лечения было выяснено, что данная комбинация эффективно уменьшала боль и увеличивала подвижность суставов (p < 0,05) (рис. 6). Оценки врачей и пациентов также свидетельствовали о достоверном лечебном эффекте комбинации (p < 0,05). Проводимое лечение переносилось хорошо [48].
/59.jpg)
Таким образом, результаты процитированных исследований позволяют ожидать высокую эффективность и безопасность при использовании усиленного комплекса Артромега® у пациентов с остеоартритом коленного и тазобедренного суставов, а также других суставов и у пациентов с остеохондрозом.
Травмы суставов
Травмы суставов могут сопровождаться широким спектром острых повреждений, включая остеохондральные переломы, разрывы связок и мениска, повреждение суставного хряща, внутрисуставные кровотечения. Как следствие, в суставе развиваются воспалительные изменения. Несмотря на то что острые симптомы разрешаются, а некоторые повреждения могут быть устранены хирургически, в хряще и других тканях запускаются хронические процессы ремоделирования, что у большинства пациентов в конечном счете приводит к развитию посттравматического остеоартрита. По данным исследователей США, частота посттравматических остеоартритов составляет 12 % от всех случаев остеоартритов [49, 50].
Несмотря на то что в данном случае этиологическим фактором выступают не возрастные дегенеративные изменения, а травма, воспалительные механизмы, лежащие в основе двух этих процессов, будут одинаковы (рис. 3) [12]. Поэтому хондропротективные средства могут использоваться в составе комплексной терапии посттравматического остеоартрита [51]. Соответственно, все вышеописанные сведения о клинической эффективности компонентов усиленного комплекса Артромега® будут актуальны и для посттравматического остеоартрита.
Спорт
Травмы суставов, возникающие в том числе при занятии спортом, были рассмотрены выше.
В данном разделе хотелось бы отметить тот факт, что, согласно исследованиям [52, 53], прием метилсульфонилметана приводил к недостоверному, но тем не менее клинически значимому уменьшению мышечной и суставной боли, мышечной усталости после физических нагрузок. Авторы исследований поясняют, что для получения достоверных различий необходимо повторить проведенные исследования с большим количеством испытуемых. Кроме того, метилсульфонилметан уменьшал выраженность окислительного стресса после ощутимых физических нагрузок [52, 54]. Препарат новозеландских зеленых мидий уменьшал повреждение мышц и воспаление после выраженных физических нагрузок [55].
Полученные данные позволяют использовать усиленный комплекс Артромега® спортсменами во время тренировок и в ходе восстановления после соревнований. Известно, что при остеоартрите в патологический процесс дополнительно вовлекается мышечный аппарат, что приводит к снижению функции мышц [56]. Результаты вышеприведенных исследований свидетельствуют о том, что применение усиленного комплекса Артромега® будет способствовать нормализации мышечной функции, что повысит эффективность лечения при остеоартрите.
Другие показания
В экспериментальных исследованиях было продемонстрировано, что при образовании костной мозоли в процессе заживления переломов костей важное значение имеют гепарана сульфат, дерматана сульфат и хондроитина сульфат. Введение извне хондроитина сульфата и его предшественника глюкозамина сульфата приводило к ускорению заживления переломов [57–59]. Таким образом, усиленный комплекс Артромега® может применяться для ускорения формирования костной мозоли и срастания костей у пациентов травматологических отделений.
Применение глюкозамина сульфата и хондроитина сульфата после выполнения лечебной артроскопии (например, выполнение множественных проколов основания дефектного хряща в сторону здоровой кости для стимуляции роста нового хряща) может ускорять восстановление пациентов, о чем сообщается в экспериментальных исследованиях и в клинических руководствах [60, 61]. Следовательно, усиленный комплекс Артромега® также целесообразно использовать при этом состоянии.
Заключение
Результаты выполненных экспериментальных и клинических исследований свидетельствуют о том, что применение комплексных хондропротективных средств более предпочтительно, чем монотерапия хондропротекторами, вследствие одновременного влияния на целый ряд патогенетических механизмов. В связи с этим следует признать обоснованной врачебную рекомендацию по применению 24-компонентного усиленного комплекса Артромега® при остеоартрите коленного, тазобедренного и других суставов, посттравматическом остеоартрите; остеохондрозе; для ускорения образования костной мозоли и, как следствие, ускорения заживления переломов; для ускорения восстановления после лечебной артроскопии; для улучшения мышечной функции, например, у спортсменов до и после тренировок и у пациентов с остеоартритом.
Список литературы
1. Wittenauer R., Smith L., Aden K. Background Paper 6.12 Osteoarthritis // Priority Medicines for Europe and the World «A Public Health Approach to Innovation». — 2013. — http://www.who.int
2. Guideline on clinical investigation of medicinal products used in the treatment of osteoarthritis // European Medicines Agency. — 2010. — http://www.ema.europa.eu
3. Barr A.J., Conaghan P.G. Disease-modifying osteoarthritis drugs (DMOADs): what are they and what can we expect from them? // Medicographia. — 2013. — V. 35. — P. 189-196.
4. Textbook of Geriatric Medicine International // Argos. — 2010. — 460 p.
5. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis / Wandel S., Jüni P., Tendal B. et al. // BMJ. — 2010. — V. 16, № 341. — Р. 4675.
6. Effect of glucosamine or chondroitin sulfate on the osteoarthritis progression: a meta-analysis / Lee Y.H., Woo J.H., Choi S.J. et al. // Rheumatol. Int. — 2010. — V. 30, № 3. — P. 357-363.
7. Henrotin Y., Marty M., Mobasheri A..What is the current status of chondroitin sulfate and glucosamine for the treatment of knee osteoarthritis? // Maturitas. — 2014. — V. 78, № 3. — P. 184-187.
8. Hochberg M.C., Zhan M., Langenberg P. The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and meta-analysis of randomized placebo-controlled trials of chondroitin sulfate // Curr. Med. Res. Opin. — 2008. — V. 24, № 11. — P. 3029-3035.
9. Hochberg M.C. Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta-analysis of randomized placebo-controlled trials of 2-year duration // Osteoarthritis Cartilage. — 2010. — V. 18 (Suppl. 1). — P. S28-S31.
10. Glucosamine and chondroitin for knee osteoarthritis: a double-blind randomised placebo-controlled clinical trial evaluating single and combination regimens / Fransen M., Agaliotis M., Nairn L. et al. // Ann. Rheum. Dis. — 2015. — V. 74, № 5. — P. 851-858.
11. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis / Clegg D.O., Reda D.J., Harris C.L. et al. // N. Engl. J. Med. — 2006. — V. 354, № 8. — P. 795-808.
12. Jerosch J. Effects of Glucosamine and Chondroitin Sulfate on Cartilage Metabolism in OA: Outlook on Other Nutrient Partners Especially Omega-3 Fatty Acids // International Journal of Rheumatology. — V. 2011, Article ID 969012. — 17 p.
13. Sokolove J., Lepus C.M. Role of inflammation in the pathogenesis of osteoarthritis: latest findings and interpretations // Ther. Adv. Musculoskelet. Dis. — 2013. — V. 5, № 2. — P. 77-94.
14. Chondroitin sulfate modulation of matrix and inflammatory gene expression in IL-1beta-stimulated chondrocytes-study in hypoxic alginate bead cultures / Legendre F., Baugé C., Roche R. et al. // Osteoarthritis Cartilage. — 2008. — V. 16, № 1. — P. 105-114.
15. Glucosamine and chondroitin sulfate regulate gene expression and synthesis of nitric oxide and prostaglandin E(2) in articular cartilage explants / Chan P.S., Caron J.P., Rosa G.J., Orth M.W. // Osteoarthritis Cartilage. — 2005 — V. 13, № 5. — P. 387-394.
16. Chan P.S., Caron J.P., Orth M.W. Effect of glucosamine and chondroitin sulfate on regulation of gene expression of proteolytic enzymes and their inhibitors in interleukin-1-challenged bovine articular cartilage explants // Am. J. Vet. Res. — 2005. — V. 66, № 11. — P. 1870-1876.
17. Antioxidant activity of chondroitin sulfate / Campo G.M., Avenoso A., Campo S. et al. // Adv. Pharmacol. — 2006. — V. 53. — P. 417-431.
18. The antioxidant activity of glucosamine hydrochloride in vitro / Xing R., Liu S., Guo Z. et al. // Bioorg. Med. Chem. — 2006. — V. 14, № 6. — P. 1706-1709.
19. Henrotin Y.1, Mobasheri A., Marty M. Is there any scientific evidence for the use of glucosamine in the management of human osteoarthritis? // Arthritis. Res. Ther. — 2012. — V. 14, № 1. — Numb. of Publ. 201 — 10 p.
20. The MSM Miracle // http://www.msm-info.com
21. Parcell S. Sulfur in human nutrition and applications in medicine // Altern. Med. Rev. — 2002. — V. 7, № 1. — P. 22-44.
23. Chondroitin Sulfate and Sulfur Containing Chondroprotective Agents: Is there a Basis for their Pharmacological Action? / Nimni M.E., Cordoba F., Strates B., Han B. // Current Rheumatology Reviews. — V. 2, № 2. — P. 137-149.
24. Crosslinking by advanced glycation end products increases the stiffness of the collagen network in human articular cartilage: a possible mechanism through which age is a risk factor for osteoarthritis / Verzijl N., DeGroot J., Ben Z.C. et al. // Arthritis Rheum. — 2002. — V. 46, № 1. — P. 114-123.
25. Cordoba F., Nimni M.E. Chondroitin sulfate and other sulfate containing chondroprotective agents may exhibit their effects by overcoming a deficiency of sulfur amino acids // Osteoarthritis and Cartilage. — 2003. — V. 11, № 3. — P. 228-230.
26. Methylsulfonylmethane (MSM) Monograph // Alternative Medicine Review. — 2003. — V. 8, № 4. — P. 438-441.
27. Mourão P.A. Distribution of chondroitin 4-sulfate and chondroitin 6-sulfate in human articular and growth cartilage // Arthritis Rheum. — 1988. — V. 31, № 8. — P. 1028-1033.
28. Coscarelli P.G., Silva L.C.F., Mourão P.A.S. Chondroitin 4- and 6-sulfate in growth and articular cartilage of young and adult humans // Mem. Inst. Oswaldo Cruz. — 1991. — V. 86 (Suppl. III). — P. 99-100.
29. Discrepancies in composition and biological effects of different formulations of chondroitin sulfate / Martel-Pelletier J., Farran A., Montell E. et al. // Molecules. — 2015. — V. 20, № 3. — P. 4277-4289.
30. Volpi N. Analytical aspects of pharmaceutical grade chondroitin sulfates // J. Pharm. Sci. — 2007. — V. 96. — P. 3168-3180.
31. Sculti L. Arthritis Benefits from Shark Cartilage Therapy // Alternative and Complementary Therapies. — 1994. — V. 1, № 1. — P. 35-37.
32. Bargahi A., Rabbani-Chadegani A. Angiogenic inhibitor protein fractions derived from shark cartilage // Biosci. Rep. — 2008. — V. 28, № 1. — P. 15-21.
33. Kendall R.V., Lawson J.W., Hurley L.A. New research and a clinical report on the use of Perna canaliculus in the management of arthritis // Townsend Letter for Doctors & Patients. — 2000. — P. 99-111.
34. Ameye L.G., Chee W.S. Osteoarthritis and nutrition. From nutraceuticals to functional foods: a systematic review of the scientific evidence // Arthritis Res. Ther. — 2006. — V. 8, № 4. — P. R127.
35. Doggrell S.A. Lyprinol — is it a useful anti-inflammatory agent? // Evid. Based Complement. Alternat. Med. — 2011. — V. 2011. — Article ID 307121.
36. An evidence-based systematic review of green-lipped mussel (Perna canaliculus) by the Natural Standard Research Collaboration / Ulbricht C., Chao W., Costa D. et al. // J. Diet Suppl. — 2009. — V. 6, № 1. — P. 54-90.
37. Савустьяненко А.В. Эффективность экстракта мартинии душистой (сустамар) при остеоартритах, поясничной боли и фибромиалгии: обзор исследований // Боль. Суставы. Позвоночник. — 2014. — Т. 3, № 15. — http://www.mif-ua.com/archive/article/39271
38. Nielsen F.H., Stoecker B.J., Penland J.G. Boron as a dietary factor for bone microarchitecture and central nervous system function / Xu F., Goldbach H.E., Brown P.H. et al. (Eds.) // Advances in plant and animal boron nutrition. — Springer: Dordrecht, 2007. — P. 277-290.
39. Newnham R.E. Essentiality of boron for healthy bones and joints // Environ Health Perspect. — 1994. — V. 102 (Suppl. 7). — P. 83-85.
40. Efficacy of methylsulfonylmethane (MSM) in osteoarthritis pain of the knee: a pilot clinical trial / Kim L.S., Axelrod L.J., Howard P. et al. // Osteoarthritis Cartilage. — 2006. — V. 14, № 3. — P. 286-294.
41. Efficacy of methylsulfonylmethane supplementation on osteoarthritis of the knee: a randomized controlled study / Debbi E.M., Agar G., Fichman G. et al. // BMC Complement. Altern. Med. — 2011. — V. 27, № 11. — Numb. of Publ. 50.
42. The Effect of Methylsulfonylmethane on Osteoarthritic Large Joints and Mobility // Pagonis T.A., Givissis P.A., Kritis A.C., Christodoulou A.C. // Int. Journal of Orthopaedics. — 2014. — V. 1, № 1. — P. 19-24.
43. Usha P.R., Naidu M.U. Randomised, Double-Blind, Parallel, Placebo-Controlled Study of Oral Glucosamine, Methyl–sulfonylmethane and their Combination in Osteoarthritis // Clin. Drug Investig. — 2004. — V. 24, № 6. — P. 353-363.
44. Treatment of knee osteoarthritis with Lyprinol, lipid extract of the green-lipped mussel — a double-blind placebo-controlled study / Lau S., Chiu P.K., Chu E.M.Y. et al. // Progress in Nutrition. — 2004. — V. 61, № 17. — P. 17-31.
45. Zawadzki M, Janosch C, Szechinski J. Perna canaliculus Lipid Complex PCSO-524TM Demonstrated Pain Relief for Osteoarthritis Patients Benchmarked against Fish Oil, a Randomized Trial, without Placebo Control // Marine Drugs. — 2013. — V. 11. — P. 1920-1935.
46. Green-lipped mussel (Perna canaliculus) extract efficacy in knee osteoarthritis and improvement in gastrointestinal dysfunction: a pilot study / Coulson S., Vecchio P., Gramotnev H., Vitetta L. // Inflammopharmacology. — 2012. — V. 20, № 2. — P. 71-76.
47. Effect of glucosamine sulfate with or without omega-3 fatty acids in patients with osteoarthritis / Gruenwald J., Petzold E., Busch R. et. al. // Adv. Ther. — 2009. — V. 26, № 9. — P. 858-871.
48. Efficacy and tolerability of glucosamine chondroitin sulphate — methyl sulfonyl methane (msm) in osteoarthritis of knee in indian patients / Vidyasagar S., Mukhyaprana P., Shashikiran U. et al. // Iranian journal of pharmacology & therapeutics. — 2004. — V. 3, № 2. — P. 61-65.
49. Lotz M.K. Posttraumatic osteoarthritis: pathogenesis and pharmacological treatment options // Arthritis Research & Therapy. — 2010. — V. 12. — Numb. of Publ. 211.
50. Posttraumatic osteoarthritis: a first estimate of incidence, prevalence, and burden of disease / Brown T.D., Johnston R.C., Saltzman C.L. et. al. // J. Orthop. Trauma. — 2006. — V. 20, № 10. — P. 739-744.
51. The Use of NSAIDs and Nutritional Supplements in Athletes with Osteoarthritis: Prevalence, Benefits, and Consequences / Robert T., Gorsline M.D., Christopher C., Kaeding M.D. // Clin. Sports Med. — 2005. — V. 24. — P. 71-82.
52. Influence of methylsulfonylmethane on markers of exercise recovery and performance in healthy men: a pilot study / Kalman D.S., Feldman S., Scheinberg A.R. et al. // J. Int. Soc. Sports Nutr. — 2012. — V. 9, № 1. — P. 46.
53. Effects of MSM on exercise-induced muscle and joint pain: a pilot study. Journal of the International Society of Sports Nutrition / Withee E.D., Tippens K.M., Dehen R., Hanes D. — 2015. — V. 12 (Suppl. 1). — P. P8.
54. Effect of chronic supplementation with methylsulfonylmethane on oxidative stress following acute exercise in untrained healthy men / Nakhostin-Roohi B., Barmaki S., Khoshkhahesh F., Bohlooli S. // Pharm. Pharmacol. — 2011. — V. 63, № 10. — P. 1290-1294.
55. The effects PCSO-524®, a patented marine oil lipid and omega-3 PUFA blend derived from the New Zealand green lipped mussel (Perna canaliculus), on indirect markers of muscle damage and inflammation after muscle damaging exercise in untrained men: a randomized, placebo controlled trial / Mickleborough T.D., Sinex J.A., Platt D. et al. // J. Int. Soc. Sports Nutr. — 2015. — V. 12. — Numb. of Publ. 10.
56. Fisher N.M., Pendergast D.R. Reduced muscle function in patients with osteoarthritis // Scand. J. Rehabil. Med. — 1997. — V. 29, № 4. — P. 213-221.
57. Oral supplementation of chondroitin sulfate to facilitate fracture healing: a pilot study / Hishmeh S., Stefan Judex S., Cardoz H., Jaggi S. // J. Orthopaedics. — 2007. — V. 4, № 4. — Numb. of Publ. e2.
58. Burger M., Sherman B.S., Sobel A.E. Observations of the influence of chondroitin sulphate on the rate of bone repair // J. Bone Joint Surg Br. — 1962. — V. 44-B, № 3. — P. 675-687.
59. Glucosamine-sulfate on fracture healing / Uğraş A., Güzel E., Korkusuz P. et al. // Ulus Travma Acil Cerrahi Derg. — 2013. — V. 19, № 1. — P. 8-12.
60. Pierce S.W. Oral Use of a Hyaluronic acid, Glucosamine and Chondroitin Combination following Arthroscopic Surgery in the Horse // https://www.kinetictech.net
61. Patient Pathway on Knee Arthroscopy // Sunshine Coast Orthopaedic Clinic. — http://www.sunshineortho.com.au
62. Pharmacological Evaluation of Glyco-Flex® III and its Constituents on Canine Chondrocytes / Yáñez J.A., Remsberg C.M., Vega-Villa K. et al. // Journal of Medical Sciences (Faisalabad). — 2008. — V. 8, № 1. — P. 1-14.
63. Methylsulfonylmethane inhibits NLRP3 inflammasome activation / Ahn H., Kim J., Lee M.J. et al. // Cytokine. — 2015. — V. 71, № 2. — P. 223-231.
64. The anti-inflammatory effects of methylsulfonylmethane on lipopolysaccharide-induced inflammatory responses in murine macrophages / Kim Y.H., Kim D.H., Lim H. et al. // Biol. Pharm. Bull. — 2009. — V. 32, № 4. — P. 651-656.
/57.jpg)
/59.jpg)

/54.jpg)
/55.jpg)
/58.jpg)