Панкреатоплевральні нориці (ППН), за даними різних авторів, розвиваються в 0,4–7,0 % хворих на хронічний панкреатит. Здебільшого виникнення ППН пов’язують із наявністю псевдокісти підшлункової залози, що сполучається з головною панкреатичною протокою (ГПП) [4].
У клінічній картині ППН переважають прояви масивного ексудативного плевриту — ядуха, біль у грудній клітці, кашель, підвищення температури тіла [5]. Здебільшого відмічається лівобічний ексудативний плеврит. Однак правобічний та двобічний плеврити виявляють в 19,0 і 14,0 % пацієнтів відповідно [6].
Для діагностики ППН використовують дослідження рівня амілази в плевральній рідині (норма < 150 МЕ/л), що є одним із провідних методів визначення наявності сполучення ГПП із плевральною порожниною [7]. Серед інструментальних методів найбільш поширеними є: оглядова рентгенографія органів грудної порожнини, ультразвукове дослідження органів черевної порожнини, комп’ютерна томографія (КТ) органів черевної та грудної порожнини. При цьому ефективність КТ для визначення локалізації ППН вважають низькою [8]. Для цього більш інформативною є ендоскопічна ретроградна холангіопанкреатографія (ЕРХПГ), що дозволяє встановити діагноз ППН у 80,0 % випадків та локалізувати норицевий хід у 59,0–74,0 % хворих [9]. Візуалізація ГПП, визначення стенозів протоки та їх рівня за даними ЕРХПГ є важливими при виборі тактики лікування (резекційні методики або дренування панкреатичного протоку). Крім того, ЕРХПГ має не тільки діагностичні, а й лікувальні можливості. Метод дозволяє проводити стентування ГПП. Останнім часом із метою оцінки локалізації та структури ППН усе частіше використовують магнітно-резонансну холангіопанкреатографію, перевагами якої є неінвазивність та висока інформативність [10].
У лікуванні ППН використовують як міні-інвазивні технології, так і традиційні хірургічні втручання. При цьому як першу ланку лікування рекомендують проведення дренування плевральної порожнини, призначення препаратів, що пригнічують секрецію підшлункової залози, та виконання РХПГ із подальшим стентуванням ГПП за наявності патології загальної панкреатичної протоки [11]. Деякі дослідники вважають, що використання ендоскопічного стентування ГПП є альтернативою традиційній хірургічній тактиці. Однак консервативне лікування супроводжується тривалим перебуванням хворого в стаціонарі, підвищенням економічних витрат, збільшенням кількості ускладнень [12]. Так, частота розвитку гострого панкреатиту, кровотечі, перфорації, септичного стану після стентування становить від 7 до 25 % [13].
Водночас використання традиційної хірургічної тактики передбачає проведення резекційних чи панкреатоцистодигестивних операцій — дистальної резекції підшлункової залози, цистопанкреатоєюностомії та інших [1–3].
Ми маємо досвід хірургічного лікування двох пацієнтів, яким було встановлено діагноз «панкреатоплевральна нориця». Наводимо ці клінічні випадки.
Пацієнт С., 56 років, госпіталізований у відділення пульмонології обласної клінічної лікарні ім. І.І. Мечникова 15.05.16 р. зі скаргами на ядуху, загальну слабкість, біль у лівій половині грудної клітки, кашель. Хворіє з березня 2016 р., коли виникли вказані вище скарги, за місцем помешкання при обстеженні виявлено лівобічний ексудативний плеврит, проводилися неодноразові плевральні пункції, після чого діагностовано рецидив плевриту. Хворий помірного харчування, в анамнезі зловживання алкоголем, неодноразові напади гострого панкреатиту. З 30.03.16 р. по 14.04.16 р. проводилося лікування у відділенні пульмонології обласної клінічної лікарні ім. І.І. Мечникова, виконувалися неодноразові пункції лівої плевральної порожнини.
При рентгенологічному дослідженні виявлено гомогенне затемнення лівої половини гемітораксу від купола діафрагми до 3-го ребра (рахунок попереду), потовщення міждолевої плеври. У загальному та біохімічному аналізі крові патологічних змін не було.
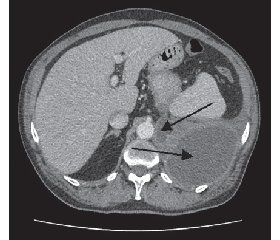
Проведена комп’ютерна томографія органів грудної та черевної порожнини з внутрішньовенним підсиленням 100 мл томогексолу 350. При дослідженні ліворуч у передніх відділах гемітораксу візуалізувалося відокремлене рідинне скупчення за типом осумкованого гідротораксу розміром 160 × 128 × 195 мм, щільністю 10 Нu, що віддавлювало нижню частку лівої легені. Підшлункова залоза не збільшена: головка — 24 мм, тіло — 18 мм, хвіст — 19 мм. Структура її неоднорідна, у хвості декілька кальцинатів діаметром 3–4 мм та рідинне скупчення до 6 мм у діаметрі з чіткими контурами. Вірсунгова протока не розширена. Установлено зв’язок рідинного скупчення лівого гемітораксу через норицевий хід, що проходить у проекції лівої ніжки діафрагми, у заочеревинний простір із псевдокістою біля хвоста підшлункової залози розміром 19 × 16 мм (рис. 1, 2).
/97-1.gif)
Під час пункції лівої плевральної порожнини видалено 1500 мл бурої рідини. Рівень амілази в рідині плевральної порожнини — 16 892 од/л. Цитологічне дослідження рідини: білок — 32 г/л, проба Рівольта позитивна, еритроцити покривають усе поле зору, клітини мезотелію — 2–3 у полі зору, лейкоцити — 2–3, переважно нейтрофіли, спостерігаються поодинокі еозинофіли та перстнеподібні клітини.
17.06.16 р. проведене планове хірургічне втручання: торакоцентез, дренування лівої плевральної порожнини в 5-му міжреберному проміжку, верхня серединна лапаротомія, дистальна резекція підшлункової залози, спленектомія, дренування черевної порожнини. Під час операції при ревізії черевної порожнини в ділянці хвоста підшлункової залози та воріт селезінки виявлено інфільтрат із вогнищами стеатонекрозів на оточуючих тканинах. ППН розташовувалась між указаним інфільтратом та реберно-хребтовим кутом діафрагми. При виконанні дистальної резекції підшлункової залози тканина останньої м’яка, вірсунгова протока діаметром 2 мм. Виконано перев’язку останньої. Панкреатоплевральна нориця видалена до діафрагми, пересічена та прошита.
Гістологічне дослідження видаленої частини підшлункової залози: у підшлунковій залозі індуративний панкреатит із перебудовою дрібних вивідних протоків, значною гіпертрофією інсулярного апарату, вогнищами крововиливів різного ступеня давнини, помірною нейтрофільною інфільтрацією фіброзної тканини в ділянці норицевого ходу та організацією та васкуляризацією великих крововиливів. У жировій клітковині, що оточує підшлункову залозу, розростання вен з ектазією стінок і пристінковими тромбами.
Перебіг післяопераційного періоду без ускладнень. Накопичення рідини в плевральній порожнині не відмічено. Дренажі з черевної та плевральної порожнини видалені на 3-тю добу. Хворий у задовільному стані виписаний із відділення на 10-ту добу після операції. При контрольному обстеженні через 3 місяці скарг не має, патологічних змін із боку органів черевної та плевральної порожнин не виявлено.
Пацієнт Р., 44 роки, хворіє з серпня 2016 р., коли після фізичного навантаження виникли ядуха, загальна слабкість. У 2014 році хворий оперований із приводу гострого панкреатиту, виконані діагностична лапаро–скопія, дренування черевної порожнини. З 09.09.2016 р. перебував на лікуванні у відділенні хірургії та трансплантації обласної клінічної лікарні ім. І.І. Мечникова. При надходженні у відділення скарги на ядуху, біль у верхніх відділах живота. Хворий помірного харчування, шкірні покрови бліді, при огляді відмічаються відставання лівої половини грудної стінки під час дихання, притуплення перкуторного звуку на боці скупчення рідини, ослаблення дихання при аускультації.
За даними спіральної комп’ютерної томографії з внутрішньовенним контрастуванням виявлено вільну рідину в лівій плевральній порожнині, що займає третину гемітораксу. У проекції хвоста підшлункової залози відмічається рідинне утворення з наявністю аневризматично розширеної судини в центрі діамет–ром 24 мм. У проекції тіла підшлункової залози спостерігається рідинне утворення, що поширюється до діафрагми, розміром 39 × 38 мм. Парамедіально в проекції лівої ніжки діафрагми виявлено рідинне утворення розміром 27 × 26 мм (рис. 3, 4). Висновок: ознаки псевдокіст підшлункової залози з ймовірним існуванням норицевого ходу в плевральну порожнину, аневризма селезінкової артерії в полості псевдокісти.
/98-1.gif)
Проведена пункція лівої плевральної порожнини, видалено 1500 мл рідини, цитологічне дослідження: рідина мутна, білок — 23,2 г/л, проба Рівольта позитивна, еритроцити покривають усе поле зору, клітини мезотелію — 2–3 у полі зору, лейкоцити — 18–20, переважно нейтрофіли, клітини з ознаками атипії не виявлені. Рівень амілази в плевральній рідині — 5497 од/л.
22.09.2016 року хірургічне втручання: торакоцентез, дренування лівої плевральної порожнини в 6-му міжреберному проміжку, верхня серединна лапаротомія, дистальна резекція підшлункової залози, спленектомія. При ревізії черевної порожнини селезінка збільшена в розмірах — 15,0 × 10,0 см, підшлункова залоза щільна, у ділянці хвоста виявлена псевдокіста до 2,5 см у діаметрі. У ділянці лівої ніжки діафрагми виявлена веретеноподібна ППН діаметром 1,5 см, що поширюється від тіла підшлункової залози до реберно-хребтового кута діафрагми. Виконано роз’єднання ППН, її прошивання, дефект у діафрагмі вшитий. Зроблена дистальна резекція хвоста підшлункової залози з псевдокістою. ГПП діаметром 4 мм, при зондуванні проходимо до рівня голівки підшлункової залози. Виділена петля тонкої кішки за методом Ру на відстані 30 см від зв’язки Трейця, довжиною 60 см, проведена позаду поперекової товстої кишки, сформовано панкреатовірсунгоєюноанастомоз «кінець у бік». Дренування черевної порожнини.
При гістологічному дослідженні отриманого матеріалу виявлена картина хронічного індуративного панкреатиту.
Перебіг післяопераційного періоду гладкий. Дренажі з черевної та плевральної порожнин видалені на 4-ту добу після операції. Шви зняті на 10-ту добу. Хворий оглянутий через 3 місяця, вільної рідини в плевральних порожнинах не виявлено, стан хворого задовільний.
Таким чином, хворі з ексудативним плевритом, що рецидивує, незважаючи на проведене консервативне лікування, потребують виконання заходів, спрямованих на виявлення можливої панкреатоплевральної нориці. Проведення комп’ютерної томографії органів грудної та черевної порожнини з внутрішньовенним контрастуванням та визначення рівня амілази в плевральній рідині є достатньо інформативними методами діагностики панкреатоплевральної нориці. Використання резекційних методів хірургічного лікування цього ускладнення хронічного панкреатиту з урахуванням патологічних змін підшлункової залози (наявність псевдокіст, діаметр головної панкреатичної протоки) та з обов’язковим роз’єднанням панкреатоплевральної нориці дозволяє отримати добрі найближчі та віддалені результати в даної категорії хворих.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Данилов М.В. Тактика лечения осложненных псевдокист поджелудочной железы / М.В. Данилов, В.Г. Зурабиани // Экспериментальная и клиническая гаст-роэнтерология. — 2011. — № 7. — С. 53-58.
2. Особенности течения хронического рецидивирующего панкреатита с формированием свища в плевральную полость / Н.В. Ефимов, А.С. Ремизов, Э.А. Синявский, А.Д. Ахметов // Сборник материалов ХІХ Международного конгресса хирургов-гепатологов России и стран СНГ, г. Иркутск, 19–21 сентября 2012. — С. 131.
3. Абдульянов А.В. Хирургическое лечение больных хроническим панкреатитом и его осложнениями / А.В. Абдульянов, М.М. Миннуллин, М.А. Бородин // Практическая медицина. — 2014. — № 4(80), Т. 2. — С. 7-11.
4. Anestis P. Ninos Role of diaphragm in pancreaticopleural fistula / Anestis P. Ninos, Stephanos K. Pierrakakis / World J. Gastroenterol. — 2011. — Vol. 17(32). — P. 3759-3760.
5. Pancreaticopleural fistula: diagnosis with magnetic resonance pancreatography / R. Materne, P. Vranckx, C. Pauls et al. // Chest. — 2000. — Vol. 117(3). — P. 912-914.
6. Pancreaticopleural fistula: a rare complication of ERCP-induced pancreatitis / M. Sut, R. Gray, M. Ramachandran, T. Diamond // Ulster Medical Journal. — 2009. — Vol. 78(3). — P. 185-186.
7. Keyashian K. Pleural effusion caused by a pancreatic pleural fistula / K. Keyashian, J. Buxbaum // Gastrointestinal Endoscopy. — 2012. — Vol. 76(2). — P. 422-424.
8. Safadi B.Y. Pancreatic-pleural fistula: the role of ERCP in diagnosis and treatment / B.Y. Safadi, J.M. Marks // Gastrointestinal Endoscopy. — 2000. — Vol. 51(2). — P. 213-215.
9. Dhebri A.R. Nonsurgical management of pancreaticopleural fistula / Dhebri A.R., Ferran N. // Journal of the Pancreas. — 2005. — Vol. 6(2). — P. 152-161.
10. Pancreaticopleural fistula: an unusual complication of pancreatitis diagnosed with magnetic resonance cholangiopancreatography / S. Vyas, D. Gogoi, SK. Sinha et al. // Journal of the Pancreas. — 2009. — Vol. 10(6). — P. 671-673.
11. Pancreatic-pleural fistula is best managed by early ope–ra–tive intervention / J.C. King, H.A. Reber, S. Shiraga, O.J. Hines // Surgery. — 2010. — Vol. 147(1). — P. 154-159.
12. Pancreatic-pleural fistula is best managed by early opera–tive intervention / J.C. King, H.A. Reber, S. Shiraga, O.J. Hines // Surgery. — 2010. — Vol. 147(1). — P. 154-159.
13. Рai C.G. Endoscopic treatment as first-line therapy for pancreatic ascites and pleural effusion / C.G. Pai, D. Suvarna, G. Bhat // J. Gastroenterol. Hepatology. — 2009. — Vol. 24. — P. 1198-1202.

/97-1.gif)
/98-1.gif)