Вступ
Сечокам’яна хвороба (СКХ) посідає друге місце у структурі патології нирок і третє — у структурі причин смерті від урологічних захворювань, що становить 30–45 % від загальної кількості хворих цього профілю [9, 11]. СКХ зустрічається у 3–5 % населення планети [9, 11]. Рецидив каменеутворення після відходження конкременту або його видалення становить 15–45 %, а частота повторного розвитку коралоподібного нефролітіазу протягом 5 років досягає 50 % [2]. Актуальність проблеми, що пов’язана з СКХ, також обумовлена високим відсотком (65–70 % випадків у осіб найбільш працездатного віку) та почастішанням випадків у дітей навіть грудного віку [2].
Велика кількість традиційних хірургічних методик і поява нових малоінвазивних оперативних технологій, що використовуються у хворих на СКХ, вимагають оцінки їх ефективності шляхом використання адекватних діагностичних маркерів. Привертає увагу відсутність класифікації за ступенем тяжкості порушень у паренхімі нирки цих хворих, що ускладнює призначення адекватної тактики ведення хворих.
У цьому аспекті нас зацікавив цистатин С, що є білком із сімейства інгібіторів цистеїнпротеїнази і використовується поодинокими дослідниками для оцінки ступеня пошкодження нирки. Наприклад, він був високоінформативним для визначення пошкодження паренхіми нирки у ранньому післяопераційному періоді після резекції пухлин нирки у режимі теплової ішемії [10, 12, 13]. Зазначений маркер синтезується всіма клітинами організму і виявляється в усіх біологічних рідинах, вільно фільтрується через клубочкову мембрану завдяки низькій молекулярній масі. Через це рівень цистатину C відносно стабільний у системній циркуляції. Чим тяжча ниркова патологія, тим гірше цистатин С фільтрується в нирках і тим вищим є його рівень у крові [13]. Доведено, що підвищення рівня цистатину С може бути інформативним вже на ранніх стадіях порушення функції нирок [10]. Отримані останніми роками дані свідчать про більшу інформативність цистатину С як маркера швидкості клубочкової фільтрації (ШКФ), ніж креатинін [10, 12]. Рівень креатиніну не є надійним індикатором функції нирок і на відміну від цистатину С залежить від віку, статі, м’язової маси, особливостей харчування, фізичної активності, раси, застосування ліків, стану гідратації та ін. [13]. При дослідженні зниженої більш ніж на 50 % функції нирок рівень креатиніну може досягати лише верхньої межі норми. Крім того, на ранній стадії гострого запалення нирки підвищення рівня креатиніну в сироватці крові має затриману індикацію ступеня функціональних змін ШКФ, що відстають від структурних зрушень, які відбуваються в нирках [10, 12]. Усе вищезазначене дозволяє розглядати на сьогодні цистатин C як найінформативніший показник, що здатен відображати функцію нирок.
Метою роботи було підвищення ефективності діагностики ушкодження паренхіми нирок та терапії хворих на СКХ.
Матеріали та методи
За період з 2014 по 2017 рік було досліджено 158 хворих на нефролітіаз.
Діагноз встановлювали згідно з клініко-анамнестичними даними і лабораторними та інструментальними дослідженнями [3, 7].
Рутинне рентгенологічне обстеження включало оглядову і екскреторну урографію або томографію з контрастуванням. Рентгендослідження було виконано на стаціонарній рентгенологічній установці; комп’ютерна томографія — на апараті Toshiba Аquilion 16 [7].
Серед досліджених хворих 97 (61,3 %) мали нефролітіаз з конкрементами до 2 см у діаметрі (у середньому 1,69 ± 0,29 см), різними за нирковою локалізацією, складом, щільністю (1003,00 ± 326,57 HU). Середній вік хворих становив 51,1 ± 9,3 року. Жінок було 55 (56,7 %), чоловіків — 42 (43,3 %). Також під спостереженням був 61 пацієнт (38,6 %) з коралоподібним нефролітіазом. Середній вік хворих становив 54,0 ± 12,8 року. Жінок було 43 (70,5 %), чоловіків — 18 (29,5 %).
Для визначення травматизації різних методів нефролітотрипсії використовувався біохімічний маркер крові цистатин С, рівень якого не залежить від статі. Методом імуноферментного аналізу визначали його вміст у сироватці крові хворих на нефролітіаз у перед–операційному періоді та у перші 48 годин після оперативного втручання. Використовували тест-систему BioVendor (Німеччина).
Хворі були розподілені на п’ять дослідних груп. Перші три групи формували пацієнти з конкрементами до 2 см. Четверту і п’яту групи формували пацієнти, які мали коралоподібний нефролітіаз. Порівняльні групи були максимально рандомізовані за віком, вихідним клінічним параметрам і супутньою патологією для забезпечення репрезентативності одержаних результатів. Шоста була репрезентативна група контролю.
Першу групу формував 31 пацієнт. У цих хворих було застосовано мікроперкутанну нефролітотрипсію з використанням фіброволоконної мікрооптики діаметром 0,9 мм за удосконаленою нами методикою [6].
До другої групи увійшов 31 хворий. У цій групі було проведено ультраміні-перкутанну нефролітотрипсію [6].
Третю групу становили 35 пацієнтів, яким було проведено стандартну перкутанну нефролітотрипсію [4].
Четверту групу сформували 30 пацієнтів із коралоподібним нефролітіазом, у яких було використано один стандартний у комбінації з множинними ультраміні-перкутанними доступами [5].
У п’ятій групі 31 пацієнту було проведено нефролітотрипсію з використанням множинних стандартних доступів [5].
Шосту групу (контрольну) становили 32 умовно-здорових добровольці. Показник цистатину С у осіб цієї групи вважався за норму.
Ендоскопічні втручання виконували за допомогою ендовідеоскопічної стійки з апаратурою фірми Stryker (США) та Karl Storz (Німеччина).
Відповідно до дослідницького протоколу пацієнти з конкрементами до 2 см формували перші три групи.
Для визначення адекватності запропонованої шкали розподілу ступеня травматизації паренхіми нирки застосовувався метод аналізу кривих операційних характеристик (ROC — Receiver Operating Characteristic curve analysis) [8].
Статистичні дослідження були виконані за допомогою пакета Statistica 6.0. Відмінності між дослідними групами визнавалися статистично значущими при р < 0,05 за t-критерієм Стьюдента або Фішера. Порівняння показників номінальних змінних здійснювалося за допомогою критерію χ2 [1].
Дані в тексті наведено у вигляді M ± SD (M — середня арифметична, SD — середньоквадратичне відхилення) або Ме (Ме — медіана).
Результати та обговорення
Для визначення ступеня травматизації паренхіми нирки при застосуванні різних методик нефролітотрипсії нами вперше було застосовано динаміку рівня цистатину С у крові.
Початкові показники вмісту цистатину С у хворих перших трьох груп були вищими за його рівень у контрольній групі (р < 0,05), що може бути пов’язано з періодичною обструкцією конкрементом сечовивідних шляхів, персистуванням патогенної флори, що сприяло хронічному запаленню та ушкодженню паренхіми нирки (табл. 1). Вихідні показники у пацієнтів IV і V груп були вірогідно вищими, ніж у хворих перших трьох груп, що пов’язано з більшим впливом коралоподібного конкременту на функціональний стан нирки. Статистично значущої різниці між рівнями цистатину С у групах І, ІІ і ІІІ, а також у групах IV і V до лікування не спостерігалося, що вказує на однорідність вибірок.
/47-2.jpg)
Після хірургічного втручання концентрація цистатина С у крові хворих перших двох груп вірогідно не змінилася, спостерігалася лише тенденція до підвищення рівня цього показника у ІІ групі. Натомість у ІІІ, IV і V групах відбулося вірогідне підвищення концентрації цистатину С, що вказувало на більший травмуючий вплив на паренхіму нирки.
Для об’єктивізації оцінки впливу конкретної хірургічної методики у хворих нами досліджувався приріст концентрації цистатину С. Статистично значущої різниці за цим показником між І та ІІ групами не спостерігалося, що також свідчило про однаковий вплив цих методик на паренхіму нирки. У зазначених групах приріст концентрації цистатину С після лікування був вірогідно меншим, ніж у ІІІ, IV і V групах, що було підтвердженням низької травматизації перших двох методик. Вірогідної різниці цього показника між групами ІІІ і IV не спостерігалося, що характеризувало незначний вплив ультраміні-перкутанного доступу на паренхіму нирки. Найбільш травматичною за показником приросту цистатину С виявилася методика використання множинних стандартних доступів, що використовувалася у хворих на коралоподібний нефролітіаз V групи.
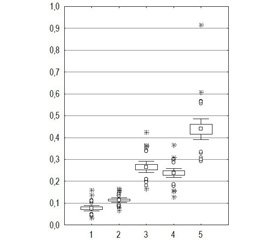
Для оцінки отриманих даних, що характеризують тяжкість пошкодження нирки залежно від травматичності різних хірургічних методик, нами був використаний коефіцієнт травматизації паренхіми нирки (k), що визначався відношенням різниці концентрацій цистатину С (до та після оперативного втручання) до вмісту цього маркера до лікування (рис. 1).
/47-1.jpg)
З’ясовано, що для пацієнтів I та II груп спостерігалися невеликі значення k < 0,18, що відповідало незначним пошкодженням паренхіми під час мікроперкутанних та ультраміні-перкутанних нефролітотрипсіях. У хворих III і IV груп відбулося збільшення k до 0,42 (0,12 < k < 0,42) відповідно за рахунок більшої травматизації стандартного доступу (III група) і більшого пошкодження нирки при коралоподібному нефролітіазі навіть при застосуванні ультраміні-перкутанних нефролітотрипсій (IV група). Для пацієнтів V групи k був максимально збільшеним до 0,3 (0,3 < k < 0,61) як за рахунок застосування декількох стандартних доступів, так і через травмуючий вплив коралоподібних конкрементів.
Усі дослідні групи хворих достатньо чітко розрізняються за значенням k, що дозволяє визначити три ступеня травматизації паренхіми нирки: легкий — k ≤ 0,15; середній — 0,15 < k <0,35; тяжкий — k > 0,35 (приблизно).
Така шкала може бути використана для оцінки результатів оперативних втручань. Наприклад, якщо при застосуванні стандартних доступів у пацієнтів із коралоподібним нефролітіазом значення k відповідає середньому ступеню травматизації нирки, то дану операцію слід вважати адекватною до початкового стану травматизації нирки (до операції). І навпаки, якщо був використаний мікроперкутанний або ультраміні-перкутанний доступи у хворих із конкрементами до 2 см у діаметрі і величина k відповідає середньому ступеню травматизації, то таке оперативне втручання завдало більшого травматичного впливу, ніж можна було очікувати. Тобто при оперативних втручаннях із різним ступенем ушкодження нирки конкрементом розроблений коефіцієнт буде нижчим при однаковій травматичності операції. Це дозволяє зробити висновок про успішність операції.
Для визначення адекватності запропонованої шкали розподілу ступеня травматизації паренхіми нирки застосовувався метод аналізу кривих операційних характеристик. Такий підхід використовувався для більш точного визначення порогу розподілу між середнім і тяжким ступенями травматизації операції. У цьому разі ROC-крива (рис. 2) є залежністю чутливості k-моделі (частки правильно визначених випадків тяжкої травматизації) від специфічності (частки хибних класифікацій) при зміни величини k.
Адекватність застосованої моделі оцінювалася за величиною площі під ROC-кривою (AUC — Area under the ROC curve) з урахуванням її 95% довірчого інтервалу (ДІ). Вважається, що модель адекватна, якщо AUC статистично значимо перевищує значення 0,5. У нашому випадку площа під ROC-кривою (AUC) = 0,942 ± 0,220 (0,95% ДІ 0,899–0,985) і р = 0,000 (відносно до AUC = 0,5), що відповідає високій якості моделі класифікації.
Значення рівня (порогу) величини коефіцієнта k для розподілу середнього і тяжкого ступеня травматизації обиралося, виходячи зі співвідношення чутливості та специфічності в моделі. Як видно з рисунку 2, збільшення чутливості моделі супроводжувалося зменшенням специфічності. Оскільки в даній моделі досягнення саме максимальної чутливості не є критичним, то шукалося порогове значення k, що відповідало рівності чутливості та специфічності. На ROC-кривій (рис. 2) така точка відповідає чутливості 0,833 і специфічності 0,83 (1 — специфічність = 0,17). Величина порогового значення при цьому становила k = 0,33.
Для оцінки точності шкали за знайденим пороговим значенням k = 0,33 було проведено класифікацію операцій середнього і тяжкого ступеня травматизації паренхіми нирки. Випадки з 0,15 < k ≤ 0,33 класифікувались як середній, з k > 0,35 — тяжкий ступінь. До них було додано випадки з k ≤ 0,15 — легкий ступінь. Результати класифікації наведено в таблиці 2. Загальна точність прогнозування становила 84 %.
Використання зазначеної шкали дозволяє характеризувати травматизацію паренхіми нирки до, після лікування, у тому числі визначити ефективність терапії та пошкоджуючий вплив використаної хірургічної методики.
Таким чином, застосування діагностичного маркера цистатину С та шкали оцінки ступеня травматизації паренхіми нирки є доцільним для використанні у практичній охороні здоров’я відповідними фахівцями.
Висновки
1. На підставі оцінки рівня маркера травматизації паренхіми нирки цистатину С у хворих на нефролітіаз із конкрементами до 2 см у діаметрі встановлено, що мікроперкутанний або ультраміні-перкутанний доступи мають статистично однаковий ступінь ушкодження, що є меншим, ніж при стандартному доступі.
2. Незалежно від діаметра конкременту нефролітотрипсія з використанням одного стандартного доступу або з комбінованим застосуванням одного стандартного та декількох ультраміні-перкутанних доступів за рівнем цистатину С мають однаковий травмуючий вплив на паренхіму нирки (р > 0,05).
3. У хворих на коралоподібний нефролітіаз за вмістом цистатину С перкутанна нефролітотрипсія із використанням множинних стандартних доступів є найбільш травмуючим ендоскопічним втручанням.
4. Розроблено шкалу прогнозування ступеня травматизації паренхіми нирки при різних клінічних формах СКХ і методах нефролітотрипсії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников / А.И. Кобзарь. — М.: Физматлит, 2012. — 816 с.
2. Малоінвазивна хірургія хворих на сечокам’яну хворобу з ранньою післяопераційною реабілітацією в Трускавці / І.А. Деркач, О.Б. Прийма, А.Є. Лоскутов [та ін.] // Journal of Education, Health and Sport. — 2017. — Vol. 7, № 7. — P. 01-110.
3. Мартов А.Г. Рентгеноэндоскопические методы диагностики и лечения заболеваний почек и верхних мочевых путей: автореф. дис… д-ра мед. наук: 14.00.40 — урологія / А.Г. Мартов; НИИ урологии. — М., 1993. — 60 с.
4. Місце мікроперкутанної лазерної ендопієлотомії у хворих на гідронефроз, обумовлений рецидивною стриктурою мисково-сечовідного сегмента / В.І. Савенков, Д.В. Щукін, Д.А. Левченко, А.В. Савенков // Експериментальна і клінічна медицина. — 2016. — № 4(73). — С. 133-137.
5. Оптимізація множинного черезшкірного доступу у хворих на коралоподібний нефролітіаз за допомогою ультра-міні-перкутанної нефролітотрипсії / В.М. Лісовий, А.В. Мальцев, Д.А. Левченко // Клінічна хірургія. — 2017. — № 4. — С. 59-61.
6. Савенков В.І. Нові можливості у лікуванні хворих на нефролітіаз з конкрементами до 2 см за допомогою мікро- та ультра-міні-перкутанних нефролітотрипсій / В.І. Савенков, А.В. Мальцев, Д.А. Левченко // Клінічна хірургія. — 2017. — № 6. — С. 58-60.
7. Урология / С.П. Пасечников, С.А. Возианов, В.Н. Лесовой [и др.]; Под ред. С.П. Пасечникова. — Винница: Нова книга, 2015. — 456 с.
8. Biostatistics: A Methodology for the Health Sciences. — Second Edition / G. van Belle, L.D. Fisher, P.J. Heagerty, T.S. Lumley. — Washington: John Wiley & Sons, Inc., 2004. — 896 p.
9. Campbell-Walsh Urology. — 10 th ed. / P. Walsh, R. Gittes, A. Perlmutter, T. Stamey. — Philadelphia: Saunders, 2012. — P. 1257-1260.
10. Detection of decreased glomerular filtration rate in intensive care units: serum cystatin C versus serum creatinine / P. Delanaye, E. Cavalier, J. Morel [et al.] // BMC Nephrol. — 2014. — Vol. 15, № 9. — doi: 10.1186/1471-2369-15-9.
11. Ramello A. Epidemiology of nephrolithiasis / A. Ramello, C. Vitale, M. Marangella // J. Nephrol. — 2000. — Vol. 13(Suppl. 3). — P. 45-50.
12. Shlipak M.G. Update on cystatin C: incorporation into clinical practice / M.G. Shlipak, M.D. Mattes, C.A. Peralta // Am. J. Kidney Dis. — 2013. — Vol. 62, № 3. — P. 595-603.
13. Urinary Cystatin C and NGAL as Early Biomarkers for Assessment of Renal Ischemia-Reperfusion Injury: A Serum Marker to Replace Creatinine? / B.W. Woodson, L. Wang, S. Mandava, B.R. Lee // J. Endourol. — 2013. — Vol. 27, № 12. — P. 1510-1515.

/47-2.jpg)
/47-1.jpg)
/48-2.jpg)
/48-1.jpg)