Резюме
У роботі наведені дані ретроспективного аналізу результатів посівів у хворих з інтраабдомінальними інфекціями (ІАІ) за 2 періоди: І період — з січня 2007 по грудень 2008 року та ІІ період — з січня 2015 по грудень 2016 року. Встановлено, що як у першому, так і в другому періоді дослідження основними збудниками інфекційного процесу у хворих з ІАІ були: E.coli, Staphylococcus spp., Klebsiella spp., Enterococcus spp., Candida spp., P.aeruginosa, Enterobacter spp., Acinetobacter spp., Citrobacter spp., Bacteroides spp., Proteus spp. У другому періоді порівняно з першим на 65 % збільшилась кількість штамів Klebsiella spp., у тому числі й полірезистентних, що були виділені у хворих з ІАІ. Збільшилась також кількість штамів Staphylococcus spp., Enterobacter spp., Acinetobacter spp., Proteus spp. від 2,4 до 5 %. Чутливість більшості штамів, що були виділені, відповідала рекомендованим схемам емпіричної антибіотикотерапії. Полірезистентні штами мікроорганізмів переважно були чутливими до карбапенемів (меропенем, дорипенем), антисиньогнойних пеніцилінів (піперациліну тазобактам, коломіцин), фосфоміцину, аміноглікозидів (тобраміцин), лінкозамідів (лінезолід). За умов збільшення кількості полірезистентних штамів протягом останнього десятиліття вибір препаратів для проведення раціональної антимікробної терапії повинен базуватись на даних бактеріоскопії та антибіотикограми.
В работе приведены данные ретроспективного анализа результатов посевов у больных с интраабдоминальными инфекциями (ИАИ) за 2 периода: I период — с января 2007 по декабрь 2008 года и II период — с января 2015 по декабрь 2016 года. Установлено, что как в первом, так и во втором периоде исследования основными возбудителями инфекционного процесса у больных с ИАИ были: E.coli, Staphylococcus spp., Klebsiella spp., Enterococcus spp., Candida spp., P.aeruginosa, Enterobacter spp., Acinetobacter spp., Citrobacter spp., Bacteroides spp., Proteus spp. Во втором периоде по сравнению с первым на 65 % увеличилось количество штаммов Klebsiella spp., в том числе и полирезистентных, выделенных у больных с ИАИ. Увеличилось также количество штаммов Staphylococcus spp., Enterobacter spp., Acinetobacter spp., Proteus spp. с 2,4 до 5 %. Чувствительность большинства выделенных штаммов отвечала рекомендованным схемам эмпирической антибиотикотерапии. Полирезистентные штаммы микроорганизмов преимущественно были чувствительными к карбапенемам (меропенем, дорипенем), антисинегнойным пенициллинам (пиперациллина тазобактам, коломицин), фосфомицину, аминогликозидам (тобрамицин), линкозамидам (линезолид). В условиях увеличения количества полирезистентных штаммов в течение последнего десятилетия выбор препаратов для проведения рациональной антимикробной терапии должен основываться на данных бактериоскопии и антибиотикограммы.
The paper presents data of a retrospective analysis of inoculation results in patients with intra-abdominal infections (IAI) for 2 periods: the first period — from January 2007 to December 2008 and the second period — from January 2015 to December 2016. It was found that both in the first and in the second study period, the main pathogens of the infectious process in patients with intra-abdominal infections were: E.coli, Staphylococcus spp., Klebsiella spp., Enterococcus spp., Candida spp., P.aeruginosa, Enterobacter spp., Acinetobacter spp., Citrobacter spp., Bacteroides spp., Proteus spp. During the second period in comparison with the first one, the number of strains of Klebsiella spp., including multidrug-resistant ones, increased by 65 %. The number of strains of Staphylococcus spp., Enterobacter spp., Acinetobacter spp., Proteus spp. also increased — from 2.4 to 5 %. The sensitivity of most strains corresponded to the recommended schemes of empirical antibiotic therapy. Multidrug-resistant strains of microorganisms were mainly sensitive to carbapenems (meropenem, doripenem), penicillins (piperacillin tazobactam, colomycin), phosphomycin, aminoglycosides (tobramycin) and lincosamides (linezolid). Against the background of an increase in the number of multidrug-resistant strains during the last decade, the choice of drugs for rational antimicrobial therapy should be based on bacterioscopy and antibioticograms.
Введение
Интраабдоминальные инфекции (ИАИ), как правило, имеют полимикробную этиологию с участием широкого спектра грамотрицательных и грамположительных анаэробных и аэробных микроорганизмов [1–3]. Ведущую роль играют грамотрицательные возбудители, главным образом энтеробактерии (E.coli, Proteus spp., Klebsiella spp. и др.) [4, 5], псевдомонады, неспорообразующие анаэробы (особенно B.fragilis). Частота выделения грамположительных микроорганизмов составляет менее 30 % [1].
В микробиологической структуре ИАИ, развивающихся в послеоперационном периоде или во время пребывания больного в стационаре, особое значение приобретают нозокомиальные штаммы коагулазо–отрицательного стафилококка и энтерококков, а также Enterobacter spp., Acinetobacter spp., P.aeruginosa. Эти микроорганизмы отличаются высокой и поливалентной резистентностью к антимикробным препаратам [4, 5].
Цель работы: изучить динамику изменений микрофлоры и чувствительности выделенных штаммов к антибиотикам у больных с интраабдоминальными хирургическими инфекциями за 10-летний период, используя методы бактериологических исследований для определения основных тенденций и выработки тактики рациональной антибиотикотерапии.
Материалы и методы
Проведен ретроспективный анализ результатов посевов у больных с ИАИ, находившихся на лечении в хирургической клинике кафедры хирургии, травматологии и ортопедии ФПО Днепропетровской медицинской академии на базе 2-й городской клинической больницы г. Кривого Рога за 2 периода: І период — с января 2007 по декабрь 2008 года, и ІІ период — с января 2015 по декабрь 2016 года.
В І периоде содержимое брюшной полости было взято на посев у 246 больных с ИАИ, во ІІ периоде — у 353. Структура патологии и количество выполненных посевов представлены в таблице 1.
Бактериологическому исследованию подвергали выпот из брюшной полости, содержимое внутрибрюшных гнойников, желчь (при гнойном холангите), гнойное раневое содержимое (в послеоперационном периоде). Выполняли бактериоскопию исследуемого материала, посев на питательные среды с целью идентификации вида возбудителя. Чувствительность к антибиотикам определяли диско-диффузионным методом с набором дисков, соответствующих выделенным группам микроорганизмов. Период инкубации составлял 24 часа.
До получения результатов посевов больным с ИАИ назначали эмпирическую антибактериальную терапию. Антибиотики выбирали с учетом диагноза (локализация и характер первичного очага инфекции), анамнеза больного, клинического течения заболевания, предполагаемых возбудителей и их прогнозируемой чувствительности к антимикробным препаратам. Результат этой терапии оценивали через 3 суток, тогда же и осуществляли первую коррекцию проводимой терапии. При наличии положительной клинической динамики антибиотикотерапию продолжали тем же (теми же) препаратом (препаратами). При отсутствии таковой проводили смену антибиотиков, ориентиром для назначения препаратов служили данные антибиотикограммы.
Результаты и обсуждение
В І периоде исследования положительными оказались результаты посевов у 188 больных (из 246) с ИАИ, во ІІ периоде — у 201 (из 353). Высеваемость составила 76,4 и 56,9 % соответственно. В последние 10 лет существует тенденция к уменьшению положительных результатов посевов на 19,5 %. Причина такого существенного снижения количества выделенных чистых культур, по нашему мнению, кроется не столько в методике идентификации и свойствах микроорганизмов, сколько в количественном и качественном объеме выполненных посевов. Так, в І периоде из 650 больных, оперированных в клинике с ИАИ, посевы взяты у 246, а во ІІ периоде — у 353 из 687 больных, что на 13,6 % больше. С учетом положительных результатов лечения больных, течения и исходов воспалительных заболеваний органов брюшной полости при использовании тактики рациональной антибиотикотерапии, основанной на своевременной идентификации микроорганизмов и определении чувствительности к антибиотикам, нам пришлось существенно расширить показания для выполнения посевов. Так, например, посевы из брюшной полости мы стали выполнять практически при всех формах аппендицитов, сопровождающихся выпотом в брюшную полость (даже серозным), при перфоративных язвах, оперированных даже в сроки до 6 часов от момента перфорации, и т.д. Такой подход позволил нам в особо сложных клинических случаях своевременно справляться с прогрессирующей инфекцией.
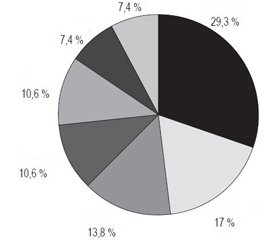
В І и ІІ периодах исследования основным возбудителем ИАИ была E.coli (29,3 и 25,4 % соответственно). В последние 10 лет мы наблюдаем снижение частоты встречаемости E.coli на 3,9 % (рис. 1, 2). Наиболее существенные изменения произошли в количестве выделенных штаммов Klebsiella spp. — 21,4 % во ІІ периоде против 13,8 % в І; относительный прирост составил 65 %. Далее, сравнивая изменения микробного пейзажа, наблюдали следующее: рост количества Staphylococcus spp. (с 17,0 до 19,4 %, +2,4 %), снижение количества Enterococcus spp. (с 10,6 до 6,9 %, –3,7 %), C.albicans (с 10,6 до 7,5 %, –3,1 %), P.aeruginosa (с 7,4 до 6,9 %, –0,5 %). В разделе «Прочие» наблюдали рост микрофлоры (Enterobacter spp., Acinetobacter spp., Citrobacter spp., Bacteroides spp., Proteus spp.) с 7,4 до 12,4 %, +5 %. Анализ показал, что такое увеличение в основном связано с ростом количества Acinetobacter spp. и Enterobacter spp. Таким образом, при ИАИ за последние 10 лет произошли серьезные изменения микрофлоры в количественном плане. Наиболее значимым событием стало существенное (на 65 %) увеличение количества штаммов Klebsiella spp.
/57-2.jpg)
/58-1.jpg)
Подобные изменения произошли и в качественном составе микрофлоры.
Всего высеяно 55 штаммов E.coli в І периоде и 51 — во ІІ, из которых полирезистентными в І периоде были 10 (18,2 %), а во ІІ — 12 (23,5 %) штаммов. Обычные штаммы проявляли хорошую чувствительность к традиционным для лечения данной патологии препаратам — цефалоспоринам ІІІ, ІV поколений, аминогликозидам, фторхинолонам ІІ–ІV поколений. Полирезистентные штаммы проявляли хорошую чувствительность к карбапенемам, пиперациллина тазобактаму, тобрамицину.
У больных с ИАИ в І периоде исследования высеяно 32 штамма Staphylococcus spp., а во ІІ — 39. Выросло количество оксациллинустойчивых штаммов: в І периоде их было 14 (43,8 %), а во ІІ — уже 25 (64,1 %). Эти резистентные штаммы проявляли чувствительность к фторхинолонам, аминогликозидам, макролидам, а также к гликопептидам и оксазолидинонам. В І периоде был обнаружен один ванкомицинустойчивый штамм, во ІІ периоде таковых не было.
Нами был отмечен существенный рост Klebsiella spp. — с 26 штаммов в І периоде до 43 — во ІІ. Соответственно, полирезистентных штаммов в І периоде было 5 (19,2 %), во ІІ — 17 (39,5 %). Если в І периоде все полирезистентные штаммы были обнаружены только у пациентов с деструктивными формами панкреатита, то во ІІ периоде к ним добавились пациенты с деструктивным аппендицитом (n = 7), холециститом (n = 1), перфоративной язвой (n = 1), абсцессами печени и брюшной полости (n = 2). Если обычные штаммы проявляли хорошую чувствительность к цефалоспоринам ІІІ и ІV поколений, аминогликозидам, фторхинолонам ІІ–ІV поколений, то полирезистентные были чувствительны к пиперациллина тазобактаму, фосфомицину, тобрамицину и дорипенему (иногда только к 1–2 из перечисленных).
Штаммы P.aeruginosa обнаружили у 28 пациентов (по 14 в І и ІІ периодах исследования). В І периоде у 6, во ІІ периоде у 5 пациентов выделенные штаммы имели признаки нозокомиальной инфекции и были полирезистентными. Патология, при которой обнаружены такие штаммы: острый деструктивный аппендицит (І период — 2, ІІ — 1), острый деструктивный холецистит — 1 (выделен из желчи в І периоде), острый деструктивный панкреатит (І период — 1, ІІ — 3), абсцессы брюшной полости (І период — 2, ІІ — 1). Чувствительность этих штаммов была разной: наибольшее количество резистентных штаммов имели высокую чувствительность к антисинегнойным пенициллинам (пиперациллина тазобактам, коломицин), а также к карбапенемам, среди которых лидировал дорипенем (во ІІ периоде исследования).
Обнаружено 20 штаммов грамположительных Enterococcus spp. при разнообразных ИАИ в І периоде исследования и 14 — во ІІ. Этот микроорганизм проявлял, как правило, хорошую чувствительность к пенициллиновому ряду антимикробных препаратов. В І периоде обнаружено 3 полирезистентных штамма: два из них были чувствительны к меропенему и ванкомицину (пациенты с холангитом и поддиафрагмальным абсцессом), а один — только к ванкомицину (пациент с флегмонозной формой аппендицита). Во ІІ периоде исследования резистентных штаммов не наблюдали.
В І периоде исследования был высеян 21 штамм Candida spp. у пациентов с различной ИАИ: перфоративная язва (n = 12), деструктивный панкреатит, постнекротическая киста поджелудочной железы с нагноением (n = 3), внутрибрюшной абсцесс (n = 1), деструктивный холецистит с холангитом (n = 1), перфорации толстой кишки на фоне рака (n = 2), туберкулез (n = 2). Во ІІ периоде таких штаммов было высеяно 15. Патология аналогична приведенной выше. В І периоде чувствительность выделенных штаммов к основным противогрибковым препаратам была хорошей. Наивысшую чувствительность показал амфотерицин В (у 19 штаммов из 21), затем нистатин (у 17 из 21). Чувствительность флюконазола была низкой и составила всего 57,1 % среди всех выделенных штаммов. Во ІІ периоде было высеяно 5 (33,3 %) полирезистентных штаммов. Полирезистентными считали штаммы с отсутствием чувствительности к следующим препаратам: флюконазол, кетоконазол, амфотерицин, нистатин, интраконазол. Дисков с другими антигрибковыми препаратами в лаборатории нет. Вопрос антибактериальной терапии кандидозной инфекции остается открытым.
Enterobacter spp., Acinetobacter spp., Citrobacter spp., Bacteroides spp., Proteus spp. составили 7,4 % (n = 14) от всех выделенных штаммов при ИАИ в І периоде исследования и 12,4 % (n = 25) — во ІІ. В І периоде одиннадцать штаммов показали хорошую чувствительность к цефалоспоринам ІІІ поколения, фторхинолонам II–IV поколений. Один штамм Enterobacter spp. и два штамма Citrobacter spp. были полирезистентными, с хорошей чувствительностью к меропенему. Во ІІ периоде обнаружено 5 полирезистентных штаммов: Acinetobacter spp. (n = 3), Enterobacter spp. (n = 1), Proteus spp. (n = 1) с чувствительностью к дорипенему, пиперациллина тазобактаму, тобрамицину и фосфомицину.
Выводы
1. Как в І, так и во ІІ периоде исследования основными возбудителями инфекционного процесса у больных с ИАИ были: E.coli, Staphylococcus spp., Klebsiella spp., Enterococcus spp., Candida spp., P.aeruginosa, Enterobacter spp., Acinetobacter spp., Citrobacter spp., Bacteroides spp., Proteus spp. В этот период прослеживается четкая тенденция к изменению количественного и качественного состава выделенной микрофлоры. Наиболее заметным стало существенное (на 65 %) увеличение количества штаммов Klebsiella spp., а среди прочих — Enterobacter spp., Acinetobacter spp., Proteus spp. Чувствительность большинства выделенных штаммов микроорганизмов соответствовала рекомендуемым схемам эмпирической антибиотикотерапии.
2. Большинство полирезистентных штаммов проявляли высокую чувствительность к карбапенемам (меропенем, дорипенем), антисинегнойным пенициллинам (пиперациллина тазобактам, коломицин), фосфомицину, аминогликозидам (тобрамицин), линкозамидам (линезолид). Полирезистентные штаммы микроорганизмов нуждаются в своевременной идентификации и, соответственно, строго направленной терапии по принципу де–эскалационной. В условиях возрастающей устойчивости микроорганизмов к проводимой АМТ ее рациональное использование должно основываться исключительно на данных бактериоскопии и антибиотикограммы.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/57-1.jpg)
/57-2.jpg)
/58-1.jpg)