Вступ
Вроджені судинні аномалії (ВСА) створюють значні труднощі для діагностики й вибору тактики лікування, оскільки їм властивий широкий спектр клінічних проявів, непередбачуваний перебіг, нестійкий результат лікування з високою частотою рецидивів та ускладнень [1]. Відсутність єдиної термінології і класифікації протягом тривалого часу супроводжувалася неточностями у формулюванні діагнозу (більше як половина пацієнтів із ВСА надходять до спеціалізованих центрів із помилковим діагнозом [2]) разом із недостатнім розумінням патофізіології цих захворювань перешкоджала створенню ефективної загальноприйнятої лікувальної тактики. Термін «гемангіома», що й сьогодні широко використовується для описання різних судинних аномалій, символізує неузгодженість та заплутаність номенклатури [3]. Стосовно різних за походженням та будовою утворень використовувалася єдина лікувальна тактика. Спочатку це було винятково хірургічне видалення. Наслідки агресивного лікування, які нерідко були катастрофічними, призвели до кардинально протилежної, надмірно консервативної тактики.
У 1982 році J.B. Mulliken, J. Glowacki [4] запропонували біологічну класифікацію судинних аномалій, згідно з якою ці ушкодження поділяють відповідно до характеристики їх ендотеліальних клітин. У 1996 році біологічна класифікація була адаптована Міжнародною асоціацією вивчення судинних аномалій (International Society for the Study of Vascular Anomalies — ISSVA) на ХІ конгресі (Рим, червень 1996), згідно з якою виділяють проліферативні пухлини, найбільш поширеною з яких є інфантильна гемангіома (ІГ), та судинні мальформації (СМ), які є структурними аномаліями, що уражають капіляри, венули, вени, артерії, лімфатичні канали та комбінації цих структур. Востаннє класифікація була оновлена в 2014 році на черговій асамблеї ISSVA [5, 6]. Результатом впровадження дихотомічного поділу ВСА на пухлини і мальформації став диференційований підхід у лікуванні, розробка нових способів лікування, що спрямовані на покращення якості життя пацієнтів з ВСА [7, 8]. Згідно із запропонованою класифікацією, судинні мальформації поділяють на мальформації з повільним кровотоком та мальформації із швидким кровотоком — артеріовенозні мальформації (АВМ).
АВМ являють собою вроджені вади розвитку як артеріальних, так і венозних судин, результатом яких є формування сполучення між судинами різного походження та діаметра [9]. Це сполучення може бути як безпосереднім (прямим), так і через ретикулярну структуру, що являє собою сітку диспластичних дрібних судин, у яких порушено дозрівання до капілярів, і має назву nidus («гніздо», «вузол»). В основі формування АВМ лежить шунтування між високошвидкісними, низькорезистентними артеріальними судинами і венозною системою через різноманітні фістули [10].
Незалежно від наявності чи відсутності вузла, всі АВМ демонструють швидкий кровотік через макро- та мікрофістульні комунікації між артеріальною і венозною системами [10]. Кровоносна система людини є замкненою системою, у якій непрямий зв’язок між серцем і тканинами відбувається за участю капілярної сітки. Якщо ця система капілярів зазнає пошкодження або не функціонує з різних причин, то всі три унікальні складові кровоносної системи — артерії, вени й лімфатичні судини впливають одна на одну негативно [11].
АВМ є найбільш агресивним видом судинних мальформацій [12]. Клінічними проявами є серцева недостатність, артеріальні ураження (ішемія, гангрена), дистальна хронічна венозна недостатність, лімфатичний набряк у результаті венозної гіпертензії. Ці ураження справляють також механічний вплив на оточуючі тканини й органи з високим ризиком ускладнень під час лікування та високою частотою ускладнень після нього. Серед усіх видів вроджених судинних аномалій АВМ є найбільш складними щодо лікування й прогнозу, оскільки рецидиви виникають з частотою понад 80 %, що більше, ніж при злоякісних новоутвореннях [13, 14].
Лікувальна тактика при АВМ фундаментально відрізняється від тактики лікування усіх інших судинних аномалій [15]. Наприклад, якщо для більшості судинних мальформацій успішно використовуються методики черезшкірного прямого пункційного введення різних лікарських речовин, для АВМ необхідна комбінація з ендоваскулярними втручаннями [16]. Хірургічне лікування також має свої особливості, що обмежу–ють можливості радикального видалення.
Матеріали та методи
У період із грудня 2010 до березня 2017 року на стаціонарному лікуванні в НДСЛ «ОХМАТДИТ» знаходилося 238 пацієнтів із судинними аномаліями віком від 0 до 17,9 року, із них у 9 дітей діагностовано АВМ, що становило 3,8 %. Серед 162 пацієнтів із судинними мальформаціями частка АВМ становить 5,6 %.
Враховували вік клінічної маніфестації симптомів, характер симптомів, стать пацієнтів, локалізацію ураження, розмір вузла, наявність та характер ускладнень, вік початку лікування, спосіб лікування, результат лікування.
При надходженні в клініку всім пацієнтам виконували ультразвукове дослідження апаратом Philips із лінійним датчиком 12-3 MHz у режимах сірої шкали, кольорового допплерівського сканування (КДС) та частково в допплерівському режимі. При виявленні високошвидкісного гемодинамічного компонента проводили КТ-ангіографію. КТ виконували на апараті Siemens Somatom Difinition AS. Для контрастування використовували йодовмісну водорозчинну контрастну речовину у дозі від 0,5 до 2,0 мл/кг маси тіла залежно від віку.
Гістологічне дослідження препаратів проводили у випадку хірургічного видалення (n = 2) з використанням світлової мікроскопії та забарвлення препарату гематоксилін-еозином.
Селективна та суперселективна ангіографія як самостійний метод діагностики ВСМ у дітей не використовувалася, а проводилася лише безпосередньо перед лікувальними маніпуляціями (склерозування та/або емболізації). Тривалість періоду спостереження після лікування становила від 6 до 80 місяців.
Цифрові результати усіх вимірювань піддавали варіаційно-статистичній обробці. Обчислення проводили за допомогою програми IBM Statistical Package for Social Sciences (SPSS Statistics, версія 23). Дані подані як середні з 95% довірчим інтервалом або стандартним відхиленням. У випадку нормального розподілу перемінних визначали середнє арифметичне значення (М) і його статистичну похибку (m). Результати подані у вигляді М ± m. Для оцінки якісних даних для кожного випадку було використано одноваріантний аналіз із застосуванням χ2 критерію Пірсона і тесту Фішера. Для усіх статистичних аналізів P < 0,05 було статистично значимим.
Лікування АВМ у дітей проводилося відповідно до впроваджених локальних протоколів, які були розроб–лені на основі міжнародних настанов [1, 12], Уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Судинні аномалії у дітей» та Адаптованої клінічної настанови, заснованої на доказах «Судинні аномалії у дітей» (Наказ МОЗ України від 08.08.2016 року № 813).
Результати
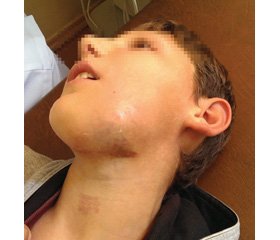
Серед 9 дітей було 3 дівчинки та 6 хлопчиків, гендерне співвідношення становило 1 : 2. За локалізацією АВМ виділені дві анатомічні ділянки: голови і шиї (n = 6; 66,67 %) та кінцівок (n = 3; 33,33 %), у двох випадках (n = 2, 22,22 %) ураження були множинними. Множинні ураження локалізувалися в одного пацієнта в ділянці великого сідничного м’яза та підколінної ямки, в іншому випадку вогнище захоплювало волосисту частину голови, ділянку орбіти, верхньої губи, плеча та плечового поясу. Клінічними проявами АВМ в ділянці обличчя були зміни кольору шкіри (n = 5; 55,55 %), асиметрія обличчя за рахунок пухлиноподібного утворення (n = 5; 55,55 %), кровотеча (n = 1; 11,11 %), виразки (n = 1; 11,11 %). Клінічними проявами АВМ в ділянці кінцівок були виражений больовий синдром (n = 3) та аcиметрія кінцівок за рахунок набряку (n = 3), збільшення довжини ураженої кінцівки (n = 2).
Перші клінічні симптоми в пацієнтів з’являлися у вікові періоди від 0 до 9 років, у середньому у віці 3,0 ± 3,8 року. Клінічні прояви у вигляді плям від рожевого до синюшно-фіолетового кольору були в 4 дітей у ділянці обличчя від народження, однак діагноз протягом першого року життя не було встановлено в жодному випадку. Вік встановлення діагнозу коливався від 2 до 12 років, у середньому — 7,67 ± 3,64 року. На момент початку лікування в усіх пацієнтів були клінічні прояви АВМ.
Первинно, без попередніх лікувальних маніпуляцій, надійшли 5 пацієнтів. Чотири дитини перед надходженням у клініку знаходилися на лікуванні в інших лікувальних закладах, де було проведено наступні втручання: операційне лікування (n = 3), прошивання та кріодеструкція вогнища АВМ (n = 1), системна терапія пропранололом (n = 2). В одному випадку обсяг операції обмежився біопсією м’яких тканин у зв’язку з виникненням інтраопераційної кровотечі в ділянці кута нижньої щелепи, у двох інших випадках рецидив захворювання проявився через 3 і 5 місяців після операції прискоренням росту вузла АВМ та посиленням больового синдрому. У дитини віком 2 роки з АВМ в ділянці крила носа і правої щоки з рецидивними кровотечами проводились повторні прошивання та кріодеструкція поверхневих тканин у ділянці ураження, результат маніпуляцій мав короткочасний ефект із посиленням інтенсивності наступної кровотечі. Терапія пропранололом проводилася у двох дітей в амбулаторних умовах, тривалість лікування — від 6 до 11 місяців, клінічного результату не було. В одному випадку у дитини 7 років на фоні тривалої терапії пропранололом у дозі 2 мг/кг/добу відмічалась брадикардія до 45/хв.
УЗД у режимі КДС у пацієнтів з АВМ виявляє високоваскуляризовану структуру, без солідної тканини, що може нагадувати інфантильну гемангіому в період проліферації. У цьому випадку необхідно враховували вік пацієнта та інші клінічні прояви, а також переважання гіперехогенної тканини в режимі сірої шкали та відсутність часточкової структури (рис. 1).
За результатами КТ-ангіографії визначали протяжність і розміри ураження, його співвідношення з оточуючими нормальними структурами. Обов’язково проводили порівняння ураженої та контралатеральної сторони, виключення наявності АВМ в інших ділянках ураженої кінцівки (рис. 2) або в органах.
При гістологічному дослідженні препаратів виявляли артерії з товстими нерівномірними стінками, які мали різний діаметр навіть на ділянках невеликої протяжності (рис. 3).
У всіх пацієнтів з АВМ використано комбіноване лікування, зокрема емболізація з одномоментним склерозуванням вузла (n = 6), повторна емболізіція та консервативне лікування (n = 1), емболізація з етапним склерозуванням та хірургічним видаленням (n = 1), емболізація та резекція (n = 1). Лікування розпочато у віці від 1 до 14 років, у середньому вік початку лікування становив 8,11 ± 3,85 року.
Емболізацію з одномоментним склерозуванням вузла виконано у 6 (66,67 %) пацієнтів із локалізацією в ділянці голови і шиї (n = 4) та нижніх кінцівок (n = 2). Позитивного результату досягнуто у всіх випадках, він полягав у припиненні кровотечі (n = 1), зменшенні венозної гіпертензії та больового синдрому (n = 2), покращенні косметичного результату за рахунок зміни кольору шкіри, зменшення об’єму пухлиноподібних утворень (n = 3), загоєнні виразок (n = 1) та зменшенні об’єму вузла. Результат оцінено як відмінний в одному випадку (відсутні клініко-рентгенологічні ознаки АВМ) та добрий у п’яти пацієнтів (зменшення діаметра вузла більше ніж на 50 % та відсутність клінічних проявів). Ангіографічним результатом емболізації аферентних судин при селективній ангіографії вважали відсутність контрастування вузла (рис. 4).
Ускладнень від проведених лікувальних маніпуляцій не було. Протягом 15 місяців епізодів кровотечі не було, відмічається нормальний колір шкірних покривів, мінімальна плюс-тканина (рис. 5).
Емболізацію з наступним хірургічним втручанням в обсязі резекції патологічно зміненої підщелепної слюнної залози виконано в одного пацієнта віком 4 роки, однак задовільного результату досягнути не вдалося внаслідок інфільтративного росту АВМ у ділянці дна порожнин рота, крилопіднебінної ямки.
Емболізацію платиновими спіралями (рис. 6) з відстроченим хірургічним втручанням та інтраопераційною склеротерапією 3% розчином полідоканолу виконано в одного пацієнта з АВМ щелепно-лицевої ділянки з добрим клінічним результатом.
Повторну емболізацію (n = 3) привідних артеріальних судин у сідничній та підколінній ділянці в поєднанні з еластичною компресією протягом дня проведено в одного пацієнта віком 8 років із добрим клінічним результатом, зменшенням діаметра вузла, що клінічно проявлялося зменшенням больового синдрому, зменшенням венозної гіпертензії і збільшенням рухової активності.
Загалом клінічного результату досягнуто у 8 (88,89 %) пацієнтів з екстракраніальними АВМ, в одному випадку (11,11 %) результат лікування відсутній, негативного результату не було. Найкращий результат отримано в пацієнтів, у яких проводилась емболізація з одночасним склерозуванням вузла, протягом періоду спостереження рецидивів не було.
Обговорення
АВМ є рідкісними захворюваннями, однак вони вимагають уваги хірургів, оскільки характеризуються агресивним перебігом, потенційно небезпечними ускладненнями та не завжди вдається досягнути бажаного результату лікування. Значний руйнівний потенціал АВМ мають внаслідок складної гемодинаміки, що забезпечується наступними властивостями: швидкий рух крові в ділянці ураження, венозна гіпертензія дистальніше від вогнища, прогресуючий перебіг захворювання і здатність до проліферації, наявність «гнізда» з комунікантами різного діаметра [17].
АВМ можуть розміщуватися в різних ділянках тіла, уражати внутрішні органи, інколи виявляють множинні вогнища. Найчастішою їх локалізацією є ділянка голови і шиї (47,4 %) та кінцівок (28,5 %) [18]. За результатами власних досліджень, АВМ діагностовано у двох анатомічних ділянках: голови і шиї (n = 6; 66,67 %) та кінцівок (n = 3; 33,33 %), у двох випадках (n = 2; 22,22 %) ураження були множинними. Множинні ураження також локалізувалися в краніофаціальній ділянці та в ділянці кінцівок: в одного пацієнта ураженими були великий сідничний м’яз та підколінна ямка, в іншому випадку вогнище захоплювало волосисту частину голови, ділянку орбіти, верхньої губи та плечового поясу.
АВМ прогресують із різною швидкістю, у деяких пацієнтів вони залишаються безсимптомними до дорослого віку, в інших клінічні прояви виникають у ранньому дитячому віці. Розвиток симптомів пов’язаний із збільшенням шунтування крові, що призводить до артеріального обкрадання та венозної гіпертензії, поєднання яких знижує перфузію тканин. Ішемія тканин клінічно проявляється болем, утворенням виразок та кровотечою.
У ранній період підвищується насосна функція серця, що дозволяє підтримувати артеріальний кровотік на попередньому рівні у відповідь на новостворену периферичну АВ-норицю з низькою резистентністю. Таким чином, тканинній ішемії можна запобігти в період компенсації, коли клінічні прояви АВМ мінімальні або відсутні. Компенсаторний ефект артеріальної системи у вигляді підвищення нагнітальної функції серця призводить до збільшення навантаження на венозну систему та згодом на сам серцевий м’яз. Негативний вплив на венозну систему частково компенсується лімфатичною системою. Проте лімфатична система обмежена у своїй ємності, оскільки механізм лімфодинаміки ґрунтується на авторегуляції перистальтичної циркуляції від судин з низькою резистентністю до судин із високою резистентністю.
Декомпенсація настає, коли включаються патофізіологічні механізми щодо усіх частин кровоносної системи. Артеріальна система не може підтримувати адекватне надходження артеріальної крові до периферичних тканин, що знаходяться дистальніше від АВ-нориці, і виникає тканинна ішемія. Венозна система, по якій відбувається дренування АВМ, не може забезпечувати нормальне функціонування клапанів. Це призводить до недостатності клапанів і ретроградного току крові. Результатом перелічених патологічних процесів є хронічна венозна недостатність і тяжка венозна гіпертензія. Ці гемодинамічні механізми пояснюють відносно низьку частоту ускладнених АВМ у дитячому віці, більшість із них є компенсованими. У нашому дослідженні симптомні АВМ відзначені лише в 5,56 % пацієнтів із судинними мальформаціями та в 3,78 % усіх пацієнтів, включених у дослідження.
Симптоми АВМ є надзвичайно різноманітними, вони можуть проявлятися болем, нейропатією, шкірними плямами, виразками, гіпертрофією тканин, кровотечою, пульсуючим шумом у вухах, серцевою недостатністю. Зазвичай перші прояви поверхневих АВМ виявляють у ранньому дитячому віці, проте протягом періоду дитинства істотних змін не спостерігається [19]. У новонароджених АВМ проявляються плямою рожевого або червоного кольору, яку на цьому етапі практично неможливо відрізнити від капілярної мальформації. На цьому етапі жоден відомий спосіб візуалізації не дозволяє відрізнити КМ та АВМ, лише імуногістохімічний аналіз зразків тканини виявляє специфічні ознаки АВМ, однак рутинну біопсію шкіри у немовлят із безсимптомними ураженнями проводити недоцільно.
У власному дослідженні перші клінічні симптоми в пацієнтів з’являлися у вікові періоди від 0 до 9 років, у середньому у 3,0 ± 3,8 року. Клінічні прояви у вигляді плям від рожевого до синюшно-фіолетового кольору були в 4 дітей в ділянці обличчя від народження, однак діагноз протягом першого року життя не було встановлено в жодному випадку. Вік встановлення діагнозу коливався від 2 до 12 років, у середньому — 7,67 ± 3,64 року.
Клінічні прояви та ускладнення АВМ багато в чому залежать від того, які органи і тканини уражені [17]. У нашому дослідженні клінічними проявами АВМ у ділянці обличчя були зміни кольору шкіри, асиметрія обличчя за рахунок пухлиноподібного утворення, кровотеча, виразки. Клінічними проявами АВМ у ділянці кінцівок були виражений больовий синдром та асиметрія кінцівок за рахунок набряку, збільшення довжини ураженої кінцівки.
Обстеження дітей із підозрою на АВМ необхідно розпочинати з мінімально інвазивних методик. Ураховуючи прогресуючий перебіг і серйозний прогноз захворювання, необхідний комплексний системний підхід у діагностиці і лікуванні [1]. Окрім оцінки первинного вогнища АВМ, необхідно обстежити органи і системи, які можуть вторинно уражатися, зокрема опорно-руховий апарат. Рання діагностика судинно-кісткового синдрому, який супроводжується різницею в довжині довгих кісток, є необхідною умовою своєчасного й патогенетично обґрунтованого лікування [20].
Базові неінвазивні та мінімально інвазивні методики, які слід виконати в першу чергу при підозрі на АВМ, включають: УЗД у режимі КДС і Допплера; дуплексну ультрасонографію (артеріальна і венозна); МРТ; КТ-ангіографію з контрастуванням, 3D-реконструкцією. КТ-ангіографія дозволяє виявляти як нормальні, так і патологічно змінені судини і їх сполучення, візуалізувати вузол [21].
Протягом багатьох років виключно хірургічне видалення вузла залишалося єдиним способом ерадикації і золотим стандартом лікування АВМ [22]. Повна ліквідація вузла необхідна для досягнення ефективного результату лікування, незважаючи на ускладнення. Проте радикальне видалення часто неможливе, оскільки пов’язане з непомірними ускладненнями. У даний час існує ряд перевірених часом способів лікування судинних мальформацій: хірургічне видалення як самостійний метод і в комбінації з емболізацією [23], ендоваскулярна абляція, різні види ендоваскулярної емболізації [16], склеротерапія пункційна й катетерна. Використання усього комплексу лікувальних заходів може бути обмежене не лише проявами судинних мальформацій (локалізацією, розмірами, співідношенням з оточуючими анатомічними структурами й органами), але й оснащенням клініки, досвідом спеціалістів, які працюють за даною проблемою [24]. З розвитком ендоваскулярної хірургії роль операційного видалення істотно змінилася. Результати відкритого хірургічного втручання значно покращилися на фоні попередніх ендоваскулярних маніпуляцій. Метою емболізації в більшості випадків є зменшення розмірів вузла, створення безпечних умов операційного втручання, зведення до мінімуму ризику інтраопераційної кровотечі та післяопераційних ускладнень [14]. У власному спостереженні після проведеної емболізації операційне лікування проведено у двох пацієнтів, слід відмітити малу крововтрату під час операції, що не відповідає обсягу видаленого судинного утворення та його васкуляризації. Одночасне проведення склерозування патологічно змінених судин вузла шляхом черезшкірного прямого введення детергенту дозволяє досягнути контролю над АВМ та відсутності ознак рецидиву протягом тривалого часу. Селективна ендоваскулярна емболізація в поєднанні з черезшкірною склеротерапією дозволяє припинити кровотік не лише в аферентних судинах, але й у самому вузлі. Ангіографічний контроль дозволяє оцінити ефективність ендоваскулярного лікування. Комплекс ендоваскулярних методів лікування в поєднанні із склеротерапією служить важливим моментом профілактики рецидивів.
Одним із складних завдань хірурга є прийняття рішення, коли час проведення операції є оптимальним. Локалізовані АВМ в анатомічно некритичних ділянках можуть бути видалені в будь-який час, проте в більшості випадків проблема вибору коректного часу є надзвичайно актуальною. Раннє операційне втручання може бути зайвим, непотрібним та спричинити активний ріст резидуальних вогнищ у випадку, якщо видалення було не радикальним.
Тяжкі ускладнення можуть виникати, якщо хірургічне втручання виконане з запізненням. Отже, знання патофізіології АВМ необхідне для вибору оптимального часу початку лікування [25].
Незважаючи на те, що АВМ, як і інші судинні мальформації, характеризуються біологічною стабільністю, численні дослідження вказують на потенційну можливість їх прогресування з часом. У першу чергу на це вказує висока частка рецидивів незалежно від способу лікування [13].
Американські автори [13] представляють найбільшу групу спостережень АВМ (272 пацієнти), у якій відмічають збільшення вогнища ураження в міру росту пацієнта. В основі цього збільшення лежить, ймовірно, поєднання наступного васкулогенезу та змін у судинній динаміці. Аналізуючи динаміку росту АВМ та частоту їх рецидиву після лікування, автори виявили, що ураження I ступеня за Шобінгером поступово збільшується в дорослому віці, інколи даючи поштовх росту в підлітковому віці. АВМ великого розміру мають тенденцію до більш швидкого росту в дитячому віці. Найбільш тривожним було те, що практично всі пацієнти (93 %) мали рецидив після лікування. Автори виявили, що рання резекція корелює з нижчими темпами розширення, однак не запобігає рецидиву. Повторна емболізація як єдиний спосіб лікування та в поєднанні з хірургічною резекцією, мабуть, мало впливають на показники рецидивів, що підтверджують інші опубліковані дані [23]. Це важлива інформація для планування лікувальної тактики АВМ, що дозволить уникнути зай–вих лікувальних маніпуляцій, проведення повторних емболізацій у безсимптомних пацієнтів.
Згідно з іншими результатами дослідження, емболізація призводить до ішемії, що, у свою чергу, може стимулювати ангіогенез та подальше розширення патологічного вогнища [26]. Ці дослідження проведені стосовно більш поширених інтракраніальних АВМ, однак основні патогенетичні чинники можуть бути справедливими і для екстракраніальних уражень. Опубліковано також результати досліджень, що розмір АВМ обернено пропорційний тиску в живлячій артеріальній судині, часткова емболізація, супроводжуючись підвищенням тиску надходження артеріальної крові до АВМ, може також стимулювати експансію АВМ [27]. У плані профілактики прогресування АВМ ми вважаємо перспективною тактику одночасного проведення емболізації і склерозування nidus АВМ з метою профілактики експансії ураження шляхом безпосереднього впливу на патологічно змінені судини вузла.
Активну хірургічну тактику з попередньою емболізацією або без неї пропонують для симптомних АВМ ІІ–ІV стадії за Шобінгером. Для безсимптомних уражень І–ІІ стадії АВМ у ділянці обличчя пропонують очікувальну тактику [13], враховуючи важливість пострезекційної косметичної деформації. Однак ця інформація дещо суперечлива, за даними публікацій, оскільки відсоток рецидивів при І ступені невисокий (21 %), а більш пізні резекції на фоні АВМ більшого розміру супроводжуються гіршим косметичним результатом. Обмеженням цього дослідження є також великий часовий проміжок (28 років) та відмінності технічних можливостей у десятилітніх перервах.
Однак чому доцільним є очікування? Враховуючи біологічні особливості АВМ, розвиток сучасної ендоваскулярної хірургії, потенційну можливість винайдення фармакологічного препарату, що впливатиме безпосередньо на ріст АВМ, слід використовувати мінімально інвазивні, найменш травматичні втручання, що забезпечать тривалий контроль над симптомами та найкращий косметичний результат.
Навіть після, здавалося б, повного видалення АВМ невеликих розмірів бувають рецидиви. При ангіографічних дослідженнях виявлено патологічні судинні скупчення, які знаходяться проксимально щодо вузла АВМ («резервний» вузол), що може згодом стати джерелом післяопераційної кровотечі та повторної експансії АВМ.
Одним із потенційних переваг консервативного спостереження за дитиною з АВМ в ділянці обличчя, особливо коли відсутні докази прогресування, є те, що існує можливість відкласти лікування до того часу, як дитина стає більш дорослою та може безпосередньо взяти участь у процесі прийняття рішень, оскільки певні види втручань можуть суттєво вплинути на зовнішній вигляд. Особливою соціальною проблемою є косметичні деформації в дітей шкільного віку.
Тенденція до прогресуючого росту АВМ, надзвичайно високі загальні показники рецидивів після резекції, опубліковані в літературних джерелах, безумовно, є невтішною перспективою як для пацієнтів, так і для хірургів. Незважаючи на велику кількість генів (понад 900), що беруть участь у патогенезі судинних вад розвитку, на даний час їх ідентифіковано десятки, тому наступні дослідження дозволять краще зрозуміти молекулярні властивості та моделі росту цих ушкоджень та стануть теоретичною основою розробки альтернативних способів лікування. Відтоді як ранні роботи J.B. Mulliken & J. Glowacki [4] показали, що судинні мальформації не ростуть завдяки клітинній проліферації, більш нові дослідження доводять наявність елементів клітинної проліферації під впливом матриксної металопротеїнази, особливо у випадку симптомних АВМ. Це нове розуміння може привести до розробки стратегії фармакотерапії для лікування симптомних АВМ. Однак на даний час хірург змушений балансувати між ризиком ускладнень агресивного лікування та ризиком ускладнень природного перебігу захворювання.
Висновки
Артеріовенозні мальформації зрідка зустрічаються в дітей. Для діагностики захворювання інформативними методами є ультразвукове сканування в допплерівському режимі та КТ із внутрішньовенним конт–растуванням. Комбіноване лікування, що полягає в одночасній емболізації та склерозуванні вузла, дозволяє досягнути тривалої ремісії в дітей з АВМ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/63-1.jpg)
/63-2.jpg)
/64-1.jpg)
/66-1.jpg)