Вступ
Інфекція сечових шляхів (ІСШ) є однією з основних причин госпіталізації дітей до стаціонару [1]. Дані про поширеність цієї патології змушують медичних працівників бути уважними ще й через широку різноманітність неспецифічних симптомів, притаманних для різних варіантів клінічного перебігу, що може спостерігатись в даних пацієнтів, — від асимптоматичного і легкого до бактеріємії та септичного шоку [2]. Важливим є той факт, що завдяки своєчасній діагностиці та лікуванню ІСШ можна запобігти виникненню небажаних наслідків, на зразок наявності рубців у нирковій паренхімі (спостерігається у 15–60 % дітей після перенесеного захворювання [3, 4]), гіпертензії та хронічної ниркової недостатності [5].
Останніми роками спільнота лікарів, які в своїй повсякденній практиці мають справу з застосуванням антибіотиків у лікуванні ІСШ у дітей, дедалі частіше повідомляє про випадки зниження чутливості збудників і висловлює свою стурбованість через нераціональне застосування антибіотиків [6], використання їх з профілактичною метою у дітей, які не мають на те відповідних показань [7]. Лікування ж хворих частіше за все починається з емпіричного застосування антибіотиків і лише згодом, після отримання результатів бактеріальних посівів, отримання чистої культури збудника (за статистикою — у 70–90 % випадків етіологічним чинником ІСШ є бактерії родини Enterobacteriaceae [8, 9]) та її чутливості до протимікробних засобів змінюється на специфічну терапію [10, 11].
Рівні мінімальної інгібуючої концентрації препаратів першої та другої лінії лікування ІСШ критично піднімаються [12]. Результати останніх досліджень демонструють, що загальноприйняті стандартні та специфічні тести визначення протимікробної чутливості [13–15] є недосконалими [16]. Вони не можуть враховувати різні типи резистентності збудника, зокрема фенотипову резистентність [17, 18], визначення якої суттєво змінює картину мінімальної концентрації антибіотика для зупинки росту та гибелі бактерій.
Метою нашої роботи було обрано дослідження стану антибіотикорезистентності серед збудників інфекції сечових шляхів.
Матеріали та методи
У дослідженні брали участь 89 пацієнтів, які проходили лікування у дитячих клінічних лікарнях № 6 і 7 міста Києва у період з вересня 2016 до січня 2017 року з приводу інфекції сечових шляхів.
Критеріями включення пацієнтів у дослідження був вік хворих від 1 року до 16 років; клінічно, лабораторно та інструментально підтверджені діагнози «інфекція нижніх сечових шляхів» (ІНСШ), «гострий пієлонефрит» (ГП), «рецидив хронічного пієлонефриту» (РХП).
Кожному пацієнту проводилося бактеріологічне дослідження зразків сечі, отриманих до початку антибіотикотерапії, з розгорнутою антибіотикограмою. Бактеріологічне дослідження зразків сечі з антибіотикограмою проводилося на базі лабораторії мікробіології, вірусології та мікології ДУ «Інститут урології НАМН України».
Індетифікація бактерій після посіву проводилася згідно з визначником Берджі, антибіотикограма — шляхом посіву бактерій на середовище Мюллера — Хінтона з подальшим визначенням чутливості до антибіотиків методом антимікробних дисків (виробник HiMedia, Індія). До дослідження були включені зразки сечі, де кількість колонієутворюючих одиниць бактерій була на рівні 103 та вище. Результати чутливості визначалися відповідно до протоколів Інституту клінічних та лабораторних стандартів (CLSI). Було перевірено чутливість до 38 протимікробних препаратів, до статті були включені 23 протимікробних препарати, що застосовуються для лікування інфекцій сечових шляхів у дітей.
Статистична обробка даних проводилася з використанням 12-ї версії програми SPSS.
Результати
У дослідження були включені діти віком від 1 року до 16 років. У педіатричних пацієнтів віком до 12 років ураження сечового міхура, уретри не перебігає ізольовано, також відсутні скарги, що дозволяють точно встановити топіку ураження, тому у дослідженні пацієнти з симптомами уретриту та циститу розглядалися у групі «інфекція нижніх сечових шляхів». У дослідження було включено 48 пацієнтів з діагнозом ІНСШ, за результатами бактеріологічного дослідження 24 зразки сечі (50 %) були негативними, виділені 24 клінічні ізоляти бактерій. З діагнозом «гострий пієлонефрит» було включено 20 пацієнтів, в одного (5 %) пацієнта бактеріологічне дослідження сечі було негативне. З діагнозом «рецидив хронічного пієлонефриту» був включений 21 пацієнт, у 3 (14,2 %) спостерігали негативний результат бакпосіву. Таким чином, чутливість до антибіотиків було визначено у 61 клінічного ізолята бактерій, виділених з сечі дітей з різними формами інфекції сечових шляхів.
Серед виділених клінічних ізолятів 25 штамів (41 %) були представлені грампозитивними мікроорганізмами (S.epidermidis, E.faecalis, S.aureus) та 36 штамів грамнегативних бактерій (E.coli, P.mirabilis, M.morganii).
У групі «інфекції нижніх сечових шляхів» було виділено 11 (46 %) штамів E.coli, 6 штамів (25 %) — S.epidermidis, інші штами — 7 (29 %), серед них E.faecalis, S.aureus, P.aeruginosa.
Згідно з рекомендаціями Європейської спілки мікробіології та інфекційних захворювань, протимікробний препарат треба обмежено застосовувати при емпіричному лікуванні ІСШ при рівні резистентності понад 10 % та не рекомендується застосовувати препарат для лікування при рівні резистентності в популяції вище 20 % [19].
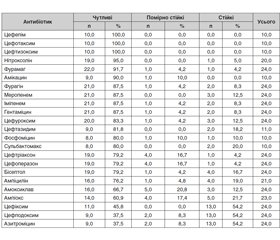
Відповідно до результатів антибіотикограми найбільшу чутливість щодо збудників ІНСШ мали цефепім, цефотаксим, цефтизоксим (табл. 1). Серед синтетичних протимікробних, що широко використовуються у педіатричній практиці для лікування інфекцій сечових шляхів, найбільшу ефективність мав нітроксолін. Високий рівень чутливості мали фурамаг і фурагін, а найвищий рівень резистентності з представників цієї групи у бісептолу. Звертає увагу порівняно низька чутливість до антибіотиків групи амінопеніцилінів та широковживаних цефалоспоринів ІІІ покоління (цефіксим).
/37-1.jpg)
У групі пацієнтів з гострим пієлонефритом спектр виділених патогенів був: E.coli — 8 клінічних ізолятів (42 %), S.epidermidis — 7 (37 %), інші — 4 (21 %), серед них E.faecalis, M.morganii. Серед протимікробних препаратів, що продемонстрували найвищу активність щодо збудників гострого пієлонефриту, слід відзначити високу чутливість до групи аміноглікозидів (табл. 2) порівняно з іншими групами антибіотиків. Із синтетичних протимікробних високий рівень чутливості спостерігався до фурагіну. Викликає занепокоєння надзвичайно низький рівень чутливості до цефтріаксону серед бактерій —збудників гострого пієлонефриту у дітей, хоча чутливість до цефалоспоринів ІІІ покоління загалом коливається на рівні 70–80 %.
/37-2.jpg)
/38-1.jpg)
Лікування рецидиву хронічного пієлонефриту потребує ретельного підбору антимікробних препаратів внаслідок того, що пацієнти з даною патологією вже отримували антибактеріальну терапію і входять у групу підвищеного ризику щодо розвитку стійкості до антибіотиків. Серед виділених –патогенів переважали E.coli — 13 ізолятів (72 %), інші клінічні ізоляти становили 28 %, серед них E.faecalis, P.mirabilis. Найбільшу ефективність до клінічних ізолятів, виділених при рецидиві хронічного пієлонефриту, in vitro серед антибіотиків продемонстрували амікацин, цефтазидим, меропенем, цефепім. Серед протимікробних високу ефективність мав фосфоміцин, а найнижчу — бісептол (табл. 3).
/38-2.jpg)
Отримані результати антибіотикочутливості свідчать про те, що в даний час чутливість до певних антимікробних препаратів, що використовуються у педіатричній практиці, становить менше 60 %, такий високий відсоток резистентності призводить до неприйнятної кількості випадків невдалого лікування ІСШ. Разом із тим існує група препаратів, що продовжують зберігати високий рівень антибактеріальної активності, у таких умовах є критично важливим проведення антибіотикограми з подальшим коригуванням лікування з урахуванням показників антибіотикочутливості.
Згідно з дослідженнями спектра патогенів, що спричиняють інфекції сечових шляхів у дітей, найчастішим збудником є E.coli, яка виділяється у 50–80 % випадків. Відповідно до отриманих результатів проведеного дослідження E.coli превалювала у пацієнтів з усіма формами інфекцій сечових шляхів. Спостерігалася тенденція до зменшення чутливості у клінічних ізолятах E.coli збудників гострого і хронічного пієлонефриту порівняно з чутливістю патогенів, виділених при інфекції нижніх сечових шляхів (табл. 4).
Серед грампозитивних збудників інфекцій сечових шляхів нами найчастіше виділялися представники виду S.epidermidis (23 %), E.faecalis (13 %), інші грампозитивні збудники (6 %). Привертає увагу вірогідне зменшення чутливості грампозитивних мікроорганізмів до всіх антибіотиків цефалоспоринового ряду (p < 0,05) при збереженні чутливості до синтетичних протимікробних препаратів порівняно з грамнегативними збудниками ІСШ (табл. 5).
Ефективність досліджуваних синтетичних мікробних препаратів статистично вірогідно не відрізнялась між собою при різних формах ІСШ, єдиним винятком був бісептол, який статистично вірогідно мав нижчий рівень ефективності при гострому пієлонефриті та рецидиві хронічного пієлонефриту порівняно з іншими синтетичними протимікробними (p < 0,05) (табл. 6).
Одним із найпоширеніших класів антибіотиків, яким користуються для лікування ІСШ в Україні, є цефалоспорини ІІІ покоління. Результати нашого дослідження демонструють високу варіативність у результатах чутливості збудників ІСШ до цефалоспоринів (табл. 7). Так, дуже насторожує рівень резистентності до цефтріаксону збудників, виділених при гострому пієлонефриті та хронічному пієлонефриті, викликає занепокоєність чутливість до цефіксиму та цефподоксиму, зберігається висока чутливість до таких антибіотиків, як цефтизоксим, цефотаксим, цефтазидим.
Обговорення
Систематичне дослідження спектра чутливості до антибіотиків у межах країн або географічних регіонів є дуже важливим через зростання рівня антибіотикорезистентності до всіх класів антимікробних речовин, а також через значні відмінності у ступені резистентності у різних країнах, через особливості застосування того чи іншого протимікробного препарату.
В Україні відсутні системи моніторингу за поширенням антибіотикорезистентності, також Україна не звітує до глобальної системи моніторингу антибіо–тикорезистентності CAESAR. Тому існує обмежена і фрагментована інформація щодо поширеності антибіотикорезистентності, що зменшує ефективність лікування ІСШ, призначеного емпірично.
У дослідженні, проведеному серед населення Північної Америки, рівень резистентності у клінічних ізолятах E.coli, виділених при ІСШ, становив до ампіциліну 37,7 %, сульфаметоксазолу/триметоприму — 21,3 % [20]. Згідно з отриманими нами результатами, рівень резистентність E.coli до ампіциліну, виділених у дітей з ІСШ, є нижчим на 10 %, а рівень резистентності до сульфаметоксазолу/триметоприму вищий на 17,5 % та становить 38,8 %. Дані результати можна пояснити широким застосуванням цього препарату протягом тривалого часу в Україні.
Резистентність до ампіциліну та сульфаметоксазолу/триметоприму значно варіює залежно від країни. Так, у дослідженні, проведеному у Туреччині, до якого були включені діти з ІСШ, рівень резистентності до ампіциліну становив 74,2 %, а до сульфаметоксазолу/триметоприму — 61,3 % [21]. У нашому дослідженні була порівняна чутливість до сульфаметоксазолу/триметоприму при різних формах ІСШ. Рівень резистентності при інфекції нижніх сечових шляхів становив 20,8 %; до порівняння резистентність штамів, виділених при рецидиві хронічного пієлонефриту, — 56,2 %. Таким чином, резистентність до антимікробних препаратів варіює відповідно до форми ІСШ, ці дані мають враховуватися при емпіричному призначенні антибіотиків.
Рівень резистентності до амікацину та цефтріаксону у популяції дітей з Туреччини становив 4,9 і 7,5 % відповідно [21]. Рівень резистентності до цефтріаксону у нашому дослідженні — 44,4 %, амікацину — 0 %. Дуже низький рівень чутливості до цефтріаксону потребує подальшого дослідження, але повсюдне використання цефтріаксону у дитячих стаціонарах для лікування широкого кола захворювань є важливим фактором росту резистентності до цього антибіотика у дитячій популяції.
У дослідженні J.I. Alos et al. зазначається 100% рівень чутливості до фосфоміцину у ізолятах E.coli [22]. У нашому дослідженні також були отримані високі показники ефективності фосфоміцину по відношенню до клінічних ізолятів E.coli, виділених при рецидиві хронічного пієлонефриту (рівень чутливості — 100 %). Чутливість до фосфоміцину у збудників ІНСШ та ГП була значно нижчою — 67 і 60 % відповідно.
Чотирирічне спостереження за ступенем резистентності у збудників ІСШ продемонструвала невпинне зростання резистентності до цефалоспоринів ІІІ покоління та фторхінолонів [23]. Результати нашого дослідження демонструють, що чутливість до деяких цефалоспоринів (цефіксим, цефподоксим) є нижчим за 50 %, що ставить під сумнів можливість емпіричного застосування даних протимікробних препаратів при лікуванні будь якої форми ІСШ.
Висновки
Чутливість до антибактеріальних препаратів значно відрізняється у різних видів бактерій, а також варіює залежно від форми інфекцій сечових шляхів у дітей. Враховуючи високий ступінь антибіотикорезистентності серед збудників ІСШ у дітей, бактеріо–логічне дослідження сечі з розгорнутою антибіотикограмою є важливим компонентом в призначенні найбільш ефективного режиму лікування і запобігання розвитку антибіотикорезистентності.
Існує необхідність у проведенні безперервного моніторингу стану чутливості бактерій до поширених у клінічній практиці антибіотиків і синтетичних протимікробних з метою попередження випадків неефективного лікування в результаті розвитку нечутливості до дії протимікробних препаратів.
Подяки. Колектив авторів висловлює вдячність завідувачу лабораторії мікробіології, вірусології та мікології Інституту урології НАМН України професору Аді Вікторівні Руденко за проведення дослідження антибіотикочутливості клінічних ізолятів у рамках співробітництва між кафедрою педіатрії № 4 Націо–нального медичного університету імені О.О. Богомольця та лабораторії мікробіології, вірусології та мікології Інституту урології НАМН України.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Рецензенти: к.б.н. Мельник О.О., к.м.н. Попович І.Л.
Список литературы
1. Kocak M., Buyukkaragoz B., Celebi Tayfur A. et al. Cau–sative pathogens and antibiotic resistance in children hospitalized for urinary tract infection // Pediatr. Int. — 2016. — 58. — P. 467-471.
2. Doern C.D., Richardson S.E. Diagnosis of Urinary Tract Infections in Children // J. Clin. Microbiol. — 2016 Sep. — 54(9). — Р. 2233-2242.
3. Faust W.C., Diaz M., Pohl H.G. Incidence of post-pyelonephritic renal scarring: a meta-analysis of the dimercapto-succinic acid literature // J. Urol. — 2009. — 181. — Р. 290-297.
4. Shaikh N., Ewing A.L., Bhatnagar S., Hoberman A. Risk of renal scarring in children with a first urinary tract infection: a systematic review // Pediatrics. — 2010. — 126. — Р. 1084-1091.
5. Montini G., Tullus K., Hewitt I. 2011. Febrile urinary tract infections in children // N. Engl. J. Med. — 365. — Р. 239-250.
6. Kutasy B., Coyle D., Fossum M. Urinary Tract Infection in Children: Management in the Era of Antibiotic Resistance-A Pediatric Urologist's View // Eur. Urol. Focus. — 2017 Sep 28. — Р. S2405-4569.
7. Brandström P., Hansson S. Long-term, low-dose prophylaxis against urinary tract infections in young children // Pediatr. Nephrol. — 2015 Mar. — 30(3). — Р. 425-32.
8. Lohr J., Downs S., Schlager T. Genitourinary tract infections, urinary tract infections // Principles and Practice of Pediatric Infectious Diseases, 3rd ed. / Long SS, Pickering LK, Prober CG. — Churchill Livingston/Elsevier, Inc, Philadelphia, PA, 2008. — Р. 343-347.
9. Feld L.G., Mattoo T.K. Urinary tract infections and vesicoureteral reflux in infants and children // Pediatr. Rev.— 2010. — 31. — Р. 451-463.
10. Shah G., Upadhyay J. Controversies in the diagnosis and management of urinary tract infections in children // Paediatr. Drugs. — 2005. — 7(6). — Р. 339-46.
11. Linhares I., Raposo T., Rodrigues A., Almeida A. Frequency and antimicrobial resistance patterns of bacteria implica–ted in community urinary tract infections: a 10-year surveillance study (2000–2009) // BMC Infect. Dis. — 2013. — 13. — Р. 19.
12. Wenzler E., Danziger L.H. Urinary Tract Infections: Resistance Is Futile // Antimicrob. Agents Chemother. — 2016. — Vol. 60, № 4. — Р. 2596-2597.
13. Subcommittee on Urinary Tract Infection, Steering Committee on Quality Improvement and Management, Roberts KB. Urinary tract infection: clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months // Pediatrics. — 2011. — 128(3). — Р. 595-610.
14. Clinical and Laboratory Science Institute. Performance standards for antimicrobial susceptibility testing: twenty-fifth informational // Curr. Infect. Dis. Rep. — 2016. — 18. — Р. 7-9.
15. European Committee on Antimicrobial Susceptibility Testing. Performance standards for antimicrobial susceptibility testing: twenty-fifth informational supplement. 2015; Version 5.0.
16. Stultz J.S., Doern C.D., Godbout E. Antibiotic Resistance in Pediatric Urinary Tract Infections // Curr. Infect. Dis. Rep. — 2016 Dec. — 18(12). — 40.
17. Olicares J., Bernardini A., Garcia-Leon G., Corona F., Sanchez M.B., Martinez J.L. The intrinsic resistome of bacterial pathogens // Front. Microbiol. — 2013. — 4. — 103.
18. Hughes D., Andersson D.I. Environmental and genetic modulation of the phenotypic expression of antibiotic resistance // FEMS Microbiol. Rev. — 2017 May 1. — 41(3). — Р. 374-391.
19. Kalpana Gupta, Thomas M. Hooton, Kurt G. Naber, Björn Wullt, Richard Colgan, Loren G. Miller, Gregory J. Moran, Lindsay E. Nicolle, Raul Raz, Anthony J. Schaeffer, David E. Soper; International Clinical Practice Guidelines for the Treatment of Acute Uncomplicated Cystitis and Pyelonephritis in Wo–men: A 2010 Update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Di–seases // Clinical Infectious Diseases. — 2011. — Vol. 52(5). — Р. e103–e120. — https://doi.org/10.1093/cid/ciq257.
20. Zhanel, George G. et al. Antibiotic resistance in Esche–richia coli outpatient urinary isolates: final results from the North American Urinary Tract Infection Collaborative Alliance (NAUTICA) // International Journal of Antimicrobial Agents. — Vol. 27(6). — Р. 468-475.
21. Yüksel Selçuk et al. Antibiotic resistance of urinary tract pathogens and evaluation of empirical treatment in Turkish children with urinary tract infections // International Journal of Antimicrobial Agents. — Vol. 28(5). — Р. 413-416.
22. Alós J.-I., Serrano M.-G., Gómez-Garcés J.-L., Perianes J. Antibiotic resistance of Escherichia coli from community-acquired urinary tract infections in relation to demographic and clinical data // Clinical Microbiology and Infection. — 2005. — 11. — Р. 199-203. — doi:10.1111/j.1469-0691.2004.01057.x.
23. Dean Ironmonger, Obaghe Edeghere, Amardeep Bains, Richard Loy, Neil Woodford, Peter M. Hawkey; Surveillance of antibiotic susceptibility of urinary tract pathogens for a population of 5.6 million over 4 years // Journal of Antimicrobial Chemotherapy. — 2015. — Vol. 70(6). — P. 1744-1750. — https://doi.org/10.1093/jac/dkv043.

/37-1.jpg)
/37-2.jpg)
/38-1.jpg)
/38-2.jpg)
/39-1.jpg)
/40-1.jpg)
/40-2.jpg)
/41-1.jpg)