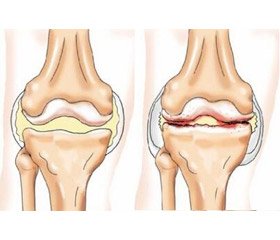
Однією з поширених патологій людей середнього та похилого віку є остеоартрит (ОА) [2, 4, 26]. За своєю поширеністю він посідає перше місце серед ревматичних захворювань, що супроводжуються суглобовим синдромом.
ОА — це поліетіологічне захворювання, виникнення та розвиток якого обумовлені рядом генетичних, механічних, гормональних та метаболічних факторів, що порушують стійкість гіалінового хряща та його фізіологічну регенерацію під впливом навантаження [2, 4].
ОА є найбільш поширеною формою артриту, від якого страждають 250 млн людей у світі (3,8 %) [2–5, 26].
Для остеоартриту характерне руйнування суглобового хряща й прилеглої до нього кістки, що супроводжується болем, порушенням або обмеженням функціональної активності суглобів, запаленням синовіальної оболонки — синовітом [2–5, 8, 26].
в основі патогенезу ОА лежать порушення рівноваги між деградацією матриксу та його синтезу хондроцитами, активація процесів вільнорадикального окиснення, перебудова субхондральної кістки та значне запалення синовіальної оболонки [3–5].
В осіб похилого віку хронічний біль, обумовлений ОА, є однією з найбільш частих причин зниження функціональної активності та якості життя [2–5]. Жінки страждають від ОА частіше за чоловіків, і в них спостерігається більш тяжкий перебіг хвороби [2].
У низці досліджень доведено, що при ОА відбувається зниження порога больової чутливості на багатьох ділянках тіла [21].
Особливістю больового синдрому при ОА є поєднання болю різного генезу — запального, механічного та нейропатичного характеру, що сприяє формуванню стійкого й хронічного перебігу [3].
Біологічно активні речовини — серотонін, цито–кіни, субстанція Р, лейкотрієни, простагландини та ін., що виділяються в місці пошкодження, стимулюють полімодальні ноцицептори, які, у свою чергу, знову підсилюють їх виділення, знижуючи таким чином поріг больової чутливості (первинна гіпералгезія). Місцевий набряк тканини внаслідок порушення проникності капілярів під впливом гістаміну, брадикініну підсилює сенситизацію рецепторів (вторинна гіпералгезія). Простагландини збільшують проникність капілярів і чутливість ноцицепторів настільки, що навіть нешкідливі в нормі стимули, наприклад тиск чи інші допорогові подразники, викликають збудження цих рецепторів та спричиняють біль [4, 6, 26].
Іншим компонентом формування болю при ОА є залучення ванілоїдних рецепторів. Як відомо, ванілоїдні рецептори є своєрідними інтеграторами больової чутливості: вони активуються як під впливом специфічних лігандів, так і під впливом різноманітних неспецифічних стимулів (ацидоз, підвищена температура, іонний дисбаланс), здатних викликати біль, у тому числі й метаболітів арахідонової кислоти. ванілоїдні рецептори, насамперед TRPV1 (transient receptor potential vanilloid 1), що знаходиться на ноцицептивних нейронах, відіграють значну роль при низці патологічних станів: при болях запального характеру, раку, нейропатичних і вісцеральних болях, захворюваннях дихальних шляхів, панкреатитах і мігрені [16].
TRPV1 активуються при ацидозі (один із факторів виникнення болю при ішемії й запаленні) і дії продуктів метаболізму арахідонової кислоти. Нещодавно було виявлено три різні класи ендогенних сполук, що можуть активувати TRPV1: ненасичені N-ацилдопаміни, продукти метаболізму арахідонової кислоти та ендоканабіноїд анандамід із деякими його спорідненими речовинами.
Крім того, активація TRPV1 відіграє значну роль у розвитку постзапальної гіпералгезії [16].
Саме тому лікування ОА обов’язково має бути комплексним [2–5, 25].
Рекомендації щодо лікування ОА, створені Європейським конгресом ревматологів (European League Against Rheumatism — EULAR) і Міжнародним товариством з вивчення остеоартрозу (The Osteoarthritis Research Society International — OARSI), включають фармакологічні, нефармакологічні (модифікація способу життя, зменшення ваги тіла, фізіотерапія та адекватна фізична активність) та хірургічні методи [2–5, 26].
Базовими принципами терапії ОА є запобігання прогресуванню хвороби, зменшення інтенсивності больового синдрому, уповільнення дегенерації хряща й відновлення (покращання) функції суглоба [2–4, 25].
Відповідно до рекомендацій Європейського товариства з клінічних та економічних аспектів остеопорозу та остеоартриту (Тhe European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis — ESCEO) та матеріалів Європейського конгресу ревматологів, Міжнародного товариства з вивчення остеоартрозу для лікування ОА застосовують швидкодіючі симптом-модифікуючі (disease modifying osteoarthritis drugs — DMOAD) засоби — нестероїдні протизапальні засоби (НПЗЗ), глюкокортикостероїди, анальгетики (переважно парацетамол), а також препарати сповільненої дії, що структурно модифікують хрящ (symptomatic slow acting drugs in osteoarthritis — SYSADOA) [3–5, 9, 26].
За даними статистики, 82 % лікарів загальної практики і 84 % лікарів-ревматологів призначають НПЗЗ. Щорічно в США виписується понад 100 млн рецептів на НПЗЗ на загальну суму понад 5 млрд доларів, a 70 % пацієнтів, старших за 65 років, приймають препарати даної групи не рідше 1 разу на тиждень [1, 11, 14].
Тільки для НПЗЗ притаманне поєднання протизапальних, аналгетичних, жарознижуючих властивостей, що перекриває весь спектр основних симптомів ревматичних та інших захворювань суглобів і хребта [14].
Основний механізм дії НПЗЗ був встановлений ще в 1971 р. групою дослідників із Великобританії на чолі з J. Vane, він пов’язаний з їх здатністю пригнічувати циклооксигеназу (ЦОГ) [1, 11, 14]. Це призводить до зменшення утворення простагландинів (ПГ), насамперед ПГ Е2α, і тромбоксану А2, що в підсумку зменшує проникність судинної стінки для формених елементів крові та плазмових білків.
Залежно від типу ЦОГ, які пригнічують НПЗЗ, — конституціональної циклооксигенази-1 (ЦОГ-1) чи індуцибельної циклооксигенази-2 (ЦОГ-2), НПЗЗ поділяють на декілька класів [2, 6, 7]: високоспецифічні НПЗЗ щодо ЦОГ-1 (ацетилсаліцилова кислота в дозі менше від 375 мг, індометацин, кетопрофен, піроксикам); помірно специфічні інгібітори ЦОГ-1,
що пригнічують ЦОГ-2 і ЦОГ-1 in vivo, a in vitro ЦОГ-2 пригнічують сильніше у 2–10 разів, ніж ЦОГ-1 (диклофенак, ібупрофен, напроксен); рівноцінні інгібітори ЦОГ-1 і ЦОГ-2 (лорноксикам); помірно специфічні інгібітори ЦОГ‑2, що пригнічують ЦОГ-2 сильніше, ніж ЦОГ-1, у 10–100 разів in vitro і в 3–10 разів — in vivo (мелоксикам, набуметон, етодолак, німесулід); високоселективні специфічні інгібітори ЦОГ-2, що пригнічують ЦОГ-2 більше, ніж ЦОГ-1, у 100–1000 разів in vitro і в 10–100 разів — in vivo (целекоксиб, вальдекоксиб, еторикоксиб) [3, 10].
Одним із найбільш досліджених НПЗЗ, які використовують при лікуванні ОА, є диклофенак.
Диклофенак (2-[2,6-дихлоро-аніліно]-фенілацети–лова кислота, CAS 15307-86-5) — НПЗЗ, що використовується для купірування болю й лікування запальних процесів різної локалізації [2]. Молекула диклофенаку була синтезована A. Sallmann і R. Pfister у вигляді натрієвої солі й була впроваджена в клінічну практику в 1973 році [1, 14].
Диклофенак характеризується частковою розчинністю в гідрофільних і гідрофобних середовищах, має короткий період напіввиведення та швидко всмоктується при пероральному прийомі [14].
Диклофенак чинить болезаспокійливу, жарознижувальну й протизапальну дії шляхом пригнічення синтезу простагландинів у периферичній і центральній нервовій системі (ЦНС). Препарат викликає інактивацію лізосомних ензимів, гальмуючи активність катепсину В1, пригнічує активність нейтральної протеази. Важливою складовою механізму знеболювальної дії диклофенаку є інгібування вивільнення фактора некрозу пухлини a, що запобігає гіпералгезії, спричиненій виділенням брадикініну й цитокінів [7, 14].
Також є дослідження відносно того, що диклофенак може впливати на антиноцицептивну опіатну систему шляхом непрямої активації каппа-опіоїдних рецепторів за рахунок збільшення виділення ендогенних опіоїдів, таких як динорфіни.
У дослідженнях А. Martini et al. було встановлено, що диклофенак збільшує концентрацію бета-ендорфінів у плазмі крові.
В інших клінічних дослідженнях знеболювальна дія диклофенаку наближалася до такої в кодеїну, була в 3–8 разів сильнішою, ніж у напроксену, у 8–16 разів — ніж в ібупрофену, а також у 12–18 разів сильнішою, ніж в ацетилсаліцилової кислоти.
У дослідженнях S.R. Smith et al. наведено результати метааналізу 17 рандомізованих контрольованих досліджень (РКД) за період з 1982 по 2015 рік. Встановлено, що 27 НПЗЗ, у тому числі диклофенак, не поступалися за знеболювальною дією опіоїдним анальгетикам. Був зроблений висновок, що НПЗЗ і опіоїди забезпечують аналогічне полегшення болю в пацієнтів з ОА.
Також складовою аналгезуючої дії диклофеннаку є вплив на рівень кінуренінової кислоти (КК). У ней–рохімічних дослідженнях S.R. Edwards, L.E. Mather, Y. Lin et al. було встановлено, що при підшкірному введенні диклофенак виявляється в головному мозку [19]. При цьому збільшується концентрація кінуренінової кислоти в ЦНС, головним чином у середньому мозку й люмбосакральних відділах спинного мозку.
Кінуренінова кислота є інтермедіатом кінуренінового шляху обміну триптофану. КК є антагоністом гліцинового модулятора в ділянці NMDA-рецептора й чинить протисудомний і неонатальний нейропротекторний ефекти, що пов’язують із дією КК на рецептори збуджувальних амінокислот [12, 15, 17, 19, 25].
Отже, диклофенак опосередковано зменшує активність системи збуджуючих амінокислот [15].
Терапевтичний ефект НПЗЗ, у тому числі й диклофенаку, також може частково зумовлюватись їх впливом на метаболізм ендогенних канабіноїдів.
Як відомо, ЦОГ-2 здатна окислювати ендоканабіноїд N-арахідоноїлетаноламін (АЕА) і 2-арахідоноїл–гліцерол (2АГ), що чинять аналгетичний, протизапальний і, можливо, анксіолітичний ефект за рахунок зв’язування з рецепторами канабіноїдів і прямої взаємодії з іонними каналами, беручи участь у сприйнятті болю [20].
Окислення під впливом ЦОГ-2 є одним з метаболічних процесів, які блокують біологічну активність АЕА і 2АГ, а простаноїди, що утворюються в результаті деградації цих сполук, можуть діяти як прозапальні медіатори. Зниження рівня ЦОГ-2 під впливом диклофенаку сприяє збереженню аналгетичної активності ендоканабіноїдів за рахунок уповільнення їх деградації. Це також веде до зменшення концентрації прозапальних простаноїдів. Експресія ЦОГ-2 на фоні запалення інколи зростає більше ніж у 50 разів [11, 20].
У кінці ХХ та на початку ХХІ століття в експериментальних дослідженнях, проведених in vitro та in vivo, були встановлені й інші механізми дії диклофенаку.
У дослідженнях О.Є. Ядловського, проведених в ДУ «Інститут фармакології та токсикології НАМН України», м. Київ, було вивчено вплив агоністів та антагоністів ванілоїдних рецепторів на антиноцицептивну дію диклофенаку [16]. Дослідниками встановлено наявність ванілоїдного компонента в антиноцицептивній дії диклофенаку.
Досить цікавою є інформація щодо протипухлинних властивостей диклофенаку. Міжнародний проект Repurposing Drugs in Oncology (ReDO) виявив значний протираковий ефект диклофенаку. Результати роботи опубліковані в ecancermedicalscience. Дослідження, проведені на тваринах і культурах людських клітин, показали, що диклофенак може пригнічувати поділ ракових клітин при нейробластомі, гліомі, меланомі, раку товстої й прямої кишок, яєчника, підшлункової залози й простати.
У пацієнтів із пухлинами молочних залоз, легень і нирок, яким призначали диклофенак, вірогідно знижувалась ймовірність дистанційного метастазування й загальна смертність; значно зменшувалась концентрація CA 19-9 (біомаркер аденокарциноми підшлункової залози) в крові й уповільнювалось прогресування захворювання. При агресивному фіброматозі застосування диклофенаку значно зменшувало розміри новоутворень.
Скорочення ризику появи післяопераційних віддалених метастазів в онкохворих за рахунок використання диклофенаку є важливою складовою при лікуванні раку.
На думку вчених, протипухлинні ефекти диклофенаку різноманітні. У першу чергу вони пов’язані з пригніченням ЦОГ-2 та зменшенням рівня ПГ Е2. Останній підтримує хронічне запалення, формуючи мікросередовище пухлини.
Крім цього, протипухлинну активність диклофенаку можуть забезпечувати такі його ефекти, як стимуляція апоптозу ракових клітин, пригнічення активності тромбоцитів і метаболізму глюкози, а також підвищення чутливості ракових клітин до променевої й хіміотерапії.
Враховуючи вищенаведене, можна зробити висновок, що диклофенак має складний механізм протизапальної та знеболювальної дії, впливає на різні ланки формування болю при ОА та здатний зменшувати апоптоз хондроцитів.
У журналі The Lancet, який був опублікований у березні 2016 року он-лайн, наведені результати мережевого метааналізу знеболювальних властивостей ацетамінофену, рофекоксибу, луміракоксибу, еторикоксибу, диклофенаку, целекоксибу, напроксену й ібупрофену. В аналіз були включені 74 рандомізовані контрольовані дослідження із залученням 58 556 пацієнтів [24].
Методика мережевого метааналізу дозволяє інтегрувати дані всіх рандомізованих контрольованих досліджень, у яких проводилося порівняння різних доз НПЗЗ як із плацебо, так і безпосередньо між собою з урахуванням рандомізації. Цей метод дає можливість здійснити порівняння активних речовин. При проведенні дослідження використовувалися багатофакторні байєсівські моделі випадкових ефектів для змішаних множинних порівнянь між варіантами лікування, що забезпечило можливість порівняння всіх доступних варіантів лікування і множинних порівнянь у дослідженнях з більше ніж двома групами лікування [24]. Первинною кінцевою точкою був біль, що оцінювався через 1, 2, 4, 6 тижнів, 3, 6 і 12 місяців [24].
У результаті аналізу 74 РКД було встановлено, що диклофенак у дозі 150 мг/добу виявився найбільш ефективним НПЗЗ як за знеболювальною дією, так і за покращанням функції суглоба при ОА колінного або тазостегнового суглоба. Його ефективність була вищою, ніж у максимально можливих доз ібупрофену, напроксену й целекоксибу. Найменш ефективним виявився ацетамінофен (парацетамол) [24].
Диклофенак випускають у вигляді натрієвої, калієвої й еполамінової солей, а також у вигляді диклофенаку діетиламіну для зовнішнього застосування.
Фармакокінетика препарату певною мірою залежить від виду солей. Додавання іонів калію дозволяє забезпечити швидке вивільнення та адсорбцію препарату зі шлунково-кишкового тракту. Вже через 10 хв після приймання він виявляється в крові, максимальна його концентрація в плазмі крові досягається через 20–40 хв; період напіввиведення становить 1–2 год, а тривалість дії — 6 год. Істотних відмінностей біодоступності диклофенаку калію залежно від дози, що вводиться, не відзначено, а швидке досягнення максимальної концентрації в крові спостерігалося навіть при застосуванні малих доз препарату.
Дослідженнями встановлено, що при однаковій ефективності аналгетичної, жарознижувальної й протизапальної дії пероральна форма диклофенаку калію діє так само швидко, як і внутрішньом’язова ін’єкція диклофенаку натрію [7].
З огляду на те, що диклофенак калію дуже швидко всмоктується зі шлунково-кишкового тракту, він є досить ефективним і швидким засобом при лікуванні гострих больових і запальних станів, при яких швидкий початковий ефект найбільш важливий. Відсутність ризику кумуляції й розвитку токсичного ефекту пов’язана з відсутністю ентеропечінкової рециркуляції [7].
Диклофенак калію пригнічує переважно фазу ексу–дації, меншою мірою — проліферації, зменшуючи синтез колагену й пов’язане з цим склерозування тканин [7].
Диклофенак калію не кумулюється. Максимальна концентрація в плазмі крові досягається через 2 години після прийому. Зв’язування з білками плазми — 99,7 %, добре проникає в синовіальну рідину. 60 % диклофенаку калію виводиться нирками у вигляді метаболітів, а менше від 1 % — нирками в незміненому вигляді, решта — у вигляді метаболітів із жовчю.
Основними побічними ефектами неселективних НПЗЗ, у тому числі й диклофенаку, є ульцерогенна дія (переважно НПЗЗ-гастропатії, стоматит, нудота, блювання, гастралгія, діарея), астматична тріада; фотосенсибілізація, інтерстиціальний нефрит, кропив’янка [2, 3, 10].
Для запобігання НПЗЗ-гастропатії необхідно використовувати препарати прикриття з групи інгібіторів протонної помпи, Н2-блокаторів [3, 10].
Кардіоваскулярні побічні ефекти НПЗЗ найбільше спостерігаються в пацієнтів похилого віку та хворих, які страждають від супутніх захворювань (ішемічна хвороба серця, цукровий діабет). Вважають, що чим вище селективність НПЗЗ, тим більш імовірним є розвиток кардіоваскулярних і церебральних ускладнень. Результати аналізу 15 659 випадків інсультів у хворих, які раніше використовували НПЗЗ, показали, що відносний ризик ішемічного інсульту для рофекоксибу й індометацину становив 1,26; піроксикаму — 1,25; напроксену — 1,24; ібупрофену — 1,19; диклофенаку — 0,98; целекоксибу — 0,97 [1].
Однак застосування лише НПЗЗ не вирішує проблему лікування ОА. Необхідно також уповільнити дегенерацію хряща й сприяти відновленню (покращанню) функції суглобів.
Із цією задачею певною мірою справляються препарати класу сповільненої дії, що структурно модифікують хрящ — глюкозамін (ГА), хондроїтин, діацереїн, гіалуронова кислота та неомилені сполуки авокадо й сої [2–5, 26].
У багатьох клінічних дослідженнях було встановлено, що застосування цих препаратів полегшує біль та сприяє поступовому відновленню тканин суглобів [2–5, 8, 13, 18, 23].
Глюкозамін є попередником глікозаміногліканів, необхідним для синтезу багатьох з них: хондроїтину, гіалуронової кислоти, гепарину сульфату, гіалуронану; стимулює вироблення хондроцитами колагену.
ГА сприяє фіксації сірки в процесі синтезу хондроїтинсірчаної кислоти, полегшує нормальне відкладання Ca2+ у кістковій тканині, гальмує розвиток дегенеративних процесів у суглобах, відновлює їх функцію, зменшуючи біль у суглобах.
ГА зменшує апоптоз хондроцитів і за цим показником майже в 4 рази перевищує активність диклофенаку. ГА має й протизапальні властивості, що реалізуються шляхом пригнічення активності процесів вільного радикального окиснення й інгібування супероксидних радикалів, зниження активності лізосомальних ензимів, ІЛ-1-стимульованої генної експресії ЦОГ-2, синтезу NO, прозапальних цитокінів, металопротеїназ і протеїнкінази С [2–4, 8, 9, 13, 22]. ГА пригнічує активність лізосомальних ферментів, що руйнують сполучну тканину при ОА.
ГА у медичній практиці використовують у вигляді глюкозаміну гідрохлориду або глюкозаміну сульфату (ГАС).
За фармакокінетичними параметрами — рівноважна концентрація (СSSmax), ступінь (AUCss) — біодоступність глюкозаміну сульфату вище від такої в глюкозаміну гідрохлориду [7–9, 13, 25], а період напіввиведення ГАС у 5 разів триваліший [7–9, 13]. Біодоступність глюкозаміну при пероральному застосуванні становить 25–26 %. Після розподілу в тканинах найбільші концентрації визначаються в печінці, нирках і хрящовій тканині.
Майже 30 % глюкозаміну сульфату абсорбується суглобовим хрящем завдяки невеликому розміру молекул. Це дозволяє ГАС вбудовуватись у структури хрящової тканини та стимулювати синтез протеогліканів і гіалуронової кислоти в синовіальній рідині [2–5].
Низкою дослідників встановлено, що застосування ГАС дозволяє зменшити використання НПЗЗ або знизити дози останніх на 36 % [9].
При лікуванні ОА також досить широко використовують високомолекулярний мукополісахарид — хондроїтину сульфат (ХС). ХС — сульфатований глікозаміноглікан, один з основних компонентів екстрацелюлярного матриксу хряща [2–5, 8, 9, 13].
За результатами досліджень M. David-Raoudi et al., дисахаридні одиниці хондроїтину (глюкуронова кислота і N-ацетил-D-галактозамін) сприяють гідратації хряща і його опору механічному стисненню [18].
структурно-модифікуюча дія препарату обумовлена підвищенням синтезу ендогенної гіалуронової кислоти, збільшенням в’язкості синовіальної рідини, зниженням концентрації прозапальних молекул (С-реактивного білка, інтерлейкіну-6), пригніченням експресії ЦОГ-2 [18]. Протизапальні властивості ХС можуть проявлятися як у міжклітинному просторі, так і в цитоплазмі хондроцитів.
Хондроїтину сульфат впливає на фосфорно-кальцієвий обмін у хрящовій тканині, уповільнює резорбцію кісткової тканини й знижує втрату кальцію, уповільнює процеси дегенерації хрящової тканини.
Після одноразового прийому ХС максимальна концентрація в плазмі крові (Сmax) досягається через 3–4 години, у синовіальній рідині — через 4–5 годин. Концентрація в синовіальній рідині перевищує концентрацію в плазмі.
За результатами систематичного огляду й метааналізу рандомізованих досліджень щодо впливу перорального прийому ХС на швидкість зміни ширини суглобової щілини, наведених у роботі М. Hochberg et al. [22], було доведено доцільність його використання при ОА.
У 2010 р. М. Hochberg довів, що ХС у дозі 800 мг/добу всередину протягом двох років уповільнює швидкість звуження суглобової щілини у хворих на гонартроз [23].
Комбінації ГА та ХС (терафлекс, протекон, мовекс та ін.) досить широко використовують у терапії ОА. Так, комбінована терапія ХС + ГАС збільшує продукцію глікозаміногліканів хондроцитами на 96,6 % порівняно з 32 % при монотерапії [2–5, 8, 9, 13, 26], а додавання до цих засобів НПЗЗ дозволяє покращити їх знеболювальні й протизапальні властивості.
Одним із представників комбінованих препаратів, що містять глюкозаміну сульфат, хондроїтину сульфат та диклофенак калію, є препарат Протекон Фаст виробництва Organosyn Life Sciences.
Препарат містить глюкозаміну сульфату 500 мг, хондроїтину сульфату натрію 400 мг, калію диклофенаку 50 мг. Усі компоненти препарату виявляють потенціюючу дію один щодо одного.
Під впливом глюкозаміну негативний заряд мембрани цитоплазми змінюється на позитивний, що сприяє взаємодії НПЗЗ із мембранними структурами, потенціюючи знеболювальну та протизапальну дію НПЗЗ [8].
Протекон Фаст уповільнює процеси пошкодження хрящової тканини та резорбцію кісткової тканини, відновлює хрящову тканину, прискорює утворення кісткової мозолі при травмах, сприяє відновленню функції суглобів.
Протекон Фаст використовують для лікування остеоартриту (у тому числі колінного, кульшового суглоба, міжхребцевого остеохондрозу, спондилоартрозу) та інших захворювань опорно-рухового апарату, що супроводжуються ознаками запалення, болем, дегенеративно-дистрофічними змінами хрящової тканини суглобів і хребта, зменшенням рухливості суглобів.
Препарат застосовують дорослим протягом 10 днів. За необхідності лікування може бути й більш тривалим. Подальшу терапію проводять препаратами, що містять глюкозаміну сульфат та хондроїтину сульфат.
Зазвичай Протекон Фаст переноситься добре. З повним переліком побічних ефектів можна ознайомитись в інструкції до медичного застосування препарату Протекон Фаст.
Отже, використання препаратів комплексного складу при лікуванні ОА є патогенетично обґрунтованим та ефективним.
Конфлікт інтересів. Не заявлений.